パーキンソン病
ウィキペディアは医学的助言を提供しません。免責事項もお読みください。 |
| パーキンソン病 | |
|---|---|
 | |
| パーキンソン病患者を写した写真(1892年) | |
| 概要 | |
| 診療科 | 神経学 |
| 頻度 | Lua エラー モジュール:PrevalenceData 内、28 行目: attempt to perform arithmetic on field 'lowerBound' (a nil value) |
| 分類および外部参照情報 | |
| ICD-10 | G20, F02.3 |
| ICD-9-CM | 332 |
| DiseasesDB | 9651 |
| MedlinePlus | 000755 |
| eMedicine |
neuro/304 neuro/635 若年性 pmr/99 リハビリ |
パーキンソン病(パーキンソンびょう、英: Parkinson's disease)は、脳内のドーパミン不足とアセチルコリンの相対的増加とを病態とし、錐体外路系徴候を示す疾患である。神経変性疾患の一つである。日本では難病(特定疾患)に指定されている。本疾患と二次性にパーキンソン病と似た症状を来たすものを総称してパーキンソン症候群と言い、本症はパーキンソン症候群を示す病気の一つである。
パーキンソン病の歴史
1817年にイギリスのジェームズ・パーキンソンにより初めて報告された。彼は現在ではパーキンソン病と考えられる症状を持つ6症例を、振戦麻痺 (shaking palsy) という名称で紹介した。彼が記載した症状は、寡動・安静時振戦・姿勢保持障害・前傾姿勢・小字症などで、筋強剛については記載してない。パーキンソンの報告は長い間評価されなかったが、1888年になってフランスのジャン=マルタン・シャルコーによって再評価された。シャルコーは筋強剛についても記載し、彼の提唱により本疾患はパーキンソン病と呼ばれるようになった[1]。
疫学

10歳代~80歳代まで幅広く発症するが、中年以降の発症が多く、高齢になるほど発症率および有病率は増加する[3]。20歳代の発症はまれである。40歳以下で発症した場合を若年性パーキンソン病と呼ぶが、症状に差はない。 日本における有病率は10万人当たり100~150人といわれる[4]。欧米では10万人当たり300人と見積もられており[5]、日本の有病率はやや低い。明らかな人種差や地域差があるかは不明である。厚生労働省の2005年(平成17年)患者調査では、パーキンソン病患者は約14万5千人となっている[6]。また厚生労働省特定疾患医療受給件数の統計によれば、2006年(平成18年)度の受給件数は86,452件であり、全特定疾患中潰瘍性大腸炎に次いで多くなっている[7]。しかしこれは、2003年(平成15年)10月よりパーキンソン病関連疾患として本疾患に進行性核上性麻痺と大脳皮質基底核変性症を併せたものになったため、現在では本疾患の正確な人数を反映する数値ではなくなっている。また特定疾患受給の要件として、後述するHoehn & Yahr分類の3度以上が目安となっているため、実際の患者数はより多いものと予想される。また喫煙者に少ないという特徴がある。
血清中のビタミンD濃度が高いとパーキンソン病発症のリスクが下がることを示唆する、コホート研究による報告が2010年に発表されたが、両者に明らかな関連があるかどうかはまだはっきりしていない[8]。
病因
病理および病態で詳述するように、中脳黒質緻密質のドーパミン分泌細胞の変性が主な原因である。ほとんどの症例が孤発性(非遺伝性)であり、そのほとんどについては、神経変性の原因は不明(特発性)である。遺伝による発症もあり2007年現在いくつかの病因遺伝子が同定されている。その他毒素、頭部外傷、低酸素脳症、薬剤誘発性パーキンソン病もわずかながら存在する。
遺伝子異常
近年、少なからぬ数の特定遺伝子の突然変異がパーキンソン病の原因となることが発見されている。この中には相当数の患者が存在する地域(イタリア、コントゥルシ・テルメ)もある。遺伝子の変異で、パーキンソン病患者のごくわずかについては説明がつく。患者の中には、血縁者の中にやはりパーキンソン病患者がいることがある。がそのことだけでは、この疾患が遺伝的に伝わることにはならない。現在アンジェスMGがHGF遺伝子治療薬の特許を複数取得して研究をリードしている。
今までに同定されている遺伝子には以下のものがある(外部リンクはヒトのメンデル遺伝データベース (OMIM) へのリンクである)。
| タイプ | OMIM | 遺伝子座 | 備考 |
| PARK1 | OMIM #168601 | 4q21 | α-シヌクレインタンパクをコードしているSNCA遺伝子の突然変異によって起こる。PARK1は常染色体優性のパーキンソン病を発症させる。PARK4といわれた遺伝子 (OMIM #605543) はおそらくSNCA遺伝子の三重重複 (triplication) によって起こる[9]。 |
| PARK2 | OMIM *602544 | 6q25.2-q27 | パーキン (Parkin) タンパクをコードする遺伝子の突然変異によって起こる。この変異は現在わかっている若年性パーキンソン病の最も一般的な原因のひとつになっている。ある研究では、40歳未満で発症したパーキンソン病患者(全患者の約10%)のうち、18%にパーキンの変異が見られ、また5%は変異体のホモ接合型であった[10]。常染色体劣性遺伝の家系では、20歳未満で発症する患者の場合はるかに高い割合でパーキンの突然変異が見られた(約80%、40歳以上の発症者では28%)[11]。パーキン突然変異 (PARK2) を持つ患者では、病理所見でレビー小体が見られない。孤発性パーキンソン病患者と極めて似た症状を示すが、ずっと若年で発症する傾向がある。 |
| PARK3 | OMIM %602404 | 2p13 | 常染色体優性であり、ごくわずかの家系だけに見られる。 |
| PARK5 | OMIM +191342 | 4p14 | ユビキチンC末端水解酵素 (Ubiquitin carboxy-terminal hydrolase L1) をコードする遺伝子UCHL1の突然変異による。 |
| PARK6 | OMIM #605909 | 1p36 | PTEN誘導性推定キナーゼ1タンパクをコードするPINK1遺伝子 (OMIM *608309) の突然変異による。PINK1タンパクはミトコンドリアに局在する基質不明のキナーゼであり、その変異は常染色体劣性遺伝型若年発症パーキンソン病のまれな原因となる[12]。 |
| PARK7 | OMIM #606324 | 1p36 | DJ-1遺伝子 (OMIM 602533) の突然変異による。 |
| PARK8 | OMIM #607060 | 12q12 | dardarinタンパク (Leucine rich repeat kinase 2) をコードするLRRK2遺伝子の突然変異による。In vitroでは、変異したLRRK2はおそらくパーキンタンパクとの相互作用によって、タンパクの凝集と細胞死を引き起こす[13]。この遺伝子を持つ家系では常染色体優性のパーキンソン病を発症し、また発症が平均50歳代であり、レボドパ治療に反応する典型的なパーキンソン病である[14]。 LRRK2の突然変異はG2019Sにおけるものが最も多いが、この変異では80歳までの浸透度はほぼ100%である[15]。 G2019Sにおける突然変異は米国およびヨーロッパの遺伝性パーキンソン病患者の1-6%に見られ、もっとも多い[16]。ことにアシュケナージ系ユダヤ人では一般的であり、家族性パーキンソン病患者で29.7%の有病率、孤発性患者でも13.3%である[17]。一方この変異では浸透度が低いという報告もあり[14]、80歳での浸透度を32%とし、孤発性患者でこれほど変異が高頻度に見られることの原因を浸透度の低さに帰する評価もある[18]。 |
| PARK9 | OMIM #606693 | 1p36 | ATP13A2遺伝子の突然変異によって起こり、Kufor-Rakeb症候群としても知られる[19]。PARK9はおそらくPARK6の対立遺伝子である。 |
| PARK10 | OMIM %606852 | 1p | - |
| PARK11 | OMIM %607688 | 2q36-37 | 遺伝子座については矛盾するデータがあるが、重要性はないであろう。 |
| PARK12 | OMIM %300557 | Xq21-q25 | - |
| PARK13 | OMIM #610297 | 2p12 | HTRA2(HtrAセリンペプチダーゼ2)遺伝子の突然変異による。 |
ミトコンドリア機能障害仮説
MPTPやロテノンといったミトコンドリアに機能障害を起こす薬物により、ヒトや実験動物においてパーキンソン病様の病態が起こること、孤発性のパーキンソン病においてミトコンドリアの呼吸鎖の機能障害が観察されることから、パーキンソン病原因の1つの仮説としてミトコンドリアの機能障害が想定されている。
病理
肉眼的には黒質・青斑核の色素脱失がみられ、組織学的には、黒質や青斑、迷走神経背側核、視床下部、交感神経節などの神経細胞脱落が生じていて、典型的には残存神経細胞やその突起の一部にレビー小体(Lewy body)という特徴的な封入体が認められる。近年ではレビー小体は自律神経節など末梢レベルでも蓄積していることが明らかになってきた。レビー小体には、リン酸化α-シヌクレインの異常な蓄積が認められる。
病態
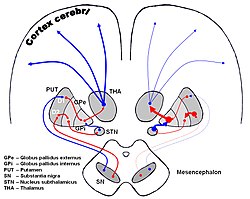
中脳黒質のドーパミン神経細胞減少により、これが投射する線条体(被殻と尾状核)においてドーパミン不足と相対的なアセチルコリンの増加がおこり、機能がアンバランスとなることが原因と考えられている。しかしその原因は解明に至っていない。このため、パーキンソン病は本態性パーキンソニズムとして、症状の原因が明らかでないパーキンソニズムに分類される。また腸管におけるアウエルバッハ神経叢(Auerbach plexas)の変性も病初期から認められており、本疾患が全身性疾患であるとの再認識をされるようになっている
症状

パーキンソン病の症状には大別して運動症状と非運動症状がある。非運動症状のなかには、精神症状、自律神経症状などが含まれる。
運動症状
主要症状は以下の4つである。振戦、固縮、無動が特に3主徴として知られている。これらの神経学的症候をパーキンソニズムと呼ぶ。
- 安静時振戦(ふるえ resting tremor)
- 指にみられることが多いが、上肢全体や下肢、顎などにもみられる。安静にしているときにふるえが起こることが本症の特徴である。精神的な緊張で増強する。動かそうとすると、少なくとも一瞬は止まる。書字困難もみられる。指先のふるえは親指が他の指に対してリズミカルに動くのが特徴的であり、薬を包んだ紙を丸める動作に似ていることからpill rolling signとも呼ばれる。
- 筋強剛(筋固縮) (rigidity)
- 力を抜いた状態で関節を他動させた際に抵抗がみられる現象。強剛(固縮)には一定の抵抗が持続する鉛管様強剛(鉛管様固縮、lead pipe rigidity)と抵抗が断続する歯車様強剛(歯車様固縮、cogwheel rigidity)があるが、本疾患では歯車様強剛が特徴的に現れ、とくに手関節(手首)で認めやすい。純粋なパーキンソン病では錐体路障害がないことが特徴である。すなわち四肢の麻痺やバビンスキー反射などは認められないのが普通である。
- パーキンソン病をはじめパーキンソン症候群に特徴的な、いわゆる仮面様顔貌(目を大きく見開きまばたきが少ない、上唇が突き出ている、これらの表情に変化が乏しい)は、顔面筋の筋強剛によるものとされる[20]。
- 無動、寡動(akinesia, bradykinesia)
- 姿勢保持反射障害(postural instability)
- バランスを崩しそうになったときに倒れないようにするための反射が弱くなる。加速歩行など。進行すると起き上がることもできなくなる。
多くの症例で、特に病初期に症状の左右差がみられる。進行すると両側性に症状が現れ、左右差はなくなることが多い。マイヤーソン徴候(Myerson symptom)なども診断の参考になる。またL-ドーパ剤投与が奏効する(症状が顕著に改善する)ことが特徴であり、これは他のパーキンソン症候群と本疾患を鑑別する上で重要な事実である。
非運動症状
自律神経症状として便秘、垂涎などの消化器症状、起立性低血圧、食後性低血圧、発汗過多、あぶら顔、排尿障害、勃起不全などがある。
精神症状としては、感情鈍麻 (apathy)、快感喪失 (anhedonia)、不安、うつ症状、精神症候(特に幻視)、認知障害を合併する場合が多い[21]。感情鈍麻はパーキンソン病のうつ症状に合併することが多い[22]が、単独でも現れる[23]。うつ症状はパーキンソン病の精神症候の中で最も頻度の高い症候とされてきたが、実際の頻度については定説がない[21]。最も用いられている数値は約40%である[24]。幻視も頻度の高い精神症候である。この症候は抗パーキンソン薬による副作用と考えられてきたが、近年ではそれだけでなく、内因性・外因性の様々な要素によって引き起こされるとする考え方が有力になっている[25]。以前は特殊な例を除き認知障害は合併しないといわれていたが、近年では後述のように認知障害を伴うパーキンソン病の例が多いとみなされるようになっている。
無動のため言動が鈍くなるため、一見して認知症またはその他の精神疾患のようにみえることもあるが、実際に痴呆やうつ病を合併する疾患もあるため鑑別を要する。
また、病的賭博、性欲亢進、強迫的買い物、強迫的過食、反復常同行動、薬剤の強迫的使用などのいわゆる衝動制御障害がパーキンソン病やむずむず脚症候群に合併することが知られるようになっている[26]。
認知症を伴うパーキンソン病・疫学
パーキンソン病は、高率に認知症を合併する。27の研究のメタアナリシスによると、パーキンソン病の約40%に認知症が合併していた[24]。約30%というメタ解析データもあり[27]、その研究では全認知症症例の3.6%がパーキンソン病であった。パーキンソン病患者は、認知症を発症するリスクは、健常者の約5-6倍と見積もられており、パーキンソン病患者を8年間追跡調査した研究では、78%が認知症を発症した。
診断
確定診断は病理所見を待たなければならないが、上記の症状を呈する緩徐な進行性の疾患であること(他の神経変性疾患では病勢が亜急性に進むものもある)、CTやMRIの画像所見で特異的な異常が認められないこと(特徴的な所見を示す神経変性疾患や脳血管障害性パーキンソニズムを除外する)、L-ドーパ投与で症状が改善することがあれば、臨床的にはパーキンソン病と診断できるとされている[28]。
簡便な病期診断として、5段階の病期分類がある(Hoehn-Yahr分類)
- 1度 一側性パーキンソニズム
- 2度 両側性パーキンソニズム
- 3度 軽度~中等度のパーキンソニズム。姿勢反射障害あり。日常生活に介助不要
- 4度 高度障害を示すが、歩行は介助なしにどうにか可能
- 5度 介助なしにはベッド又は車椅子生活
運動症状・非運動症状を含めた各症状を総合的に評価する方法としては、パーキンソン病統一スケール (Unified Parkinson's disease rating scale, UPDRS)がある。
鑑別診断
パーキンソニズムを呈するすべての疾患。その中にはパーキンソニズムを合併する他の神経変性疾患(多系統萎縮症、進行性核上性麻痺、シャイ・ドレーガー症候群、大脳皮質基底核変性症など)、症候性パーキンソニズム(脳血管障害性パーキンソニズム、薬剤性パーキンソニズム、中毒性パーキンソニズム、感染後パーキンソニズムなど)などが挙げられる[28]。特に薬剤性パーキンソニズムは原因薬物の投与中止によって完治することのできる疾患なので、鑑別が重要である。パーキンソン症候群を参照。
治療
現在のところ、一般的なパーキンソン病に対する治療は、運動症状や精神症状、自律神経症状にたいする対症療法がほとんどである。しかしながら、神経変性の機序が明らかになるにつれ、変性すなわち症状の進行を遅らせるための治療法(神経保護薬による治療法)が試みられるようになってきた。また変性した神経を再生させる遺伝子治療や幹細胞移植などの根本治療も現実的なものとして視野に入っている[29]。ここではまず現在の日本で現実的な(保険適応がある)治療について概説し、さらに新しい治療についても現在の到達点と将来的な見通しを記す。
日本において本疾患は1978(昭和53)年10月1日に特定疾患治療研究事業対象疾患に指定され、公費受給が可能となっている(ただし前述のように、Hoehn-Yahr分類の3度以上が認定の目安となるため、病初期の治療は健康保険の範囲内で自己負担せざるをえない)。
薬物療法
特に記さない限り、日本神経学会パーキンソン病治療ガイドライン2002に基づいて解説する。
ドーパミン補充療法
ドーパミンの前駆物質であるレボドパ (L-dopa) を投与する。ドーパミンを直接投与しないのは、ドーパミンが血液脳関門を通過できないためである。ドーパミン脱炭酸酵素阻害薬であるカルビドパ(商品名メネシット、ネオドパストンなど)あるいはベンセラジド(商品名イーシー・ドパール、ネオドパゾール、マドパー)との合剤を用いることが多い。主に3主徴に対して、きわめて有効に働く。振戦の改善はその他の抗パーキンソン病薬に比べるとマイルドである。1960年代に臨床応用されて以来、薬物治療のゴールデンスタンダードだが、長期にわたる服用によりオン・オフ現象(突然薬の効果がきれ体が動かなくなる)やウェアリング・オフ現象(内服直後や時間がたった時に効果が突然切れる)、ジスキネジアといった副作用(運動合併症)が現れる。このため、現在では初期治療としてはドーパミン受容体作動薬から投与することで、少しでもレボドパの内服開始時期を遅らせる治療法が一般的となっている。
L-ドーパやドーパミンアゴニストを投与すると悪心・嘔吐の副作用が出ることが多いが、これに対する治療としての制吐剤には、パーキンソニズムを悪化させるものが多い。通常最もよく使われる制吐剤メトクロプラミドはこの用途には用いず、ドンペリドンを用いるのが一般的である(パーキンソン症候群の薬剤性パーキンソニズムの項を参照)。
ドーパミン受容体作動薬
ドーパミンアゴニストとも呼ばれる。麦角系としてカベルゴリン(商品名カバサール)、ペルゴリド(商品名ペルマックス)、ブロモクリプチン(商品名パーロデルなど)、非麦角系としてプラミペキソール(商品名ビ・シフロール)、ロピニロール(商品名レキップ)、タリペキソール(商品名ドミン)などがある。レボドパ製剤と比較してウェアリングオフやジスキネジアを起こしにくいことから、認知症を伴わない70歳未満の患者については、レボドパではなくこちらを第一選択とすることが推奨されている[30]。幻覚(幻視が主である)などの精神症状が強く出やすいため、認知障害のある患者では投与を避ける。
また麦角系ドーパミンアゴニストでは重篤な副作用(心臓弁膜症や間質性肺炎など)を起こすことがわかり[31]、新たに投与を開始する場合はまず非麦角系薬を選択し、治療効果が不充分であったり忍容性に問題があるときのみ麦角系薬を使用する[32]ことになっている(その場合、投与開始前および開始後定期的に心臓超音波検査をはじめとするフォローが必要である)。ただし、非麦角系薬にも突発性睡眠などの重大な副作用があるため、注意が必要であることには変わりがない。また、これらの薬剤を内服している人が急に内服を中止すると悪性症候群などの重大な副作用を引き起こす危険がある[33]ので、必ず医師に相談する必要がある。
ドーパミン放出薬
アマンタジン(商品名シンメトレルなど)は、もともとインフルエンザ治療薬として開発されたが、本剤を投与されたパーキンソン病患者の運動症状が改善されたことから、抗パーキンソン病薬としても認められるようになった。NMDA型グルタミン酸受容体に対する拮抗作用があり、これが抗パーキンソン作用の原因となっているという考えがある。また神経保護作用もあるといわれるが、証拠はまだない。アマンタジンはセレギリンと同様に覚醒させる方向に働くとされており、朝、昼に内服する場合が多い。初期パーキンソン病の運動障害の改善の他、運動障害を悪化させずにジスキネジアを改善させる作用がある。運動障害の改善のためには100~200mg/dayの投与で十分であるが抗ジスキネジア作用を期待するには300mg/day以上の投与が必要である。腎排泄性の薬物であり高齢者の投与の場合は減量が必要である。血液透析で除去されにくいのも特徴である。また高齢者、腎機能障害者に投与した場合、副作用である幻覚やミオクローヌスが出現しやすい。ミオクローヌスと振戦の区別が難しい場合もある。その他の副作用としては網状皮膚斑などが知られている。
MAO-B阻害薬
選択的不可逆的モノアミン酸化酵素B (MAO-B) 阻害薬である。中枢内に多く存在し、ドーパミンの代謝経路として働くMAO-Bを選択的に阻害することで、ドーパミン濃度を高める働きがある。セレギリン(商品名エフピー)が現在日本で使用されている唯一のMAO-B阻害薬である。セレギリンは治療量内ではMAO-Bに対して選択的に働くが、高用量になるとMAO-AおよびMAO-Bに対して非選択的に阻害してしまうので注意が必要である。また、進行期パーキンソン病の運動合併症であるジスキネジアの発現を増強するため、ジスキネジアが出現した場合には投与を中止する。
セレギリンは神経保護作用もあるといわれているが、その効果については報告によって違いが見られ、議論が分かれている。COMT阻害薬と異なり、MAO-B阻害薬単独でも効果はあるといわれているが、日本ではL-ドーパとの併用のみが認められている。
セレギリンは代謝されアンフェタミン、メタンフェタミンが産出され、覚醒方向に働き不安、不眠の副作用が生じることがあり夕の内服は避けられる傾向がある。ウェアリングオフやすくみ足といった他の抗パーキンソン病薬では効果が低い症状に有効である。しかしピークドーズジスキネジアは出現しやすいくなる。そのため早期パーキンソン病ではレボドパの開始と同時期に開始し、病気の進行を遅らせたり後期パーキンソン病で幻覚や認知症のない例でウェアリングオフが認められジスキネジアが認められない例で用いられる場合が多い。メペリジン、三環系抗うつ薬、SSRIとは急性の中毒性相互作用(セロトニン症候群)が知られている。また血圧を下げる作用があるため起立性低血圧が認められる場合は増悪する可能性がある。またMIBGシンチグラフィーの検査に影響を与えることが知られている。
COMT阻害薬
中枢外に存在するドーパミン代謝経路の酵素であるカテコール-O-メチル基転移酵素 (COMT) を阻害する薬剤である。末梢でのL-ドーパ分解を抑制して中枢への移行性を高めるための薬剤であり、L-ドーパとの併用のみで用いられる。エンタカポン(商品名コムタン)およびトルカポンが開発されているが、トルカポンは致死的な肝障害の副作用が見られたため、現在米国以外では使用されていない。日本ではエンタカポンが2007年1月に承認されている。ウェアリングオフ現象の改善に有効であるが、ジスキネジア、精神症状の増悪が認められることがある。
抗コリン薬
アセチルコリン受容体のうち、ムスカリン受容体をブロックする薬剤である。最も古くから使用されている抗パーキンソン病薬であり、19世紀から天然アルカロイドが用いられていた。1949年に合成薬トリヘキシフェニジル(商品名アーテンなど)が開発されて以来、様々な薬剤が使われている。主な抗コリン薬としては他にビペリデン(商品名アキネトンなど)、プロフェナミン(商品名パーキン)、メチキセン(商品名コリンホール)などがある。2002年のガイドラインではあくまで補助的な薬物として位置づけられている。前立腺肥大、緑内障の患者では禁忌であり、幻覚、妄想、せん妄、認知症の悪化という副作用も認められるため認知症が認められる患者や高齢者ではあまり用いられない。少量から開始し、中止する場合もゆっくりと減量をする。
ノルアドレナリン作動薬
ドロキシドパは日本で開発されたノルアドレナリンの非生理的な前駆物質である。進行期パーキンソン病のすくみ足や姿勢維持障害に効果があるといわれている。また起立性低血圧にも効果がある。
抗ヒスタミン薬
フェノチアジン系であるプロメタジン(商品名ピレチア)はパーキンソン病の振戦の緩和作用が知られている。鎮静作用が強く不眠改善も期待できる。
非運動症状に対する治療薬
自律神経症状や精神症状に対しては、それぞれの症状に対する治療薬を用いる。抗精神病薬は、フェノチアジン系やブチロフェノン系などの定型抗精神病薬にパーキンソニズムを誘発する副作用があるためほとんど用いられない。現在推奨されているのは、クロザピン、クエチアピン、オランザピン、リスペリドンなどの非定型抗精神病薬である。
レボドパ長期内服で生じる運動障害の対応
ウェアリングオフ
レポドパ製剤の半減期は60~90分であるが早期パーキンソン病ではその効果が切れることを体感することはほとんどない。しかし進行期パーキンソン病では次の内服時間の前に運動障害が悪化するウェアリングオフが認められることがある。この場合は症状日誌やMASAC-PD31で症状の変動、オフ期の有無を評価する。そしてジスキネジアが増悪しないように内服調節を行う。具体的には、オフの時間帯に合わせてレボドパを追加する、COMT阻害薬を追加する、ドパミンアゴニストを追加、変更、増量しオフ時状態の改善(底上げ)を行う、MAO-B阻害薬を追加するといった方法がある。内服調節でコントロールが困難な場合は脳深部刺激療法も考慮する。
不随意運動
振戦以外にパーキンソン病治療薬によって不随意運動が生じることがある。ジスキネジアが一般的であるが、ジストニア、バリズムが起こることも知られている。レボドパの血中濃度が最大の時に生じるピークドーズジスキネジア、急激な濃度変化でおこる二相性ジスキネジア、薬効が切れた時に生じるオフジストニアがよく知られている。内服調節で改善することもあるが治療は難渋する場合が多い。定位脳手術が施行されることもある。
外科療法

脳神経外科学領域において視床下核部定位脳手術が著効する例もあるが、侵襲をともなう治療法であるために慎重な適応が必要である。パーキンソン病に対する外科的アプローチは20世紀前半から行われていた。1950年代に視床VL,Vim核、淡蒼球内節、視床下核破壊術が確立したが、その後これらの部位に電極を埋め込む深部脳刺激術 (Deep brain stimulation therapy, DBS) が開発され、現在はこの方法が一般的である。外科療法の適応となるのは、L-ドーパによる治療効果があり、治療が十分に行われたがADL(日常生活で行う活動)に障害をきたしている場合である。ただし認知障害があったり著しい精神症状がある場合、重篤な全身疾患がある場合には適応除外となる。年齢による適応の制限はない。
| 症状 | 視床(Vm核、VL核) | 淡蒼球内節 | 背側視床後部、不確帯尾側部 | 視床下核 |
|---|---|---|---|---|
| 振戦 | 著効 | 効果あり | 著効 | 効果あり |
| 筋固縮 | 著効 | 著効 | 著効 | 著効 |
| 無動 | 効果少ない | 著効 | 著効 | 著効 |
| 歩行障害 | 効果少ない | 効果あり? | 著効? | 著効? |
| レボドパの減量 | 効果少ない | 効果あり | 効果あり | 著効 |
| ジスキネジア | 効果少ない | 著効 | 効果あり | 時に悪化 |
| 語想起障害 | 左で出現 | 左で出現 | ? | 出現 |
| ドパミン調節異常症候群 | 影響なし | 稀に悪化 | 影響なし | 時に悪化 |
視床の手術
視床Vim核の刺激術は振戦の改善に有効であり、本態性振戦で用いられることもある。VL核の刺激術は筋固縮やジストニアのような筋緊張の亢進は改善するものの無動に対しては効果が薄い。
淡蒼球内節の手術
GPiの刺激術は全てのパーキンソン病の症状を改善させる。特にオン時のジスキネジアの改善に効果的である。しかし振戦の改善は視床Vim核の手術ほどの改善は見込めない。レボドパの減量効果も視床下核の手術ほどではない。ジストニアの治療のターゲットとしても注目されている。
腹側視床後部、不確帯尾側部の手術
振戦や筋固縮を強く抑制し、小字症など無動や姿勢保持反射、歩行障害に有効である。ジスキネジアに対する抑制効果も報告されている。
視床下核の手術
効果がレボドパに類似しておりレボドパの減量が期待できる。しかし長期的には認知機能の低下や歩行障害、うつの発生などが認められる。
脚橋被蓋の手術
十分なデータが蓄積されていない。
リハビリテーション
- 運動療法
- 患者は進行性に運動が困難になっていくが、放っておくと廃用によって二次性の筋力低下や関節拘縮をきたすことがあるため、極力運動を行うように心がけることが大切である。またそのことによって少しでも症状の進行を遅らせることができるともいわれている。近年はパーキンソン病体操なども開発されている。
- 音楽療法
- 運動療法と組み合わせて音楽を用いたリハビリテーションを行うだけでなく、音楽の持つリラクゼーション効果やヒーリング効果に期待する。歩行訓練を伴わない音リズムだけによる刺激によっても、パーキンソン病の歩行障害(小刻み歩行や歩行速度の低下)が改善したとする報告がある[34]。
先端的な治療
遺伝子治療
この節の加筆が望まれています。 |
先端治療に関する新知見
京都大先端領域融合医学研究機構の木下専(きのしたまこと)助教授、猪原匡史(いはらまさふみ)特別研究員らが所属するグループによって、原因物質がたまるのを抑えるSept4というたんぱく質の性質を確認。2007年2月15日付のニューロン電子版に発表する[35]。これは「進行を遅らせる効果が確認された」という趣旨の発表であり治療法が確立されたわけではないが、病気のメカニズムの解明がまた一歩進んだことを示す。
また、米シリコンバレーの研究所で、タバコに含まれるニコチンに当該疾患の予防効果があるという研究結果が発表されている。ニコチンを投薬したマウスは、それ以外のものと比べて運動障害の発生率が50%抑制されたという。ただ、ニコチンは毒性が強いため、医療用としての転用には更なる研究が待たれる。
2008年4月、新型の万能細胞「人工多能性幹細胞(iPS細胞)」から作り出した神経細胞を使い、パーキンソン病のラットを治療することに、米マサチューセッツ工科大のルドルフ・ヤニッシュ教授らのグループが成功した[36]。研究グループはマウスの皮膚からiPS細胞を作り、神経伝達物質のドーパミンを分泌する細胞に分化させた。パーキンソン病を人工的に発症させたラット9匹の脳に移植したところ、8匹の症状が改善、特有の異常動作がなくなった。移植した細胞がラットの脳内に定着し、ドーパミンを正常に分泌し始めたらしい。患者自身の皮膚などからiPS細胞を作れば、拒絶反応なしにこうした移植治療ができると期待される。
予後
パーキンソン病は、それ自体で生命を落とす疾患ではない。パーキンソン病患者の死因としては、臥床生活となった後の身体機能低下による感染症(下気道感染や尿路感染)、転落による外傷などが原因となることが多い。運動症状を改善させる治療法が進んだために、生命予後は改善しているとみられるが、総合的な検討はまだなされていない[37]。
罹患した著名人
- アーサー・ケストラー
- アドルフ・ヒトラー
- E・H・エリック
- 石母田正
- 梅原"PAUL"達也 (44MAGNUM)
- 江戸川乱歩
- 岡本太郎
- オトマール・スウィトナー
- 萱野茂
- 神部和夫(シュリークス)
- 金槿泰
- キャサリン・ヘプバーン
- クラウス・フォン・アムスベルク
- 小森和子
- 春風亭栄橋
- 佃公彦
- デボラ・カー
- 鄧小平
- 樋口了一
- ビリー・グラハム
- フィデル・カストロ
- フィル・ヒル
- フランシスコ・フランコ
- フレディ・ローチ
- ペーター・ホーフマン
- マイケル・J・フォックス
- マサ斎藤
- マンフレート・ロンメル
- モーリス・ホワイト
- モハメド・アリ
- 三浦綾子
- 山田風太郎
- ヨハネ・パウロ2世
- レアルコ・グエッラ
- 永六輔
脚注
- ^ Mizuno, Y et al. (2008), “Progress in the pathogenesis and genetics of Parkinson's disease”, Philos Trans R Soc Lond B Biol Sci 363: 2215-27, PMID 18426756full text
- ^ “Death and DALY estimates for 2004 by cause for WHO Member States” (xls). World Health Organization (2004年). 2011年12月20日閲覧。
- ^ de Lau, LM; Giesbergen, PC; de Rijk, MC; Hofman, A; Koudstaal, PJ; Breteler, MM (2004), “Incidence of parkinsonism and Parkinson disease in a general population: the Rotterdam Study”, Neurology 63: 1240-4, PMID 15477545
- ^ 難病情報センターのパーキンソン病のページ
- ^ Rao, Shobha S.; Hofmann, Laura A.; Shakil, Amer (2006), “Parkinson's disease: diagnosis and treatment”, Am Fam Physician 74: 2046-54, PMID 17186710full text
- ^ 厚生労働省 : 平成17年患者調査の概況 表12
- ^ 厚生労働省:平成18年度保健・衛生行政業務報告(衛生行政報告例)結果の概況
- ^ Knekt, Paul; Kilkkinen, Annamari; Rissanen, Harri; Marniemi, Jukka; Sääksjärvi, Katri; Heliövaara, Markku (2010). “Serum Vitamin D and the risk of Parkinson disease”. Arch Neurol 67 (7): 808-811. doi:10.1001/archneurol.2010.120.
- ^ Singleton AB, Farrer M, Johnson J, et al (2003). “alpha-Synuclein locus triplication causes Parkinson's disease”. Science 302 (5646): 841. doi:10.1126/science.1090278. PMID 14593171.
- ^ Poorkaj P et al. (2004). “parkin mutation analysis in clinic patients with early-onset Parkinson's disease” (abstract page). American Journal of Medical Genetics Part A 129A (1): 44–50. doi:10.1002/ajmg.a.30157.
- ^ Ebba Lohmann et al. (2003). “How much phenotypic variation can be attributed to parkin genotype?” (abstract page). Annals of Neurology 54 (2): 176–185. doi:10.1002/ana.10613. PMID 12891670.
- ^ Valente, EM, et al (2004), “PINK1 mutations are associated with sporadic early-onset parkinsonism”, Ann Neurol 56: 336-41, PMID 15349860
- ^ Smith WW et al. (2005). “Leucine-rich repeat kinase 2 (LRRK2) interacts with parkin, and mutant LRRK2 induces neuronal degeneration” (abstract page). Proceedings of the National Academy of Sciences of the United States of America 102 (51): 18676–18681. doi:10.1073/pnas.0508052102. PMID 16352719.
- ^ a b Funayama, M, et al (2002), “A new locus for Parkinson's disease (PARK8) maps to chromosome 12p11.2-q13.1”, Ann Neurol 51: 296-301, PMID 11891824
- ^ Kachergus J, Mata IF, Hulihan M, et al (2005). “Identification of a novel LRRK2 mutation linked to autosomal dominant parkinsonism: evidence of a common founder across European populations”. Am. J. Hum. Genet. 76 (4): 672–80. doi:10.1086/429256. PMID 15726496.
- ^ Brice A (2005). “Genetics of Parkinson's disease: LRRK2 on the rise”. Brain 128 (Pt 12): 2760–2. doi:10.1093/brain/awh676. PMID 16311269.
- ^ Ozelius L, Senthil G, Saunders-Pullman R, et al (2006). “LRRK2 G2019S as a cause of Parkinson's disease in Ashkenazi Jews”. NEJM 354 (4): 424–5. doi:10.1056/NEJMc055509. PMID 16436782.
- ^ Goldwurm, S, et al (2007), “Evaluation of LRRK2 G2019S penetrance: relevance for genetic counseling in Parkinson disease”, Neurology 68: 1141-3, PMID 17215492
- ^ Hampshire, DJ; Roberts, E; Crow, Y; Bond, J; Mubaidin, A; Wriekat, AL; Al-Din, A; Woods, CG (2001), “Kufor-Rakeb syndrome, pallido-pyramidal degeneration with supranuclear upgaze paresis and dementia, maps to 1p36.”, J Med Genet 38: 680-682, PMID 11584046full text
- ^ 岩田(1994)p.18
- ^ a b 高橋一司「パーキンソン病における精神症候の頻度」山本 (2008) 所収、pp.128-140
- ^ Aarsland, D, et al (1999), “Range of neuropsychiatric disturbances in patients with Parkinson's disease”, J Neurol Neurosurg Psychiatry 67: 492-6, PMID 10486397
- ^ Kirsch-Darrow, L; Fernandez, HH; Marsiske, M; Okun, MS; Bowers, D (2006), “Dissociating apathy and depression in Parkinson disease”, Neurology 67: 33-8, PMID 16832074
- ^ a b Cummings, JL (1988), “Intellectual impairment in Parkinson's disease: clinical, pathologic, and biochemical correlates”, J Geriatr Psychiatry Neurol 1: 24-36, PMID 2908099
- ^ Wolters, EC (2001), “Intrinsic and extrinsic psychosis in Parkinson's disease”, J Neurol 248 Suppl 3: III22-7, PMID 11697684
- ^ Valerie Voon, Susan H. Fox(菊地誠志監訳)「パーキンソン病における衝動制御障害」山本 (2008) 所収、pp.202-212
- ^ Aarsland, D; Zaccai, J; Brayne, C (2005), “A systematic review of prevalence studies of dementia in Parkinson's disease”, Mov Disord 20: 1255-63, PMID 16041803
- ^ a b 水野 (1999) p.1867
- ^ 山本 (2008) 序
- ^ パーキンソン病治療ガイドライン2002の総論日本神経学会のサイト内のページ
- ^ Zanettini, R; Antonini, A; Gatto, G; Gentile, R; Tesei, S; Pezzoli, G (2007), “Valvular heart disease and the use of dopamine agonists for Parkinson's disease”, NEJM 356: 39-46, PMID 17202454full text
- ^ ペルマックス添付文書、カバサール添付文書
- ^ ペルマックス患者用説明、カバサール患者用ガイド
- ^ 林明人. Parkinson病と音楽療法. 神経内科2007; 67: 236-242
- ^ “Sept4, a Component of Presynaptic Scaffold and Lewy Bodies, Is Required for the Suppression of alpha-Synuclein Neurotoxicity.”. Neuron 53 (4): 519-33. (2007). PMID 17296554.
- ^ Wernig, M, et al (2008), “Neurons derived from reprogrammed fibroblasts functionally integrate into the fetal brain and improve symptoms of rats with Parkinson's disease”, Proc Natl Acad Sci U S A 105: 5856-61, PMID 18391196
- ^ Post, B; Merkus, MP; de Haan, RJ; Speelman, JD; CARPA study group (2007), “Prognostic factors for the progression of Parkinson's disease: a systematic review”, Mov Disord 22: 1839-51, PMID 17595026
参考文献
- 水野美邦「Parkinson病」杉本・小俣編『内科学』第7版、朝倉書店、1999年、pp.1864-1868、ISBN 4254321864
- 村上史織・野口拓也・一條秀憲「神経変性疾患とASK1のシグナル伝達」高橋良輔編『神経変性疾患のサイエンス』、南山堂、2007年、pp.80-90、ISBN 9784525130916
- 山本光利編著『パーキンソン病 病因病態と治療、うつ・衝動制御障害』、中外医学社、2008年、ISBN 9784498128422
- パーキンソン病Q&A 日本醫亊新報社 ISBN 9784784964031
- 岩田誠『神経症候学を学ぶ人のために』、医学書院、1994年 ISBN 4260117866
関連項目
外部リンク
- 難病情報センター - 特定疾患情報 パーキンソン病
- 全国パーキンソン病友の会
- 国立病院機構宇多野病院関西脳神経筋センター・パーキンソン病センター
- プライマリケア医とパーキンソン病 池田正行教授による総説
- 薬理学電子教科書(上) - 抗パーキンソン病薬
- shorterlink.com - Parkinson's Disease : symptoms, diagnosis, biochemistry, causes, treatments, history, prevalence, organisations, toxic causes, genetic causes]
- マイケル・J・フォックス パーキンソン病リサーチ財団 研究、治療に関する最新情報(英文)
- グーグルのセルゲイ・ブリン氏がパーキンソン病の治療を検索(英文)
