「酢酸」の版間の差分
m →製造: - |
|||
| (4人の利用者による、間の16版が非表示) | |||
| 1行目: | 1行目: | ||
{{Chembox |
{{Chembox |
||
| 出典=[http://www.nihs.go.jp/ICSC/icssj-c/icss0363c.html ICSC] |
| 出典=[http://www.nihs.go.jp/ICSC/icssj-c/icss0363c.html ICSC] |
||
| Name = 酢酸 |
|||
| ImageFile = Acetic acid structures4.png |
|||
| ImageFileL1 = Acetic-acid-2D-skeletal.svg |
|||
| ImageSize = 270px |
|||
| ImageSizeL1 = 121px |
|||
| IUPACName = 酢酸(許容慣用名)<br />エタン酸(系統名) |
|||
| ImageNameL1 = Skeletal formula of acetic acid |
|||
| ImageFileR1 = Acetic-acid-CRC-GED-3D-vdW-B.png |
|||
| ImageSizeR1 = 121px |
|||
| ImageNameR1 = Spacefill model of acetic acid |
|||
| ImageFileL2 =Acetic-acid-2D-flat.png |
|||
| ImageSizeL2 = 121px |
|||
| ImageNameL2 = Skeletal formula of acetic acid with all explicit hydogens added |
|||
| ImageFileR2 = Acetic-acid-CRC-GED-3D-balls-B.png |
|||
| ImageSizeR2 = 121px |
|||
| ImageNameR2 = Ball and stick model of acetic acid |
|||
| IUPACName = 酢酸(許容慣用名)<br />エタン酸(系統名) |
|||
| Section1 = {{Chembox Identifiers |
| Section1 = {{Chembox Identifiers |
||
| CASNo = 64-19-7 |
| CASNo = 64-19-7 |
||
| SMILES=CC(=O)O |
| SMILES=CC(=O)O |
||
| KEGG = C00033 }} |
| KEGG = C00033 |
||
}} |
|||
| Section2 = {{Chembox Properties |
| Section2 = {{Chembox Properties |
||
| Formula = C<sub>2</sub>H<sub>4</sub>O<sub>2</sub> |
| Formula = C<sub>2</sub>H<sub>4</sub>O<sub>2</sub>, CH<sub>3</sub>COOH |
||
| MolarMass = |
| MolarMass = 60.05 |
||
| Appearance = 無色液体 |
| Appearance = 無色液体 |
||
| Density = 1.049, 液体 |
| Density = 1.049, 液体 |
||
| 相対蒸気密度=2.1 |
| 相対蒸気密度=2.1 |
||
| 水への溶解度=自由に混和 |
| 水への溶解度=自由に混和 |
||
| 融点=16.7 |
| 融点=16.7 |
||
| 沸点=118 |
| 沸点=118 |
||
| pKa=4.76 | pKb= |
| pKa=4.76 | pKb= |
||
| 旋光度= | 粘度= | 屈折率=1.3715 }} |
| 旋光度= | 粘度= | 屈折率=1.3715 |
||
}} |
|||
}} |
}} |
||
'''酢酸'''(さくさん、旧字 |
'''酢酸'''(さくさん、旧字'''醋酸'''、{{lang-en-short|acetic acid}})は、[[化学式]]が CH<sub>3</sub>COOH と表される簡単な[[カルボン酸]]の一種である。[[IUPAC命名法]]では酢酸は許容慣用名であり、系統名は'''エタン酸''' ethanoic acid である。純粋なものは冬に凍結することから'''氷酢酸'''(ひょうさくさん)と呼ばれる。2分子の酢酸が脱水縮合すると別の化合物の[[無水酢酸]]となる。 |
||
[[酢]]に含まれる弱酸で、強い酸味と刺激臭を持つ。[[遊離酸]]・[[塩 (化学)|塩]]・[[エステル]]の形で植物界に広く分布する。[[発酵|酸敗]]した[[牛乳|ミルク]]・[[チーズ]]のなかにも存在する。 |
|||
純粋な酢酸は融点約 17℃と室温よりやや低い程度であり、水分が少ないものは冬に凍ってしまうことから'''氷酢酸''' (glacial acetic acid) と呼ばれる。2分子の酢酸が脱水縮合すると別の化合物の[[無水酢酸]]となる。 |
|||
[[試薬]]や工業品として重要であり、合成樹脂の[[アセチルセルロース]]や接着剤の[[ポリ酢酸ビニル]]などの製造に使われる。全世界での消費量は年間およそ6.5メガトンである。このうち1.5メガトンが再利用されており、残りは石油化学原料から製造される<ref name=Ullmann />。生物資源からの製造も研究されているが、大規模なものには至っていない。 |
|||
[[遊離酸]]・[[塩 (化学)|塩]]・[[エステル]]の形で植物界に広く分布する。[[発酵|酸敗]]した[[牛乳|ミルク]]・[[チーズ]]のなかにも存在する。 |
|||
== 歴史 == |
== 歴史 == |
||
[[ファイル:Essig-1.jpg|thumb|left|180px|バルサミコ酢と赤・白のワインビネガー]] |
|||
[[ファイル:AceticAcid012.jpg||thumb|氷酢酸]][[酢]]の歴史は文明と同程度に古く、[[酢酸菌|酢酸産生菌]]はいたるところに存在する。そして、[[ビール]]や[[ワイン]]など[[酒]]を醸造する文明は、[[アルコール飲料]]を大気にさらすと、自然な帰結により酢を発見することになる。 |
|||
=== 酢の利用 === |
|||
[[酢]]の歴史は文明と同程度に古く、[[酢酸菌|酢酸産生菌]]はいたるところに存在する。そして、[[ビール]]や[[ワイン]]など[[酒]]を醸造する文明は、[[アルコール飲料]]を大気にさらすと、自然と酢ができることを発見することになる<ref name="Payen">{{cite book | author=Payen, Anselme M. | year=1878 | title=Industrial chemistry: A manual for use in technical colleges or schools and for manufacturers, etc | editor=Paul, B. H. | publisher=Longmans, Green, and Co | location=London | pages=961–962 | url=http://books.google.co.jp/books?id=GR9DAAAAIAAJ&pg=PA961}}</ref>。紀元前、ギリシャの哲学者[[テオプラストス]]やローマの[[ウィトルウィウス]]、[[ガイウス・プリニウス・セクンドゥス|プリニウス]]は酢が金属に作用して芸術に有用な[[顔料]]、たとえば[[鉛白]](塩基性炭酸鉛)やビリジリス([[酢酸銅(II)]] を含む銅塩の緑色の混合物)となることについて著述している<ref name="Church">{{cite book | author=Church, Arthur Herbert | year=1890 | title=The chemistry of paints and painting | publisher=Seeley | location=London | page=111 | url=http://books.google.co.jp/books?id=a4c6AAAAMAAJ&pg=PA111}}</ref><ref name="GBPO">{{cite book | author=Great Britain Patent Office | year=1871 | title=Patents for inventions: abridgments of specifications | publisher=Office of the Commissioners of Patents for Inventons | location=London | page=p. xx}}</ref>。また、酢はその時代にはローマでは治療の目的<ref name="Payen" />、エジプトでは死体の保存<ref name="Thomson">{{cite book | author=Thomson, Robert Dundas | year=1854 | title=Cyclopaedia of chemistry with its applications to mineralogy, physiology | publisher=Griffin and Co. | location=London and Glasgow | page=3 | url=http://books.google.co.jp/books?id=8tDnAAAAMAAJ&pg=PA3}}</ref>に用いられていたともされている。[[古代ローマ人]]は酸っぱくなったワインを鉛の壷で煮沸すると、サパあるいは{{仮リンク|デフルタム|en|defrutum}}と呼ばれる非常に甘いシロップができることを見出している。サパやデフルタムの甘さは含まれる[[酢酸鉛(II)]] によるもので、その物質は鉛糖 (sugar of lead) とか土の糖 (sugar of saturn) と呼ばれ好まれたが、ローマ貴族の間で[[鉛中毒]]を引き起こした<ref name="村田">村田徳治 『廃棄物のやさしい化学』 第1巻、日報出版、2009年、52頁。ISBN 4-89086-180-7。</ref>。<!-- 主題から離れすぎるのでコメントアウト 後の[[ルートヴィヒ・ヴァン・ベートーヴェン|ベートーベン]]の難聴も、好物のワインに含まれていた sapa による鉛中毒の結果であるとする説が有力である。--> |
|||
=== 発見と研究 === |
|||
[[古代]]において、酢酸は化学的な面において使用されるようになる。ギリシヤの哲学者[[テオファントス]]は紀元前3世紀に酢が金属に作用して芸術に有用な[[顔料]]となり、[[白鉛]](white lead, [[炭酸鉛]])あるいはビリジリス(virigiris, [[酢酸銅]]を含む銅塩の混合物)の事について著述している。古代[[ローマ人]]は酸っぱくなったワインを鉛の壷で煮沸すると、sapa と呼ばれる非常に甘いシロップができることを見出している。Sapa は[[酢酸鉛]]を豊富に含み、その物質は、鉛の糖 (sugar of lead) とか土の糖 (sugar of saturn) と呼ばれ、ローマ貴族の間で[[鉛中毒]]を引き起こした。後の[[ルートヴィヒ・ヴァン・ベートーヴェン|ベートーベン]]の難聴も、好物のワインに含まれていた sapa による鉛中毒の結果であるとする説が有力である。 |
|||
8世紀に[[ジャービル・イブン=ハイヤーン]](ゲベル)は初めて酢の蒸留によって酢酸を得ている<ref name="Rezende">{{cite book | author=Rezende, Lisa | year=2006 | title=Chronology of science | publisher=Facts on File | location=New York | page=61 | isbn=0-8160-5342-1}}</ref>。また[[ルネサンス]]時代には、[[錬金術]]師たちは酢酸銅(II) などの金属酢酸塩を[[乾留]]して氷酢酸を製造した<ref name="Kirk-Othmer">{{cite book | author=Othmer, Donald F.; Kirk, Raymond E.; Kroschwitz, Jacqueline I.; Howe-Grant, Mary | year=1991 | title=Kirk-Othmer encyclopedia of chemical technology | volume=1 | publisher=Wiley | location=New Jersey | page=121 | isbn=047152669X}}</ref>。最初にそのような製法で酢酸を作り出したのは{{仮リンク|バシル・バレンティン|en|Basil Valentine}}とされている<ref name="Payen" />。16世紀の[[ドイツ]]の化学者{{仮リンク|アンドレアス・リバビウス|en|Andreas Libavius}}は、氷酢酸の製法と、得られた氷酢酸と酢との物性の比較について著述している<ref name="Kirk-Othmer" />。そのように、酢の中には水が存在するため物性が酢酸と異なることから、氷酢酸と酢の中の酸は別の物質であると長く信じられていたが<ref name="Griffiths">{{cite journal | author=Griffiths, Ralph | year=1799 | title=Memoir on the Acetic Acid. By P A. Adet | journal=The Monthly review | volume=28 | page=558}}</ref>、18世紀になるとフランス人化学者の{{仮リンク|ピエール・エディ|en|Pierre Adet}}により両者が同一であることが示された<ref name="Adet">{{cite journal | author=Adet, P. A. | year=1798 | title=Mémoire sur l'acide acétique | journal=Annales de Chemie | volume=27 | pages=299–319}}</ref><ref name="Darracq">{{cite journal | author=Darracq, M. | year=1802 | title=Obsercations on the Acetous and Acetic Acids | journal=Journals of the Royal Institution of Great Britain | volume=1 | page=132}}</ref>。 |
|||
1845年にドイツ人化学者の[[ヘルマン・コルベ]]は無機物から有機物である酢酸を合成できることを示した<ref name="Rocke">{{cite book | author=Rocke, Alan J. | year=1993 | title=The quiet revolution: Hermann Kolbe and the science of organic chemistry | publisher=University of California Press | location=Berkeley | pages=59–60}}</ref>。その反応は、まず[[二硫化炭素]]から[[四塩化炭素]]への塩素化で始まり、次いで[[テトラクロロエチレン]]への[[熱分解]]、そして[[トリクロロ酢酸]]への水性塩素化、最後に電解還元による酢酸の生成、というものだった<ref name="goldwhite">{{cite journal | last=Goldwhite | first = Harold | journal = The New Haven Section of the American Chemical Society | volume=20 | issue=3 | month=September | year=2003 | title=Short summary of the career of the German organic chemist, Hermann Kolbe}}</ref>。この結果は[[フリードリヒ・ウェーラー]]の尿素合成による[[生気論]]の否定を決定付けた<ref name="ベー有p2">{{Harvnb|山口|山本|田村|2010|p=2}}.</ref>。一方[[ルイ・パスツール]]は1862年に酢酸菌を発見し、酢の醸造に利用されるようになったが、得られる濃度が低いため工業用の酢酸の製造には適していなかった<ref name="桜井p2">{{Harvnb|桜井|2001|p=2}}</ref>。 |
|||
[[ルネサンス]]時代に[[錬金術]]師は金属酢酸塩を乾留して氷酢酸を製造した。16世紀の[[ドイツ]]の化学者[[アンドレアス・リバビリス]] (Andreas Libavius) は、氷酢酸の製法と、得られた氷酢酸と酢との物性の比較について著述している。酢のなかに水が存在するので、酢酸の物性は意味深いものとなり、氷酢酸と酢のなかの酸は別の物質であると明確に信じられていた。[[フランス]]人化学者の[[ピエール・エディ]] (Pierre Adet) が両者が同一であると発見し、1847年に[[ドイツ]]人化学者[[ヘルマン・コルベ]]が最初に無機物から酢酸を合成した。 |
|||
== |
=== 工業生産 === |
||
[[ファイル:Acetic acid 1884 plant.jpg|thumb|180px|酢酸の精製・濃縮工場(1884年)]] |
|||
[[常温]]で無色[[液体]]、刺激臭、[[酸味]]がある。[[水]]、[[エタノール]]、[[エーテル (化学)|エーテル]]とは任意の割合で混ざる。腐食性、可燃性がある。 |
|||
1910年頃までは、氷酢酸は大部分が木材の乾留で得られる[[木酢液]]から作られていた<ref name="Martin">{{cite book | last=Martin | first=Geoffrey | year=1917 | title=Industrial and Manufacturing Chemistry | edition=Part 1, Organic | location=London | publisher=Crosby Lockwood | pages=330–31 | url=http://babel.hathitrust.org/cgi/pt?view=image;size=100;id=mdp.39076005015040;page=root;seq=366;num=330}}</ref>。イギリスでは1820年ごろから<ref name="McClure">{{Cite web | author=McClure, David Courtney | url=http://www.ayrshirehistory.org.uk/AcidWorks/acidworks.htm | work=Ayrshire History | title=Kilkerran Pyroligneous Acid Works 1845 to 1945 | accessdate=2011-08-19}}</ref>、日本では明治時代に<ref name="桜井p2">{{Harvnb|桜井|2001|p=2}}</ref>、この方法による酢酸の製造が始められていた。木酢液を[[水酸化カルシウム]](石灰乳)で処理して生成する[[酢酸カルシウム]]を[[硫酸]]で酸性化することにより、酢酸が分離される<ref name="Martin" />。1917年頃のドイツは年間およそ1万トンの氷酢酸を生産していたが、その30%は[[インディゴ]]の製造に充てられていた<ref name="Martin" />。1910年代の半ば以降からは、ドイツとカナダで[[カルシウムカーバイド]]から得られる[[アセチレン]]を原料とした酢酸の製造が始められた<ref name="carbide">{{cite book | author=Almqvist, Ebbe | year=2003 | title=History of industrial gases | publisher=Springer | location=Berlin | page=118 | isbn=0306472775}}; {{cite book | author=Brown, William H.; Foote, Christopher S.; Iverson, Brent L.; Anslyn, Eric V. | year=2011 | title=Organic Chemistry | edition=6th edition | publisher= | location=Belmont | page=660 | isbn=084005498X}}</ref>。カルシウムカーバイドは[[コークス]](石炭の乾留物)を[[酸化カルシウム]](生石灰)とともに[[電気炉]]で加熱することにより得られるが、ドイツは石油に乏しいが石炭を産出すること、カナダは水力発電による電力を有することが有利な点であった<ref name="Aftalion">{{cite book | author=Aftalion, Fred | year=1991 | title=A history of the international chemical industry | publisher=University of Pennsylvania Press | location=Philadelphia | page=135}}</ref>。日本でも水力発電の発達に伴い、1928年以降この製法で酢酸が作られるようになった<ref name="桜井p3">{{Harvnb|桜井|2001|p=3}}</ref><ref name="有合化">紫垣明典 「酢酸製造プロセスの進歩」『有機化学合成協会誌』 第41巻、1983年553–560頁。</ref>。1937年に日本窒素肥料(現[[チッソ]])も同法による酢酸の製造を開始したが、アセチレンの酸化に用いられる[[硫酸水銀(II)]] がのちに[[水俣病]]の原因となった<ref name="藤森">藤森萬年 『産業倫理』 文芸社、2006年、43頁。</ref>。 |
|||
やがて石油化学工業が発展すると、酢酸の製造法は[[エチレン]]や[[アルカン]]を原料とするものに変わっていった<ref name="桜井p8">{{Harvnb|桜井|2001|p=8}}</ref>。さらに1960年代にドイツの[[BASF]]によってコバルト触媒、1970年にアメリカ合衆国の[[モンサント (企業)|モンサント]]によってロジウム触媒を用いた[[メタノール]]のカルボニル化反応が開発・実用化され、それ以降はこれらが工業的に主要な氷酢酸の製造法となった<ref name="桜井p6">{{Harvnb|桜井|2001|p=6}}</ref>。 |
|||
水溶液中では[[カルボキシル基]]から[[水素イオン|プロトン]]を失い、酢酸イオン (acetate ion) CH<sub>3</sub>COO<sup>−</sup> になることができる。酢酸の [[酸解離定数|p''K''a]] は 25 °Cにおいて約 4.8 である。 |
|||
== 名称 == |
|||
気体では酢酸は個々の分子の形態をとらず、相互に[[水素結合]]して対を成している([[二量体]])。それゆえ、酢酸の気体は理想気体の振る舞いから大きく乖離している。 |
|||
[[ファイル:AceticAcid012.jpg|thumb|left|180px|凍った酢酸(氷酢酸)]] |
|||
日本語の「酢酸」は江戸時代後期に[[宇田川榕菴]]が著書[[舎密開宗]]で用いたのが最初である<ref name="大森">{{cite web | url=http://www.shujitsu.ac.jp/shigaku/kyoyo/jdg/jdg-contents5-1-3.htm | title=舎密開教 | author=大森晋爾 | work=会報 第43号 | date=2000-12 | publisher=岡山日独協会 | accessdate=2011-08-19}}</ref>。オランダ語 azijnzuur の訳語であり、これはさらにドイツ語 Essigsäure、英語 acetic acid の訳語であった。これらの名称はそのまま現代でも使われ、acetic acid や「酢酸」は[[IUPAC命名法]]における許容慣用名<ref name="マクマリーp740">{{Harvnb|マクマリー|2009|p=740}}.</ref>かつ[[優先IUPAC名]] (PIN)<ref name="IUPAC">{{citation | author=IUPAC | year=2004 | url=http://old.iupac.org/reports/provisional/abstract04/BB-prs310305/Chapter1.pdf | title=Preferred IUPAC Names | chapter=Chapter P-1 Nomenclature of Organic Compounds | page=4}}.</ref> およびその訳語である。IUPAC系統名は「エタン酸」ethanoic acid であり<ref>{{cite web | author=貞廣知行 | url=http://homepage1.nifty.com/nomenclator/triv/ethane.htm | title=エタン誘導体 | date=2008-02-24 | accessdate=2011-08-19 | work=化合物命名法談義}}</ref>、これは母体化合物「エタン」 ethane にカルボン酸官能基を表す接尾辞「酸」 -oic acid を付加したものである。 |
|||
[[有機化学]]では[[アセチル基]] CH<sub>3</sub>C(=O)− の略号 Ac を用いて文章や化学式中で AcOH または HOAc と略記される。酢酸の[[エステル]]や[[塩 (化学)|塩]]は英語ではアセテート(アセタート) acetate と呼ばれる。たとえばエチルエステルの[[酢酸エチル]]は ethyl acetate、アンモニウム塩の[[酢酸アンモニウム]]は ammonium acetate である。 |
|||
化学反応の面では、[[アルコール]]や[[アミン]]からそれぞれ[[エステル]]や[[アミド]]を生成するなど、酢酸は一般的な[[カルボン酸]]の性質を示す。また、酢酸は[[アルケン]]に付加して酢酸エステルとなる。440 °Cに加熱すると分解して[[二酸化炭素]]と[[メタン]]となるか、もしくは[[ケテン]]と水とを生ずる。 |
|||
純粋な酢酸は室温が低いと固体になり、外見が[[氷]]に似ていることから「氷酢酸」(glacial acetic acid) とも呼ばれる<ref name="Stoddard">{{cite book | author=Stoddard, John Tappan | year=1918 | title=Introduction to Organic Chemistry | edition=2nd ed. | publisher=P. Blakiston's Son & Co. | location=Philadelphia | page=96 | url=http://books.google.com/books?id=ZKW4-3S8ryIC&pg=PA96}}Forgotten Books から2010年に再版されている。</ref>。古くは単に vinegar (酢)、 酢の蒸留によって得られたことから acetous acid (酢の酸)、木材の乾留で得られることから pyroligneous acid (火木酸)、ほか spilit of verdigris (ビリジリスの精)や wood vinegar (木酢)とも呼ばれた<ref name="Thomson" />。 |
|||
英語 acetic acid の語源は酢を意味するラテン語 ''acetum'' と「鋭い」を意味する ''acer'' に由来する<ref name="ベー有p30">{{Harvnb|山口|山本|田村|2010|p=30}}.</ref><ref name="Chemoetymology_p3">{{Harvnb|Senning|2007|p=3}}.</ref>。ここから派生して「アセト」acet(o)- の語は酢酸から得られたり構造が類似する化合物などにも用いられる。たとえば[[アセトン]]、[[アセトニトリル]]、[[アセトイン]]、[[アセトフェノン]]、アセチル基がそうである<ref name="Chemoetymology_p3" />。また炭素原子の数が同じく2個である[[ビニル基]](ビニル[[基|ラジカル]])も古くは acetic acid を語源としてアセチルラジカル acetyl radical と呼ばれており<ref name="Chemoetymology_p3" />、これに由来する名称を持つ化合物として[[アセチレン]]や[[アセナフテン]]などがある<ref name="Chemoetymology_p3" /><ref name="Chemoetymology_p2">{{Harvnb|Senning|2007|p=2}}.</ref>。 |
|||
== 性質 == |
|||
=== 物理的性質 === |
|||
{| class="wikitable" style="float: right; margin: 0 0 .5em .5em; clear: right;" |
|||
|+ 酢酸の濃度と比重の関係<ref name="Martin" /> |
|||
! 濃度 (重量%) !! 比重 (25 {{℃}}/4 {{℃}}) |
|||
|- |
|||
| 100 || 1.0553 |
|||
|- |
|||
| 90 || 1.0713 |
|||
|- |
|||
| 80 || 1.0748 |
|||
|- |
|||
| 70 || 1.0733 |
|||
|- |
|||
| 60 || 1.0685 |
|||
|- |
|||
| 50 || 1.0615 |
|||
|- |
|||
| 40 || 1.0523 |
|||
|} |
|||
[[常温]]では酸味と刺激臭を持つ無色透明の液体であり、融点は約 16.6 {{℃}}、沸点は約 118 {{℃}} である<ref name="Stoddard" />。水と共沸しない<ref name="Hilmen">{{Cite web | url = http://www.chemeng.ntnu.no/thesis/download/2000/hilmen/Thesis_Hilmen.pdf | title = Separation of Azeotropic Mixtures: Tools for Analysis and Studies on Batch Distillation Operation | accessdate = 2011-08-20| author = Hilmen, Eva-Katrine | year = 2000 | month = November | publisher = Norwegian University of Science and Technology, dept. of Chemical Engineering | page = 13}}</ref>。酢酸に少量の水を加えると融点が大きく下がり<ref name="Payen" />、水の割合が40%のとき最低値 −26.75 {{℃}} となる<ref name="Stoddard" />。冷却したとき、これよりも水が少ないと酢酸が、多いと氷が晶出する<ref name="Stoddard" />。また水との混合により[[比重]]が増加し、酢酸の濃度が約80%のとき最も大きくなり<ref name="Martin" />、43%のとき純粋な酢酸と同じになる<ref name="Stoddard" />。蒸気を燃やすとき、炎は淡青色である<ref name="Stoddard" />。 |
|||
酢酸は水、アセトニトリル、[[エタノール]]、[[酢酸エチル]]、[[クロロホルム]]、[[ベンゼン]]、[[ジエチルエーテル|エーテル]]、[[石油エーテル]]と任意の割合で混和する<ref name="PLC">{{cite book | author=Armarego, Wilfred L. F.; Chai, Christina L. L. | year=2009 | title=Purification of Laboratory Chemicals | edition=6th ed. | publisher=Elsevier | location=Burlington | page=40}}</ref><ref name="Celanese" />。[[オクタン]]など長鎖炭化水素には溶けにくく、溶解度は鎖が長くなるほど低くなる<ref name="Zieborak">{{citation | author=Zieborak, K.; Olszewski, K. | year=1958 | journal=Bulletin de l'Academie Polonaise des Sciences. Serie des Sciences Chimiques Geologiques et Geographiques | volume=6 | issue=2 | pages=3315–3322 | separator=.}}</ref>。二硫化炭素には不溶である<ref name="Celanese">{{cite web | publisher=Celanese | title=Product Description. Acetic Acid, Glacial | url=http://www.chemvip.com/proddesc-aceticacid-glacial-en.pdf | accessdate=2011-08-20}}</ref>。[[比誘電率]]は約6であり、あまり高くはないが<ref name="Emsley">{{cite journal | author=Emsley, John | date=1986-02-13 | journal=New Scientist | title=The solution is the problem | pages=33–37 | url=http://books.google.co.jp/books?id=Gu6wFrdExO4C&pg=PA33}}</ref>、無機塩や[[糖]]といった極性化合物を溶かすことができる<ref name="AP" />。また単体[[硫黄]] S<sub>8</sub>、[[ヨウ素]] I<sub>2</sub> など無極性の分子も酢酸に溶ける<ref name="AP">{{cite book | author=Thorpe, Gary | year=2007 | title=AP Chemistry | publisher=John Wiley and Sons | location=Hoboken | edition=4th ed. | page=63 | url=http://books.google.co.jp/books?id=peKfop1XI8AC&pg=PA63}}</ref>。ほかに[[ゼラチン]]、[[フィブリン]]、[[アルブミン]]、[[樟脳]]、[[ニトロセルロース]]も溶ける<ref name="Payen" />。酢酸の純度を知る古い方法として[[レモン油]]を加えるというものがあり、これは純粋な酢酸であれば重量で10%のレモン油を完全に溶かすことによる<ref name="Payen" />。 |
|||
酢酸を構成する炭素原子と酸素原子は平面上に位置し、結合角は C−C=O と C−C−OH が119°、O=C−OH が122°で、結合距離は C−C が 152 pm、C=O が125 pm、C−OH が131 pm である<ref name="マクマリーp742">{{Harvnb|マクマリー|2009|p=742}}.</ref>。 |
|||
==== 二量体 ==== |
|||
[[ファイル:Acetic acid cyclic dimer.png|thumb|酢酸の二量体。破線は水素結合を示す]] |
|||
酢酸は[[水素結合]]を介して2分子が結合した、環状の[[二量体]]を形成する<ref name="マクマリーp742" />。気体状態では[[電子回折]]により<ref name="Karle">{{cite journal | author=Karle, J.; Brockway, L. O. | year=1944 | title=An Electron Diffraction Investigation of the Monomers and Dimers of Formic, Acetic and Trifluoroacetic Acids and the Dimer of Deuterium Acetate | journal=Journal of the American Chemical Society | volume=66 | issue=4 | pages=574–584 | doi=10.1021/ja01232a022}}</ref>、固体状態では[[X線結晶構造解析]]により<ref name="Jones">{{cite journal | author=Jones, R. E.; Templeton, D. H. | year = 1958 | title = The crystal structure of acetic acid | journal = Acta Crystallographica | volume = 11 | issue = 7 | pages=484–487 | doi = 10.1107/S0365110X58001341}}</ref>、それぞれ構造が確認されている。純粋な液体状態ではほとんど単量体としては存在しないが、二量体となっているか、もしくは直鎖状あるいは環状の多量体となっているとされる<ref name="Briggs">{{cite journal | author=Briggs, James M.; Nguyen, Toan B.; Jorgensen, William L. | title=Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions | journal=The Journal of Physcal Chemistry | year=1991 | volume=95 | pages=3315–22 | doi=10.1021/j100161a065}}</ref>。希薄な溶液の場合、[[四塩化炭素]]<ref name="Davies">{{cite journal | author=Davies, M. M.; Sutherland, G. B. B. M. | year=1938 | title=The Infra‐Red Absorption of Carboxylic Acids in Solution I. Qualitative Features | journal=The Journal of Chemical Physics | volume=6 | isuue=12 | pages=755–767 | doi=10.1063/1.1750166}}</ref>やベンゼンなどの非プロトン性溶媒中では二量体を形成するが、水などプロトン性の溶媒中では単量体として存在する<ref name="Walker">{{cite book | author=Walker, James | year=1899 | title=Introduction to Physical Chemistry | publisher=Macmillan and Co. | location=New York | page=197 | url=http://books.google.com/books?id=evU_p902bKYC&pg=PA197}}</ref><ref name="CSV">{{cite journal | year=1998 | title=Hydrgen Bonding | journal=Competition Science Vision | volume=1 | issue=8 | pages=1164–1172 | url=http://books.google.com/books?id=F-gDAAAAMBAJ&pg=PA1164}}</ref>。 |
|||
この二量体を形成するという性質のため、酢酸(分子量60.05)の沸点は水素結合を作らない[[酢酸メチル]](分子量74.08、沸点 57 {{℃}}<ref name="MeOAc">{{cite web | publisher=Celanese | title=Product Description. Methyl Acetate | url=http://www.chemvip.com/proddesc-methyl_acetate-en.pdf | accessdate=2011-08-20}}</ref>)よりも高く、分子量が2倍程度のオクタン(分子量114.23、沸点 125 {{℃}})に近い<ref name="Sorrell">{{cite book | author=Sorrell, Thomas N. | year=2006 | title=Organic Chemistry | edition=2nd ed. | publisher=University Science Books | location=Sausalito | page=69 | url=http://books.google.com/books?id=txmp1aoCJp8C&pg=PA69}}</ref>。 |
|||
==== 酸性度 ==== |
|||
酢酸の[[カルボキシル基]] −COOH は溶液中でプロトン (H<sup>+</sup>) を放出し、解離して酢酸イオン(カルボキシラートイオン)となる<ref name="ベー有p32">{{Harvnb|山口|山本|田村|2010|p=32}}.</ref>。 |
|||
:CH<sub>3</sub>CO<sub>2</sub>H + H<sub>2</sub>O → CH<sub>3</sub>CO<sub>2</sub><sup>−</sup> + H<sub>3</sub>O<sup>+</sup> |
|||
この性質のため、酢酸は酸性を持つ。酢酸は弱酸であり、水溶液中でのp''K''<sub>a</sub>はおよそ4.76である<ref name="マクマリーp743" />。すなわち、1.0 mol/L の水溶液のpHは2.4となり、全体の0.4%が解離していることになる<ref>{{citation | title=地球環境化学夏休み宿題解答-1 | publisher=東京工業大学附属科学技術高等学校 | url=http://www.hst.titech.ac.jp/~meb/answer05.pdf}}</ref>。酢酸は塩酸や硫酸などの[[無機酸]]よりは弱く、[[炭酸]]や[[フェノール類|フェノール]]、[[アルコール]]よりは強い酸である<ref name="ベー有p32" /><ref name="マクマリーp743">{{Harvnb|マクマリー|2009|p=743}}.</ref>。 |
|||
=== 化学反応 === |
|||
==== 酸としての反応 ==== |
|||
塩基である[[炭酸カリウム]]と混合すると、中和により[[酢酸カリウム]]が生成する。これを[[単離]]し酢酸に溶かして加熱すると脱水して二酢酸カリウムとなり、200 {{℃}} 以上でさらに反応して無水酢酸と酢酸カリウムに分離する<ref name=Schorlemmer>{{cite book | author=Schorlemmer, Carl | year=1874 | title=A manual of the chemistry of the carbon compounds | publisher=Macmillan | location=London | page=137 | url=http://books.google.co.jp/books?id=Kjs3AAAAMAAJ&pg=PA137}}</ref>。 |
|||
:CH<sub>3</sub>COOH + K<sub><sub>2</sub></sub>CO<sub>3</sub> → CH<sub>3</sub>COOK + H<sub>2</sub>CO<sub>3</sub> |
|||
:CH<sub>3</sub>COOH + CH<sub>3</sub>COOK → (CH<sub>3</sub>COO)<sub>2</sub>KH + H<sub>2</sub>O |
|||
:(CH<sub>3</sub>COO)<sub>2</sub>KH → (CH<sub>3</sub>CO)<sub>2</sub>O + CH<sub>3</sub>COOK |
|||
酢酸は[[アルミニウム]]、[[銅]]、[[銀]]、[[チタン]]、[[ジルコニウム]]を腐食しないので、これらの金属は酢酸の容器として利用できる。一方、[[鉛]]や[[ステンレス]]は酢酸によって侵される<ref name=Craig>{{cite book | author=Craig, Bruce D.; Anderson, David S. | year=1995 | title=Handbook of Corrosion Data | edition=2nd ed. | publisher=ASM International | location=Russell Township, Ohio | pages=pp. 88–89 | url=http://books.google.co.jp/books?id=KXwgAZJBWb0C&lpg=PA11&pg=RA1-PT41#v=onepage&q&f=false}}</ref>。また、酢酸は[[マグネシウム]]と反応して[[水素]]と[[酢酸マグネシウム]]を生じる<ref name=Xam>{{cite book | author=Jain, Rahul | year=2005 | title=Xam Idea - Science | edition=6th ed. | publisher=V. K. (India) Enterprises | location=New Delhi | page=31 | url=http://books.google.co.jp/books?id=nRLQcNzSyVAC&pg=PP41}}</ref>。 |
|||
:2 CH<sub>3</sub>COOH + Mg → (CH<sub>3</sub>COO)<sub>2</sub>Mg + H<sub>2</sub> |
|||
==== カルボキシル基の変換 ==== |
|||
{{Imageframe|width=250|content=[[ファイル:Acetic-acid-CRC-GED-3D-balls-A.png|100px]][[ファイル:Ethyl-acetate-3D-balls.png|150px]]|caption=酢酸(左)と[[酢酸エチル]](右)の[[分子モデル|分子模型]]}} |
|||
酢酸はカルボン酸として一般的な反応性を示す。たとえば[[硫酸]]を触媒として[[アルコール]]と共に加熱すると[[酢酸エステル]]が生成する。これは[[フィッシャーエステル合成反応]]と呼ばれる方法である。[[可逆反応]](平衡反応)であるため、エステル生成物を効率よく得るには出発物質を過剰に使用する必要があり、[[3-メチル-1-ブタノール|イソペンチルアルコール]]との反応による[[酢酸イソアミル|酢酸イソペンチル]]の合成では、過剰量の酢酸が用いられる<ref name=Pavia>{{cite book | author=Pavia, Donald L. | year=2005 | title=Introduction to Organic Laboratory Techniques | publisher=Thomson Learning | location=Belmont | pages=pp. 93–96 | url=http://books.google.co.jp/books?id=ega5c11VHvkC&pg=PA93#}}</ref>。 |
|||
:CH<sub>3</sub>COOH + C<sub>5</sub>H<sub>11</sub>OH → CH<sub>3</sub>COOC<sub>5</sub>H<sub>11</sub> + H<sub>2</sub>O |
|||
酢酸からのエステル合成法としては他に[[アルケン]]への[[付加反応|付加]]があり、[[ヘテロポリ酸]]を触媒として[[エチレン]]から[[酢酸エチル]]が得られる<ref name=Kozhevnikov>{{cite book | author=Kozhevnikov, Ivan V. | year=2002 | title=Catalysis by Polyoxometalates | publisher=John Wiley & Sons | location=Chichester | series=Catalysts for Fine Chemical Synthesis | volume=2 | page=178 | url=http://books.google.co.jp/books?id=jaTXrZyGSuAC&pg=PA178}}</ref>。 |
|||
:CH<sub>3</sub>COOH + CH<sub>2</sub>=CH<sub>2</sub> → CH<sub>3</sub>COOCH<sub>2</sub>CH<sub>3</sub> |
|||
{{Imageframe|width=250|content=[[ファイル:Acetamide-3D-balls.png|125px]][[ファイル:Acetyl-chloride-3D-balls.png|125px]]|caption=[[アセトアミド]](左)と[[塩化アセチル]](右)の分子模型|align=right}} |
|||
炭酸アンモニウムと混合して加熱すると、酢酸アンモニウムの生成と脱水を経て[[アセトアミド]]が得られる。この反応は蒸留によって酢酸を除きながら行い、さらに沸点のより高い残渣を引き続いて蒸留し、純粋な目的物を得る<ref name=OS1923>{{OrgSynth | author=Coleman, G. H.; Alvarado, A. M. | year=1923 | title=Acetamide | volume=3 | pages=3 | collvol=1 | collvolpages=3 | prep=cv1p0003}}</ref>。[[アンモニア]]を使っても同様な反応が起きる<ref name=OS1923 />。 |
|||
:2 CH<sub>3</sub>COOH + (NH<sub>4</sub>)<sub>2</sub>CO<sub>3</sub> → 2 CH<sub>3</sub>COONH<sub>4</sub> + H<sub>2</sub>CO<sub>3</sub> |
|||
:CH<sub>3</sub>COONH<sub>4</sub> → CH<sub>3</sub>CONH<sub>2</sub> + H<sub>2</sub>O |
|||
[[カルボン酸塩化物]]である[[塩化アセチル]]は、酢酸と[[三塩化リン]]や[[塩化チオニル]]などの反応で得られる<ref name=Ahluwalia>{{cite book | author=Ahluwalia, V. K.; Aggarwal, R. | year=2000 | title=Comprehensive Practical Organic Chemistry | publisher=Universities Press (India) | location=Hyderabad | pages=pp. 14–15 | url=http://books.google.co.jp/books?id=mnsKyupepQEC&pg=PA14}}</ref>。塩化チオニルは過剰量を用いるが、蒸留では塩化アセチルと分離しづらいため、余ったぶんは[[ギ酸]]と反応させて分解する<ref name=Ahluwalia />。 |
|||
:CH<sub>3</sub>COOH + SOCl<sub>2</sub> → CH<sub>3</sub>COCl + SO<sub>2</sub> + HCl |
|||
==== 脱水 ==== |
|||
{{Imageframe|width=250|content=[[ファイル:Acetic-anhydride-3D-balls.png|150px]][[ファイル:Ketene-3D-balls.png|100px]]|caption=[[無水酢酸]](左)と[[ケテン]](右)の分子模型|align=right}} |
|||
加熱により2分子間で[[脱水縮合]]を起こし、[[無水酢酸]]を与える。環状の[[酸無水物]]を生成する場合を除き、このような反応はほかのカルボン酸では起こらない<ref name="マクマリーp781">{{Harvnb|マクマリー|2009|p=781}}.</ref>。 |
|||
:2 CH<sub>3</sub>COOH → (CH<sub>3</sub>CO)<sub>2</sub>O + H<sub>2</sub>O (800 {{℃}}) |
|||
また、[[リン酸エステル]]の存在下に 700–800 {{℃}} に加熱すると、分子内脱水により[[ケテン]](エテノン)を生じる<ref name=Chauvel>{{cite book | author=Chauvel, A.; Lefebvre, G. | year=1989 | title=Petrochemical Processes | volume=Vol. 2 | publisher=Editions Technip | location=Paris | page=59 | url=http://books.google.co.jp/books?id=3fkEv6TDqpkC&pg=PA59}}</ref>。 |
|||
:CH<sub>3</sub>COOH → CH<sub>2</sub>=C=O + H<sub>2</sub>O (O=P(OCH<sub>2</sub>CH<sub>3</sub>)<sub>3</sub>, 700–800 {{℃}}) |
|||
さらに、酢酸はケテンに付加して無水酢酸を与える<ref name=Wittcoff>{{cite book | author=Wittcoff, Harold; Reuben, B. G.; Plotkin, Jeffrey S. | year=2004 | title=Industrial Organic Chemicals | edition=2nd ed. | publisher=John Wiley & Sons | location=Hoboken | pages=pp. 365–369 | url=http://books.google.co.jp/books?id=4KHzc-nYPNsC&pg=PA365}}</ref>。 |
|||
:CH<sub>3</sub>COOH + CH<sub>2</sub>=C=O → (CH<sub>3</sub>CO)<sub>2</sub>O |
|||
==== メチル基での反応 ==== |
|||
[[ファイル:Chloroacetic-acid-3D-balls.png|thumb|150px|[[クロロ酢酸]]の分子模型]] |
|||
日光を当てながら酢酸と塩素を反応させると、水素原子と塩素原子が交換した[[クロロ酢酸]]が生成する<ref name=Kane>{{cite book | author=Kane, Robert; Draper, John William | year=1851 | title=Elements of Chemistry | publisher=Harper and Brothers | location=New York | page=564 | url=http://books.google.co.jp/books?id=1KWzya73ITsC&pg=PA564}}</ref>。この反応は[[ラジカル (化学)|ラジカル]]の発生を含む機構で進行し、[[ジクロロ酢酸]]や[[トリクロロ酢酸]]が副生成物となるが、触媒の使用によりそれらの生成を抑えることもできる<ref name=>{{cite journal | author=Maki-Arvela, Paivi; Salmi, Tapio; Paatero, Erkki | year=1994 | title=Kinetics of the Chlorination of Acetic Acid with Chlorine in the Presence of Chlorosulfonic Acid and Thionyl Chloride | journal=Industrial & Engineering Chemistry Research | volume=33 | number=9 | pages=2073–2083 | doi=10.1021/ie00033a008}}</ref>。 |
|||
:CH<sub>3</sub>COOH + Cl<sub>2</sub> → CH<sub>2</sub>ClCOOH + HCl |
|||
同様にして[[臭素]]と[[リン]]触媒を使って酢酸から[[ブロモ酢酸]]を作ることができる<ref name=Dalton>{{cite book | author=Dalton, David R. | year=2011 | title=Foundations of Organic Chemistry | publisher=John Wiley & Sons | location=Hoboken | pages=pp. 648–649 | url=http://books.google.co.jp/books?id=2rxFRgp57_0C&pg=PA648}}</ref>。この合成法は[[ヘル・ボルハルト・ゼリンスキー反応]]と呼ばれる。 |
|||
== 生化学 == |
== 生化学 == |
||
酢酸は生体内で活性化体である[[アセチルCoA]](アセチル補酵素A)としてさまざまな役割を果たす。アセチルCoAは活性酢酸とも呼ばれる<ref name=Izumiya>泉屋信夫、野田耕作、下東康幸 『生物化学序説』 第2版、化学同人、1998年、129–135頁。</ref>酢酸の[[チオエステル]]体であり、CoASHはよい[[脱離基]]として働くため酢酸そのものよりも[[置換反応]]が起こりやすい<ref name=BruiceE>パウラ・Y・ブルース 『[http://books.google.co.jp/books?id=vD7oGQheNNYC&pg=PA559 有機化学概説]』 第2版、大船泰史、[[香月勗]]、西郷和彦、富岡清 監訳、化学同人、2010年、559頁。</ref>。 |
|||
酢酸は[[補酵素A|コエンザイムA]] (CoA) と結合した状態で、ほとんど全ての生命形態において代謝と生合成のプロセスにおける中核を担っている。それゆえ、砂糖やエタノールを含む食物や飲料にある種の細菌が作用すると酢酸を生ずるのである。 |
|||
[[ファイル:Acetyl-CoA-3D-balls.png|thumb|300px|[[アセチルCoA]]の分子模型。左端の黄色い硫黄原子上にアセチル基が結合している]] |
|||
アセチルCoAは体内での代謝経路、すなわち、[[解糖系]]による[[糖]]からの[[ピルビン酸]]の生成とそれに続く[[補酵素A]]との結合<ref name=McMarry_p1125>{{Harvnb|マクマリー|2009|pp=1125–1135}}.</ref>、[[脂肪酸]]の[[β酸化]]の繰り返しによる逐次分解<ref name=Bruice_p1273>{{Harvnb|ブルース|2009|pp=1273–1275}}.</ref>、そしてアミノ基転移を経る[[アミノ酸]]の異化<ref name=Bruice_p1281>{{Harvnb|ブルース|2009|pp=1281–1282}}.</ref>によって生成する。また、アセチルCoAリガーゼ(アセチルCoA合成酵素)により酢酸と[[補酵素A]]から直接合成される。2種類のアセチルCoAリガーゼにより以下の反応が起こる。 |
|||
:{| |
|||
| 酢酸 + [[アデノシン三リン酸|ATP]] + CoA → アセチルCoA + [[アデニル酸|AMP]] + [[二リン酸]] || style="padding-left: 2em" | [[アセチルCoAリガーゼ]] (EC 6.2.1.1)<ref name=EC6211>{{cite web | url=http://www.chem.qmul.ac.uk/iubmb/enzyme/EC6/2/1/1.html | title=EC 6.2.1.1| work=IUBMB Enzyme Nomenclature | accessdate=2011-09-04}}</ref> |
|||
|- |
|||
|酢酸 + ATP + CoA → アセチルCoA + [[アデノシン二リン酸|ADP]] + [[リン酸]] || style="padding-left: 2em" | [[アセチルCoAリガーゼ (ADP生成)]] (EC 6.2.1.13)<ref name=EC62113>{{cite web | url=http://www.chem.qmul.ac.uk/iubmb/enzyme/EC6/2/1/13.html | title=EC 6.2.1.1| work=IUBMB Enzyme Nomenclature | accessdate=2011-09-04}}</ref> |
|||
|} |
|||
生成したアセチルCoAは[[クエン酸回路]]でのエネルギー生産や、[[脂肪酸の合成]]、[[メバロン酸経路]]による[[テルペノイド]]・[[ステロイド]]の[[生合成]]などに利用される<ref name=Izumiya /><ref name=>K・P・C・ボルハルト、N・E・ショアー 『[http://books.google.co.jp/books?id=PdD-Nv267EwC&pg=PA921 現代有機化学]』 第4版 下巻、古賀憲司、[[野依良治]]、村橋俊一 監訳、大嶌幸一郎、小田嶋和徳、小松満男、戸部義人 訳、化学同人、2004年、921–925頁。</ref><ref name=McMarry_p1054>{{Harvnb|マクマリー|2009|pp=1054–1073}}.</ref>。クエン酸回路による代謝では、酢酸は最終的に二酸化炭素と水になる<ref name=Hatayama>畑山巧 『[http://books.google.com/books?id=_LWyzHAjVTgC&pg=PA149 ベーシック生化学]』 化学同人、2009年、149–151頁。</ref>。 |
|||
[[ファイル:Acetylcholine-3D-balls.png|thumb|180px|left|[[アセチルコリン]]の分子模型]] |
|||
[[アセチルコリン]]は[[コリン]]とアセチルCoAとから合成される神経伝達物質であり、神経細胞の末端において小胞体に蓄えられる。刺激を受けると放出され、受容体に結合することによって信号を伝達する。役目を終えるとすぐにアセチルコリン加水分解酵素によってコリンと酢酸とに分解される<ref name=Yonetani>米谷民雄 『[http://books.google.co.jp/books?id=JIb0myXxyDkC&pg=PA28 食品中の化学物質と安全性]』 日本食品衛生協会、2009年、28頁。</ref>。 |
|||
また、アルコール飲料を摂取すると人体では酢酸が生産される。エタノールは[[アセトアルデヒド]]を経て酵素[[アルデヒドデヒドロゲナーゼ]]により酢酸に変換される(「[[エタノールと人体]]」も参照)。 |
|||
[[メタン菌|メタン生成古細菌]](メタン菌)と呼ばれる古細菌のうち、[[メタノサエタ属]]や[[メタノサルキナ属]]は酢酸を代謝して[[メタン]]を生成することが知られており、汚水処理やバイオマス生産への利用が検討されている<ref name=Yukawa>湯川英明 監修 『[http://books.google.com/books?id=rldnQO4QMLkC&pg=PA223 CO2固定化・削減と有効利用]』 CMC出版、CMCテクニカルライブラリー 地球環境シリーズ 第336巻、2009年、223–224頁。</ref><ref name=Ohkuma>工藤俊章、大熊盛也 監修 『[http://books.google.com/books?id=x-w4ZL6i3fIC&pg=PA107 難培養微生物の利用技術]』CMC出版、CMCテクニカルライブラリー バイオテクノロジーシリーズ 第344巻、2010年、107頁。</ref>。 |
|||
[[サソリモドキ]]というクモ綱の節足動物は、後腹部から酢酸を噴射して身を守るとされている<ref name=McGavin>ジョージ・C・マクガヴァン 『[http://books.google.com/books?id=-RGjr5gAeWAC&pg=PA219 完璧版昆虫の写真図鑑]』 日本語版 野村周平 監修、日本ヴォーグ、2000年、219頁。</ref>。 |
|||
生物学上の重要性を示す例として、アルコール飲料を摂取すると、人体では酢酸が生産される。エタノールは[[アセトアルデヒド]]を経て[[アルデヒドデヒドロゲナーゼ]]酵素で酢酸に変換される。次いでアセチルCoAリガーゼで[[アセチルCoA]]へと変換される([[アルコール飲料#吸収代謝|アルコール飲料]]及び[[エタノールと人体]]の項に詳しい)。 |
|||
== 製造 == |
== 製造 == |
||
化学合成と[[バクテリア]]による[[発酵]]の両方によって作られる。今日では発酵法は全世界での生産量の10%を占めるに過ぎないが、食品の品質に関する法律は食用の酢として用いられる場合に生物由来であることを求めるものが多いため<ref>{{cite book | author=Myers, Richard L. | year=2007 | title=The 100 most important chemical compounds | publisher=Greenwood | location=Westport | page=3 | url=http://books.google.co.jp/books?id=MwpQWcIKMzAC&pg=PA3}}</ref>、依然として[[酢|食酢]]の製造には重要である<ref name=Yoneda>{{cite journal | author=Yoneda, Noriyki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve | year=2001 | title=Recent advances in processes and catalysts for the production of acetic acid | journal=Applied Catalysis A: General | volume=221 | pages=253–265 | doi=10.1016/S0926-860X(01)00800-6}}</ref>。化学工業で用いられる酢酸のおよそ8割は[[メタノール]]の[[カルボニル化]]によって作られている<ref>[[#McMurry2009|マクマリー (2009)]], 739頁。</ref>。 |
|||
[[ファイル:Acetic acid 1884 plant.jpg|thumb|酢酸の精製・濃縮工場(1884年)]] |
|||
化学合成と[[バクテリア]]による[[発酵]]の両方によって作られる。今日では発酵法は全世界での生産量の 10% を占めるに過ぎないが、食品の品質に関する法律は食用の酢として用いられる場合に生物由来である事を求めるものが多いため、依然として[[酢|食酢]]の製造には重要である。化学工業で用いられる酢酸の 75% は次に説明する[[メタノール]]の[[カルボニル化]]によって作られている。他の方法はその下に示す<small><ref>Yoneda, Noriyki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve (2001). ''Appl. Catal. A: Gen.'' '''221''': 253–265.</ref></small>。 |
|||
全世界での酢酸の純生産量はおよそ年5メガトンと見積もられ、その半分は[[アメリカ合衆国]]によるものである。[[ヨーロッパ]]での生産量は年に約1メガトンだが減少傾向にあり、日本では年0.7メガトンである(酢酸の2008年度日本国内生産量は |
全世界での酢酸の純生産量はおよそ年5メガトンと見積もられ、その半分は[[アメリカ合衆国]]によるものである。[[ヨーロッパ]]での生産量は年に約1メガトンだが減少傾向にあり、日本では年0.7メガトンである(酢酸の2008年度日本国内生産量は500,211トン、消費量は181,799トンである<ref>[http://www.meti.go.jp/statistics/tyo/seidou/result/ichiran/02_kagaku.html 経済産業省生産動態統計・生産・出荷・在庫統計]平成20年年計による</ref>)。残り1.5メガトンは毎年再利用されており、都合、全世界での市場流通量は年6.5メガトンとなる<ref>"Production report". ''Chem. Eng. News'' (July 11, 2005), 67–76.</ref><ref>Suresh, Bala (2003). [http://www.sriconsulting.com/CEH/Public/Reports/602.5000/ "Acetic Acid"]. CEH Report 602.5000, SRI International.</ref>。これにより、酢酸は世界で最も広く生産されている酸となっている。 |
||
=== メタノールのカルボニル化 === |
=== メタノールのカルボニル化 === |
||
[[ファイル:Monsanto process catalytic cycle.svg|thumb|400px|[[モンサント法]]における触媒サイクル]] |
|||
大部分の酢酸はこの方法によって生産されている。メタノールと[[一酸化炭素]]を下記の反応式に従って反応させる。 |
大部分の酢酸はこの方法によって生産されている。メタノールと[[一酸化炭素]]を下記の反応式に従って反応させる。 |
||
: CH<sub>3</sub>OH + CO → CH<sub>3</sub>COOH |
: CH<sub>3</sub>OH + CO → CH<sub>3</sub>COOH |
||
この方法は中間体として[[ヨードメタン]]を含む3段階の過程である。2段階目の反応は触媒を必要とし、通常これには金属錯体が用いられる。 |
この方法は中間体として[[ヨードメタン]]を含む3段階の過程である。2段階目の反応は触媒を必要とし、通常これには[[第9族元素]]の金属錯体が用いられる。 |
||
: CH<sub>3</sub>OH + HI → CH<sub>3</sub>I + H<sub>2</sub>O |
|||
: CH<sub>3</sub>I + CO → CH<sub>3</sub>COI |
|||
: CH<sub>3</sub>COI + H<sub>2</sub>O → CH<sub>3</sub>COOH + HI |
|||
同じプラントでも条件を変える |
同じプラントでも条件を変えることによって[[無水酢酸]]を製造することができる。メタノールと一酸化炭素は共に簡単に得られる原料であるため、メタノールのカルボニル化は長らく酢酸製造の魅力的な方法であった。{{仮リンク|セラニーズ|en|Celanese}}社のヘンリー・ドレフュス (Henry Drefyus) は本法の試験プラントを1925年頃に既に開発していた<ref>Wagner, F. S. (1978). "Acetic acid". In ''Kirk-Othmer Encyclopedia of Chemical Technology''; Grayson, M., Ed.; New York: John Wiley & Sons.; 3rd edition.</ref>。しかし、腐食性の混合物を200気圧という高圧下で反応させることができる装置がなかったため、当時は工業化することができなかった。最初の工業化は[[コバルト]]触媒を用いる方法で、[[ドイツ]]の化学会社 [[BASF]]社によって1963年に開発された。1968年に[[ロジウム]]触媒 (''cis''-[Rh(CO)<sub>2</sub>I<sub>2</sub>]<sup>−</sup>) が発見され、より低圧でほとんど副生物を発生させずに反応を進行させることが可能になった。この触媒を使用した最初のプラントは1970年にアメリカの化学会社[[モンサント (企業)|モンサント]]社によって建設され、ロジウム触媒によるメタノールのカルボニル化が酢酸製造の主要な方法になった([[モンサント法]])。1990年代後期、化学会社 BPケミカルズ社がロジウムを[[イリジウム]]で置き換えた[[カティバ法|カティバ触媒]] ([Ir(CO)<sub>2</sub>I<sub>2</sub>]<sup>−</sup>) を開発した。この触媒はより[[グリーンサスティナブルケミストリー|グリーン]]・高効率であり<ref name=Lancaster>{{cite book | author=Lancaster, Mike | year=2002 | title=Green Chemistry: an Introductory Text | location=Cambridge | publisher=Royal Society of Chemistry | pages=pp. 262–266 | isbn=0-85404-620-8}}</ref>、同じプラントで利用できるモンサント法にとって代わった。 |
||
=== アセトアルデヒドの酸化 === |
=== アセトアルデヒドの酸化 === |
||
モンサント法が工業化される以前には、大部分の酢酸は[[アセトアルデヒド]]の酸化によって製造されていた。メタノールのカルボニル化と競合するほどではないが、依然として第2の重要な製造法である。アセトアルデヒドは[[ブタン]]や軽[[ナフサ]]の酸化、あるいは[[エチレン]] |
モンサント法が工業化される以前には、大部分の酢酸は[[アセトアルデヒド]]の酸化によって製造されていた。メタノールのカルボニル化と競合するほどではないが、依然として第2の重要な製造法である。アセトアルデヒドは[[ブタン]]や軽[[ナフサ]]の酸化<ref name=Sakurai3>[[#Sakurai2001|桜井 (2001)]], 3–4頁。</ref>、あるいは[[エチレン]]の酸化([[ワッカー法]])によって作られる<ref>[[#Sakurai2001|桜井 (2001)]], 5頁。</ref>。 |
||
ブタンや軽ナフサを空気中で[[マンガン]]、コバルト、[[クロム]]などの金属イオンの存在下に加熱すると、 |
ブタンや軽ナフサを空気中で[[マンガン]]、コバルト、[[クロム]]などの金属イオンの存在下に加熱すると、[[ヒドロペルオキシド]]が生成したのちに分解し、酢酸を与える<ref name=Sakurai3 />。 |
||
: 2 C<sub>4</sub>H<sub>10</sub> + 5 O<sub>2</sub> → 4 CH<sub>3</sub>COOH + 2 H<sub>2</sub>O |
: 2 C<sub>4</sub>H<sub>10</sub> + 5 O<sub>2</sub> → 4 CH<sub>3</sub>COOH + 2 H<sub>2</sub>O |
||
一般的に、ブタンが液体状態である限界の高温で反応を進行させられるように温度と圧力を設定する。典型的には |
一般的に、ブタンが液体状態である限界の高温で反応を進行させられるように温度と圧力を設定する。典型的には150 {{℃}}、55気圧である。[[メチルエチルケトン]]、[[酢酸エチル]]、[[ギ酸]]、[[プロピオン酸]]などが副生物として得られる。これらの副生物も市場価値があるため、十分に採算が取れれば、これらがより多く生成するように条件が変更されることもある。もっとも、それらから酢酸を分離するには余分なコストがかかる。 |
||
ブタンの酸化と同様な条件・触媒を用いたアセトアルデヒドの空気酸化によっても酢酸が得られる。 |
ブタンの酸化と同様な条件・触媒を用いたアセトアルデヒドの空気酸化によっても酢酸が得られる。 |
||
: 2 CH<sub>3</sub>CHO + O<sub>2</sub> → 2 CH<sub>3</sub>COOH |
: 2 CH<sub>3</sub>CHO + O<sub>2</sub> → 2 CH<sub>3</sub>COOH |
||
近代的な触媒を用いれば、この反応によって酢酸が |
近代的な触媒を用いれば、この反応によって酢酸が95%以上の収率で得られる。主な副生物は酢酸エチル、ギ酸、[[ホルムアルデヒド]]で、これらは全て酢酸より沸点が低いため、蒸留によって容易に分離できる。 |
||
=== エチレンの酸化 === |
=== エチレンの酸化 === |
||
アセトアルデヒドは[[ワッカー法]]によりエチレンから作ることができ、これを上記の方法で酸化する。 |
アセトアルデヒドは[[ワッカー法]]によりエチレンから作ることができ、これを上記の方法で酸化する。より安価な1段階のエチレンからの酢酸の製造法が[[昭和電工]]によって工業化され、1997年に[[大分県]]でエチレン酸化プラントが開業された<ref name=Sano>{{cite journal | author=Sano, Ken-ichi; Uchida, Hiroshi; Wakabayashi, Syoichirou | year=1999 | title=A new process for acetic acid production by direct oxidation of ethylene | journal=Catalyst Surveys from Japan | volume=3 | pages=55–60 | doi=10.1023/A:1019003230537}}</ref>。その方法では[[タングストケイ酸]]などの[[ヘテロポリ酸]]上に担持された[[パラジウム]]触媒を用いる<ref>[[#Sakurai2001|桜井 (2001)]], 7–8頁。</ref>。エチレンの価格によっては、小さめのプラント(100–150キロトン/年)でメタノールのカルボニル化と競合する。しかしながら2009年に[[昭和電工]]は大分での酢酸製造設備を停止し、[[メタノール]]法の酢酸をマレーシア、中国などから輸入するようになった。これは[[ナフサ]]価格上昇にともない、[[エチレン]]価格も高騰したため、[[メタノール]]法酢酸製造プラントに対抗できなくなったためである<ref name=Ohitagodo>{{cite | title=休止状態の酢酸プラント廃棄も 昭和電工 | newspaper=大分合同新聞 | date=2009-08-01 | url=http://www.oita-press.co.jp/localNews/2009_124908787945.html | accessdate=2011-09-11}}</ref>。これにより現在日本で酢酸を製造するプラントは[[協同酢酸]]の1社のみとなった。 |
||
=== 発酵 === |
=== 発酵 === |
||
==== 酸化的発酵 ==== |
==== 酸化的発酵 ==== |
||
人類の歴史の大部分において、酢酸は酢の形で[[アセトバクター属]] (''Acetobacter'') の細菌によって作られてきた。十分な量の酸素を与えられれば、それらのバクテリアは様々なアルコールを含む食材から酢を作り出す。普通に使われるのは[[シードル|リンゴ酒]]、[[ワイン]]、発酵させた[[穀物]]、[[麦芽]]、[[米]]、すりつぶした[[ジャガイモ]]である。バクテリアによって促進される化学反応は、全体として以下のようなものである |
人類の歴史の大部分において、酢酸は酢の形で[[アセトバクター属]] (''Acetobacter'') の細菌によって作られてきた。十分な量の酸素を与えられれば、それらのバクテリアは様々なアルコールを含む食材から酢を作り出す。普通に使われるのは[[シードル|リンゴ酒]]、[[ワイン]]、発酵させた[[穀物]]、[[麦芽]]、[[米]]、すりつぶした[[ジャガイモ]]である。バクテリアによって促進される化学反応は、全体として以下のようなものである。 |
||
: C<sub>2</sub>H<sub>5</sub>OH + O<sub>2</sub> → CH<sub>3</sub>COOH + H<sub>2</sub>O |
: C<sub>2</sub>H<sub>5</sub>OH + O<sub>2</sub> → CH<sub>3</sub>COOH + H<sub>2</sub>O |
||
薄いアルコールの溶液に |
薄いアルコールの溶液にアセトバクター属を接種して保温すると、空気に触れている部分が数か月後に酢になる。工業的な酢の製造過程では、酸素を供給することによってバクテリアによる酸化を促進する。 |
||
発酵によって酢が初めて作られたのは、おそらくワインの製造の失敗によるものである。[[マスト (醸造学)|マスト]](must, 発酵中のブドウ果汁)の熟成時に温度が高すぎると、 |
発酵によって酢が初めて作られたのは、おそらくワインの製造の失敗によるものである。[[マスト (醸造学)|マスト]](must, 発酵中のブドウ果汁)の熟成時に温度が高すぎると、アセトバクター属が自然にブドウに付着している[[酵母]]を圧倒してしまう。料理、医療、保健衛生における酢の需要が増すと、ワイン製造者たちはすぐに、ブドウが熟してワインの製造に適するようになる前の暑い夏季に他の有機物を使って酢を作ることを学んだ。しかし、ワイン製造者たちは発酵の過程を理解していなかったため、その方法は時間がかかる上にいつも成功するとは限らなかった<ref name=Hromatka>{{cite journal | author=Hromatka, Otto; Ebner, Heinrich | title=Vinegar by Submerged Oxidative Fermentation | journal=Industrial & Engineering Chemistry |year=1959 | volume=51 | issue=10 | pages=1279–1280 | doi=10.1021/ie50598a033}}</ref>。 |
||
最初の近代的な工業的生産過程の1つは「促成法」あるいは「ジャーマン法」と呼ばれるもので、1823年にドイツで使われ始めた。この方法では、発酵は木の削り屑や炭を詰めた塔の中で行われる。アルコールを含んだ原料が塔の頂上から流し込まれ、新鮮な空気を自然に、または人為的な対流によって供給する。空気の供給量を増やすことによって、数ヶ月かかった酢の製造は数週間に短縮された。 |
最初の近代的な工業的生産過程の1つは「促成法」あるいは「ジャーマン法」と呼ばれるもので、1823年にドイツで使われ始めた。この方法では、発酵は木の削り屑や炭を詰めた塔の中で行われる。アルコールを含んだ原料が塔の頂上から流し込まれ、新鮮な空気を自然に、または人為的な対流によって供給する。空気の供給量を増やすことによって、数ヶ月かかった酢の製造は数週間に短縮された<ref name=Partridge>{{cite journal | author=Partridge, Everett P. | year=1931 | title=Acetic Acid and Cellulose Acetate in the United States. A General Survey of Economic and Technical Developments | journal=Industrial & Engineering Chemistry | volume=23 | issue=5 | pages=482–498 | doi=10.1021/ie50257a005}}</ref>。 |
||
今日における酢の製造には1949年にオットー・ホロマツカ |
今日における酢の製造には1949年にオットー・ホロマツカとハインリヒ・エプナーによって考案された<ref name=Hromatka1949>{{cite journal | author=Hromatka, Otto; Ebner, Heinrich | year=1949 | title=Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures | journal=Enzymologia | volume=13 | page=369}}</ref>浸水形の培養槽が用いられている。この方法では、発酵は撹拌されるタンクの中で溶液に酸素を通じさせながら行われ、15%の酢酸を含んだ酢が24時間で、[[流加培養法]]を使うと20%の濃度のものが60時間ででき上がる<ref name=Hromatka />。 |
||
==== 無気性発酵 ==== |
==== 無気性発酵 ==== |
||
[[クロストリジウム属]] (''Clostridium'') のある種の好気性バクテリアは[[糖]]類を直接酢酸に変換させることができ、中間体としてエタノールを必要としない。これらのバクテリアによる化学反応は全体として次のようなものである |
|||
: C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> → 3 CH<sub>3</sub>COOH |
: C<sub>6</sub>H<sub>12</sub>O<sub>6</sub> → 3 CH<sub>3</sub>COOH |
||
工業化学者の観点から興味深い |
工業化学者の観点から興味深いことに、これらの[[酢酸菌|酢酸産生菌]]の多くはメタノール、一酸化炭素、または[[二酸化炭素]]と[[水素]]の混合物など、1炭素の化合物から直接酢酸を作り出すことができる。 |
||
: 2 CO<sub>2</sub> + 4 H<sub>2</sub> → CH<sub>3</sub>COOH + 2 H<sub>2</sub>O |
: 2 CO<sub>2</sub> + 4 H<sub>2</sub> → CH<sub>3</sub>COOH + 2 H<sub>2</sub>O |
||
糖類またはより安価な原料を直接酢酸の製造に利用できる |
糖類またはより安価な原料を直接酢酸の製造に利用できるクロストリジウム属の能力は、アセトバクター属のようなエタノール酸化菌より効率的に酢酸を作り出せる可能性があることを示している。しかしながら、クロストリジウム属は酸に弱く、最も酸に強い クロストリジウム属でも数%の酢酸を含む酢しか作れない。一方、アセトバクター属には酢酸濃度20%までの酢を作ることができるものがある。現時点では アセトバクター属を使う酢の製造はクロストリジウム属で作った酢を濃縮するよりも価格面でより効率的である。その結果、酢酸産生菌は1940年からその存在が知られているものの、工業的な利用は限られた条件下の場合のみである。 |
||
== 用途 == |
== 用途 == |
||
| 101行目: | 218行目: | ||
=== 酢酸ビニルモノマー === |
=== 酢酸ビニルモノマー === |
||
酢酸の主要な用途は[[酢酸ビニル]]モノマーの製造である。全世界で生産される酢酸のうち |
酢酸の主要な用途は[[酢酸ビニル]]モノマーの製造である。全世界で生産される酢酸のうち40%–45%がこの目的で消費される。[[酸素]]の存在下、[[エチレン]]と酢酸を[[パラジウム触媒]]で反応させる。 |
||
: 2 CH<sub>3</sub>COOH + 2 CH<sub>2</sub>=CH<sub>2</sub> + O<sub>2</sub> → 2 CH<sub>3</sub>COO−CH=CH<sub>2</sub> + 2 H<sub>2</sub>O |
: 2 CH<sub>3</sub>COOH + 2 CH<sub>2</sub>=CH<sub>2</sub> + O<sub>2</sub> → 2 CH<sub>3</sub>COO−CH=CH<sub>2</sub> + 2 H<sub>2</sub>O |
||
酢酸ビニルは[[重合反応|重合]]させてポリ酢酸ビニルなどの[[ポリマー]]としたのち、[[塗料]]や[[接着剤]]として使われる。 |
酢酸ビニルは[[重合反応|重合]]させてポリ酢酸ビニルなどの[[ポリマー]]としたのち、[[塗料]]や[[接着剤]]として使われる。 |
||
=== 無水酢酸 === |
=== 無水酢酸 === |
||
{{ |
{{Main|無水酢酸}} |
||
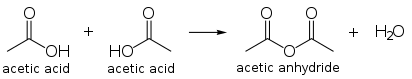
2分子の酢酸を[[付加脱離反応|脱水縮合]]させると[[無水酢酸]]が得られる。これは酢酸の主要な用途であり、全生産量のうち |
2分子の酢酸を[[付加脱離反応|脱水縮合]]させると[[無水酢酸]]が得られる。これは酢酸の主要な用途であり、全生産量のうち25%–35%が使用されている。[[メタノール]]のカルボニル化によって直接得ることもでき、[[カティバ法]]のプラントをこの目的に使うこともできる。 |
||
: [[ファイル:Acetic_acid_condensation.svg|412px|酢酸の脱水縮合による無水酢酸の合成]] |
: [[ファイル:Acetic_acid_condensation.svg|412px|酢酸の脱水縮合による無水酢酸の合成]] |
||
無水酢酸は強力なアセチル化試剤であり、[[写真フィルム]]や合成繊維などの用途がある[[アセチルセルロース]]の製造などに用いられる。また[[アスピリン]]や[[ヘロイン]]などの合成にも使われる。 |
無水酢酸は強力なアセチル化試剤であり、[[写真フィルム]]や合成繊維などの用途がある[[アセチルセルロース]]の製造などに用いられる。また[[アスピリン]]や[[ヘロイン]]などの合成にも使われる。 |
||
| 114行目: | 231行目: | ||
酢酸の[[エステル]]類はインク、塗料、上塗の溶媒として使用される。[[酢酸エチル]]、[[酢酸ブチル]]、[[酢酸イソブチル]]、[[酢酸プロピル]]が一般的で、これらは対応するアルコールとの触媒反応によって合成される。 |
酢酸の[[エステル]]類はインク、塗料、上塗の溶媒として使用される。[[酢酸エチル]]、[[酢酸ブチル]]、[[酢酸イソブチル]]、[[酢酸プロピル]]が一般的で、これらは対応するアルコールとの触媒反応によって合成される。 |
||
: CH<sub>3</sub>COOH + HOR → CH<sub>3</sub>COO−R + H<sub>2</sub>O (R は[[アルキル基]]を示す) |
: CH<sub>3</sub>COOH + HOR → CH<sub>3</sub>COO−R + H<sub>2</sub>O (R は[[アルキル基]]を示す) |
||
しかしながら、酢酸エステルの大部分は[[ティシチェンコ反応]]によって[[アルデヒド]]から合成されている。また、エーテル類の酢酸エステルは[[ニトロセルロース]]、[[アクリル塗料]]、[[ワニス]]の洗浄剤、木材用塗料の溶媒として使われる。まずグリコールのモノエーテルを[[エチレンオキシド]]や[[プロピレンオキシド]]とアルコールの反応で作り、これを酢酸でエステル化する。主なものはエチレングリコールモノエチルエーテル酢酸エステル (EEA)、エチレングリコールモノブチルエーテル酢酸エステル (EBA)、プロピレングリコールモノメチルエーテル酢酸エステル (PMA) の3つである。この用途には全生産量の |
しかしながら、酢酸エステルの大部分は[[ティシチェンコ反応]]によって[[アルデヒド]]から合成されている。また、エーテル類の酢酸エステルは[[ニトロセルロース]]、[[アクリル塗料]]、[[ワニス]]の洗浄剤、木材用塗料の溶媒として使われる。まずグリコールのモノエーテルを[[エチレンオキシド]]や[[プロピレンオキシド]]とアルコールの反応で作り、これを酢酸でエステル化する。主なものはエチレングリコールモノエチルエーテル酢酸エステル (EEA)、エチレングリコールモノブチルエーテル酢酸エステル (EBA)、プロピレングリコールモノメチルエーテル酢酸エステル (PMA) の3つである。この用途には全生産量の15%-20%が消費される。EEA など、これらのエステルのうちいくつかが人間の生殖に対して有害であることが示されている。 |
||
=== 酢 === |
=== 酢 === |
||
5 |
5-18 重量%の濃度の酢酸溶液は、[[酢]]として[[調味料]]や野菜などの[[漬物]]を作るのに用いられる。全世界で酢として用いられる酢酸の量はそれほど多くはないが、歴史的に最も古く、また良く知られている用途である。また韓国では、氷酢酸がのり巻きや刺し身のたれを作る材料として食用に販売されている。 |
||
=== 溶媒 === |
=== 溶媒 === |
||
氷酢酸は優れた極性プロトン性溶媒であり、有機化合物の再結晶溶媒としてしばしば使われる。純粋な酢酸は、[[ポリエチレンテレフタラート]] (PET) の原料である[[テレフタル酸]]の製造の際に溶媒として用いられる。この用途は世界での使用量の |
氷酢酸は優れた極性プロトン性溶媒であり、有機化合物の再結晶溶媒としてしばしば使われる。純粋な酢酸は、[[ポリエチレンテレフタラート]] (PET) の原料である[[テレフタル酸]]の製造の際に溶媒として用いられる。この用途は世界での使用量の5%–10%に過ぎないが、PET の生産量が増加すればより重要な用途になると考えられている。 |
||
[[フリーデル・クラフツ反応]]などのようにカルボカチオンを含む反応にしばしば用いられる。例えば、[[樟脳]]の工業的製造の1工程はカンフェンの[[ワーグナー・メーヤワイン転位]]による酢酸イソボルニルの生成だが、酢酸はこの際に転位生成物であるカルボカチオンのトラップ剤兼溶媒として働く。[[パラジウム炭素]]で芳香族ニトロ基を還元してアニリンとする際にも溶媒として選択される。 |
[[フリーデル・クラフツ反応]]などのようにカルボカチオンを含む反応にしばしば用いられる。例えば、[[樟脳]]の工業的製造の1工程はカンフェンの[[ワーグナー・メーヤワイン転位]]による酢酸イソボルニルの生成だが、酢酸はこの際に転位生成物であるカルボカチオンのトラップ剤兼溶媒として働く。[[パラジウム炭素]]で芳香族ニトロ基を還元してアニリンとする際にも溶媒として選択される。 |
||
| 130行目: | 247行目: | ||
様々な無機塩・有機塩類が酢酸から合成される。 |
様々な無機塩・有機塩類が酢酸から合成される。 |
||
* [[酢酸ナトリウム]] |
* [[酢酸ナトリウム]] - 織物工業、食品の防腐剤 |
||
* [[酢酸銅(II)]] |
* [[酢酸銅(II)]] - [[顔料]]、[[殺菌剤]]、[[忌避剤]](サメ用) |
||
* 酢酸アルミニウム、酢酸鉄(II) |
* [[酢酸アルミニウム]]、[[酢酸鉄(II)]] - 染料の[[媒染剤]] |
||
* [[酢酸パラジウム(II)]] |
* [[酢酸パラジウム(II)]] - [[ヘック反応]]など、カップリング反応の触媒 |
||
酢酸の誘導体には以下のようなものがある。 |
酢酸の誘導体には以下のようなものがある。 |
||
* [[モノクロロ酢酸]] (MCA)、ジクロロ酢酸、[[トリクロロ酢酸]] |
* [[モノクロロ酢酸]] (MCA)、ジクロロ酢酸、[[トリクロロ酢酸]] - MCA は[[インディゴ]]染料の製造に使われる |
||
* ブロモ酢酸 |
* [[ブロモ酢酸]] - [[ブロモ酢酸エチル]]の製造 |
||
* [[トリフルオロ酢酸]] - [[有機合成]]における一般的な試薬 |
* [[トリフルオロ酢酸]] - [[有機合成]]における一般的な試薬 |
||
これら、その他の用途に用いられる量は全生産量の |
これら、その他の用途に用いられる量は全生産量の5%–10%である(テレフタル酸の製造に使用される量を除く)。 |
||
*細胞の[[固定 (組織学)|固定]]に使われる。 |
*細胞の[[固定 (組織学)|固定]]に使われる。 |
||
| 155行目: | 272行目: | ||
** [[ジフルオロ酢酸]] |
** [[ジフルオロ酢酸]] |
||
** [[モノフルオロ酢酸]] |
** [[モノフルオロ酢酸]] |
||
== 出典 == |
|||
{{Reflist|2|refs= |
|||
<ref name="Ullmann">{{cite book | author=Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul | year=2005 | chapter=Acetic Acid | title=Ullmann's Encyclopedia of Industrial Chemistry | publisher=Wiley-VCH | location=Weinheim | doi=10.1002/14356007.a01_045}}</ref> |
|||
}} |
|||
== 参考文献 == |
== 参考文献 == |
||
* {{cite book | author=Senning, Alexander | year=2007 | title=Elsevier's Dictionary of Chemoetymology | publisher=Elsevier | location=Amsterdam | isbn=0-444-52239-5}} |
|||
<references /> |
|||
* [[桜井秀樹]]ほか 『化学と社会』 岩波講座 現代科学への入門 18、岩波書店、2001年。ISBN 4-00-011048-9。 |
|||
* パウラ・Y・ブルース 『有機化学』 第5版 下巻、大船泰史、[[香月勗]]、西郷和彦、富岡清 監訳、化学同人、2009年。ISBN 4759811699。 |
|||
* ジョン・マクマリー 『有機化学』 第7版、伊東椒、児玉三明、荻野敏夫、深澤義正、通元夫 訳、東京化学同人、2009年。ISBN 9784807906987(上)、ISBN 9784807906994(中)、ISBN 9784807907007(下)。 |
|||
* 山口良平、山本行男、田村類 『ベーシック有機化学』 第2版、化学同人、2010年。ISBN 4759814396。 |
|||
== 関連項目 == |
== 関連項目 == |
||
| 166行目: | 292行目: | ||
* [[木材乾留]] |
* [[木材乾留]] |
||
* [[酢酸菌]] |
* [[酢酸菌]] |
||
{| class="toccolours" style="width: 20em; margin: 0 auto; text-align: center" |
|||
|- |
|||
| style="width: 33%" | C<sub>1</sub>:<br />[[蟻酸]] |
|||
| style="width: 34%; border-left: 1px solid #aaa; border-right: 1px solid #aaa" | [[飽和脂肪酸]] |
|||
| style="width: 33%" | C<sub>3</sub>:<br />[[プロピオン酸]] |
|||
|} |
|||
{{脂肪酸}} |
{{脂肪酸}} |
||
{{DEFAULTSORT:さくさん}} |
|||
[[Category:脂肪酸]] |
|||
[[Category:生化学]] |
|||
[[Category:畜産学]] |
|||
[[Category:第2石油類]] |
|||
{{Link FA|bg}} |
{{Link FA|bg}} |
||
{{Link FA|en}} |
{{Link FA|en}} |
||
{{Link FA|zh}} |
{{Link FA|zh}} |
||
{{Link FA|id}} |
{{Link FA|id}} |
||
{{Link FA|ro}} |
{{Link FA|ro}} |
||
{{DEFAULTSORT:さくさん}} |
|||
[[Category:脂肪酸]] |
|||
[[Category:生化学]] |
|||
[[Category:畜産学]] |
|||
[[Category:第2石油類]] |
|||
[[af:Asynsuur]] |
[[af:Asynsuur]] |
||
| 203行目: | 321行目: | ||
[[es:Ácido acético]] |
[[es:Ácido acético]] |
||
[[et:Etaanhape]] |
[[et:Etaanhape]] |
||
[[eu:Azido azetiko]] |
|||
[[fa:استیک اسید]] |
[[fa:استیک اسید]] |
||
[[fi:Etikkahappo]] |
[[fi:Etikkahappo]] |
||
2011年9月11日 (日) 15:41時点における版
| 酢酸 | |
|---|---|

|

|

|

|
酢酸(許容慣用名) | |
| 識別情報 | |
| CAS登録番号 | 64-19-7 |
| E番号 | E260 (防腐剤) |
| KEGG | C00033 |
| |
| 特性 | |
| 化学式 | C2H4O2, CH3COOH |
| モル質量 | 60.05 |
| 外観 | 無色液体 |
| 密度 | 1.049, 液体 |
| 相対蒸気密度 | 2.1 |
| 融点 |
16.7 |
| 沸点 |
118 |
| 酸解離定数 pKa | 4.76 |
| 屈折率 (nD) | 1.3715 |
| 出典 | |
| ICSC | |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
酢酸(さくさん、旧字醋酸、英: acetic acid)は、化学式が CH3COOH と表される簡単なカルボン酸の一種である。IUPAC命名法では酢酸は許容慣用名であり、系統名はエタン酸 ethanoic acid である。純粋なものは冬に凍結することから氷酢酸(ひょうさくさん)と呼ばれる。2分子の酢酸が脱水縮合すると別の化合物の無水酢酸となる。
酢に含まれる弱酸で、強い酸味と刺激臭を持つ。遊離酸・塩・エステルの形で植物界に広く分布する。酸敗したミルク・チーズのなかにも存在する。
試薬や工業品として重要であり、合成樹脂のアセチルセルロースや接着剤のポリ酢酸ビニルなどの製造に使われる。全世界での消費量は年間およそ6.5メガトンである。このうち1.5メガトンが再利用されており、残りは石油化学原料から製造される[1]。生物資源からの製造も研究されているが、大規模なものには至っていない。
歴史

酢の利用
酢の歴史は文明と同程度に古く、酢酸産生菌はいたるところに存在する。そして、ビールやワインなど酒を醸造する文明は、アルコール飲料を大気にさらすと、自然と酢ができることを発見することになる[2]。紀元前、ギリシャの哲学者テオプラストスやローマのウィトルウィウス、プリニウスは酢が金属に作用して芸術に有用な顔料、たとえば鉛白(塩基性炭酸鉛)やビリジリス(酢酸銅(II) を含む銅塩の緑色の混合物)となることについて著述している[3][4]。また、酢はその時代にはローマでは治療の目的[2]、エジプトでは死体の保存[5]に用いられていたともされている。古代ローマ人は酸っぱくなったワインを鉛の壷で煮沸すると、サパあるいはデフルタムと呼ばれる非常に甘いシロップができることを見出している。サパやデフルタムの甘さは含まれる酢酸鉛(II) によるもので、その物質は鉛糖 (sugar of lead) とか土の糖 (sugar of saturn) と呼ばれ好まれたが、ローマ貴族の間で鉛中毒を引き起こした[6]。
発見と研究
8世紀にジャービル・イブン=ハイヤーン(ゲベル)は初めて酢の蒸留によって酢酸を得ている[7]。またルネサンス時代には、錬金術師たちは酢酸銅(II) などの金属酢酸塩を乾留して氷酢酸を製造した[8]。最初にそのような製法で酢酸を作り出したのはバシル・バレンティンとされている[2]。16世紀のドイツの化学者アンドレアス・リバビウスは、氷酢酸の製法と、得られた氷酢酸と酢との物性の比較について著述している[8]。そのように、酢の中には水が存在するため物性が酢酸と異なることから、氷酢酸と酢の中の酸は別の物質であると長く信じられていたが[9]、18世紀になるとフランス人化学者のピエール・エディにより両者が同一であることが示された[10][11]。
1845年にドイツ人化学者のヘルマン・コルベは無機物から有機物である酢酸を合成できることを示した[12]。その反応は、まず二硫化炭素から四塩化炭素への塩素化で始まり、次いでテトラクロロエチレンへの熱分解、そしてトリクロロ酢酸への水性塩素化、最後に電解還元による酢酸の生成、というものだった[13]。この結果はフリードリヒ・ウェーラーの尿素合成による生気論の否定を決定付けた[14]。一方ルイ・パスツールは1862年に酢酸菌を発見し、酢の醸造に利用されるようになったが、得られる濃度が低いため工業用の酢酸の製造には適していなかった[15]。
工業生産

1910年頃までは、氷酢酸は大部分が木材の乾留で得られる木酢液から作られていた[16]。イギリスでは1820年ごろから[17]、日本では明治時代に[15]、この方法による酢酸の製造が始められていた。木酢液を水酸化カルシウム(石灰乳)で処理して生成する酢酸カルシウムを硫酸で酸性化することにより、酢酸が分離される[16]。1917年頃のドイツは年間およそ1万トンの氷酢酸を生産していたが、その30%はインディゴの製造に充てられていた[16]。1910年代の半ば以降からは、ドイツとカナダでカルシウムカーバイドから得られるアセチレンを原料とした酢酸の製造が始められた[18]。カルシウムカーバイドはコークス(石炭の乾留物)を酸化カルシウム(生石灰)とともに電気炉で加熱することにより得られるが、ドイツは石油に乏しいが石炭を産出すること、カナダは水力発電による電力を有することが有利な点であった[19]。日本でも水力発電の発達に伴い、1928年以降この製法で酢酸が作られるようになった[20][21]。1937年に日本窒素肥料(現チッソ)も同法による酢酸の製造を開始したが、アセチレンの酸化に用いられる硫酸水銀(II) がのちに水俣病の原因となった[22]。
やがて石油化学工業が発展すると、酢酸の製造法はエチレンやアルカンを原料とするものに変わっていった[23]。さらに1960年代にドイツのBASFによってコバルト触媒、1970年にアメリカ合衆国のモンサントによってロジウム触媒を用いたメタノールのカルボニル化反応が開発・実用化され、それ以降はこれらが工業的に主要な氷酢酸の製造法となった[24]。
名称

日本語の「酢酸」は江戸時代後期に宇田川榕菴が著書舎密開宗で用いたのが最初である[25]。オランダ語 azijnzuur の訳語であり、これはさらにドイツ語 Essigsäure、英語 acetic acid の訳語であった。これらの名称はそのまま現代でも使われ、acetic acid や「酢酸」はIUPAC命名法における許容慣用名[26]かつ優先IUPAC名 (PIN)[27] およびその訳語である。IUPAC系統名は「エタン酸」ethanoic acid であり[28]、これは母体化合物「エタン」 ethane にカルボン酸官能基を表す接尾辞「酸」 -oic acid を付加したものである。
有機化学ではアセチル基 CH3C(=O)− の略号 Ac を用いて文章や化学式中で AcOH または HOAc と略記される。酢酸のエステルや塩は英語ではアセテート(アセタート) acetate と呼ばれる。たとえばエチルエステルの酢酸エチルは ethyl acetate、アンモニウム塩の酢酸アンモニウムは ammonium acetate である。
純粋な酢酸は室温が低いと固体になり、外見が氷に似ていることから「氷酢酸」(glacial acetic acid) とも呼ばれる[29]。古くは単に vinegar (酢)、 酢の蒸留によって得られたことから acetous acid (酢の酸)、木材の乾留で得られることから pyroligneous acid (火木酸)、ほか spilit of verdigris (ビリジリスの精)や wood vinegar (木酢)とも呼ばれた[5]。
英語 acetic acid の語源は酢を意味するラテン語 acetum と「鋭い」を意味する acer に由来する[30][31]。ここから派生して「アセト」acet(o)- の語は酢酸から得られたり構造が類似する化合物などにも用いられる。たとえばアセトン、アセトニトリル、アセトイン、アセトフェノン、アセチル基がそうである[31]。また炭素原子の数が同じく2個であるビニル基(ビニルラジカル)も古くは acetic acid を語源としてアセチルラジカル acetyl radical と呼ばれており[31]、これに由来する名称を持つ化合物としてアセチレンやアセナフテンなどがある[31][32]。
性質
物理的性質
| 濃度 (重量%) | 比重 (25 °C/4 °C) |
|---|---|
| 100 | 1.0553 |
| 90 | 1.0713 |
| 80 | 1.0748 |
| 70 | 1.0733 |
| 60 | 1.0685 |
| 50 | 1.0615 |
| 40 | 1.0523 |
常温では酸味と刺激臭を持つ無色透明の液体であり、融点は約 16.6 °C、沸点は約 118 °C である[29]。水と共沸しない[33]。酢酸に少量の水を加えると融点が大きく下がり[2]、水の割合が40%のとき最低値 −26.75 °C となる[29]。冷却したとき、これよりも水が少ないと酢酸が、多いと氷が晶出する[29]。また水との混合により比重が増加し、酢酸の濃度が約80%のとき最も大きくなり[16]、43%のとき純粋な酢酸と同じになる[29]。蒸気を燃やすとき、炎は淡青色である[29]。
酢酸は水、アセトニトリル、エタノール、酢酸エチル、クロロホルム、ベンゼン、エーテル、石油エーテルと任意の割合で混和する[34][35]。オクタンなど長鎖炭化水素には溶けにくく、溶解度は鎖が長くなるほど低くなる[36]。二硫化炭素には不溶である[35]。比誘電率は約6であり、あまり高くはないが[37]、無機塩や糖といった極性化合物を溶かすことができる[38]。また単体硫黄 S8、ヨウ素 I2 など無極性の分子も酢酸に溶ける[38]。ほかにゼラチン、フィブリン、アルブミン、樟脳、ニトロセルロースも溶ける[2]。酢酸の純度を知る古い方法としてレモン油を加えるというものがあり、これは純粋な酢酸であれば重量で10%のレモン油を完全に溶かすことによる[2]。
酢酸を構成する炭素原子と酸素原子は平面上に位置し、結合角は C−C=O と C−C−OH が119°、O=C−OH が122°で、結合距離は C−C が 152 pm、C=O が125 pm、C−OH が131 pm である[39]。
二量体

酢酸は水素結合を介して2分子が結合した、環状の二量体を形成する[39]。気体状態では電子回折により[40]、固体状態ではX線結晶構造解析により[41]、それぞれ構造が確認されている。純粋な液体状態ではほとんど単量体としては存在しないが、二量体となっているか、もしくは直鎖状あるいは環状の多量体となっているとされる[42]。希薄な溶液の場合、四塩化炭素[43]やベンゼンなどの非プロトン性溶媒中では二量体を形成するが、水などプロトン性の溶媒中では単量体として存在する[44][45]。
この二量体を形成するという性質のため、酢酸(分子量60.05)の沸点は水素結合を作らない酢酸メチル(分子量74.08、沸点 57 °C[46])よりも高く、分子量が2倍程度のオクタン(分子量114.23、沸点 125 °C)に近い[47]。
酸性度
酢酸のカルボキシル基 −COOH は溶液中でプロトン (H+) を放出し、解離して酢酸イオン(カルボキシラートイオン)となる[48]。
- CH3CO2H + H2O → CH3CO2− + H3O+
この性質のため、酢酸は酸性を持つ。酢酸は弱酸であり、水溶液中でのpKaはおよそ4.76である[49]。すなわち、1.0 mol/L の水溶液のpHは2.4となり、全体の0.4%が解離していることになる[50]。酢酸は塩酸や硫酸などの無機酸よりは弱く、炭酸やフェノール、アルコールよりは強い酸である[48][49]。
化学反応
酸としての反応
塩基である炭酸カリウムと混合すると、中和により酢酸カリウムが生成する。これを単離し酢酸に溶かして加熱すると脱水して二酢酸カリウムとなり、200 °C 以上でさらに反応して無水酢酸と酢酸カリウムに分離する[51]。
- CH3COOH + K2CO3 → CH3COOK + H2CO3
- CH3COOH + CH3COOK → (CH3COO)2KH + H2O
- (CH3COO)2KH → (CH3CO)2O + CH3COOK
酢酸はアルミニウム、銅、銀、チタン、ジルコニウムを腐食しないので、これらの金属は酢酸の容器として利用できる。一方、鉛やステンレスは酢酸によって侵される[52]。また、酢酸はマグネシウムと反応して水素と酢酸マグネシウムを生じる[53]。
- 2 CH3COOH + Mg → (CH3COO)2Mg + H2
カルボキシル基の変換
酢酸はカルボン酸として一般的な反応性を示す。たとえば硫酸を触媒としてアルコールと共に加熱すると酢酸エステルが生成する。これはフィッシャーエステル合成反応と呼ばれる方法である。可逆反応(平衡反応)であるため、エステル生成物を効率よく得るには出発物質を過剰に使用する必要があり、イソペンチルアルコールとの反応による酢酸イソペンチルの合成では、過剰量の酢酸が用いられる[54]。
- CH3COOH + C5H11OH → CH3COOC5H11 + H2O
酢酸からのエステル合成法としては他にアルケンへの付加があり、ヘテロポリ酸を触媒としてエチレンから酢酸エチルが得られる[55]。
- CH3COOH + CH2=CH2 → CH3COOCH2CH3
炭酸アンモニウムと混合して加熱すると、酢酸アンモニウムの生成と脱水を経てアセトアミドが得られる。この反応は蒸留によって酢酸を除きながら行い、さらに沸点のより高い残渣を引き続いて蒸留し、純粋な目的物を得る[56]。アンモニアを使っても同様な反応が起きる[56]。
- 2 CH3COOH + (NH4)2CO3 → 2 CH3COONH4 + H2CO3
- CH3COONH4 → CH3CONH2 + H2O
カルボン酸塩化物である塩化アセチルは、酢酸と三塩化リンや塩化チオニルなどの反応で得られる[57]。塩化チオニルは過剰量を用いるが、蒸留では塩化アセチルと分離しづらいため、余ったぶんはギ酸と反応させて分解する[57]。
- CH3COOH + SOCl2 → CH3COCl + SO2 + HCl
脱水
加熱により2分子間で脱水縮合を起こし、無水酢酸を与える。環状の酸無水物を生成する場合を除き、このような反応はほかのカルボン酸では起こらない[58]。
- 2 CH3COOH → (CH3CO)2O + H2O (800 °C)
また、リン酸エステルの存在下に 700–800 °C に加熱すると、分子内脱水によりケテン(エテノン)を生じる[59]。
- CH3COOH → CH2=C=O + H2O (O=P(OCH2CH3)3, 700–800 °C)
さらに、酢酸はケテンに付加して無水酢酸を与える[60]。
- CH3COOH + CH2=C=O → (CH3CO)2O
メチル基での反応

日光を当てながら酢酸と塩素を反応させると、水素原子と塩素原子が交換したクロロ酢酸が生成する[61]。この反応はラジカルの発生を含む機構で進行し、ジクロロ酢酸やトリクロロ酢酸が副生成物となるが、触媒の使用によりそれらの生成を抑えることもできる[62]。
- CH3COOH + Cl2 → CH2ClCOOH + HCl
同様にして臭素とリン触媒を使って酢酸からブロモ酢酸を作ることができる[63]。この合成法はヘル・ボルハルト・ゼリンスキー反応と呼ばれる。
生化学
酢酸は生体内で活性化体であるアセチルCoA(アセチル補酵素A)としてさまざまな役割を果たす。アセチルCoAは活性酢酸とも呼ばれる[64]酢酸のチオエステル体であり、CoASHはよい脱離基として働くため酢酸そのものよりも置換反応が起こりやすい[65]。

アセチルCoAは体内での代謝経路、すなわち、解糖系による糖からのピルビン酸の生成とそれに続く補酵素Aとの結合[66]、脂肪酸のβ酸化の繰り返しによる逐次分解[67]、そしてアミノ基転移を経るアミノ酸の異化[68]によって生成する。また、アセチルCoAリガーゼ(アセチルCoA合成酵素)により酢酸と補酵素Aから直接合成される。2種類のアセチルCoAリガーゼにより以下の反応が起こる。
酢酸 + ATP + CoA → アセチルCoA + AMP + 二リン酸 アセチルCoAリガーゼ (EC 6.2.1.1)[69] 酢酸 + ATP + CoA → アセチルCoA + ADP + リン酸 アセチルCoAリガーゼ (ADP生成) (EC 6.2.1.13)[70]
生成したアセチルCoAはクエン酸回路でのエネルギー生産や、脂肪酸の合成、メバロン酸経路によるテルペノイド・ステロイドの生合成などに利用される[64][71][72]。クエン酸回路による代謝では、酢酸は最終的に二酸化炭素と水になる[73]。
アセチルコリンはコリンとアセチルCoAとから合成される神経伝達物質であり、神経細胞の末端において小胞体に蓄えられる。刺激を受けると放出され、受容体に結合することによって信号を伝達する。役目を終えるとすぐにアセチルコリン加水分解酵素によってコリンと酢酸とに分解される[74]。
また、アルコール飲料を摂取すると人体では酢酸が生産される。エタノールはアセトアルデヒドを経て酵素アルデヒドデヒドロゲナーゼにより酢酸に変換される(「エタノールと人体」も参照)。
メタン生成古細菌(メタン菌)と呼ばれる古細菌のうち、メタノサエタ属やメタノサルキナ属は酢酸を代謝してメタンを生成することが知られており、汚水処理やバイオマス生産への利用が検討されている[75][76]。
サソリモドキというクモ綱の節足動物は、後腹部から酢酸を噴射して身を守るとされている[77]。
製造
化学合成とバクテリアによる発酵の両方によって作られる。今日では発酵法は全世界での生産量の10%を占めるに過ぎないが、食品の品質に関する法律は食用の酢として用いられる場合に生物由来であることを求めるものが多いため[78]、依然として食酢の製造には重要である[79]。化学工業で用いられる酢酸のおよそ8割はメタノールのカルボニル化によって作られている[80]。
全世界での酢酸の純生産量はおよそ年5メガトンと見積もられ、その半分はアメリカ合衆国によるものである。ヨーロッパでの生産量は年に約1メガトンだが減少傾向にあり、日本では年0.7メガトンである(酢酸の2008年度日本国内生産量は500,211トン、消費量は181,799トンである[81])。残り1.5メガトンは毎年再利用されており、都合、全世界での市場流通量は年6.5メガトンとなる[82][83]。これにより、酢酸は世界で最も広く生産されている酸となっている。
メタノールのカルボニル化
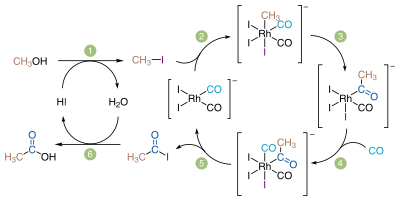
大部分の酢酸はこの方法によって生産されている。メタノールと一酸化炭素を下記の反応式に従って反応させる。
- CH3OH + CO → CH3COOH
この方法は中間体としてヨードメタンを含む3段階の過程である。2段階目の反応は触媒を必要とし、通常これには第9族元素の金属錯体が用いられる。
- CH3OH + HI → CH3I + H2O
- CH3I + CO → CH3COI
- CH3COI + H2O → CH3COOH + HI
同じプラントでも条件を変えることによって無水酢酸を製造することができる。メタノールと一酸化炭素は共に簡単に得られる原料であるため、メタノールのカルボニル化は長らく酢酸製造の魅力的な方法であった。セラニーズ社のヘンリー・ドレフュス (Henry Drefyus) は本法の試験プラントを1925年頃に既に開発していた[84]。しかし、腐食性の混合物を200気圧という高圧下で反応させることができる装置がなかったため、当時は工業化することができなかった。最初の工業化はコバルト触媒を用いる方法で、ドイツの化学会社 BASF社によって1963年に開発された。1968年にロジウム触媒 (cis-[Rh(CO)2I2]−) が発見され、より低圧でほとんど副生物を発生させずに反応を進行させることが可能になった。この触媒を使用した最初のプラントは1970年にアメリカの化学会社モンサント社によって建設され、ロジウム触媒によるメタノールのカルボニル化が酢酸製造の主要な方法になった(モンサント法)。1990年代後期、化学会社 BPケミカルズ社がロジウムをイリジウムで置き換えたカティバ触媒 ([Ir(CO)2I2]−) を開発した。この触媒はよりグリーン・高効率であり[85]、同じプラントで利用できるモンサント法にとって代わった。
アセトアルデヒドの酸化
モンサント法が工業化される以前には、大部分の酢酸はアセトアルデヒドの酸化によって製造されていた。メタノールのカルボニル化と競合するほどではないが、依然として第2の重要な製造法である。アセトアルデヒドはブタンや軽ナフサの酸化[86]、あるいはエチレンの酸化(ワッカー法)によって作られる[87]。
ブタンや軽ナフサを空気中でマンガン、コバルト、クロムなどの金属イオンの存在下に加熱すると、ヒドロペルオキシドが生成したのちに分解し、酢酸を与える[86]。
- 2 C4H10 + 5 O2 → 4 CH3COOH + 2 H2O
一般的に、ブタンが液体状態である限界の高温で反応を進行させられるように温度と圧力を設定する。典型的には150 °C、55気圧である。メチルエチルケトン、酢酸エチル、ギ酸、プロピオン酸などが副生物として得られる。これらの副生物も市場価値があるため、十分に採算が取れれば、これらがより多く生成するように条件が変更されることもある。もっとも、それらから酢酸を分離するには余分なコストがかかる。
ブタンの酸化と同様な条件・触媒を用いたアセトアルデヒドの空気酸化によっても酢酸が得られる。
- 2 CH3CHO + O2 → 2 CH3COOH
近代的な触媒を用いれば、この反応によって酢酸が95%以上の収率で得られる。主な副生物は酢酸エチル、ギ酸、ホルムアルデヒドで、これらは全て酢酸より沸点が低いため、蒸留によって容易に分離できる。
エチレンの酸化
アセトアルデヒドはワッカー法によりエチレンから作ることができ、これを上記の方法で酸化する。より安価な1段階のエチレンからの酢酸の製造法が昭和電工によって工業化され、1997年に大分県でエチレン酸化プラントが開業された[88]。その方法ではタングストケイ酸などのヘテロポリ酸上に担持されたパラジウム触媒を用いる[89]。エチレンの価格によっては、小さめのプラント(100–150キロトン/年)でメタノールのカルボニル化と競合する。しかしながら2009年に昭和電工は大分での酢酸製造設備を停止し、メタノール法の酢酸をマレーシア、中国などから輸入するようになった。これはナフサ価格上昇にともない、エチレン価格も高騰したため、メタノール法酢酸製造プラントに対抗できなくなったためである[90]。これにより現在日本で酢酸を製造するプラントは協同酢酸の1社のみとなった。
発酵
酸化的発酵
人類の歴史の大部分において、酢酸は酢の形でアセトバクター属 (Acetobacter) の細菌によって作られてきた。十分な量の酸素を与えられれば、それらのバクテリアは様々なアルコールを含む食材から酢を作り出す。普通に使われるのはリンゴ酒、ワイン、発酵させた穀物、麦芽、米、すりつぶしたジャガイモである。バクテリアによって促進される化学反応は、全体として以下のようなものである。
- C2H5OH + O2 → CH3COOH + H2O
薄いアルコールの溶液にアセトバクター属を接種して保温すると、空気に触れている部分が数か月後に酢になる。工業的な酢の製造過程では、酸素を供給することによってバクテリアによる酸化を促進する。
発酵によって酢が初めて作られたのは、おそらくワインの製造の失敗によるものである。マスト(must, 発酵中のブドウ果汁)の熟成時に温度が高すぎると、アセトバクター属が自然にブドウに付着している酵母を圧倒してしまう。料理、医療、保健衛生における酢の需要が増すと、ワイン製造者たちはすぐに、ブドウが熟してワインの製造に適するようになる前の暑い夏季に他の有機物を使って酢を作ることを学んだ。しかし、ワイン製造者たちは発酵の過程を理解していなかったため、その方法は時間がかかる上にいつも成功するとは限らなかった[91]。
最初の近代的な工業的生産過程の1つは「促成法」あるいは「ジャーマン法」と呼ばれるもので、1823年にドイツで使われ始めた。この方法では、発酵は木の削り屑や炭を詰めた塔の中で行われる。アルコールを含んだ原料が塔の頂上から流し込まれ、新鮮な空気を自然に、または人為的な対流によって供給する。空気の供給量を増やすことによって、数ヶ月かかった酢の製造は数週間に短縮された[92]。
今日における酢の製造には1949年にオットー・ホロマツカとハインリヒ・エプナーによって考案された[93]浸水形の培養槽が用いられている。この方法では、発酵は撹拌されるタンクの中で溶液に酸素を通じさせながら行われ、15%の酢酸を含んだ酢が24時間で、流加培養法を使うと20%の濃度のものが60時間ででき上がる[91]。
無気性発酵
クロストリジウム属 (Clostridium) のある種の好気性バクテリアは糖類を直接酢酸に変換させることができ、中間体としてエタノールを必要としない。これらのバクテリアによる化学反応は全体として次のようなものである
- C6H12O6 → 3 CH3COOH
工業化学者の観点から興味深いことに、これらの酢酸産生菌の多くはメタノール、一酸化炭素、または二酸化炭素と水素の混合物など、1炭素の化合物から直接酢酸を作り出すことができる。
- 2 CO2 + 4 H2 → CH3COOH + 2 H2O
糖類またはより安価な原料を直接酢酸の製造に利用できるクロストリジウム属の能力は、アセトバクター属のようなエタノール酸化菌より効率的に酢酸を作り出せる可能性があることを示している。しかしながら、クロストリジウム属は酸に弱く、最も酸に強い クロストリジウム属でも数%の酢酸を含む酢しか作れない。一方、アセトバクター属には酢酸濃度20%までの酢を作ることができるものがある。現時点では アセトバクター属を使う酢の製造はクロストリジウム属で作った酢を濃縮するよりも価格面でより効率的である。その結果、酢酸産生菌は1940年からその存在が知られているものの、工業的な利用は限られた条件下の場合のみである。
用途

多くの化合物を作る際に試薬として用いられる。主に酢酸ビニルモノマーの製造に使われ、無水酢酸や他の酢酸エステルがこれに次ぐ。酢として利用される酢酸は比較的少ない。
酢酸ビニルモノマー
酢酸の主要な用途は酢酸ビニルモノマーの製造である。全世界で生産される酢酸のうち40%–45%がこの目的で消費される。酸素の存在下、エチレンと酢酸をパラジウム触媒で反応させる。
- 2 CH3COOH + 2 CH2=CH2 + O2 → 2 CH3COO−CH=CH2 + 2 H2O
酢酸ビニルは重合させてポリ酢酸ビニルなどのポリマーとしたのち、塗料や接着剤として使われる。
無水酢酸
2分子の酢酸を脱水縮合させると無水酢酸が得られる。これは酢酸の主要な用途であり、全生産量のうち25%–35%が使用されている。メタノールのカルボニル化によって直接得ることもでき、カティバ法のプラントをこの目的に使うこともできる。
無水酢酸は強力なアセチル化試剤であり、写真フィルムや合成繊維などの用途があるアセチルセルロースの製造などに用いられる。またアスピリンやヘロインなどの合成にも使われる。
エステルの製造
酢酸のエステル類はインク、塗料、上塗の溶媒として使用される。酢酸エチル、酢酸ブチル、酢酸イソブチル、酢酸プロピルが一般的で、これらは対応するアルコールとの触媒反応によって合成される。
- CH3COOH + HOR → CH3COO−R + H2O (R はアルキル基を示す)
しかしながら、酢酸エステルの大部分はティシチェンコ反応によってアルデヒドから合成されている。また、エーテル類の酢酸エステルはニトロセルロース、アクリル塗料、ワニスの洗浄剤、木材用塗料の溶媒として使われる。まずグリコールのモノエーテルをエチレンオキシドやプロピレンオキシドとアルコールの反応で作り、これを酢酸でエステル化する。主なものはエチレングリコールモノエチルエーテル酢酸エステル (EEA)、エチレングリコールモノブチルエーテル酢酸エステル (EBA)、プロピレングリコールモノメチルエーテル酢酸エステル (PMA) の3つである。この用途には全生産量の15%-20%が消費される。EEA など、これらのエステルのうちいくつかが人間の生殖に対して有害であることが示されている。
酢
5-18 重量%の濃度の酢酸溶液は、酢として調味料や野菜などの漬物を作るのに用いられる。全世界で酢として用いられる酢酸の量はそれほど多くはないが、歴史的に最も古く、また良く知られている用途である。また韓国では、氷酢酸がのり巻きや刺し身のたれを作る材料として食用に販売されている。
溶媒
氷酢酸は優れた極性プロトン性溶媒であり、有機化合物の再結晶溶媒としてしばしば使われる。純粋な酢酸は、ポリエチレンテレフタラート (PET) の原料であるテレフタル酸の製造の際に溶媒として用いられる。この用途は世界での使用量の5%–10%に過ぎないが、PET の生産量が増加すればより重要な用途になると考えられている。
フリーデル・クラフツ反応などのようにカルボカチオンを含む反応にしばしば用いられる。例えば、樟脳の工業的製造の1工程はカンフェンのワーグナー・メーヤワイン転位による酢酸イソボルニルの生成だが、酢酸はこの際に転位生成物であるカルボカチオンのトラップ剤兼溶媒として働く。パラジウム炭素で芳香族ニトロ基を還元してアニリンとする際にも溶媒として選択される。
分析化学においては、アミドなどの弱い塩基の定量の際に用いられる。水よりもずっと弱い塩基なので、酢酸中ではアミドは強い塩基として振舞い、過塩素酸など非常に強い酸で滴定することができる。
その他
薄い溶液が弱い酸として利用される。写真の現像において現像処理と定着処理の間で使われるが、これは現像液がアルカリ性であるから、弱い酸性を示す酢酸で現像処理を停止させるためである。この場合、食物由来のものではなく工業製品として合成された酢酸が使用される。他に、ヤカンや蛇口に付いたカルシウムなどによる水垢を除去する水垢除去剤、クラゲに刺された場合すぐに塗布する事によって刺胞を破壊し症状を和らげる治療薬、外耳炎患者の治療薬ヴォソール (Vosol) などへの調合剤、といった用途があげられる。また、家畜用の牧草のスプレー型防腐剤として、バクテリアやカビの増殖を抑えるために用いられる。コルポスコピー・上部消化管内視鏡においては粘膜を刺激し、正常粘膜と異常粘膜の反応の差異を判断に用いることがある。
様々な無機塩・有機塩類が酢酸から合成される。
- 酢酸ナトリウム - 織物工業、食品の防腐剤
- 酢酸銅(II) - 顔料、殺菌剤、忌避剤(サメ用)
- 酢酸アルミニウム、酢酸鉄(II) - 染料の媒染剤
- 酢酸パラジウム(II) - ヘック反応など、カップリング反応の触媒
酢酸の誘導体には以下のようなものがある。
これら、その他の用途に用いられる量は全生産量の5%–10%である(テレフタル酸の製造に使用される量を除く)。
- 細胞の固定に使われる。
主な誘導体
出典
- ^ Cheung, Hosea; Tanke, Robin S.; Torrence, G. Paul (2005). “Acetic Acid”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a01_045
- ^ a b c d e f Payen, Anselme M. (1878). Paul, B. H.. ed. Industrial chemistry: A manual for use in technical colleges or schools and for manufacturers, etc. London: Longmans, Green, and Co. pp. 961–962
- ^ Church, Arthur Herbert (1890). The chemistry of paints and painting. London: Seeley. p. 111
- ^ Great Britain Patent Office (1871). Patents for inventions: abridgments of specifications. London: Office of the Commissioners of Patents for Inventons. p. p. xx
- ^ a b Thomson, Robert Dundas (1854). Cyclopaedia of chemistry with its applications to mineralogy, physiology. London and Glasgow: Griffin and Co.. p. 3
- ^ 村田徳治 『廃棄物のやさしい化学』 第1巻、日報出版、2009年、52頁。ISBN 4-89086-180-7。
- ^ Rezende, Lisa (2006). Chronology of science. New York: Facts on File. p. 61. ISBN 0-8160-5342-1
- ^ a b Othmer, Donald F.; Kirk, Raymond E.; Kroschwitz, Jacqueline I.; Howe-Grant, Mary (1991). Kirk-Othmer encyclopedia of chemical technology. 1. New Jersey: Wiley. p. 121. ISBN 047152669X
- ^ Griffiths, Ralph (1799). “Memoir on the Acetic Acid. By P A. Adet”. The Monthly review 28: 558.
- ^ Adet, P. A. (1798). “Mémoire sur l'acide acétique”. Annales de Chemie 27: 299–319.
- ^ Darracq, M. (1802). “Obsercations on the Acetous and Acetic Acids”. Journals of the Royal Institution of Great Britain 1: 132.
- ^ Rocke, Alan J. (1993). The quiet revolution: Hermann Kolbe and the science of organic chemistry. Berkeley: University of California Press. pp. 59–60
- ^ Goldwhite, Harold (September 2003). “Short summary of the career of the German organic chemist, Hermann Kolbe”. The New Haven Section of the American Chemical Society 20 (3).
- ^ 山口, 山本 & 田村 2010, p. 2.
- ^ a b 桜井 2001, p. 2
- ^ a b c d e Martin, Geoffrey (1917). Industrial and Manufacturing Chemistry (Part 1, Organic ed.). London: Crosby Lockwood. pp. 330–31
- ^ McClure, David Courtney. “Kilkerran Pyroligneous Acid Works 1845 to 1945”. Ayrshire History. 2011年8月19日閲覧。
- ^ Almqvist, Ebbe (2003). History of industrial gases. Berlin: Springer. p. 118. ISBN 0306472775; Brown, William H.; Foote, Christopher S.; Iverson, Brent L.; Anslyn, Eric V. (2011). Organic Chemistry (6th edition ed.). Belmont. p. 660. ISBN 084005498X
- ^ Aftalion, Fred (1991). A history of the international chemical industry. Philadelphia: University of Pennsylvania Press. p. 135
- ^ 桜井 2001, p. 3
- ^ 紫垣明典 「酢酸製造プロセスの進歩」『有機化学合成協会誌』 第41巻、1983年553–560頁。
- ^ 藤森萬年 『産業倫理』 文芸社、2006年、43頁。
- ^ 桜井 2001, p. 8
- ^ 桜井 2001, p. 6
- ^ 大森晋爾 (2000年12月). “舎密開教”. 会報 第43号. 岡山日独協会. 2011年8月19日閲覧。
- ^ マクマリー 2009, p. 740.
- ^ IUPAC (2004), “Chapter P-1 Nomenclature of Organic Compounds”, Preferred IUPAC Names, p. 4.
- ^ 貞廣知行 (2008年2月24日). “エタン誘導体”. 化合物命名法談義. 2011年8月19日閲覧。
- ^ a b c d e f Stoddard, John Tappan (1918). Introduction to Organic Chemistry (2nd ed. ed.). Philadelphia: P. Blakiston's Son & Co.. p. 96Forgotten Books から2010年に再版されている。
- ^ 山口, 山本 & 田村 2010, p. 30.
- ^ a b c d Senning 2007, p. 3.
- ^ Senning 2007, p. 2.
- ^ Hilmen, Eva-Katrine (2000年11月). “Separation of Azeotropic Mixtures: Tools for Analysis and Studies on Batch Distillation Operation”. Norwegian University of Science and Technology, dept. of Chemical Engineering. p. 13. 2011年8月20日閲覧。
- ^ Armarego, Wilfred L. F.; Chai, Christina L. L. (2009). Purification of Laboratory Chemicals (6th ed. ed.). Burlington: Elsevier. p. 40
- ^ a b “Product Description. Acetic Acid, Glacial”. Celanese. 2011年8月20日閲覧。
- ^ Zieborak, K.; Olszewski, K. (1958). Bulletin de l'Academie Polonaise des Sciences. Serie des Sciences Chimiques Geologiques et Geographiques 6 (2): 3315–3322
- ^ Emsley, John (1986-02-13). “The solution is the problem”. New Scientist: 33–37.
- ^ a b Thorpe, Gary (2007). AP Chemistry (4th ed. ed.). Hoboken: John Wiley and Sons. p. 63
- ^ a b マクマリー 2009, p. 742.
- ^ Karle, J.; Brockway, L. O. (1944). “An Electron Diffraction Investigation of the Monomers and Dimers of Formic, Acetic and Trifluoroacetic Acids and the Dimer of Deuterium Acetate”. Journal of the American Chemical Society 66 (4): 574–584. doi:10.1021/ja01232a022.
- ^ Jones, R. E.; Templeton, D. H. (1958). “The crystal structure of acetic acid”. Acta Crystallographica 11 (7): 484–487. doi:10.1107/S0365110X58001341.
- ^ Briggs, James M.; Nguyen, Toan B.; Jorgensen, William L. (1991). “Monte Carlo simulations of liquid acetic acid and methyl acetate with the OPLS potential functions”. The Journal of Physcal Chemistry 95: 3315–22. doi:10.1021/j100161a065.
- ^ Davies, M. M.; Sutherland, G. B. B. M. (1938). “The Infra‐Red Absorption of Carboxylic Acids in Solution I. Qualitative Features”. The Journal of Chemical Physics 6: 755–767. doi:10.1063/1.1750166.
- ^ Walker, James (1899). Introduction to Physical Chemistry. New York: Macmillan and Co.. p. 197
- ^ “Hydrgen Bonding”. Competition Science Vision 1 (8): 1164–1172. (1998).
- ^ “Product Description. Methyl Acetate”. Celanese. 2011年8月20日閲覧。
- ^ Sorrell, Thomas N. (2006). Organic Chemistry (2nd ed. ed.). Sausalito: University Science Books. p. 69
- ^ a b 山口, 山本 & 田村 2010, p. 32.
- ^ a b マクマリー 2009, p. 743.
- ^ 地球環境化学夏休み宿題解答-1, 東京工業大学附属科学技術高等学校
- ^ Schorlemmer, Carl (1874). A manual of the chemistry of the carbon compounds. London: Macmillan. p. 137
- ^ Craig, Bruce D.; Anderson, David S. (1995). Handbook of Corrosion Data (2nd ed. ed.). Russell Township, Ohio: ASM International. pp. pp. 88–89
- ^ Jain, Rahul (2005). Xam Idea - Science (6th ed. ed.). New Delhi: V. K. (India) Enterprises. p. 31
- ^ Pavia, Donald L. (2005). Introduction to Organic Laboratory Techniques. Belmont: Thomson Learning. pp. pp. 93–96
- ^ Kozhevnikov, Ivan V. (2002). Catalysis by Polyoxometalates. Catalysts for Fine Chemical Synthesis. 2. Chichester: John Wiley & Sons. p. 178
- ^ a b Coleman, G. H.; Alvarado, A. M. (1923). "Acetamide". Organic Syntheses (英語). 3: 3.; Collective Volume, vol. 1, p. 3
- ^ a b Ahluwalia, V. K.; Aggarwal, R. (2000). Comprehensive Practical Organic Chemistry. Hyderabad: Universities Press (India). pp. pp. 14–15
- ^ マクマリー 2009, p. 781.
- ^ Chauvel, A.; Lefebvre, G. (1989). Petrochemical Processes. Vol. 2. Paris: Editions Technip. p. 59
- ^ Wittcoff, Harold; Reuben, B. G.; Plotkin, Jeffrey S. (2004). Industrial Organic Chemicals (2nd ed. ed.). Hoboken: John Wiley & Sons. pp. pp. 365–369
- ^ Kane, Robert; Draper, John William (1851). Elements of Chemistry. New York: Harper and Brothers. p. 564
- ^ Maki-Arvela, Paivi; Salmi, Tapio; Paatero, Erkki (1994). “Kinetics of the Chlorination of Acetic Acid with Chlorine in the Presence of Chlorosulfonic Acid and Thionyl Chloride”. Industrial & Engineering Chemistry Research 33 (9): 2073–2083. doi:10.1021/ie00033a008.
- ^ Dalton, David R. (2011). Foundations of Organic Chemistry. Hoboken: John Wiley & Sons. pp. pp. 648–649
- ^ a b 泉屋信夫、野田耕作、下東康幸 『生物化学序説』 第2版、化学同人、1998年、129–135頁。
- ^ パウラ・Y・ブルース 『有機化学概説』 第2版、大船泰史、香月勗、西郷和彦、富岡清 監訳、化学同人、2010年、559頁。
- ^ マクマリー 2009, pp. 1125–1135.
- ^ ブルース 2009, pp. 1273–1275.
- ^ ブルース 2009, pp. 1281–1282.
- ^ “EC 6.2.1.1”. IUBMB Enzyme Nomenclature. 2011年9月4日閲覧。
- ^ “EC 6.2.1.1”. IUBMB Enzyme Nomenclature. 2011年9月4日閲覧。
- ^ K・P・C・ボルハルト、N・E・ショアー 『現代有機化学』 第4版 下巻、古賀憲司、野依良治、村橋俊一 監訳、大嶌幸一郎、小田嶋和徳、小松満男、戸部義人 訳、化学同人、2004年、921–925頁。
- ^ マクマリー 2009, pp. 1054–1073.
- ^ 畑山巧 『ベーシック生化学』 化学同人、2009年、149–151頁。
- ^ 米谷民雄 『食品中の化学物質と安全性』 日本食品衛生協会、2009年、28頁。
- ^ 湯川英明 監修 『CO2固定化・削減と有効利用』 CMC出版、CMCテクニカルライブラリー 地球環境シリーズ 第336巻、2009年、223–224頁。
- ^ 工藤俊章、大熊盛也 監修 『難培養微生物の利用技術』CMC出版、CMCテクニカルライブラリー バイオテクノロジーシリーズ 第344巻、2010年、107頁。
- ^ ジョージ・C・マクガヴァン 『完璧版昆虫の写真図鑑』 日本語版 野村周平 監修、日本ヴォーグ、2000年、219頁。
- ^ Myers, Richard L. (2007). The 100 most important chemical compounds. Westport: Greenwood. p. 3
- ^ Yoneda, Noriyki; Kusano, Satoru; Yasui, Makoto; Pujado, Peter; Wilcher, Steve (2001). “Recent advances in processes and catalysts for the production of acetic acid”. Applied Catalysis A: General 221: 253–265. doi:10.1016/S0926-860X(01)00800-6.
- ^ マクマリー (2009), 739頁。
- ^ 経済産業省生産動態統計・生産・出荷・在庫統計平成20年年計による
- ^ "Production report". Chem. Eng. News (July 11, 2005), 67–76.
- ^ Suresh, Bala (2003). "Acetic Acid". CEH Report 602.5000, SRI International.
- ^ Wagner, F. S. (1978). "Acetic acid". In Kirk-Othmer Encyclopedia of Chemical Technology; Grayson, M., Ed.; New York: John Wiley & Sons.; 3rd edition.
- ^ Lancaster, Mike (2002). Green Chemistry: an Introductory Text. Cambridge: Royal Society of Chemistry. pp. pp. 262–266. ISBN 0-85404-620-8
- ^ a b 桜井 (2001), 3–4頁。
- ^ 桜井 (2001), 5頁。
- ^ Sano, Ken-ichi; Uchida, Hiroshi; Wakabayashi, Syoichirou (1999). “A new process for acetic acid production by direct oxidation of ethylene”. Catalyst Surveys from Japan 3: 55–60. doi:10.1023/A:1019003230537.
- ^ 桜井 (2001), 7–8頁。
- ^ “休止状態の酢酸プラント廃棄も 昭和電工”, 大分合同新聞, (2009-08-01) 2011年9月11日閲覧。
- ^ a b Hromatka, Otto; Ebner, Heinrich (1959). “Vinegar by Submerged Oxidative Fermentation”. Industrial & Engineering Chemistry 51 (10): 1279–1280. doi:10.1021/ie50598a033.
- ^ Partridge, Everett P. (1931). “Acetic Acid and Cellulose Acetate in the United States. A General Survey of Economic and Technical Developments”. Industrial & Engineering Chemistry 23 (5): 482–498. doi:10.1021/ie50257a005.
- ^ Hromatka, Otto; Ebner, Heinrich (1949). “Investigations on vinegar fermentation: Generator for vinegar fermentation and aeration procedures”. Enzymologia 13: 369.
参考文献
- Senning, Alexander (2007). Elsevier's Dictionary of Chemoetymology. Amsterdam: Elsevier. ISBN 0-444-52239-5
- 桜井秀樹ほか 『化学と社会』 岩波講座 現代科学への入門 18、岩波書店、2001年。ISBN 4-00-011048-9。
- パウラ・Y・ブルース 『有機化学』 第5版 下巻、大船泰史、香月勗、西郷和彦、富岡清 監訳、化学同人、2009年。ISBN 4759811699。
- ジョン・マクマリー 『有機化学』 第7版、伊東椒、児玉三明、荻野敏夫、深澤義正、通元夫 訳、東京化学同人、2009年。ISBN 9784807906987(上)、ISBN 9784807906994(中)、ISBN 9784807907007(下)。
- 山口良平、山本行男、田村類 『ベーシック有機化学』 第2版、化学同人、2010年。ISBN 4759814396。
関連項目
Template:Link FA Template:Link FA Template:Link FA Template:Link FA Template:Link FA