マグネシウム
| |||||||||||||||||||||||||
| 外見 | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
銀白色 マグネシウムのスペクトル線 | |||||||||||||||||||||||||
| 一般特性 | |||||||||||||||||||||||||
| 名称, 記号, 番号 | マグネシウム, Mg, 12 | ||||||||||||||||||||||||
| 分類 | アルカリ土類金属 | ||||||||||||||||||||||||
| 族, 周期, ブロック | 2, 3, s | ||||||||||||||||||||||||
| 原子量 | 24.3050(6) | ||||||||||||||||||||||||
| 電子配置 | [Ne] 3s2 | ||||||||||||||||||||||||
| 電子殻 | 2, 8, 2(画像) | ||||||||||||||||||||||||
| 物理特性 | |||||||||||||||||||||||||
| 相 | 固体 | ||||||||||||||||||||||||
| 密度(室温付近) | 1.738 g/cm3 | ||||||||||||||||||||||||
| 融点での液体密度 | 1.584 g/cm3 | ||||||||||||||||||||||||
| 融点 | 923 K, 650 °C, 1202 °F | ||||||||||||||||||||||||
| 沸点 | 1363 K, 1091 °C, 1994 °F | ||||||||||||||||||||||||
| 融解熱 | 8.48 kJ/mol | ||||||||||||||||||||||||
| 蒸発熱 | 128 kJ/mol | ||||||||||||||||||||||||
| 熱容量 | (25 °C) 24.869 J/(mol·K) | ||||||||||||||||||||||||
| 蒸気圧 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| 原子特性 | |||||||||||||||||||||||||
| 酸化数 | 2, 1[1] (強塩基性酸化物) | ||||||||||||||||||||||||
| 電気陰性度 | 1.31(ポーリングの値) | ||||||||||||||||||||||||
| イオン化エネルギー | 第1: 737.7 kJ/mol | ||||||||||||||||||||||||
| 第2: 1450.7 kJ/mol | |||||||||||||||||||||||||
| 第3: 7732.7 kJ/mol | |||||||||||||||||||||||||
| 原子半径 | 160 pm | ||||||||||||||||||||||||
| 共有結合半径 | 141 ± 7 pm | ||||||||||||||||||||||||
| ファンデルワールス半径 | 173 pm | ||||||||||||||||||||||||
| その他 | |||||||||||||||||||||||||
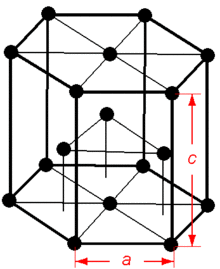
| 結晶構造 | 六方晶系 | ||||||||||||||||||||||||
| 磁性 | 常磁性 | ||||||||||||||||||||||||
| 電気抵抗率 | (20 °C) 43.9 nΩ⋅m | ||||||||||||||||||||||||
| 熱伝導率 | (300 K) 156 W/(m⋅K) | ||||||||||||||||||||||||
| 熱膨張率 | (25 °C) 24.8 μm/(m⋅K) | ||||||||||||||||||||||||
| 音の伝わる速さ (微細ロッド) |
(r.t.) (annealed) 4940 m/s | ||||||||||||||||||||||||
| ヤング率 | 45 GPa | ||||||||||||||||||||||||
| 剛性率 | 17 GPa | ||||||||||||||||||||||||
| 体積弾性率 | 45 GPa | ||||||||||||||||||||||||
| ポアソン比 | 0.290 | ||||||||||||||||||||||||
| モース硬度 | 2.5 | ||||||||||||||||||||||||
| ブリネル硬度 | 260 MPa | ||||||||||||||||||||||||
| CAS登録番号 | 7439-95-4 | ||||||||||||||||||||||||
| 主な同位体 | |||||||||||||||||||||||||
| 詳細はマグネシウムの同位体を参照 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||

マグネシウム(ラテン語: magnesium[2] 英語発音: [mæɡˈniːziəm])は、原子番号12の元素である。元素記号Mg。原子量24.305。アルカリ土類金属のひとつ。
名称[編集]
マグネシウムという名称は、マグネシア(magnesia)またはその語源である産地のギリシャ・マグニシア県にちなんで命名された。酸化マグネシウムおよびオキソ酸塩の成分としてのマグネシウムは、苦い味に由来して苦土(くど、bitter salts)とも呼ばれている。日本に初めて紹介されたときは漢字で「麻倔涅叟母」と表記された[3]。
性質[編集]
ヒトを含む動物や植物の生命活動を支えるミネラル(必須元素)のひとつであり、とりわけ植物の光合成に必要なクロロフィルで配位結合の中心として不可欠である。また、有機化学においてはグリニャール試薬の構成元素として重要である。

酸化数はほぼ常に2価。比重1.74の柔らかい金属で、融点650 °C、沸点1090–1110 °C(異なる実験値あり)。マグネシウムには2つの同素体があり、常温、常圧で安定な結晶構造は六方最密充填構造(HCP)だが、温度を上げると、体心立方格子が安定となる。
酸素と結合しやすく、強い還元作用を持つ。空気中で長期間放置すると、表面が次第に酸化され灰色を帯びる。また、二酸化炭素、水、亜硫酸とも反応するが、いずれも不動態皮膜となるためアルカリ金属やカルシウムと異なり腐食は進行せず、鉱油中で保存する必要はない。
空気中で加熱すると炎と強い光を発して燃焼する(燃焼熱は601.7 kJ/mol)。さらに窒素や二酸化炭素中でも燃焼し、それぞれ窒化マグネシウム(Mg3N2、生成熱は461.08[4]kJ/mol)、酸化マグネシウム(MgO、生成熱は601.60 [5]kJ/mol)となる。
熱水や塩水、薄い酸には容易に溶解して水素を発生させる。このため、マグネシウム火災の消火には水は使えず[6][7]、ダライ粉などを用いる[8]。
同族元素との性質の違い[編集]
マグネシウムとベリリウムは第2族元素であるが、アルカリ土類金属ではない。これは第1族元素である水素がアルカリ金属ではないのと同様、化学的性質が異なるためである。ただし、まったく異なるわけではなく、第2族元素の代名詞として「アルカリ土類金属」の名が使われているため、広義にはアルカリ土類金属に含まれている。
カルシウム以降との違い[編集]
アルカリ土類金属とはカルシウム・ストロンチウム・バリウム(およびラジウム)に共通の化学的性質に由来するグループで、周期表に基づく族分類に先立って成立した。マグネシウムはアルカリ土類金属とは違う性質を持つ。
- 化合物が炎色反応を示さない(アルカリ土類金属は特有の発色を持つ)。
- 単体(粉末状を除く)が常温の水と反応しない(アルカリ土類金属は激しく反応して水素を発生する)。
- 常温空気中で表面に酸化不動態を形成する(アルカリ土類金属は内部まで急速に酸化される)。
- 硫酸塩が水に易溶である(アルカリ土類金属は難溶)。
- 水酸化物が水に難溶かつ弱塩基性(アルカリ土類金属は易溶)。
- 水酸化カルシウムは比較的水に溶けにくいが、それでも水酸化マグネシウムよりは溶けやすい。
ベリリウムとの違い[編集]
マグネシウムはベリリウムと共通した化学的性質を持つが、違いもある。
- 陽性が強い。ベリリウム化合物は共有結合性のものが多いのに対し、マグネシウム化合物は幾分共有結合性を帯びるものの依然イオン結合性のものが多い。
- 塩基性が強い。ベリリウムは両性元素であるため酸にもアルカリにも溶けるが、マグネシウムは塩基性が強いため、酸には溶けるもののアルカリには溶けない。
リチウムとの類似性[編集]
マグネシウムはリチウムと類似性があることでも知られている。その関係は斜めの関係と呼ばれている関係の一例である。斜めの関係とは、周期表で左上と右下の位置関係にある元素に見ることができる類似関係であり、周期表の左上隅の元素に見ることが出来る。ここで類似性の例を示す。
- マグネシウムにおけるグリニャール試薬やリチウムにおけるアルキルリチウムなど、有機金属化合物を形成する。
- 硫酸塩が水に易溶である(硫酸リチウム一水和物は0.436 kg/kg (at 0 °C)[9]、硫酸マグネシウムは0.30 kg/L (at 20 °C)[10])
- マグネシウムとリチウムはふつうの酸化物を形成する。(他のアルカリ金属やバリウムは過酸化物や超酸化物を形成する)
しかし、以下のような点では性質が異なっている。
- リチウムは常温で水と激しく反応して水素を発生するが、マグネシウムは常温で水と反応しない
このような性質はリチウムとマグネシウムが似た電荷密度を持っていることで説明できる。(リチウムイオンは98 C/mm3、マグネシウムイオンは120 C/mm3、ナトリウムイオンは24 C/mm3[11])
異方性[編集]

0001:滑り面 0012:双晶面
マグネシウムの結晶構造は室温では2つの面でしか滑りを起こさないため、純マグネシウムや合金を加熱せずに圧延などの加工をすると割れが発生しやすい。加工には加熱が必須となるが、燃焼しないよう注意を払う必要がある。
歴史[編集]
マグネシウムは安定な酸化物を作るため、ラボアジエはマグネシア(酸化マグネシウム)を元素としてあげている。1755年、スコットランドのジョゼフ・ブラックは炭酸マグネシウムを熱分解し、酸化マグネシウムと二酸化炭素に分離しているが、これをマグネシウムの発見とする事もある。
単離され金属元素であることが証明されたのは、1808年、ハンフリー・デービーによるマグネシアと酸化水銀の溶融電気分解による。
商業生産は1886年(明治19年)、アルミニウムと同時期に開始されたものの、精錬(カルシウムとの分離)が困難で普及が遅れた。第一次世界大戦を契機に軍事利用が伸び、1936年には軍事目的を陰に五輪の聖火リレーに利用され、1939年には3万2850トン、1943年のアメリカで18万4000トンが生産されている。日本では第二次世界大戦前から1994年(平成6年)まで宇部興産により生産されていた。マグネサイトなどの鉱石資源は、中国、北朝鮮、ロシアの3国で6割以上を占めている[12]。
用途[編集]
非常に軽い軽合金材料として重要であり、金属マグネシウムとしてさまざまな合金の第一金属(合金の基本となる金属)や、添加剤に利用される。また、反応性の高さから脱酸素剤や脱硫剤、さらに有機合成用試薬として欠かせない。必須元素であり、食品や医薬品のほか、飼料、肥料として広く用いられる。
金属として[編集]
- 合金 - 軽量で優れた性質を持ち、特に軽量化が重視される分野で需要が伸びている。安価になればプラスチックを代替する可能性もある。
- 工業的に使用されているもっとも軽い金属で用途は広く、航空機、自動車、農業機械、工具、精密機械、スポーツ用具、スピーカーの振動板、携帯用機器の筐体、医療機器、宇宙船、兵器など多種にわたる。かねてより問題であった腐食しやすい性質が改善されるにつれ、利用されるようになっていった。
- 合金添加剤 - 1998年ごろには世界需要の半数近くを占めた[13]。アルミニウム合金などに添加元素として少量付加するだけであっても、その合金としての性質を大きく左右する働きを持つ。この性質から、これまでの合金の硬度、強度、耐食性、耐熱性、その他機械的性質を向上させるための研究が活発に行われている。
- 鋳鉄 - ダクタイル鋳鉄(FCD)の黒鉛ノジュラー(球状)化剤。
- 鉄鋼脱硫剤 - 合金用途以外ではもっとも消費量が多く、精錬用フェロアロイ(フェロマグネシウム)。
- 金属還元剤 - ジルコニウム、チタンの製錬。
- 防食 - 防食マグネとして、金属の犠牲電極効果や、酸化物が使用される。
- カメラのフラッシュ - 酸化剤を混合した閃光粉が利用され、「マグネシウムを焚く」と表現した。光量調節が難しく、換算表に規定の使用量を天秤秤で毎回計量することを必要とし、発光時に大量の煙を発生させ、シャッターとの同調も手作業であるため、閃光電球やエレクトロニックフラッシュによって置き換えられた。
- 発火用具(ファイアスタータ)- 水に濡れていても発火できるため、軍事用、キャンプ用、非常用など。通常発火点としてのフェロセリウムと組み合わされており、あらかじめナイフなどで削ったマグネシウム粉を火口 (点火具)とし、フェロセリウム部で火花を起こして点火する。マグネシウム部のないフェロセリウムの発火機能のみのファイヤースターター類であっても「マグネシウム・ファイヤースターター」などの呼称が用いられる例が少なくないが、これは誤用である。
- スピーカーの振動板 - 単体は合金より内部損失が大きく、酸化防止の樹脂コーティングを施して使用される。
工業[編集]
- 耐火材 - 炉内耐火材(塩基性耐火煉瓦)として、おもに電気炉で用いる。
- 吸着材 - 水酸化マグネシウムが多く、酸化、炭酸マグネシウムなども。
- ゴム、プラスチック配合剤 - 添加剤、充填剤。
- セラミックス - 原料、焼結助剤。
- ガラス - 酸化ガラス添加剤。
- 電池 - 空気マグネシウム電池。
- 排煙脱硫剤 - 安価で脱硫効率が高い、水酸化マグネシウム放流法。
- 排水処理 - 石灰と同様、酸性排水の中和(カルシウムが混在したものが使われる)。
- 水質改善 - アオコ対策、赤潮対策、底質改善。
- 重金属処理 - アルカリ剤として不溶化処理、ヘドロなど泥土の固化。
有機合成用試薬[編集]
マグネシウムはハロゲン化アルキルと反応し、R-MgX(Rは有機置換基、Xはハロゲン)の一般式で表される有機金属化合物を作る。これはグリニャール試薬と呼ばれ、カルボニル化合物などと反応して炭素-炭素結合を生成する。このため有機合成分野において重要な試薬として用いられる。
そのほかにも多くの錯体・塩基性塩などの化合物を合成する。これらはおもに化学実験において、合成試料や試薬として使われる。
農業、食品、医薬[編集]
- 肥料 - 肥料分野においては、苦土の名称が用いられる事が多い。代表的な苦土肥料として、炭酸苦土肥料(もっとも代表的なものとして、炭酸カルシウム(CaCO3)との混合物である苦土石灰)、水酸苦土肥料、硫酸苦土肥料など。肥料としてのマグネシウムの効果については栄養素_(植物)#マグネシウム参照のこと。
- 食品添加物 - にがり(主成分は塩化マグネシウム(MgCl2))が豆腐製造の凝固剤(塩析剤)として用いられる(豆腐用の凝固剤に用いられるマグネシウム化合物には、ほかに硫酸マグネシウム(MgSO4)がある[14]。)。ほかに、膨張剤(炭酸マグネシウム(MgCO3))、栄養強化剤、加工助剤、呈味料など。なお、マグネシウムには呈味効果を有する有機酸との化合物が多数あるが(酢酸マグネシウムなど)、現在(2019年)の日本においては、それらの多くは食品添加物として認められていない。
- 医薬品 - クエン酸マグネシウムが大腸検査用下剤などとして。また一般用医薬品の分類で酸化マグネシウム製剤や水酸化マグネシウム製剤が市販されている。
次世代エネルギー[編集]
燃焼にて二酸化炭素を発生しないことから、化石燃料に替わる次世代エネルギーとしての利用研究が進められている。
水素に比べて常温・常圧下で固体なので輸送・貯蔵がしやすいというメリットがある。水と反応させて燃えるときの熱を利用するほか、同反応により発生する水素を燃料として利用する方法が挙げられる。燃焼後の酸化物をリサイクルするための還元処理に大きなエネルギーが必要となることが最大の課題であり、レーザーによる高温を利用する方法などが提案されている[15]。
ただし、マグネシウムを燃料として使用する場合、燃焼させて熱エネルギーに変換したうえで熱機関を利用する以上、カルノー効率を超えることはできない。また、水と反応させて水素を取り出しその水素を燃焼させる場合や生成した水素を燃料電池で電気エネルギーに変換するという用途も同様に効率が低い。
マグネシウムの持つ化学エネルギーを効率よく電気エネルギーに変換する方法としては、電池の陰極としてマグネシウムを使用する方法が効率がよい。ただし、マグネシウムは反応性が高く水と反応してしまうため、電解質に水溶液を用いることができない。このため、有機系電解質または溶融塩を使用することになる。
マグネシウムの化合物[編集]
無機塩[編集]
- フッ化マグネシウム(MgF2)
- 塩化マグネシウム(MgCl2)
- 臭化マグネシウム(MgBr2)
- ヨウ化マグネシウム(MgI2)
- 水素化マグネシウム(MgH2)
- 二ホウ化マグネシウム(MgB2)
- 窒化マグネシウム(Mg3N2)
- 硫化マグネシウム(MgS)
- 三ケイ酸マグネシウム(2MgO、3SiO2、nH2O) - 制酸剤、医薬品添加物、食品添加物
オキソ酸塩[編集]
- 炭酸マグネシウム(MgCO3) - 菱苦土石
- 炭酸カルシウムマグネシウム(CaMg(CO3)2) - 苦灰石、ドロマイト
- 硝酸マグネシウム(Mg(NO3)2)
- 硫酸マグネシウム(MgSO4)
- 亜硫酸マグネシウム(MgSO3)
- 過塩素酸マグネシウム(MgClO4)
- リン酸三マグネシウム(Mg3(PO4)2、8H2O)(Trimagnesium phosphate)
- 過マンガン酸マグネシウム(Mg(MnO4)2)
- リン酸マグネシウム
鉱物[編集]
有機塩[編集]
有機酸との塩である。
- 酢酸マグネシウム(Mg(CH3COO)2)
- クエン酸マグネシウム (Magnesium citrate)
- クエン酸トライマグネシウム(クエン酸トリマグネシウム、2クエン酸3マグネシウム)(Trimagnesium citrate, trimagnesium bicitrate)
- リンゴ酸マグネシウム
- グルタミン酸マグネシウム
- 安息香酸マグネシウム(C14H10MgO4)
- ステアリン酸マグネシウム(Mg(CH3(CH2)16COO)2)
- オロト酸マグネシウム
- グルコン酸マグネシウム
- グリシン酸マグネシウム
- タウリン酸マグネシウム
- スレオニン酸マグネシウム
同位体[編集]
マグネシウムは3つの安定同位体24Mg、25Mg、26Mg を持つ。
栄養学[編集]
精製・加工していない食品に広く含まれ、ゴマやアーモンドなどの種実類、ひじきなどの海藻類に多く、加工食品に少ない。
摂取基準[編集]
厚生労働省が定めた2015年版の『日本人の食事摂取基準』[16]より抜粋改変。
| 性別 | 年齢 | 推奨量 (RDA, mg/日) |
耐容上限量 (UL, mg/日) |
|---|---|---|---|
| 男 | 18歳以上 | 320–370 | 設定なし (参考値 650–700)[注 1] |
| 女 | 18歳以上 | 270–290 | 設定なし (参考値 650–700)[注 1] |
サプリメントなどの通常の食品以外からの摂取分については耐容上限量を350 mgとする。[17]
摂取状況[編集]
平成22年国民健康・栄養調査によれば、日本人成人(30–49歳男性)の推定摂取量は240–244 mg/日とされ、WHO推奨量である420 mg/日より不足している[18]。
生化学[編集]
生物との関係[編集]
マグネシウムは植物の光合成色素であるクロロフィルに含まれ、光を受け止める役割を担っている。このためマグネシウムが欠乏すると、植物の生育は減退し、収穫量の減量につながる。これは砂地で生育する植物に特に現れる。カリウムが豊富に含まれる土壌でも、植物へのマグネシウムの供給が行われにくくなることもわかっている。このため肥料として、マグネシウム化合物を含んだものが使用されることがある。
植物はマグネシウム不足になると小葉の葉脈間が黄変する症状がみられる[19]。
人間の生体内には約25 gのマグネシウムが存在し[20]、その50–60 %がリン酸塩として骨組織に[20]、残りは血漿、赤血球、筋肉中の各組織に存在する。血清中のマグネシウムは、約75–85 %がイオンや塩類の形態の透析型で、残りの15–25 %はアルブミンなどと結合した蛋白結合型(非透析型)で存在し、その濃度はおおむね1.8–2.3程度に維持されている[20]。
マグネシウムは人体にとっても、骨や歯の形成[20]、ならびにリボソームの構造維持やタンパク質の合成、そのほかエネルギー代謝に関する生体機能に必須な元素であるため、マグネシウムの欠乏は骨粗鬆症、虚血性心疾患、糖尿病などの原因のひとつと考えられている[20]。生体内でマグネシウムはおもに骨の表面近くにマグネシウムイオンとして保存され、代謝が不足した場合にはカルシウムイオンと置き換わり、マグネシウムが体内に補充される。マグネシウムの生体内での栄養素や薬理的な働きについては広範にわたって研究が行われているが、いまだその重要な面に関しては不明な点が多い。最近では、ミネラル成分のひとつとしてサプリメントや清涼飲料水などに添加されることが多くなってきている[要出典]。
マグネシウム過多による植物への影響は不明とされている[19]。
マグネシウムは動植物に対して毒性の強い元素でないため、植物肥料として過剰使用を特に警戒する必要はないが、動物が直接食物から摂取する場合には、ほかの無機物(リンやカルシウム)とのバランスを適切にしなければ、尿路結石などの原因になりうることがわかっている。これを受けて、猫用の飼料は、組成中のマグネシウムを減らすように改良されるようになった。
薬理作用[編集]
マグネシウム欠乏症の治療と予防に用いられるほか、乳酸が溜まった状況下で、足のつり(腓(こむら)返り)などの緩和に有効性が示唆されている。
マグネシウムは生体に必要不可欠な成分である反面、豆腐の製造にマグネシウムを含むにがりが使われることからも分かるように、高濃度のマグネシウムイオンはタンパク質を固化する性質を有する。マグネシウムの吸収機構は解明されていないが[21][信頼性要検証]、腸管からのマグネシウムの吸収率は、マグネシウム摂取量が多ければ吸収率が低下し、摂取量が少なければ吸収率は高くなる[22]。腸管から吸収されなければ、マグネシウムイオン濃度の高まりにより腸管内での浸透圧が高まることになる。このためサプリメントなどによるマグネシウムの過剰摂取で下痢を起こす[20]。この作用を利用し、クエン酸マグネシウムなどは大腸内視鏡検査に際して下剤として使われる。また、便秘の不快症状を緩和する目的の下剤として酸化マグネシウム(通称カマ)として用いられる。弱い塩基である酸化マグネシウムや水酸化マグネシウムは、胃酸中和のために胃腸薬に配合される。食品では、豆腐や天然塩などに含まれるにがりからマグネシウムが微量に摂取される。
過剰摂取により高マグネシウム血症を引き起こす。重篤な腎不全患者における大量摂取は非常に危険であり、心ブロック患者には静脈注射が禁忌となっている[23]。なお、近年のダイエットブームにおいてにがりの過剰摂取で死亡した事例もあるため、安易な過剰摂取は厳に慎むべきである。マグネシウムの急性毒性は、塩化マグネシウムとして、マウス経口LD50は4700 mg/kg、ラット経口LD50は2800 mg/kgである[24][信頼性要検証]。このラットのデータを70 kgのヒトに当てはめた場合、約200 gの塩化マグネシウムを一時に摂取すると50 %の確率で死に至ることに相当する。
また、マグネシウム摂取量が多いグループの男性の大腸癌リスクが低い[25]との報告がある。
糖尿病との関連性[編集]
慢性的な摂取不足は、脂肪細胞から分泌される分泌蛋白アディポネクチンの低下を招き、高感度CRPやIL-6の上昇に関連しており、2型糖尿病発症リスクを上昇させている[26]。
うつ病との関連性[編集]
マグネシウム欠乏下では、興奮性グルタミン酸神経のNMDA受容体の抑えが効かなくなり[注 2]、その神経毒性によりうつ病が引き起こされているのではないかという仮説がある。
NMRを用いた計測では、治療抵抗性うつ病で自殺企図あるいは自殺未遂経験のある患者では、脳脊髄液中のマグネシウム量が低いこと、抗うつ薬は脳内マグネシウム量を増やす作用があること、2008年の糖尿性うつ病患者へのマグネシウム投与で成果をあげていることから[27]、治療抵抗性うつ病患者に限らず、マグネシウムの処方は有益であるとする報告がある[28]。
また、magnesium glycinateまたはmagnesium taurinateの投与により、およそ1週間程度の短期での症状改善の報告がある[29]。
免疫系との関連性[編集]
閉経後の女性に関するコホート研究において、さまざまな変数を調整後のマグネシウムの摂取量と、炎症に関係するバイオマーカーの数値とが反比例するとの報告がある[30]。すなわち、マグネシウムの摂取量が多いほど体内の炎症反応が少ないことを示している。
高血圧との関連性
2022年1月、アメリカ食品医薬品局(FDA)は、マグネシウムの摂取が高血圧のリスクを低減する可能性があることを示す健康強調表示を企業が使用することに反対するつもりはないと発表した[31]。(つまり、企業がマグネシウムを含む食品や薬品において、高血圧リスクを低減できる効果があるかもしれない、と謳うことには問題がないと示した)
当然ながら消費者に誤解を与えないことや、健康強調表示自体を行うための他の基準を満たしていることが前提である。また、FDA自身はマグネシウム自体が高血圧に対して効果がある可能性は認めつつも、それらのエビデンスについては「一貫性がなく結論も出ていない」(inconsistent and inconclusive)ものであるとしている。
睡眠改善との関連性
また、マグネシウムの摂取は、睡眠時のリラックス効果やレストレスレッグ症候群に効果があるとされている[32]。
マグネシウムが関連した主な事故[編集]
- 1957年(昭和27年)12月26日 - 愛知県名古屋市中区新栄町の写真機材店でマグネシウムが爆発。死者10人、重軽傷者27人[33]。
- 2014年(平成26年)5月13日 - 東京都町田市の金属加工会社でマグネシウムが発火。工場側はマグネシウムの取り扱いを届け出ていなかったこともあり、駆けつけた消防隊が放水を続けて被害が拡大した。死者1人、重軽傷者7人[34]。
- 2018年(平成30年)9月 - 兵庫県神戸市東灘区の六甲アイランドで保管されていたコンテナから出火。マグネシウムが保管されていたコンテナが、台風第21号の暴風雨や高潮などの影響で冠水したことが原因。消火活動は困難を極め、1ヶ月以上にわたり燃え続けた[35]。
関連項目[編集]
脚注[編集]
注釈[編集]
- ^ a b 第6次改定版(2000年版)では650–700 mg/日とされていた。(第6次改定日本人の栄養所要量について参照)
- ^ マグネシウムはNMDA受容体の活性をブロックするモジュレータ(英)として働く。
出典[編集]
- ^ Bernath, P. F., Black, J. H., & Brault, J. W. (1985). “The spectrum of magnesium hydride”. Astrophysical Journal 298: 375. オリジナルの2012年1月11日時点におけるアーカイブ。.
- ^ WEBSTER'S DICTIONARY, 1913
- ^ “芝哲夫「認定化学遺産 第001号 杏雨書屋蔵 宇田川榕菴 化学関係資料」” (PDF). 公益社団法人日本化学会. 2022年4月5日閲覧。
- ^ “magnesium nitride” (英語). webbook.nist.gov. 2022年7月5日閲覧。
- ^ “magnesium oxide” (英語). webbook.nist.gov. 2022年7月5日閲覧。
- ^ 東京・町田「マグネシウム火災」工場 無許可操業で過去にも同様の火災!市は放置 - J-CASTニュース(2014/5/15 14:52版 / 2015年11月6日閲覧)
- ^ 金属工場火災、鎮火のめど立たず 1人重体、7人重軽傷 - 産経ニュース(2014.5.14 00:59版 / 2015年11月6日閲覧)
- ^ マグネシウムの基礎知識:安全な取扱い - 日本マグネシウム協会(更新日不明 / 2015年10月6日閲覧)
- ^ “安全データシート-国産化学-硫酸リチウム”. 2020年6月12日閲覧。
- ^ “安全データシート-国産化学-硫酸マグネシウム”. 2020年6月12日閲覧。
- ^ レイナーキャナム無機化学(原著第4版). 東京化学同人. (2016年10月20日). pp. 134p
- ^ 2.7 マグネシウム(Mg) (PDF) 東北経済産業局(2013年1月21日時点のアーカイブ)
- ^ 日本マグネシウム協会
- ^ 日本豆腐協会│豆腐のあれこれQ&A Q2. 凝固剤にはどんなものがあるのでしょうか?
- ^ 東工大クロニクルNo.402「太陽光レーザー、水、マグネシウムによる革新的エネルギーサイクル」 - ウェイバックマシン(2013年3月20日アーカイブ分)
- ^ 「「日本人の食事摂取基準(2015年版)策定検討会」の報告書を取りまとめました(厚生労働省)」『日本人の食事摂取基準(2015年版)の概要』(pdf)(レポート)(平成26年8月21日)厚生労働省、2014年3月28日。2018年2月3日閲覧。
- ^ 「日本人の食事摂取基準(2015 年版)の概要」 p.32 (PDF)
- ^ マグネシウム 国立健康・栄養研究所
- ^ a b 岐阜県街路樹等整備・管理の手引き 岐阜県建設研究センター、岐阜県造園緑化協会、2022年4月23日閲覧。
- ^ a b c d e f 「日本人の食事摂取基準(2015年版)策定検討会」報告書 p.262 (PDF)
- ^ 8.マグネシウムの再吸収異常と生活習慣病との関連性について
- ^ Barbara A. Bowman, Robert M. Russell 編『専門領域の最新情報 最新栄養学』(第8版)建帛社。ISBN 4767960983。 NCID BA59068042。
- ^ マグネシウム - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- ^ 製品安全データシート 0.01mol/1(M/100)-塩化マグネシウム溶液 (PDF) キシダ化学株式会社
- ^ マグネシウム摂取と大腸がんとの関連について JPHC Study 多目的コホート研究 独立行政法人国立がん研究センター
- ^ マグネシウム摂取不足の解消こそが糖尿病の増加を抑える 日経メディカルオンライン 2012年5月22日
- ^ Barragán-Rodríguez, L; Rodríguez-Morán, M; Guerrero-Romero, F (2008). “Efficacy and safety of oral magnesium supplementation in the treatment of depression in the elderly with type 2 diabetes: a randomized, equivalent trial”. Magnesium research : official organ of the International Society for the Development of Research on Magnesium 21 (4): 218–23. PMID 19271419.
- ^ Eby Ga, 3rd; Eby, KL (2010). “Magnesium for treatment-resistant depression: a review and hypothesis”. Medical hypotheses 74 (4): 649–660. doi:10.1016/j.mehy.2009.10.051. PMID 19944540.
- ^ George A. Eby; Karen L. Eby (2006). “Rapid recovery from major depression using magnesium treatment”. Medical hypotheses 67 (2): 362–370. doi:10.1016/j.mehy.2006.01.047.
- ^ Sara A. Chacko, MPH, Yiqing Song, MD, SCD, Lauren Nathan, MD, Lesley Tinker, PHD, Ian H. de Boer, MD, Fran Tylavsky, DRPH, Robert Wallace, MD and Simin Liu, MD, SCD1 (2009). “Relations of Dietary Magnesium Intake to Biomarkers of Inflammation and Endothelial Dysfunction in an Ethnically Diverse Cohort of Postmenopausal Women”. Diabetes Care 33 (2): 304–310. doi:10.1016/j.mehy.2006.01.047.
- ^ Nutrition, Center for Food Safety and Applied (2022-01-10). “FDA Announces Qualified Health Claim for Magnesium and Reduced Risk of High Blood Pressure” (英語). FDA.
- ^ “Your "Prescription" - Sleep and the Brain”. Coursera. 2022年3月19日閲覧。
- ^ 日外アソシエーツ編集部 編『日本災害史事典 1868-2009』日外アソシエーツ、2010年9月27日、89頁。ISBN 9784816922749。
- ^ “指導無視、マグネシウム届け出ず 町田工場火災、初動で消防隊が放水、爆発・炎上”. 産経新聞 (2014年5月27日). 2023年10月1日閲覧。
- ^ “コンテナ火災、台風後1カ月鎮火せず 放水で爆発の恐れ”. 朝日新聞DIGITAL (2018年10月5日). 2023年10月1日閲覧。
外部リンク[編集]
- Magnesium マグネシウム(英語) - (オレゴン州大学・ライナス・ポーリング研究所)
- マグネシウム解説 - 素材情報データベース<有効性情報>(国立健康・栄養研究所)
- 実験5 マグネシウムの酸化
- 国際化学物質安全性カード マグネシウム(粉末) (ICSC:0289) 日本語版(国立医薬品食品衛生研究所による), 英語版
- 国際化学物質安全性カード マグネシウム(ペレット) (ICSC:0701) 日本語版(国立医薬品食品衛生研究所による), 英語版
- 『マグネシウム』 - コトバンク
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| |||||||||||||||||||||||||||||||||



