「COVID-19ワクチン」の版間の差分
修正 |
en:COVID-19 vaccine (11 December 2020 00:17 UTC) より抄訳 タグ: サイズの大幅な増減 |
||
| 101行目: | 101行目: | ||
[[Category:予防接種]] |
[[Category:予防接種]] |
||
[[Category:反ワクチン運動]] |
[[Category:反ワクチン運動]] |
||
{{翻訳中途|1=[https://en.wikipedia.org/w/index.php?title=COVID-19_vaccine&oldid=993511118 "COVID-19 vaccine" 11 December 2020 00:17 UTC] |date=2020年12月}} |
|||
[[File:COVID-19 vaccine map.svg|thumb|right|400px| |
|||
ワクチンの展開と承認状況で色分けした地図 |
|||
{{legend|Green|一般的な使用が認められている(Approved)}} |
|||
{{legend|LightGreen|[[緊急使用許可|EUA]]付与、集団予防接種実施中}} |
|||
{{legend|DarkOrange|EUA付与、使用制限あり}} |
|||
{{legend|Gold|EUA保留中}}]] |
|||
'''COVID‑19ワクチン'''(コビッド19ワクチン)は、 [[新型コロナウイルス感染症 (2019年)|2019年新型コロナウイス感染症]](COVID‑19)に対する獲得免疫([[:en:Acquired_immunity|acquired immunity]])を提供することを目的とした、いくつかの異なる[[ワクチン]]技術の総称。このコロナウイルス感染症に対するワクチンを開発するための以前の研究、つまり[[重症急性呼吸器症候群|SARS]]および[[中東呼吸器症候群|MERS]]の研究は、コロナウイルスの構造と機能に関する知識を確立し、2020年初頭にCOVID-19ワクチンのさまざまな技術プラットフォームの開発を加速させた<ref name="diamond">{{Cite journal|last=Diamond|first=Michael S|last2=Pierson|first2=Theodore C|date=2020-05-13|title=The challenges of vaccine development against a new virus during a pandemic|journal=Cell Host and Microbe|volume=27|issue=5|pages=699–703|DOI=10.1016/j.chom.2020.04.021|PMID=32407708|PMC=7219397}}</ref>。 |
|||
2020年12月時点で、世界中で59のワクチン候補が開発されており、約42が第I/Ⅱ相試験、17が第Ⅱ/Ⅲ相試験中である <ref name="thanh2" /><ref name="london">{{cite web|url=https://vac-lshtm.shinyapps.io/ncov_vaccine_landscape/|title=COVID-19 vaccine development pipeline (Refresh URL to update)|publisher=Vaccine Centre, London School of Hygiene and Tropical Medicine|date=2020-11-30|access-date=2 December 2020}}</ref><ref name="milken">{{cite web|title=COVID-19 vaccine tracker (Choose vaccines tab, apply filters to view select data)|url=https://airtable.com/shrSAi6t5WFwqo3GM/tblEzPQS5fnc0FHYR/viwDBH7b6FjmIBX5x?blocks=hide|publisher=Milken Institute|access-date=2020-11-09|date=2020-11-16|lay-url=https://milkeninstitute.org/covid-19-tracker}}</ref><ref name="who-tracker">{{Cite web|title=Draft landscape of COVID 19 candidate vaccines|url=https://www.who.int/who-documents-detail/draft-landscape-of-covid-19-candidate-vaccines|publisher=World Health Organization|date=2020-11-12|access-date=2020-11-16}}</ref>。第Ⅲ相試験を完全に終えたワクチン候補は、まだない。 |
|||
[[世界保健機関]](WHO)、感染症流行対策イノベーション連合([[:en:Coalition_for_Epidemic_Preparedness_Innovations|Coalition for Epidemic Preparedness Innovations]], CEPI)、および[[ビル&メリンダ・ゲイツ財団|ゲイツ財団]](GF)は、COVID-19感染症の継続を防ぐためにいくつかのワクチンが必要になるという見通しのため、資金と組織のリソースを投入している<ref name="gates2">{{Cite web|title=The vaccine race explained: What you need to know about the COVID-19 vaccine|url=https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccine|author=Gates|first=Bill|publisher=The Gates Notes|date=2020-04-30|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200514010012/https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccine|archivedate=14 May 2020}}</ref> 。ワクチン候補の迅速な投資と開発のために20億ドルの世界基金を組織しているCEPI<ref name="cepi-fund">{{Cite web|title=CEPI welcomes UK Government's funding and highlights need for $2 billion to develop a vaccine against COVID-19|url=https://cepi.net/news_cepi/2-billion-required-to-develop-a-vaccine-against-the-covid-19-virus/|publisher=Coalition for Epidemic Preparedness Innovations, Oslo, Norway|accessdate=23 March 2020|date=6 March 2020|archiveurl=https://web.archive.org/web/20200322170547/https://cepi.net/news_cepi/2-billion-required-to-develop-a-vaccine-against-the-covid-19-virus/|archivedate=22 March 2020}}</ref>は、9月に、ライセンス取得を支援するための臨床データが2020年末までに入手できる可能性があることを示した。2020年5月4日には、WHOが主催したテレソン([[日本の長時間特別番組一覧|長時間特別番組]])で、40カ国から81億ドルの誓約書が寄せられた <ref name="waked">{{Cite web|title=EU spearheads $8 billion virus fundraiser|url=https://finance.yahoo.com/news/eu-hosts-virus-telethon-seeking-first-7-5-003500556.html|publisher=Yahoo Finance|first=Damon|author=Wake|date=2020-05-04|accessdate=2020-05-04|archiveurl=https://web.archive.org/web/20200629033556/https://finance.yahoo.com/news/eu-hosts-virus-telethon-seeking-first-7-5-003500556.html|archivedate=29 June 2020}}</ref>。同時に、WHOは、第II/III相臨床試験に到達した複数のワクチン候補の同時評価のための国際的な「連帯試験」の展開も発表した <ref name="who-accel">{{Cite web|title=Update on WHO Solidarity Trial – Accelerating a safe and effective COVID-19 vaccine|url=https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-trial-accelerating-a-safe-and-effective-covid-19-vaccine|publisher=World Health Organization|date=2020-04-27|accessdate=2020-05-02|quote=It is vital that we evaluate as many vaccines as possible as we cannot predict how many will turn out to be viable. To increase the chances of success (given the high level of attrition during vaccine development), we must test all candidate vaccines until they fail. [The] WHO is working to ensure that all of them have the chance of being tested at the initial stage of development. The results for the efficacy of each vaccine are expected within three to six months and this evidence, combined with data on safety, will inform decisions about whether it can be used on a wider scale.|archiveurl=https://web.archive.org/web/20200430185550/https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-trial-accelerating-a-safe-and-effective-covid-19-vaccine|archivedate=30 April 2020}}</ref>。 |
|||
2020年11月、[[バーレーン]]は{{仮リンク|Sinopharm|en|China National Pharmaceutical Group}}社製ワクチンの緊急販売承認を与え、[[アラブ首長国連邦]]がこれに続いた。12月には、バーレーンと英国が[[ファイザー]]社製ワクチンを緊急時の使用を承認した<ref name=ukgov12-2/><ref name="bna">{{cite news |title=Bahrain second in the world to approve the Pfizer/BioNTech Covid-19 vaccine |url=https://www.bna.bh/en/news?cms=q8FmFJgiscL2fwIzON1%2BDteRtB2wfPWh%2FOmYUjt6ApY%3D |access-date=9 December 2020 |agency=Bahrain News Agency |date=4 December 2020}}</ref>一方で、UAEとカナダは一般使用を承認した<ref name="hcreg">{{cite web|date=9 December 2020|title=Regulatory Decision Summary - Pfizer-BioNTech COVID-19 Vaccine|url=https://covid-vaccine.canada.ca/info/regulatory-decision-summary-detailTwo.html?linkID=RDS00730|accessdate=9 December 2020|publisher=Health Canada, Government of Canada}}</ref><ref name="hcapps">{{cite web|date=9 December 2020|title=Drug and vaccine authorizations for COVID-19: List of applications received|url=https://www.canada.ca/en/health-canada/services/drugs-health-products/covid19-industry/drugs-vaccines-treatments/authorization/applications.html|accessdate=9 December 2020|publisher=Health Canada, Government of Canada}}</ref><ref name=":0">{{Cite news|last=Zimmer|first=Carl|last2=Corum|first2=Jonathan|last3=Wee|first3=Sui-Lee|date=2020-06-10|title=Coronavirus Vaccine Tracker|language=en-US|work=The New York Times|url=https://www.nytimes.com/interactive/2020/science/coronavirus-vaccine-tracker.html|access-date=2020-12-10|issn=0362-4331}}</ref>。 |
|||
== 概要と沿革 == |
|||
=== SARSとMERS === |
|||
2003年現在、鳥類感染性気管支炎ウイルス([[:en:Infectious_bronchitis_virus|infectious bronchitis virus]])、[[犬コロナウイルス]]、猫コロナウイルスなど、コロナウイルスによって引き起こされるいくつかの動物の病気に対してワクチンは製造されている<ref>{{Cite journal|date=December 2003|title=Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus|journal=Avian Pathology|volume=32|issue=6|pages=567–82|DOI=10.1080/03079450310001621198|PMID=14676007|PMC=7154303}}</ref>。ヒトに影響を与える[[コロナウイルス科|''コロナウイルス''科]]の''[[コロナウイルス科|ウイルス]]''に対するワクチンを開発するための以前のプロジェクトは、[[重症急性呼吸器症候群]](SARS)と[[中東呼吸器症候群]](MERS)を対象としていた。SARS<ref>{{Cite journal|date=December 2003|title=Effects of a SARS-associated coronavirus vaccine in monkeys|journal=Lancet|volume=362|issue=9399|pages=1895–96|DOI=10.1016/S0140-6736(03)14962-8|PMID=14667748|PMC=7112457}}</ref>およびMERS<ref>{{Cite journal|date=October 2014|title=Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice|journal=Vaccine|volume=32|issue=45|pages=5975–82|DOI=10.1016/j.vaccine.2014.08.058|PMID=25192975|PMC=7115510}}</ref>に対するワクチンは、ヒト以外の[[モデル生物|動物で]]テストされている。 |
|||
2005年と2006年に発表された研究によると、SARSを治療するための新しいワクチンと医薬品の特定と開発は、当時の世界中の政府と衛生行政機関にとって優先事項だった <ref name="PMID 15655773">{{Cite journal|date=February 2005|title=Development and characterization of a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody that provides effective immunoprophylaxis in mice|journal=The Journal of Infectious Diseases|volume=191|issue=4|pages=507–14|DOI=10.1086/427242|PMID=15655773|PMC=7110081}}</ref> <ref name="PMID 15885812">{{Cite journal|date=September 2005|title=Monoclonal antibodies to SARS-associated coronavirus (SARS-CoV): identification of neutralizing and antibodies reactive to S, N, M and E viral proteins|journal=Journal of Virological Methods|volume=128|issue=1–2|pages=21–28|DOI=10.1016/j.jviromet.2005.03.021|PMID=15885812|PMC=7112802}}</ref> <ref name="PMID 16453264">{{Cite journal|date=March 2006|title=Therapy with a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody reduces disease severity and viral burden in golden Syrian hamsters|journal=The Journal of Infectious Diseases|volume=193|issue=5|pages=685–92|DOI=10.1086/500143|PMID=16453264|PMC=7109703}}</ref>。2020年の時点で、ヒトのSARSに対して安全で効果的であることが証明されている治療法や予防ワクチンは無い <ref name="JiangFutureVirology">{{Cite journal|date=January 2013|title=Development of SARS vaccines and therapeutics is still needed|journal=Future Virology|volume=8|issue=1|pages=1–2|DOI=10.2217/fvl.12.126|PMID=32201503|PMC=7079997}}</ref> <ref>{{Cite web|url=https://www.nhs.uk/conditions/sars/|title=SARS (severe acute respiratory syndrome)|date=5 March 2020|publisher=[[National Health Service]]|archiveurl=https://web.archive.org/web/20200309174230/https://www.nhs.uk/conditions/sars/|archivedate=9 March 2020|accessdate=31 January 2020}}</ref>。 |
|||
MERSに対し確立されたワクチンも、存在しない<ref>{{Cite journal|last=Shehata|first=Mahmoud M.|last2=Gomaa|first2=Mokhtar R.|last3=Ali|first3=Mohamed A.|last4=Kayali|first4=Ghazi|date=20 January 2016|title=Middle East respiratory syndrome coronavirus: a comprehensive review|journal=Frontiers of Medicine|volume=10|issue=2|pages=120–36|DOI=10.1007/s11684-016-0430-6|PMID=26791756|PMC=7089261}}</ref>。MERSが普及したとき、既存のSARS研究は、MERS-CoV感染に対するワクチンと治療法を開発するための有用なテンプレートを提供する可能性があると考えられていた<ref name="JiangFutureVirology">{{Cite journal|date=January 2013|title=Development of SARS vaccines and therapeutics is still needed|journal=Future Virology|volume=8|issue=1|pages=1–2|DOI=10.2217/fvl.12.126|PMID=32201503|PMC=7079997}}</ref> <ref name="Butler3oct2013">{{Cite journal|date=October 2012|title=SARS veterans tackle coronavirus|journal=Nature|volume=490|issue=7418|page=20|bibcode=2012Natur.490...20B|DOI=10.1038/490020a|PMID=23038444}}</ref> 。2020年3月現在、ヒトでの第I相臨床試験を完了した(DNAベースの)MERSワクチンが1種<ref>{{Cite journal|date=September 2019|title=Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial|journal=The Lancet. Infectious Diseases|volume=19|issue=9|pages=1013–22|DOI=10.1016/S1473-3099(19)30266-X|PMID=31351922|PMC=7185789}}</ref>、その他3種のワクチンが進行中であり、いずれもアデノウイルスベクター型2種(ChAdOx1-MERS、BVRS-GamVac)、MVAベクター型1種(MVA-MERS-S)である <ref>{{Cite journal|year=2019|title=Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus|journal=Frontiers in Microbiology|volume=10|page=1781|DOI=10.3389/fmicb.2019.01781|PMID=31428074|PMC=6688523}}</ref>。 |
|||
=== 2020年のCOVID‑19ワクチン開発 === |
|||
感染症のワクチンは、これまで数年以内に製造されたことがなく、ヒトのコロナウイルス感染を予防するためのワクチンは存在しない<ref name="gates2">{{Cite web|title=The vaccine race explained: What you need to know about the COVID-19 vaccine|url=https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccine|author=Gates|first=Bill|publisher=The Gates Notes|date=2020-04-30|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200514010012/https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccine|archivedate=14 May 2020}}</ref> 。2019年12月にコロナウイルスが検出された後 <ref name="who-time">{{Cite web|title=World Health Organization timeline – COVID-19|url=https://www.who.int/news-room/detail/27-04-2020-who-timeline---covid-19|publisher=World Health Organization|date=2020-04-27|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200429012212/https://www.who.int/news-room/detail/27-04-2020-who-timeline---covid-19|archivedate=29 April 2020}}</ref> COVID‑19の[[塩基配列|遺伝子配列]]が2020年1月11日に公開され、発生に備えて予防ワクチンの開発を早めるための緊急の国際的対応が引き起こされた <ref name="thanh">{{Cite journal|last=Thanh Le|first=Tung|last2=Andreadakis|first2=Zacharias|last3=Kumar|first3=Arun|last4=Gómez Román|first4=Raúl|last5=Tollefsen|first5=Stig|last6=Saville|first6=Melanie|last7=Mayhew|first7=Stephen|date=9 April 2020|title=The COVID-19 vaccine development landscape|journal=Nature Reviews Drug Discovery|volume=19|issue=5|pages=305–06|DOI=10.1038/d41573-020-00073-5|ISSN=1474-1776|PMID=32273591}}</ref> <ref name="gates1">{{Cite journal|date=February 2020|title=Responding to Covid-19: A once-in-a-century pandemic?|journal=The New England Journal of Medicine|volume=382|issue=18|pages=1677–79|DOI=10.1056/nejmp2003762|PMID=32109012}}</ref> <ref name="Fauci">{{Cite journal|date=March 2020|title=Covid-19: Navigating the uncharted|journal=The New England Journal of Medicine|volume=382|issue=13|pages=1268–69|DOI=10.1056/nejme2002387|PMID=32109011|PMC=7121221}}</ref>。 |
|||
2020年2月、[[世界保健機関]](WHO)は、原因ウイルスである[[SARSコロナウイルス2|重症急性呼吸器症候群コロナウイルス2]] (SARS-CoV-2)に対するワクチンが18か月以内に利用可能になるとは予想していなかったと述べた<ref>{{Cite web|url=https://theconversation.com/heres-why-the-who-says-a-coronavirus-vaccine-is-18-months-away-131213|title=Here's why the WHO says a coronavirus vaccine is 18 months away|author=Grenfell|first=Rob|date=14 February 2020|website=Business Insider|accessdate=11 November 2020}}</ref>。2020年初頭に世界的にCOVID-19の感染率が急増したことで、国際的なアライアンスや政府の取り組みが刺激され、複数のワクチンを短期間で製造するためのリソースを緊急に整理し<ref name="who-accel">{{Cite web|title=Update on WHO Solidarity Trial – Accelerating a safe and effective COVID-19 vaccine|url=https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-trial-accelerating-a-safe-and-effective-covid-19-vaccine|publisher=World Health Organization|date=2020-04-27|accessdate=2020-05-02|quote=It is vital that we evaluate as many vaccines as possible as we cannot predict how many will turn out to be viable. To increase the chances of success (given the high level of attrition during vaccine development), we must test all candidate vaccines until they fail. [The] WHO is working to ensure that all of them have the chance of being tested at the initial stage of development. The results for the efficacy of each vaccine are expected within three to six months and this evidence, combined with data on safety, will inform decisions about whether it can be used on a wider scale.|archiveurl=https://web.archive.org/web/20200430185550/https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-trial-accelerating-a-safe-and-effective-covid-19-vaccine|archivedate=30 April 2020}}</ref>、3月には4つのワクチン候補がヒト評価に入ることになりました(後述の[[COVID-19ワクチン|2020年に開始される臨床試験床試験]]の表を参照) <ref name="thanh">{{Cite journal|last=Thanh Le|first=Tung|last2=Andreadakis|first2=Zacharias|last3=Kumar|first3=Arun|last4=Gómez Román|first4=Raúl|last5=Tollefsen|first5=Stig|last6=Saville|first6=Melanie|last7=Mayhew|first7=Stephen|date=9 April 2020|title=The COVID-19 vaccine development landscape|journal=Nature Reviews Drug Discovery|volume=19|issue=5|pages=305–06|DOI=10.1038/d41573-020-00073-5|ISSN=1474-1776|PMID=32273591}}</ref> <ref name="yamey">{{Cite journal|date=May 2020|title=Ensuring global access to COVID‑19 vaccines|journal=Lancet|volume=395|issue=10234|pages=1405–06|DOI=10.1016/S0140-6736(20)30763-7|PMID=32243778|PMC=7271264}}</ref> |
|||
2020年4月、WHOは、異なる技術と流通を持つ3種類以上のワクチンを開発するための総費用を80億米ドルと見積もった <ref name="who-accel">{{Cite web|title=Update on WHO Solidarity Trial – Accelerating a safe and effective COVID-19 vaccine|url=https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-trial-accelerating-a-safe-and-effective-covid-19-vaccine|publisher=World Health Organization|date=2020-04-27|accessdate=2020-05-02|quote=It is vital that we evaluate as many vaccines as possible as we cannot predict how many will turn out to be viable. To increase the chances of success (given the high level of attrition during vaccine development), we must test all candidate vaccines until they fail. [The] WHO is working to ensure that all of them have the chance of being tested at the initial stage of development. The results for the efficacy of each vaccine are expected within three to six months and this evidence, combined with data on safety, will inform decisions about whether it can be used on a wider scale.|archiveurl=https://web.archive.org/web/20200430185550/https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/solidarity-trial-accelerating-a-safe-and-effective-covid-19-vaccine|archivedate=30 April 2020}}</ref> <ref name="cepi-landmark">{{Cite web|title=Landmark global collaboration launched to defeat COVID-19 pandemic|url=https://cepi.net/news_cepi/landmark-global-collaboration-launched-to-defeat-covid-19-pandemic/|publisher=CEPI|date=2020-04-24|accessdate=2020-05-02|quote=The global nature of a pandemic means that any vaccine or medicine that is successfully developed will be needed immediately all over the world. That means that the challenge we face is not only one of R&D but one of manufacturing at scale, and equitable access.|archiveurl=https://web.archive.org/web/20200502023137/https://cepi.net/news_cepi/landmark-global-collaboration-launched-to-defeat-covid-19-pandemic/|archivedate=2 May 2020}}</ref> 。2020年4月までに、「19カ国のほぼ80の企業や研究機関」がこの仮想的なゴールドラッシュに取り組んでいた <ref name="cssa">{{Cite news|last=Schmidt|first=Charles|title=Genetic Engineering Could Make a COVID-19 Vaccine in Months Rather Than Years|url=https://www.scientificamerican.com/article/genetic-engineering-could-make-a-covid-19-vaccine-in-months-rather-than-years1/|publisher=Scientific American|date=1 June 2020|accessdate=26 August 2020|archivedate=11 October 2020|archiveurl=https://web.archive.org/web/20201011084737/https://www.scientificamerican.com/article/genetic-engineering-could-make-a-covid-19-vaccine-in-months-rather-than-years1//}}</ref>。 また、4月には、CEPIは、COVID-19に対するワクチン候補のうち、6つのワクチンが国際的な連合によって第II-III相試験を経て開発のために選ばれ、3つのワクチンは最終的なライセンス取得に向けて規制と品質保証を経て合理化されなければならないと見積もっている <ref name="thanh2">{{Cite journal|last=Le|first=Tung Thanh|last2=Cramer|first2=Jakob P.|last3=Chen|first3=Robert|last4=Mayhew|first4=Stephen|date=2020-09-04|title=Evolution of the COVID-19 vaccine development landscape|journal=Nature Reviews Drug Discovery|volume=19|issue=10|pages=667–68|DOI=10.1038/d41573-020-00151-8|ISSN=1474-1776|PMID=32887942}}</ref> <ref name="yamey">{{Cite journal|date=May 2020|title=Ensuring global access to COVID‑19 vaccines|journal=Lancet|volume=395|issue=10234|pages=1405–06|DOI=10.1016/S0140-6736(20)30763-7|PMID=32243778|PMC=7271264}}</ref> <ref name="gates2">{{Cite web|title=The vaccine race explained: What you need to know about the COVID-19 vaccine|url=https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccine|author=Gates|first=Bill|publisher=The Gates Notes|date=2020-04-30|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200514010012/https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccine|archivedate=14 May 2020}}</ref>。別の分析によると、10のワクチン候補が同時に初期開発を必要とし、そのうちのいくつかがライセンス取得に向けた最終的な道筋として選ばれる前に、10のワクチン候補が同時に初期開発を必要とすると見積もっている。 |
|||
2020年7月、英国国家サイバーセキュリティ―センター([[:en:National_Cyber_Security_Centre_(United_Kingdom)|National Cyber Security Centre]])として、それぞれの政府および軍隊の英米諜報機関およびセキュリティ組織が、カナダ通信保安局([[:en:Communications_Security_Establishment|Communications Security Establishment]])、国土安全保障省国家保護・プログラム総局([[:en:Cybersecurity_and_Infrastructure_Security_Agency|Cybersecurity Infrastructure Security Agency]])、[[アメリカ国家安全保障局]](NSA)は、ロシアの国家支援ハッカーが他の国の学術機関や製薬機関からCOVID‑19治療とワクチン研究を盗もうとした可能性があると主張した。ロシアはそれを否定した<ref>{{Cite news|last=Fox|first=Chris|author2=Kelion|first2=Leo|date=2020-07-16|title=Russian spies 'target coronavirus vaccine'|newspaper=BBC News Online|url=https://www.bbc.com/news/technology-53429506|accessdate=2020-08-01|archivedate=11 October 2020|archiveurl=https://web.archive.org/web/20201011084740/https://www.bbc.com/news/technology-53429506/}}</ref>。 |
|||
== グローバル開発 == |
|||
2020年の間に、年初からのCOVID-19ワクチン開発の取り組み全体の大きな変化は、[[製薬|多国籍製薬業界]]と各国政府との共同研究の増加と、COVID-19ワクチンに注力する多くの国の[[生物工学|バイオテクノロジー]]企業の多様性と増加である <ref name="thanh2" />。CEPIによると、COVID-19ワクチン開発の一般的な地理的分布は、北米の組織が世界のCOVID-19ワクチン研究の約40%を占めているのに対し、アジアと[[オーストラリア]]では30%、ヨーロッパでは26%、[[南アメリカ|南米]]とアフリカではいくつかのプロジェクトが存在している <ref name="thanh">{{Cite journal|last=Thanh Le|first=Tung|last2=Andreadakis|first2=Zacharias|last3=Kumar|first3=Arun|last4=Gómez Román|first4=Raúl|last5=Tollefsen|first5=Stig|last6=Saville|first6=Melanie|last7=Mayhew|first7=Stephen|date=9 April 2020|title=The COVID-19 vaccine development landscape|journal=Nature Reviews Drug Discovery|volume=19|issue=5|pages=305–06|DOI=10.1038/d41573-020-00073-5|ISSN=1474-1776|PMID=32273591}}</ref>。 |
|||
=== 国際機関 === |
|||
ワクチン開発を加速させ、流通に備えるための国際的な提携を形成している組織があるが、その中には、5月初旬に8億米ドルの資金調達を開始し、史上前例のない規模で協力、研究の加速化、国際的なコミュニケーションを促進している[[世界保健機関|WHO]]も含まれている<ref name="waked">{{Cite web|title=EU spearheads $8 billion virus fundraiser|url=https://finance.yahoo.com/news/eu-hosts-virus-telethon-seeking-first-7-5-003500556.html|publisher=Yahoo Finance|first=Damon|author=Wake|date=2020-05-04|accessdate=2020-05-04|archiveurl=https://web.archive.org/web/20200629033556/https://finance.yahoo.com/news/eu-hosts-virus-telethon-seeking-first-7-5-003500556.html|archivedate=29 June 2020}}</ref> 。WHOはまた、世界的なワクチン開発を調整するためのCovid-19 Vaccines Global Access(COVAX)を実施し、[[GAVIアライアンス|GAVI]]やCEPIと共同で''[[:en:Access_to_COVID-19_Tools_Accelerator|Access to COVID-19 Tools (ACT) Accelerator]]''のワクチンの柱となっている <ref name="thanh2" /><ref name="who-covax" /><ref name="covax-gavi" />。7月、WHOは、世界人口の最大60%を占める165カ国が、最終的な認可ワクチンの公正かつ衡平な配分のためのWHO COVAX計画に合意したことを発表した。 COVAXは、COVID-19ワクチンの開発と製造を加速し、認可ワクチンへのアクセスがすべての国に公平に提供されることを保証することを目標としている。2021年末までに、各参加国が最も脆弱な20%の人口にワクチンを接種するために、保証された分量を受け取ることを保証する。 |
|||
組織は、ワクチン開発を促進し、配布の準備をするために国際的な提携を結んでいます。これには、コラボレーション、加速された研究、および歴史上前例のない規模の国際コミュニケーションを促進するWHOが含まれ、5月上旬に{{US$|8.1}}を調達します。{{Spaces}}数十億の誓約。 <ref name="waked">{{Cite web|title=EU spearheads $8 billion virus fundraiser|url=https://finance.yahoo.com/news/eu-hosts-virus-telethon-seeking-first-7-5-003500556.html|publisher=Yahoo Finance|first=Damon|author=Wake|date=2020-05-04|accessdate=2020-05-04|archiveurl=https://web.archive.org/web/20200629033556/https://finance.yahoo.com/news/eu-hosts-virus-telethon-seeking-first-7-5-003500556.html|archivedate=29 June 2020}}</ref> WHOはまた、グローバルなワクチン開発を調整するための''Covid‑19 Vaccines Global Access'' (COVAX)、 [[GAVIアライアンス|GAVI]]およびCoalition for Epidemic Preparedness Innovations (CEPI)と協力して、 ''Access to COVID-19 Tools(ACT)Accelerator''のワクチンの柱を実装しました。 <ref name="thanh2" /><ref name="who-covax">{{Cite web|title=The Access to COVID-19 Tools (ACT) Accelerator|url=https://www.who.int/initiatives/act-accelerator|publisher=World Health Organization|date=2020|accessdate=2020-08-29|archivedate=25 September 2020|archiveurl=https://web.archive.org/web/20200925122714/https://www.who.int/initiatives/act-accelerator/}}</ref> <ref name="covax-gavi">{{Cite web|title=COVAX: Ensuring global equitable access to COVID-19 vaccines|url=https://www.gavi.org/covid19/covax-facility|publisher=GAVI|accessdate=28 August 2020|date=2020|archivedate=25 September 2020|archiveurl=https://web.archive.org/web/20200925122717/https://www.gavi.org/covid19/covax-facility/}}</ref> 7月、WHOは、世界人口の最大60%を占める165か国が、最終的に認可されたワクチンを公正かつ公平に配布するためのWHO COVAX計画に合意し、各参加国が保証された用量の割合を受け取ることを保証したと発表しました。 2021年末までに人口の最も脆弱な20%にワクチンを接種する <ref name="covax">{{Cite web|title=More than 150 countries engaged in COVID-19 vaccine global access facility|url=https://www.who.int/news-room/detail/15-07-2020-more-than-150-countries-engaged-in-covid-19-vaccine-global-access-facility|publisher=World Health Organization|accessdate=25 July 2020|date=15 July 2020|quote=COVAX is the only truly global solution to the COVID-19 pandemic. For the vast majority of countries, whether they can afford to pay for their own doses or require assistance, it means receiving a guaranteed share of doses and avoiding being pushed to the back of the queue, as we saw during the H1N1 pandemic a decade ago. Even for those countries that are able to secure their own agreements with vaccine manufacturers, this mechanism represents, through its world-leading portfolio of vaccine candidates, a means of reducing the risks associated with individual candidates failing to show efficacy or gain licensure.|archivedate=15 July 2020|archiveurl=https://web.archive.org/web/20200715152301/https://www.who.int/news-room/detail/15-07-2020-more-than-150-countries-engaged-in-covid-19-vaccine-global-access-facility}}</ref>。 COVAXは、COVID‑19ワクチンの開発と製造を加速し、認可されたワクチンへのアクセスがすべての国に公平に提供されることを保証することを目標としている 。 |
|||
CEPIは、国際保健当局およびワクチン開発者と協力して、さらに{{US$|2}}を作成しています。{{Spaces}}公的、私的、慈善団体、市民社会の組織間のグローバルパートナーシップで、8つのワクチン候補の研究と臨床試験を加速するための10億の資金を提供し、2020〜21年の目標は、ライセンスの完全な開発のためにいくつかの候補を支援することです。 <ref name="thanh2" /><ref name="cepi-landmark">{{Cite web|title=Landmark global collaboration launched to defeat COVID-19 pandemic|url=https://cepi.net/news_cepi/landmark-global-collaboration-launched-to-defeat-covid-19-pandemic/|publisher=CEPI|date=2020-04-24|accessdate=2020-05-02|quote=The global nature of a pandemic means that any vaccine or medicine that is successfully developed will be needed immediately all over the world. That means that the challenge we face is not only one of R&D but one of manufacturing at scale, and equitable access.|archiveurl=https://web.archive.org/web/20200502023137/https://cepi.net/news_cepi/landmark-global-collaboration-launched-to-defeat-covid-19-pandemic/|archivedate=2 May 2020}}</ref>英国、カナダ、ベルギー、ノルウェー、スイス、ドイツ、オランダはすでに{{US$|915}}寄付していました{{Spaces}}5月上旬までにCEPIに100万ドル。 <ref name="waked">{{Cite web|title=EU spearheads $8 billion virus fundraiser|url=https://finance.yahoo.com/news/eu-hosts-virus-telethon-seeking-first-7-5-003500556.html|publisher=Yahoo Finance|first=Damon|author=Wake|date=2020-05-04|accessdate=2020-05-04|archiveurl=https://web.archive.org/web/20200629033556/https://finance.yahoo.com/news/eu-hosts-virus-telethon-seeking-first-7-5-003500556.html|archivedate=29 June 2020}}</ref> <ref name="reuters">{{Cite news|date=2020-04-27|title=Special Report: Countries, companies risk billions in race for coronavirus vaccine|first=Julie|last=Steenhuysen|first2=Peter|author2=Eisler|first3=Allison|author3=Martell|first4=Stephanie|author4=Nebehay|newspaper=Reuters|url=https://www.reuters.com/article/health-coronavirus-vaccine-idUSL2N2CF0JG|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200515031817/https://www.reuters.com/article/health-coronavirus-vaccine-idUSL2N2CF0JG|archivedate=15 May 2020}}</ref>ワクチンの研究と配布を専門とする民間の慈善団体である[[ビル&メリンダ・ゲイツ財団|ビル&メリンダゲイツ財団]](ゲイツ財団)は、 {{US$|250}}寄付しています。{{Spaces}}COVID‑19ワクチンの研究と公教育支援のためのCEPIの支援で100万人。 <ref name="sanger">{{Cite news|last=Sanger|date=2020-05-02|archiveurl=https://web.archive.org/web/20200511003506/https://www.nytimes.com/2020/05/02/us/politics/vaccines-coronavirus-research.html|issn=0362-4331|accessdate=2020-05-02|url=https://www.nytimes.com/2020/05/02/us/politics/vaccines-coronavirus-research.html|newspaper=[[The New York Times]]|title=With Pressure Growing, Global Race for a Vaccine Intensifies|first5=Sui-Lee|first=David E.|author5=Wee|first4=Katie|author4=Thomas|first3=Carl|author3=Zimmer|first2=David D.|author2=Kirkpatrick|archivedate=11 May 2020}}</ref> <ref>{{Cite news|title=Bill Gates thinks there are 8 to 10 promising coronavirus vaccine candidates and one could be ready in as little as 9 months|url=https://www.businessinsider.com/bill-gates-10-promising-coronavirus-vaccine-candidates-2020-5|last=Hamilton|first=Isobel Asher|date=2020-05-01|newspaper=Business Insider|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200516101559/https://www.businessinsider.com/bill-gates-10-promising-coronavirus-vaccine-candidates-2020-5|archivedate=16 May 2020}}</ref> |
|||
6月4日、英国のロンドンから、 [[G7]]および[[G20]]諸国の35[[元首|の国家元首を]]含む、52か国の民間および政府の代表者の間で[[仮想共同体|仮想]]サミットが調整され、 {{US$|8.8}}が調達されました。{{Spaces}}300のCOVID‑19ワクチン接種に備えるための[[GAVIアライアンス|ワクチンと予防接種のため]]の[[GAVIアライアンス|グローバルアライアンス(GAVI)]]を支援する10億{{Spaces}}2025年までに発展途上国の100万人の子供たち。 <ref name="gavi-summit">{{Cite web|title=Global Vaccine Summit 2020: World leaders make historic commitments to provide equal access to vaccines for all|url=https://www.gavi.org/news/media-room/world-leaders-make-historic-commitments-provide-equal-access-vaccines-all|accessdate=2020-06-04|publisher=Global Alliance for Vaccines and Immunisation|date=2020-06-04|archiveurl=https://web.archive.org/web/20200606161748/https://www.gavi.org/news/media-room/world-leaders-make-historic-commitments-provide-equal-access-vaccines-all|archivedate=6 June 2020}}</ref>主な寄付は{{US$|1.6}}{{Spaces}}ゲイツ財団からの10億ドル<ref>{{Cite press release|title=Bill & Melinda Gates Foundation pledges {{US$|1.6}}{{nbsp}}billion to Gavi, the Vaccine Alliance, to protect the next generation with lifesaving vaccines|publisher=The Bill & Melinda Gates Foundation|date=2020-06-04|url=https://www.prnewswire.com/news-releases/bill--melinda-gates-foundation-pledges-1-6-billion-to-gavi-the-vaccine-alliance-to-protect-the-next-generation-with-lifesaving-vaccines-301070878.html|accessdate=2020-06-04|archiveurl=https://web.archive.org/web/20200604165907/https://www.prnewswire.com/news-releases/bill--melinda-gates-foundation-pledges-1-6-billion-to-gavi-the-vaccine-alliance-to-protect-the-next-generation-with-lifesaving-vaccines-301070878.html|archivedate=4 June 2020}}</ref>および{{GBP|330}}{{Spaces}}英国政府による5年間で年間100万{{US$|2.1}}(約{{US$|2.1}}{{Spaces}}2020年6月に10億)。 |
|||
== テクノロジープラットフォーム == |
|||
See also: [[:en:ULT freezer § Use for COVID-19 vaccine storage|''ULT freezer § Use for COVID-19 vaccine storage'']] |
|||
CEPIの科学者は、2020年9月に、COVID-19に対する有効なワクチンを作成するために、9つの異なる技術プラットフォーム-多数の候補の技術が未定義のまま-が2020年中に研究開発中であることを報告した<ref name="thanh2" />。CEPIによると、9月時点で臨床試験中のワクチン候補のプラットフォームのほとんどは、COVID-19感染の主要[[抗原]]としてのコロナウイルススパイクタンパク質とその変異体に焦点を当てている<ref name="thanh2" />。2020年に開発中のプラットフォームには、[[核酸]]技術([[RNA]]と[[DNA]])、非複製ウイルスベクター、[[ペプチド]]、[[組換えタンパク質]]、[[弱毒化ウイルス|弱毒生ウイルス]]、[[不活化ウイルス]]などがある <ref name="diamond">{{Cite journal|last=Diamond|first=Michael S|last2=Pierson|first2=Theodore C|date=2020-05-13|title=The challenges of vaccine development against a new virus during a pandemic|journal=Cell Host and Microbe|volume=27|issue=5|pages=699–703|DOI=10.1016/j.chom.2020.04.021|PMID=32407708|PMC=7219397}}</ref> <ref name="gates2">{{Cite web|title=The vaccine race explained: What you need to know about the COVID-19 vaccine|url=https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccine|author=Gates|first=Bill|publisher=The Gates Notes|date=2020-04-30|accessdate=2020-05-02|archiveurl=https://web.archive.org/web/20200514010012/https://www.gatesnotes.com/Health/What-you-need-to-know-about-the-COVID-19-vaccine|archivedate=14 May 2020}}</ref> <ref name="thanh">{{Cite journal|last=Thanh Le|first=Tung|last2=Andreadakis|first2=Zacharias|last3=Kumar|first3=Arun|last4=Gómez Román|first4=Raúl|last5=Tollefsen|first5=Stig|last6=Saville|first6=Melanie|last7=Mayhew|first7=Stephen|date=9 April 2020|title=The COVID-19 vaccine development landscape|journal=Nature Reviews Drug Discovery|volume=19|issue=5|pages=305–06|DOI=10.1038/d41573-020-00073-5|ISSN=1474-1776|PMID=32273591}}</ref>。 |
|||
COVID‑19のために開発されている多くのワクチン技術は、インフルエンザを予防するためにすでに使用されているワクチンとは異なり、COVID‑19感染メカニズムの精度を高めるために「次世代」戦略を使用している<ref name="diamond">{{Cite journal|last=Diamond|first=Michael S|last2=Pierson|first2=Theodore C|date=2020-05-13|title=The challenges of vaccine development against a new virus during a pandemic|journal=Cell Host and Microbe|volume=27|issue=5|pages=699–703|DOI=10.1016/j.chom.2020.04.021|PMID=32407708|PMC=7219397}}</ref> <ref name="thanh2" />。開発中のワクチンプラットフォームは、医療従事者、高齢者、子供、妊婦、既存の[[免疫系|免疫力]]が低下している人々など、感受性の高い集団サブグループにおけるCOVID-19感染のメカニズムを標的とする抗原操作の柔軟性と有効性を改善する可能性がある 。 |
|||
[[ファイル:Vaccine_candidate_mechanisms_for_SARS-CoV-2_(49948301838).jpg|サムネイル|400x400ピクセル|免疫応答を促すためにSARS-CoV-2タンパク質を形成するための潜在的な候補]] |
|||
{| class="wikitable" style="text-align: right;" |
|||
|+COVID‑19:ワクチン技術プラットフォーム、2020年9月<ref name="london" /> |
|||
!分子プラットフォーム |
|||
!候補ワクチン総数 |
|||
!治験中の候補ワクチン総数 |
|||
|- |
|||
| style="text-align:left" | 非複製型ウィルスベクター |
|||
|<center> 31</center> |
|||
|<center> 4 {{efn|name="phase2orhigher"|1つまたはそれ以上の候補ワクチンがPhase II または Phase II–III 臨床試験中}} |
|||
|- |
|||
| style="text-align:left" | RNAベース |
|||
|<center> 31</center> |
|||
|<center> 3{{efn|name="phase2orhigher"}}</center> |
|||
|- |
|||
| style="text-align:left" | 不活化ウイルス |
|||
|<center> 14</center> |
|||
|<center> 3{{efn|name="phase2orhigher"}} </center> |
|||
|- |
|||
| style="text-align:left" | タンパク質サブユニット |
|||
|<center> 76</center> |
|||
|<center> 3{{efn|name="phase2orhigher"}} </center> |
|||
|- |
|||
| style="text-align:left" | DNA-ベース |
|||
|<center> 19</center> |
|||
|<center> 0{{efn|name="phase2orhigher"}}</center> |
|||
|- |
|||
| style="text-align:left" | 複製ウイルスベクター |
|||
|<center> 21</center> |
|||
|<center> 0 </center> |
|||
|- |
|||
| style="text-align:left" | ウイルス様粒子 |
|||
|<center> 13</center> |
|||
|<center> 0 </center> |
|||
|- |
|||
| style="text-align:left" |生きたまま減衰させたウイルス |
|||
|<center> 4</center> |
|||
|<center> 0</center> |
|||
|- |
|||
|} |
|||
{{Notelist-lr}}^<small>数十の候補ワクチン向けのテクノロジーは、発表されていないか、「不明」</small><ref name="london" /> |
|||
== ワクチン候補 == |
|||
CEPIでは、ワクチンの開発ステージを「探索的(exploratory)」(候補品を計画・設計し、[[In vivo|生体内で]]の評価を行わない)、「前臨床的(preclinical)」(生体内での評価を行い、ヒトで試験するための化合物を製造する準備を行う)、または健常者を対象とした第I相安全性試験の開始に分類している <ref name="thanh2" />。9月の時点で、合計321のワクチン候補が、臨床試験または初期段階の「探索的」または「前臨床」開発で確認されたプロジェクトとして開発中 。 |
|||
第I相試験では、主に数十人の健康な被験者を対象に安全性と予備的投与量を試験し、第II相試験では、第I相試験の成功後、免疫原性、投与量レベル([[バイオマーカー]]に基づく有効性)、および候補ワクチンの副作用を評価し、通常は数百人を対象とします。 第III相試験では、通常、複数の施設でより多くの参加者が参加し、対照群を含み、最適な用量での副作用をモニタリングしながら、病気を予防するためのワクチンの有効性を試験する(「介入試験」または「ピボタル試験」) <ref name="Vaccines.gov">{{Cite web|title=Vaccine Safety – Vaccines|url=https://www.vaccines.gov/basics/safety|website=vaccines.gov|publisher=US Department of Health and Human Services|accessdate=13 April 2020|archiveurl=https://web.archive.org/web/20200422073442/https://www.vaccines.gov/basics/safety|archivedate=22 April 2020}}</ref> <ref name="fda-ddp">{{Cite web|title=The drug development process|url=https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process|publisher=U.S. [[Food and Drug Administration]] (FDA)|accessdate=12 April 2020|date=4 January 2018|archiveurl=https://web.archive.org/web/20200222182002/https://www.fda.gov/patients/learn-about-drug-and-device-approvals/drug-development-process|archivedate=22 February 2020}}</ref>。フェーズ{{Spaces}}I–II試験は、予備的な安全性と免疫原性試験で構成され、通常は無作為化、プラセボ対照、より正確で効果的な用量を決定します。 段階{{Spaces}}III試験は通常、複数の場所でより多くの参加者を含み、対照群を含み、最適な用量で副作用を監視しながら、病気を予防するためのワクチンの有効性をテストします(「介入」または「重要」試験) 。第III相試験におけるワクチンの安全性、有効性、および臨床エンドポイントの定義は、副作用の程度、感染または感染量、ワクチンが中等度または重度のCOVID-19感染を予防するかどうかなど、異なる企業の試験によって異なる場合がある <ref name="cohen6-19">{{Cite journal|last=Cohen|first=Jon|date=2020-06-19|title=Pandemic vaccines are about to face the real test|journal=Science|volume=368|issue=6497|pages=1295–96|bibcode=2020Sci...368.1295C|DOI=10.1126/science.368.6497.1295|PMID=32554572}}</ref> <ref name="cdc-eff">{{Cite web|title=How flu vaccine effectiveness and efficacy are measured|url=https://www.cdc.gov/flu/vaccines-work/effectivenessqa.htm?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fflu%2Fprofessionals%2Fvaccination%2Feffectivenessqa.htm|date=2016-01-29|publisher=Centers for Disease Control and Prevention, National Center for Immunization and Respiratory Diseases, US Department of Health and Human Services|accessdate=2020-05-06|archivedate=7 May 2020|archiveurl=https://web.archive.org/web/20200507083203/https://www.cdc.gov/flu/vaccines-work/effectivenessqa.htm?CDC_AA_refVal=https%3A%2F%2Fwww.cdc.gov%2Fflu%2Fprofessionals%2Fvaccination%2Feffectivenessqa.htm}}</ref> <ref>{{Cite web|title=Principles of epidemiology, Section 8: Concepts of disease occurrence|url=https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section8.html|date=2012-05-18|publisher=Centers for Disease Control and Prevention, Center for Surveillance, Epidemiology, and Laboratory Services, US Department of Health and Human Services|accessdate=2020-05-06|archiveurl=https://web.archive.org/web/20200406212227/https://www.cdc.gov/csels/dsepd/ss1978/lesson1/section8.html|archivedate=6 April 2020}}</ref>。 |
|||
=== 2020年に開始された臨床試験 === |
|||
{{main|en:COVID-19_vaccine#Clinical_trials_started_in_2020}} |
|||
'''EUA'''(Emergency Use Authorization|Emergency Use Authorization) :[[緊急使用許可]] |
|||
{| class="wikitable" |
|||
|+ COVID-19: 第Ⅰ~Ⅲ相臨床試験におけるワクチン候補品<ref name=london /><ref name=milken /><ref name=who-tracker /> |
|||
|- |
|||
! ワクチン候補薬、開発者、出資者 !! 技術 !! EUA認可 !! 認可 |
|||
|- |
|||
| '''{{仮リンク|Tozinameran|en|Tozinameran}}''''<ref name=hcreg/><ref name="NCT04368728">{{cite web |title=Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults |url=https://clinicaltrials.gov/ct2/show/NCT04368728 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04368728 |date=30 April 2020 |access-date=14 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084828/https://clinicaltrials.gov/ct2/show/NCT04368728/ |url-status=live }}</ref><ref name="EudraCT-2020-001038-36">{{cite web |title=A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults |url=https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001038-36/DE |website=EU Clinical Trials Register |publisher=European Union |type=Registry |id=[[EudraCT]] 2020-001038-36 |date=14 April 2020 |access-date=22 April 2020 |archive-url=https://web.archive.org/web/20200422111024/https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001038-36/DE |archive-date=22 April 2020 |url-status=live}}</ref><br />{{仮リンク|BioNTech|en|BioNTech}}、{{仮リンク|Fosun Pharmaceutical|en|Fosun Pharmaceutical}}、[[ファイザー]] || modRNA(RNAワクチン) || 承認(英国MHRA<ref name="ukgov12-2">{{cite web |title=UK medicines regulator gives approval for first UK COVID-19 vaccine |url=https://www.gov.uk/government/news/uk-medicines-regulator-gives-approval-for-first-uk-covid-19-vaccine |publisher=Medicines and Healthcare Products Regulatory Agency, Government of the UK |access-date=2 December 2020 |date=2 December 2020}}</ref>、バーレーンNHRA<ref>{{cite web |title=Bahrain becomes second country to approve Pfizer COVID-19 vaccine |url=https://www.aljazeera.com/news/2020/12/4/bahrain-becomes-second-country-to-approve-pfizer-covid-19-vaccine |website=[[Al Jazeera]] |access-date=5 December 2020}}</ref>)、サウジアラビアSFDA<br />保留(米国FDA,<ref>{{Cite web|last=O'Neill|first=Natalie|date=2020-11-20|title=Pfizer applies for emergency FDA approval of COVID-19 vaccine|url=https://nypost.com/2020/11/20/pfizer-applies-for-emergency-fda-approval-of-covid-19-vaccine/|access-date=2020-11-22|website=New York Post|language=en-US}}</ref>、欧州連合EMA<ref>{{Cite web|title=Pfizer-BioNTech apply for EU emergency authorization for COVID-19 vaccine|url=https://www.msn.com/en-au/lifestyle/wellbeing/pfizer-biontech-apply-for-eu-emergency-authorization-for-covid-19-vaccine/ar-BB1bwhii|access-date=2020-12-01|website=www.msn.com}}</ref>、メキシコCOFEPRIS<ref name=ukgov12-2/> Bahrain NHRA<ref>{{cite web |title=Bahrain becomes second country to approve Pfizer COVID-19 vaccine |url=https://www.aljazeera.com/news/2020/12/4/bahrain-becomes-second-country-to-approve-pfizer-covid-19-vaccine |website=[[Al Jazeera]] |access-date=5 December 2020}}</ref>、インドDCGI)、スイスSwissmedic)||承認(カナダ保健省<ref>{{Cite web|last=MacCharles|first=Tonda|date=2020-12-03|title=Health Canada could approve COVID-19 vaccine within a week|url=https://www.thestar.com/politics/federal/2020/12/03/health-canada-could-approve-covid-19-vaccine-within-a-week.html/|access-date=2020-12-07|website=The Star|language=en-ca}})</ref> |
|||
|- |
|||
| '''{{仮リンク|AZD1222|en|AZD1222}}''' {{efn-la|Oxford name: ''ChAdOx1{{nbsp}}nCoV-19''. Manufacturing in Brazil to be carried out by [[Oswaldo Cruz Foundation]].<ref>{{cite news |last1=Walsh |first1=Nick |last2=Shelley |first2=Jo |last3=Duwe |first3=Eduardo |last4=Bonnett |first4=William |date=27 July 2020 |title=The world's hopes for a coronavirus vaccine may run in these health care workers' veins |url=https://edition.cnn.com/2020/07/27/americas/brazil-covid-19-sinovac-vaccine-intl/index.html |work=[[CNN]] |location=[[São Paulo]] |access-date=3 August 2020 |name-list-style=vanc |archive-date=3 August 2020 |archive-url=https://web.archive.org/web/20200803211040/https://edition.cnn.com/2020/07/27/americas/brazil-covid-19-sinovac-vaccine-intl/index.html |url-status=live }}</ref>}}<ref name="NCT04400838">{{cite web |title=Investigating a Vaccine Against COVID-19 |url=https://clinicaltrials.gov/ct2/show/NCT04400838 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04400838 |date=26 May 2020 |access-date=14 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084750/https://clinicaltrials.gov/ct2/show/NCT04400838/ |url-status=live }}</ref><ref name="EudraCT-2020-001228-32">{{cite web |url=https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001228-32/GB |title=A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19 |website=EU Clinical Trials Register |publisher=European Union |type=Registry |id=[[EudraCT]] 2020-001228-32 |date=21 April 2020 |access-date=3 August 2020 |archive-date=5 October 2020 |archive-url=https://web.archive.org/web/20201005201654/https://www.clinicaltrialsregister.eu/ctr-search/trial/2020-001228-32/GB |url-status=live }}</ref><ref name="ISRCTN89951424">{{cite journal |title=A Phase III study to investigate a vaccine against COVID-19 |website=ISRCTN |type=Registry |id=ISRCTN89951424 |doi=10.1186/ISRCTN89951424 |date=26 May 2020 |last1=O'Reilly |first1=Peter |name-list-style=vanc | doi-access=free }}</ref><br />[[オックスフォード大学]]、[[アストラゼネカ]]|| 改変[[チンパンジー]][[アデノウイルス]][[ベクター]](ChAdOx1) || |
|||
|- |
|||
| '''Ad5-nCoV''' <br />{{仮リンク|CanSinoBIO|en|CanSino Biologics}}, {{仮リンク|中国陸軍医科学院|en|Beijing Institute of Biotechnology of the Academy of Military Medical Sciences}}, NPO Petrovax<ref name="NCT04540419">{{cite web |title=Clinical Trial of Recombinant Novel Coronavirus Vaccine (Adenovirus Type 5 Vector) Against COVID-19 |url=https://clinicaltrials.gov/ct2/show/NCT04540419 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04540419 |date=13 November 2020 |access-date=17 November 2020}}</ref>{{efn-la|name="Ad5-nCoV-manufacture"|Manufacturing partnership with the [[National Research Council (Canada)|National Research Council of Canada]] and Canadian Center for Vaccinology, [[Halifax, Nova Scotia|Halifax]], Nova Scotia<ref>{{Cite web|title=The National Research Council of Canada and CanSino Biologics Inc. announce collaboration to advance vaccine against COVID-19|url=https://www.canada.ca/en/national-research-council/news/2020/05/the-national-research-council-of-canada-and-cansino-biologics-inc-announce-collaboration-to-advance-vaccine-against-covid-19.html|publisher=National Research Council, Government of Canada|date=2020-05-12|access-date=2020-05-22|archive-url=https://web.archive.org/web/20200522153344/https://www.canada.ca/en/national-research-council/news/2020/05/the-national-research-council-of-canada-and-cansino-biologics-inc-announce-collaboration-to-advance-vaccine-against-covid-19.html|archive-date=22 May 2020|url-status=live}}</ref>}}|| 組換えアデノウイルス5型ベクター || 保留(インドDCGI、カナダ、スイスSwissmedic) || |
|||
|- |
|||
| ''BBIBP-CorV''<ref name="ChiCTR2000034780">{{cite journal |last1=Chen |first1=Wei |last2=Al Kaabi |first2=Nawal |title=A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells) |journal=Chinese Clinical Trial Registry |date=18 July 2020 |url=http://www.chictr.org.cn/showprojen.aspx?proj=56651 |access-date=15 August 2020 |name-list-style=vanc }}</ref><br />{{仮リンク|Sinopharm|en|China National Pharmaceutical Group}}: 北京生物製品研究所、武漢生物製品研究所 || [[不活化]][[SARS-CoV-2]]([[vero細胞]])|| 承認(中国<ref>{{Cite web|title=China Sinopharm's COVID-19 vaccine taken by about 1 million people in emergency use|url=https://www.channelnewsasia.com/news/asia/covid-19-vaccines-china-sinopharm-emergency-use-13592322|access-date=2020-11-22|website=CNA|language=en}}</ref>、バーレーン<ref>{{Cite web|date=2020-11-03|title=Coronavirus: Bahrain allows Sinopharm vaccine candidate use in frontline workers|url=https://english.alarabiya.net/en/coronavirus/2020/11/03/Coronavirus-Bahrain-allows-Sinopharm-vaccine-candidate-use-in-frontline-workers|access-date=2020-11-22|website=Al Arabiya English|language=en}}</ref>、UAE<ref>{{Cite web|title=Coronavirus: UAE authorises emergency use of vaccine for frontline workers|url=https://www.thenationalnews.com/uae/health/coronavirus-uae-authorises-emergency-use-of-vaccine-for-frontline-workers-1.1077680|access-date=2020-11-24|website=The National|language=en}}</ref>)||承認(UAE) |
|||
|- |
|||
| '''{{仮リンク|CoronaVac|en|CoronaVac}}'''<ref name="NCT04383574">{{cite web |title=Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu) |url=https://clinicaltrials.gov/ct2/show/NCT04383574 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04383574 |date=12 May 2020 |access-date=14 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084809/https://clinicaltrials.gov/ct2/show/NCT04383574/ |url-status=live }}</ref><ref name="NCname= nct04456595=">{{cite web |url=https://clinicaltrials.gov/ct2/show/NCT04456595 |title=Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV) |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04456595 |date=2 July 2020 |access-date=3 August 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084811/https://clinicaltrials.gov/ct2/show/NCT04456595/ |url-status=live }}</ref><ref>{{cite journal |last1=PT. Bio Farma |title=A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia |journal=Registri Penyakit Indonesia |date=10 August 2020 |url=https://www.ina-registry.org/index.php?act=registry_trial_detail&code_trial=16202009080721WXFM0YX |access-date=15 August 2020 }}</ref><br />Sinovac|| 不活化SARS-CoV-2 || 承認(中国<ref>{{Cite news|title=China prepares large-scale rollout of domestically-produced coronavirus vaccines|url=https://www.theglobeandmail.com/world/article-china-prepares-large-scale-rollout-of-domestically-produced|date=2020-12-06|access-date=2020-12-07|work=The Globe and Mail|author=Huizhong Wu|language=en}}</ref>) |
|||
|- |
|||
| '''{{仮リンク|Gam-COVID-Vac|en|Gam-COVID-Vac}}'''(Sputnik V) <br />Gamaleya Research Institute of Epidemiology and Microbiology(商品名Sputnik V)|| 非複製型ウイルスベクター || 承認(ロシア保健省<ref name="burki">{{cite journal | vauthors = Burki TK | title = The Russian vaccine for COVID-19 | journal = The Lancet. Respiratory Medicine | volume = 8 | issue = 11 | pages = e85-e86 | date = November 2020 | pmid = 32896274 | doi = 10.1016/S2213-2600(20)30402-1 | url = https://www.thelancet.com/journals/lanres/article/PIIS2213-2600(20)30402-1/fulltext | doi-access = free }}</ref>)|| |
|||
|- |
|||
| '''{{仮リンク|mRNA-1273|en|MRNA-1273}}'''<ref name="NCT04470427">{{cite web |title=A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19 |url=https://clinicaltrials.gov/ct2/show/NCT04470427 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04470427 |date=14 July 2020 |access-date=27 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084833/https://clinicaltrials.gov/ct2/show/NCT04470427/ |url-status=live }}</ref><ref name="palca">{{cite news |last1=Palca |first1=Joe |title=COVID-19 vaccine candidate heads to widespread testing in U.S. |url=https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people |access-date=27 July 2020 |work=NPR |date=27 July 2020 |name-list-style=vanc |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084836/https://www.npr.org/sections/coronavirus-live-updates/2020/07/27/895672859/us-vaccine-candidate-heads-to-widespread-testing-in-people/ |url-status=live }}</ref><br />モデルナ、[[アメリカ国立アレルギー・感染症研究所|NIAID]]、[[アメリカ生物医学先端研究開発局|BARDA]]|| modRNAを含む脂質ナノ粒子分散液 ||保留(米国FDA<ref>{{Cite web|last=Jr|first=Berkeley Lovelace|date=2020-11-30|title=Moderna says new data shows Covid vaccine is more than 94% effective, plans to ask FDA for emergency clearance later Monday|url=https://www.cnbc.com/2020/11/30/moderna-covid-vaccine-is-94point1percent-effective-plans-to-apply-for-emergency-ok-monday.html|access-date=2020-11-30|website=CNBC|language=en}}</ref>、欧州連合EMA、英国MHRA<ref>{{Cite web|last=Kitching|first=Chris|date=2020-12-01|title=Moderna coronavirus vaccine could get UK approval within two weeks, says expert|url=https://www.mirror.co.uk/news/uk-news/moderna-coronavirus-vaccine-941-effective-23095544|access-date=2020-12-01|website=mirror|language=en}}</ref>、カナダ、スイスSwissmedic) || |
|||
|- |
|||
| '''Ad26.COV2.S'''<ref>{{Cite web|title=A Study of Ad26.COV2.S in Adults|url=https://clinicaltrials.gov/ct2/show/NCT04436276|access-date=2020-08-23|publisher=ClinicalTrials.gov, US National Library of Medicine|date=2020-08-04|archive-date=16 September 2020|archive-url=https://web.archive.org/web/20200916063346/https://clinicaltrials.gov/ct2/show/NCT04436276|url-status=live}}</ref><ref>{{Cite report|last1=Sadoff|first1=Jerry|last2=Le Gars|first2=Mathieu|last3=Shukarev|first3=Georgi|last4=Heerwegh|first4=Dirk|last5=Truyers|first5=Carla|last6=de Groot|first6=Anna Marit|last7=Stoop|first7=Jeroen|last8=Tete|first8=Sarah|last9=Van Damme|first9=Wim|last10=Leroux-Roels|first10=Isabel|last11=Berghmans|first11=Pieter-Jan|date=2020-09-25|title=Safety and immunogenicity of the Ad26.COV2.S COVID-19 vaccine candidate: interim results of a phase 1/2a, double-blind, randomized, placebo-controlled trial|url=http://medrxiv.org/lookup/doi/10.1101/2020.09.23.20199604|doi=10.1101/2020.09.23.20199604|s2cid=221882008|access-date=27 September 2020|type=none|name-list-style=vanc|archive-date=1 November 2020|archive-url=https://web.archive.org/web/20201101220844/https://www.medrxiv.org/content/10.1101/2020.09.23.20199604v1|url-status=live}}</ref><ref>{{Cite web|title=A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants|url=https://clinicaltrials.gov/ct2/show/NCT04505722|url-status=live|archive-url=https://web.archive.org/web/20200926145744/https://clinicaltrials.gov/ct2/show/NCT04505722|archive-date=26 September 2020|website=ClinicalTrials.gov|publisher=US National Library of Medicine |accessdate=2020-12-08}}</ref><br />[[ヤンセン ファーマ]]、[[ベス・イスラエル・ディーコネス医療センター|BIDMC]] || 非複製型ウイルスベクター || 保留(カナダ)|| |
|||
|- |
|||
| '''NVX-CoV2373'''<ref name="NCT04368988">{{cite web |title=Evaluation of the Safety and Immunogenicity of a SARS-CoV-2 rS (COVID-19) Nanoparticle Vaccine With/Without Matrix-M Adjuvant |url=https://clinicaltrials.gov/ct2/show/NCT04368988 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04368988 |date=30 April 2020 |access-date=14 July 2020 |archive-date=14 July 2020 |archive-url=https://web.archive.org/web/20200714224741/https://clinicaltrials.gov/ct2/show/NCT04368988 |url-status=live }}</ref><br />{{仮リンク|Novavax|en|Novavax}} || SARS-CoV-2組換えスパイク蛋白質アジュバントナノ粒子 || || |
|||
|- |
|||
| '''BBV152 (Covaxin)'''{{仮リンク|Bharat Biotech|en|Bharat Biotech}}、{{仮リンク|インド医学研究評議会|en|Indian Council of Medical Research}}|| 不活化SARS-CoV-2 || 保留(インドDCGI)|| |
|||
|- |
|||
| '''CoVLP'''[154]<br />{{仮リンク|medicago|en|Medicago Inc.}}、[[グラクソ・スミスクライン|GSK]] || GSKアジュバントを用いた組換え植物性ウイルス様粒子 || |
|||
|- |
|||
| ''名称未定''><ref name=london/><ref name=milken/><ref name=who-tracker/><ref name="NCT04445194">{{cite web |title=Phase I Clinical Study of Recombinant Novel Coronavirus Vaccine |url=https://clinicaltrials.gov/ct2/show/NCT04445194 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04445194 |date=24 June 2020 |access-date=14 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084838/https://clinicaltrials.gov/ct2/show/NCT04445194/ |url-status=live }}</ref><br />Anhui Zhifei Longcom Biopharmaceutical Co. Ltd.|| 組換えタンパク質サブユニット || |
|||
|- |
|||
| '''CVnCoV'''<ref>{{Cite web|date=2020-11-13|title=GSK, Medicago launch phase 2/3 clinical trials of plant-derived COVID-19 vaccine|url=http://www.pmlive.com/pharma_news/gsk,_medicago_launch_phase_23_clinical_trials_of_plant-derived_covid-19_vaccine_1356854|access-date=2020-11-16|website=PMLive|language=en}}</ref><br />{{仮リンク|CureVac|en|CureVac}}、{{仮リンク|CEPI|en|Coalition for Epidemic Preparedness Innovations}}|| modRNA || |
|||
|- |
|||
| '''INO-4800'''{{efn-la|name="INO-4800-phase"|South Korean Phase I–II in parallel with Phase I in the US}}<ref name="NCT04336410">{{cite web |title=Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers |url=https://clinicaltrials.gov/ct2/show/NCT04336410 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04336410 |date=7 April 2020 |access-date=14 July 2020 |archive-date=11 October 2020 |archive-url=https://web.archive.org/web/20201011084843/https://clinicaltrials.gov/ct2/show/NCT04336410/ |url-status=live }}</ref><ref>{{Cite web|url=https://www.ivi.int/ivi-inovio-and-knih-to-partner-with-cepi-in-a-phase-i-ii-clinical-trial-of-inovios-covid-19-dna-vaccine-in-south-korea/|title=IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO's COVID-19 DNA vaccine in South Korea|publisher=International Vaccine Institute|date=2020-04-16|access-date=2020-04-23}}</ref><br />{{仮リンク|Inovio|en|Inovio Pharmaceuticals}}、CEPI、[[疾病管理本部|韓国疾病管理本部]]、{{仮リンク|IVI|en|International Vaccine Institute}} ||エレクトロポレーションで送達されたDNAプラスミド || |
|||
|- |
|||
| '''EpiVacCorona'''<ref name="NCT04527575">{{cite web |title=Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona) |url=https://clinicaltrials.gov/ct2/show/NCT04527575 |website=[[ClinicalTrials.gov]] |publisher=[[United States National Library of Medicine]] |type=Registry |id=NCT04368988 |date=22 September 2020 |access-date=16 November 2020}}</ref><br />[[ロシア国立ウイルス学・生物工学研究センター|Vector]] || ペプチド抗原を用いたワクチン<ref name="NCT04527575" />|| |
|||
|- |
|||
|} |
|||
他、多数 |
|||
{{Reflist|group=lower-alpha}} |
|||
== サプライチェーン == |
|||
2021年以降にCOVID-19ワクチン接種を展開するには、100~190億本(バイアル)の世界的な輸送と追跡が必要となる可能性があり、この取り組みは容易に史上最大のサプライチェーンの課題となる<ref name=gates2/><ref name="wef">{{cite web |title=How the massive plan to deliver the COVID-19 vaccine could make history – and leverage blockchain like never before |url=https://www.weforum.org/agenda/2020/07/blockchain-role-in-distributing-covid-19-vaccine-could-make-history/ |publisher=World Economic Forum |access-date=16 September 2020 |date=17 July 2020 |archive-date=16 September 2020 |archive-url=https://web.archive.org/web/20200916062816/https://www.weforum.org/agenda/2020/07/blockchain-role-in-distributing-covid-19-vaccine-could-make-history/ |url-status=live }}</ref><ref name="unequal">{{cite journal |last1=Callaway |first1=Ewen |title=The unequal scramble for coronavirus vaccines – by the numbers |journal=Nature |date=27 August 2020 |volume=584 |issue=7822 |pages=506–07 |doi=10.1038/d41586-020-02450-x |pmid=32839593 |bibcode=2020Natur.584..506C |s2cid=221285160 |doi-access=free }}</ref>。2020年9月の時点で、[[サプライチェーン・マネジメント|サプライチェーン]]と[[物流|ロジスティクス]](物流)の専門家は、認可ワクチンを流通させるための国際的および国内的なネットワークが、量・緊急性ともに対応する準備ができていないと懸念を表明していて、その理由は主に2020年のパンデミックのロックダウンと供給能力を低下させるダウンサイジングの間のリソースの悪化が原因としている<ref name=wef/><ref name="murray">{{cite news|title=The world's supply chain isn't ready for a Covid-19 vaccine|work=Bloomberg World|url=https://www.bloomberg.com/news/articles/2020-07-25/the-supply-chain-to-save-the-world-is-unprepared-for-a-vaccine|authors=Brendan Murray and Riley Griffin|date=24 July 2020|access-date=13 September 2020|archive-date=28 August 2020|archive-url=https://web.archive.org/web/20200828193152/https://www.bloomberg.com/news/articles/2020-07-25/the-supply-chain-to-save-the-world-is-unprepared-for-a-vaccine|url-status=live}}</ref><ref name="scott">{{cite news |first1=Scott Duke | last1=Kominers |first2=Alex | last2=Tabarrok | name-list-style=vanc |title=Vaccines use bizarre stuff. We need a supply chain now |url=https://www.bloomberg.com/opinion/articles/2020-08-18/a-resilient-covid-19-vaccine-supply-chain-starts-now |access-date=13 September 2020 |work=Bloomberg Business |date=18 August 2020 |archive-date=29 August 2020 |archive-url=https://web.archive.org/web/20200829033725/https://www.bloomberg.com/opinion/articles/2020-08-18/a-resilient-covid-19-vaccine-supply-chain-starts-now |url-status=live }}</ref>。COVAX(The COVID-19 Vaccines Global Access)パートナーシップ、世界の製薬会社、契約ワクチンメーカー、国境を越えた輸送、保管施設、各国の保健機関など、多数の組織を調整することで直面している世界的な課題について、[[GAVIアライアンス|GAVI]]の[[最高経営責任者]]である{{仮リンク|セス・バークレー|en|Seth Berkley}}は次のように述べている。"何十億ものワクチンを効率的に全世界に届けるためには、サプライチェーンに沿った非常に複雑なロジスティックとプログラム上の障害を伴うことになる”<ref name="unicef-now">{{cite web |title=The time to prepare for COVID-19 vaccine transport is now |url=https://www.unicef.org/press-releases/time-prepare-covid-19-vaccine-transport-now |publisher=UNICEF |access-date=13 September 2020 |date=10 September 2020 |archive-date=13 September 2020 |archive-url=https://web.archive.org/web/20200913091315/https://www.unicef.org/press-releases/time-prepare-covid-19-vaccine-transport-now |url-status=live }}</ref>。 |
|||
課題の大きさを強調する例として、[[国際航空運送協会]]は、COVID-19パンデミックを経験している200カ国以上の人々に1回分の投与量のみを輸送するだけでも、8,000機の[[ボーイング747|747]]型貨物機(精密ワクチン保冷装置を導入)が必要であると述べている<ref name="desai">{{cite news |first1=Devika | last1=Desai | name-list-style=vanc |title=Transporting one single dose of COVID-19 vaccine could take up to 8,000 jumbo planes, says aviation body |url=https://nationalpost.com/news/transporting-one-single-dose-of-covid-19-vaccine-could-take-up-to-8000-jumbo-planes-says-aviation-body |access-date=13 September 2020 |work=National Post |date=10 September 2020|quote=The IATA estimated that 8,000 747 cargo planes, at minimum, would be needed to transport a single dose of the vaccine worldwide, but more equipment could be required as administering the vaccine might mean several doses. Vaccines would also have to be stored at a temperature range between two and eight degrees Celsius, which could rule out the use of some types of planes.}}</ref> 。 GAVIは、「動きの速いパンデミックでは、全員が安全でなければ誰も安全ではない」と述べている<ref name=covax-gavi/>。 |
|||
ワクチン技術や初期段階の臨床研究への数十億ドルの投資とは対照的に、ワクチンのライセンス取得後のサプライチェーンは、同様な計画、調整、セキュリティ、または投資を受けていない<ref name=wef/><ref name=murray/><ref name="pharmiweb">{{cite web | last=Quelch | first=Rich | title=COVID-19 vaccine delivery – overcoming the supply chain challenges | publisher=PharmiWeb.com | date=2020-08-14 | url=https://www.pharmiweb.com/article/covid-19-vaccine-delivery-overcoming-the-supply-chain-challenges | access-date=2020-09-13|quote=Delivering a new vaccine for COVID-19 worldwide will be one of the greatest challenges faced by modern pharma. The difficulties are intensified by pre-existing shortcomings in the supply chain.}}</ref>。主な懸念は、[[開発途上国|低・中所得国]]、特に子どもたちへのワクチン接種のためのワクチン流通資源が不足しているか、または存在しないということである<ref name=covax-gavi/><ref name="seidman">{{cite journal | last1=Seidman | first1=Gabriel | last2=Atun | first2=Rifat | title=Do changes to supply chains and procurement processes yield cost savings and improve availability of pharmaceuticals, vaccines or health products? A systematic review of evidence from low-income and middle-income countries | journal=BMJ Global Health | volume=2 | issue=2 | year=2017 | issn=2059-7908 | pmid=28589028 | pmc=5435270 | doi=10.1136/bmjgh-2016-000243 | page=e000243}}</ref>。9月には、COVAXのパートナーシップには、172カ国がCOVID-19ワクチンのサプライチェーンを最適化するための計画を調整することが含まれており<ref name="gavi9-4">{{cite web |title=172 countries and multiple candidate vaccines engaged in COVID-19 Vaccine Global Access Facility |url=https://www.gavi.org/news/media-room/172-countries-multiple-candidate-vaccines-engaged-covid-19-vaccine-global-access |publisher=GAVI |access-date=15 September 2020 |date=4 September 2020 |archive-date=16 September 2020 |archive-url=https://web.archive.org/web/20200916232718/https://www.gavi.org/news/media-room/172-countries-multiple-candidate-vaccines-engaged-covid-19-vaccine-global-access |url-status=live }}</ref>、[[国際連合児童基金|国連児童基金]](ユニセフ)はCOVAXと協力して、92の開発途上国における子どもたちのワクチン接種のための、資金調達とサプライチェーンを準備することになった<ref name="unicef">{{cite web |title=UNICEF to lead procurement and supply of COVID-19 vaccines in world's largest and fastest ever operation of its kind |url=https://www.unicef.org/press-releases/unicef-lead-procurement-and-supply-covid-19-vaccines-worlds-largest-and-fastest-ever |publisher=UNICEF |access-date=15 September 2020 |date=4 September 2020 |archive-date=16 September 2020 |archive-url=https://web.archive.org/web/20200916152249/https://www.unicef.org/press-releases/unicef-lead-procurement-and-supply-covid-19-vaccines-worlds-largest-and-fastest-ever |url-status=live }}</ref><ref name="cook">{{cite web |first1=Emily | last1=Cook | name-list-style=vanc |title=UNICEF to lead supply chain for COVID-19 vaccine |url=https://www.manufacturingglobal.com/procurement-and-supply-chain/unicef-lead-supply-chain-covid-19-vaccine |publisher=Manufacturing |access-date=13 September 2020 |date=4 September 2020 |archive-date=1 November 2020 |archive-url=https://web.archive.org/web/20201101220835/https://www.manufacturingglobal.com/procurement-and-supply-chain/unicef-lead-supply-chain-covid-19-vaccine |url-status=live }}</ref>。 |
|||
=== 物流 === |
|||
ワクチン接種のための物流サービスは、必要な機器、スタッフ、国際的な国境を越えた認可ワクチンの供給を保証するものである<ref name="hessel">{{cite journal | last=Hessel | first=Luc | title=Pandemic influenza vaccines: meeting the supply, distribution and deployment challenges | journal=Influenza and Other Respiratory Viruses | volume=3 | issue=4 | year=2009 | issn=1750-2640 | pmid=19627373 | pmc=4634681 | doi=10.1111/j.1750-2659.2009.00085.x | pages=165–70}}</ref>。物流の中核には、ワクチンの取り扱いとモニタリング、コールドチェーン管理、ワクチン接種ネットワーク内での流通の安全性などが含まれる<ref name="who-log">{{cite web |title=Vaccine management and logistics support |url=https://www.who.int/immunization/programmes_systems/supply_chain/resources/tools/en/ |publisher=World Health Organization |access-date=14 September 2020 |date=2020 |archive-date=13 September 2020 |archive-url=https://web.archive.org/web/20200913154344/https://www.who.int/immunization/programmes_systems/supply_chain/resources/tools/en/ |url-status=live }}</ref>。COVAX施設の目的は、製造、輸送、および全体的なサプライチェーンのインフラを統合し、参加国間の物流資源を一元化し、平等に管理することである<ref name=covax-gavi/><ref name=pharmiweb/>。ワクチン予測とニーズ推定、国内ワクチン管理、無駄遣いの可能性、および在庫管理のための物流ツールが含まれている<ref name=who-log/>。 |
|||
COVID-19 ワクチンの輸送中に国際的に実施される他の物流要因には、以下のものがある<ref name=wef/><ref name="jarrett">{{cite journal | last1=Jarrett | first1=Stephen | last2=Yang | first2=Lingjiang | last3=Pagliusi | first3=Sonia | title=Roadmap for strengthening the vaccine supply chain in emerging countries: Manufacturers' perspectives | journal=Vaccine X| volume=5 | date=2020-06-09 | issn=2590-1362 | pmid=32775997 | pmc=7394771 | doi=10.1016/j.jvacx.2020.100068 | page=100068}}</ref><ref name="lloyd">{{cite journal | last1=Lloyd | first1=John | last2=Cheyne | first2=James | title=The origins of the vaccine cold chain and a glimpse of the future | journal=Vaccine | volume=35 | issue=17 | year=2017 | issn=0264-410X | doi=10.1016/j.vaccine.2016.11.097 | pages=2115–20 | pmid=28364918 | doi-access=free }}</ref>: |
|||
*個々のワクチンバイアルを[[バーコード]]による可視化し、追跡可能にする(visibility and traceability) |
|||
*サプライヤー監査の共有化 |
|||
*製造から被接種者へのワクチンバイアル輸送[[証拠保全]]の共有化 |
|||
*ワクチン温度監視ツールの使用 |
|||
*温度安定性試験と保証 |
|||
*新しい包装・配送技術 |
|||
*備蓄 |
|||
*各国内の物資調整([[化学防護服#個人用防護具(PPE)|個人用保護具(PPE)]]、{{仮リンク|希釈剤|en|diluent}}、注射器、針、ゴム栓、冷蔵燃料や電源、廃棄物処理など |
|||
*通信技術 |
|||
*各国の環境影響 |
|||
あるワクチン開発者によると、いずれかの段階で物流が不足すると、サプライチェーン全体が脱線する可能性があるという<ref name="wef-manuf">{{cite web |title=How can we make enough vaccine for 2 billion people? |url=https://www.weforum.org/agenda/2020/08/covid-vaccine-manufacture-distribute-2-billion-doses/ |publisher=World Economic Forum |access-date=16 September 2020 |date=25 August 2020 |archive-date=16 September 2020 |archive-url=https://web.archive.org/web/20200916165424/https://www.weforum.org/agenda/2020/08/covid-vaccine-manufacture-distribute-2-billion-doses |url-status=live }}</ref>。ワクチンのサプライチェーンが失敗した場合、パンデミックの経済的・人的コストは何年にもわたって長期化する可能性がある<ref name=scott/>。 |
|||
=== 製造能力 === |
|||
2020年8月時点で、安全性と有効性の確立から数ヶ月が経過した段階で、いくつかのワクチン候補が第III相試験に入った段階にもかかわらず、多くの政府が50億米ドル以上の費用をかけて20億回分以上のワクチンを予約注文した<ref name=unequal/><ref name=wef-manuf/><ref>{{cite news |title=Coronavirus vaccine pre-orders worldwide top 5 billion |url=https://www.japantimes.co.jp/news/2020/08/12/world/science-health-world/pre-orders-coronavirus-vaccines/ |access-date=13 September 2020 |work=The Japan Times |date=12 August 2020 |archive-date=20 September 2020 |archive-url=https://web.archive.org/web/20200920183450/https://www.japantimes.co.jp/news/2020/08/12/world/science-health-world/pre-orders-coronavirus-vaccines/ |url-status=live }}</ref>。英国政府からの2021年のワクチン予約注文は、1人当たり5回分であった<ref name=unequal/>。 9月には、CEPIは、2021年末までに認可された3種のワクチンを20億回分製造するという資金調達の約束の下、9種のワクチン候補の基礎研究と臨床研究を資金面で支援している<ref name=gavi9-4/>。 2022年までに全体で70億~100億回分のCOVID-19ワクチンが世界中で製造される可能性があるが、富裕国による大量の事前注文(「ワクチンナショナリズム」と呼ばれる)は、より貧しい国のワクチン利用を脅かすものである<ref name=gates2/><ref name=wef-manuf/><ref name=unequal/> 。 |
|||
{{仮リンク|インド血清研究所|en|Serum Institute of India}}は、少なくとも10億回分のワクチンを生産する計画であるが、その半分はインドで使用されると述べている<ref name=unequal/>。 |
|||
中国は、10月にCOVAXに参加した後、2020年末までに6億回分のワクチンを生産し、2021年にはさらに10億回分のワクチンを生産することを明らかにしたが、14億人の自国の人口に対して何回分のワクチンを生産するのかは不明であった<ref>{{Cite web|last=C|first=Hannah|date=2020-10-10|title=China Commits to Producing 600 Million Vaccine Doses by the End of 2020|url=https://www.sciencetimes.com/articles/27653/20201010/china-producing-600-million-vaccine-2020.htm|access-date=2020-10-10|website=Science Times|archive-date=10 October 2020|archive-url=https://web.archive.org/web/20201010154916/https://www.sciencetimes.com/articles/27653/20201010/china-producing-600-million-vaccine-2020.htm|url-status=live}}</ref>。{{仮リンク|Sinopharm|en|China National Pharmaceutical Group}}社は、2021年に10億用量以上の生産能力を持つ可能性があると述べている<ref>{{Cite news|last=Staff|first=Reuters|date=2020-10-20|title=Sinopharm says may be able to make over 1 billion coronavirus vaccine doses in 2021|language=en|work=Reuters|url=https://www.reuters.com/article/health-coronavirus-china-vaccine-int-idUSKBN2750WM|access-date=2020-12-07}}</ref>。Sinovac社は、2020年末までに第2の生産施設を完成させ、{{仮リンク|CoronaVac|en|CoronaVac}}の生産能力をそれまでの3億用量から6億用量に引き上げることを目指していると述べている<ref>{{Cite news|last=Staff|first=Reuters|date=2020-12-07|title=Sinovac secures $515 million to boost COVID-19 vaccine production|language=en|work=Reuters|url=https://www.reuters.com/article/china-sinovac-vaccine-funding-idINKBN28G0YF|access-date=2020-12-07}}</ref>。 |
|||
アストラゼネカの{{仮リンク|パスカル・ソリオ|en|Pascal Soriot}}CEOは次のように述べている。"課題はワクチンそのものの製造ではなく、バイアルへの充填にある。世界には十分なバイアルが無い」<ref name="molteni">{{cite web |first1=Megan | last1=Molteni | name-list-style=vanc |title=Vaccine makers turn to microchip tech to beat glass shortages |url=https://www.wired.com/story/vaccine-makers-turn-to-microchip-tech-to-beat-glass-shortages/ |publisher=Wired |access-date=17 September 2020 |date=26 June 2020 |archive-date=16 September 2020 |archive-url=https://web.archive.org/web/20200916152242/https://www.wired.com/story/vaccine-makers-turn-to-microchip-tech-to-beat-glass-shortages/ |url-status=live }}</ref>バイアル製造の高い需要に備えて、アメリカのガラスメーカーは7月にバイアル工場のために1億6,300万ドルを投資した[308]。バイアル製造のためのガラスの入手可能性と、汚染物質の管理が懸念されているが<ref name="burger">{{cite news |first1=Ludwig | last1=Burger |first2=Matthias | last2=Blamont | name-list-style=vanc |title=Bottlenecks? Glass vial makers prepare for COVID-19 vaccine |url=https://www.reuters.com/article/us-health-coronavirus-schott-exclusive-idUSKBN23J0SN |access-date=17 September 2020 |work=Reuters |date=11 June 2020 |archive-date=29 September 2020 |archive-url=https://web.archive.org/web/20200929040220/https://www.reuters.com/article/us-health-coronavirus-schott-exclusive-idUSKBN23J0SN |url-status=live }}</ref>、手頃な価格のワクチンが求められる中、製造コストの上昇と開発者の利益の可能性の低下を示している<ref name=covax-gavi/><ref name=unequal/><ref name=scott/>。 |
|||
ワクチンは、国際的な規則を用いて取り扱われ、輸送され、ワクチン技術によって異なる温度管理された状態で維持され、保管中に劣化する前に予防接種に使用されなければならない<ref name=unequal/><ref name=wef-manuf/>。COVID-19ワクチンのサプライチェーンの規模は、脆弱な集団への世界的な配送を確実にするために、膨大なものになると予想される<ref name=gates2/><ref name=murray/>。このような流通のための施設を準備するための優先事項には、温度管理された施設や設備、インフラの最適化、予防接種スタッフの訓練、厳格なモニタリングが含まれる<ref name=murray/><ref name=unicef-now/><ref name=unicef/>。[[RFID]]技術は、製造業者からワクチン接種までのサプライチェーン全体に沿ってワクチンの投与量を追跡し、認証するために実施されている<ref name="kaplan">{{cite web |first1=Deborah Abrams | last1=Kaplan | name-list-style=vanc |title=3 applications for RFID in the fight against COVID-19 |url=https://www.supplychaindive.com/news/coronavirus-rfid-sensor-tracking-hospital-supply-chain/581066/ |publisher=Supply Chain Dive |access-date=17 September 2020 |date=7 July 2020 |archive-date=2 October 2020 |archive-url=https://web.archive.org/web/20201002013438/https://www.supplychaindive.com/news/coronavirus-rfid-sensor-tracking-hospital-supply-chain/581066/ |url-status=live }}</ref>。 |
|||
2020年9月、{{仮リンク|グランドリバー・アセプティック・マニュファクチャリング|en|Grand River Aseptic Manufacturing}}社は、[[ジョンソン・エンド・ジョンソン]]社と、[[技術移転]]と{{仮リンク|充填・仕上げ|en|Fill and finish}}製造を含むワクチン候補の製造を支援することで合意した<ref name="contract">{{cite web|title=Ramping Up COVID-19 Vaccine Fill and Finish Capacity|url=https://www.contractpharma.com/content-microsite/covid-19/2020-11-03/ramping-up-covid-19-vaccine-fill-and-finish-capacity|publisher=Contract Pharma|author=Kristin Brooks|date=2020-11-03|access-date=2020-11-25}}</ref>。 2020年10月には、2020年12月に最初の投与量を製造する予定のパートナーである[[ロンザ (企業)|ロンザグループ]]が、スイスの{{仮リンク|フィスプ|en|Visp}}でワクチン候補のモデルナを製造することが発表された<ref name="swiss">{{cite web|url=https://www.swissinfo.ch/eng/sci-tech/swiss-factory-rushes-to-prepare-for-moderna-covid-19-vaccine/46081656|title=Swiss factory rushes to prepare for Moderna Covid-19 vaccine |date=2020-10-07 |publisher=SwissInfo| access-date=2020-11-01}}</ref>。新たに建設された2,000平方メートルの施設では、年間3億投与量の製造が開始される予定である。ここで製造されたものは、製造の最終段階のために、スペインのLaboratorios Farmacéuticos Rovi SAに-70℃で冷凍出荷される予定である<ref name=swiss/>。ニューハンプシャー州ポーツマスにあるロンザの拠点は、早ければ11月にも米国専用のワクチン原料の製造を開始することを目指している<ref name=swiss/>。 |
|||
=== コールドチェーン === |
|||
{{also|en:ULT freezer#Use for COVID-19 vaccine storage}} |
|||
ワクチン(およびアジュバント)は、温度変化に対して本質的に不安定であり、サプライチェーン全体を通して[[コールドチェーン]]管理を必要とし、通常は2~8℃(36~46°F)の温度で保たれる<ref name=lloyd/><ref name="karto">{{cite journal | last1=Kartoglu | first1=Umit | last2=Milstien | first2=Julie | title=Tools and approaches to ensure quality of vaccines throughout the cold chain | journal=Expert Review of Vaccines | volume=13 | issue=7 | date=2014-05-28 | issn=1476-0584 | pmid=24865112 | pmc=4743593 | doi=10.1586/14760584.2014.923761 | pages=843–54}}</ref>。COVID-19ワクチンの技術は、いくつかの新しい技術の中でも多様であるため、コールドチェーン管理には新たな課題があり、凍結中は安定しているが熱に弱いワクチンもあれば、凍結すべきではないワクチンもあり、また温度を超えて安定しているワクチンもある<ref name=karto/>。凍結による損傷や、現地での接種プロセスにおける人員のトレーニング不足が大きな懸念事項である<ref name="hanson">{{cite journal | last1=Hanson | first1=Celina M. | last2=George | first2=Anupa M. | last3=Sawadogo | first3=Adama | last4=Schreiber | first4=Benjamin | title=Is freezing in the vaccine cold chain an ongoing issue? A literature review | journal=Vaccine | volume=35 | issue=17 | date=2017-04-19 | issn=0264-410X | pmid=28364920 | doi=10.1016/j.vaccine.2016.09.070 | pages=2127–33 | doi-access=free }}</ref> 。 複数のCOVID-19ワクチンが承認された場合、ワクチンのコールドチェーンは、気候条件や温度維持のための現地資源が変化する、異なる国の間で、これらすべての温度感受性に対応しなければならない可能性がある<ref name=karto/>。{{仮リンク|Sinopharm|en|China National Pharmaceutical Group}}とSinovacのワクチンは、既存のコールドチェーンシステムを使用して輸送できる第III相試験中の不活化ワクチンの例であるが、CoronaVac自体は凍結する必要はない<ref>{{Cite web|date=2020-10-24|title=There are clear frontrunners in the COVID-19 vaccine race — but getting it to a clinic is a challenge in itself|url=https://www.abc.net.au/news/2020-10-25/the-logistics-of-lab-to-jab-covid-19-vaccine/12808914|access-date=2020-11-15|website=Australian Broadcasting Corporation}}</ref><ref>{{Cite web|date=2020-11-01|title=CoronaVac: Doses will come from China on nine flights and can...|url=https://alkhaleejtoday.co/international/5246732/CoronaVac-Doses-will-come-from-China-on-nine-flights-and-can.html|access-date=2020-11-15|website=AlKhaleej Today|language=ar}}</ref>。 |
|||
開発中のmodRNAワクチン技術は、大量生産や分解の制御が難しく、超低温での保管や輸送を必要とする場合がある<ref name=scott/>。例として、モデルナのRNAワクチン候補は、保管期間は限られるが、氷点下ぎりぎりの温度でのコールドチェーン管理を必要とし、BioNTech-PfizerのRNA候補は、ワクチンの製造から接種までの輸送保管中、-70℃以下での保管を必要とする<ref name="blankenship">{{cite web |first1=Kyle | last1=Blankenship | name-list-style=vanc |title=Pfizer, Moderna's coronavirus shot rollouts could freeze up, experts say, citing cold-storage needs |url=https://www.fiercepharma.com/manufacturing/pfizer-moderna-s-covid-19-shot-rollouts-could-be-ice-as-analysts-question-cold |publisher=FiercePharma, Questex LLC |access-date=11 November 2020 |date=28 August 2020}}</ref><ref name="odonnell">{{cite news |first1=Carl | last1=O'Donnell | name-list-style=vanc |title=Why Pfizer's ultra-cold COVID-19 vaccine will not be at the local pharmacy any time soon |url=https://de.reuters.com/article/us-health-coronavirus-vaccines-distribut/why-pfizers-ultra-cold-covid-19-vaccine-will-not-be-at-the-local-pharmacy-any-time-soon-idUSKBN27P2VI |access-date=11 November 2020 |work=Reuters |date=9 November 2020}}</ref>。 |
|||
ワクチンバイアルには数回分のワクチンが入っているが、はじめの投与のために穿刺された後、6時間しか生存可能ではなく、その後廃棄されなければならないため、現地での低温保管と接種プロセスの管理に注意を払う必要がある<ref name=gates2/><ref name="weise">{{cite news |first1=Elizabeth | last1=Weise | name-list-style=vanc |title='Mind-bogglingly complex': Here's what we know about how COVID-19 vaccine will be distributed when it's approved |url=https://www.usatoday.com/story/news/health/2020/09/06/covid-vaccine-complex-distribution-supply-chain-follow-approval/5712053002/ |access-date=13 September 2020 |work=USA Today |date=6 September 2020 |archive-date=12 September 2020 |archive-url=https://web.archive.org/web/20200912170618/https://www.usatoday.com/story/news/health/2020/09/06/covid-vaccine-complex-distribution-supply-chain-follow-approval/5712053002/ |url-status=live }}</ref>。 COVID-19ワクチンは、初期展開の間、多くの場所で供給が不足する可能性が高いため、接種スタッフは、一般的に供給量の30%にもなる腐敗・廃棄処分を回避しなければならない<ref name=wef/><ref name=weise/> 。 コールドチェーンはさらに、バイクや[[ドローン宅配便|ドローン]]などの地方コミュニティにおけるワクチンの輸送の方法、ブースター投与の必要性、希釈剤の使用、医療従事者、子供、高齢者などの脆弱な人々へのアクセスによっても課題となっている.<ref name=gates2/><ref name=unicef/><ref name="durbha">{{cite web |first1=Madhav | last1=Durbha | name-list-style=vanc |title=The extra mile: preparing a supply chain for a COVID-19 vaccine |url=https://www.europeanpharmaceuticalreview.com/article/122358/the-extra-mile-preparing-a-supply-chain-for-a-covid-19-vaccine/ |publisher=European Pharmaceutical Review |access-date=13 September 2020 |date=29 June 2020 |archive-date=11 September 2020 |archive-url=https://web.archive.org/web/20200911074323/https://www.europeanpharmaceuticalreview.com/article/122358/the-extra-mile-preparing-a-supply-chain-for-a-covid-19-vaccine/ |url-status=live }}</ref>。 |
|||
=== 航空輸送・陸上輸送 === |
|||
国際航空貨物の調整は、COVID-19ワクチンの、時間と温度に敏感な配布に不可欠な要素であるが、2020年9月の時点では、航空貨物ネットワークは多国籍展開の準備ができていない<ref name=murray/><ref name=desai/><ref name="iata">{{cite web |title=The time to prepare for COVID-19 vaccine transport is now |url=https://www.iata.org/en/pressroom/pr/2020-09-09-01/ |publisher=International Air Transport Association |access-date=13 September 2020 |date=9 September 2020 |archive-date=12 September 2020 |archive-url=https://web.archive.org/web/20200912232217/https://www.iata.org/en/pressroom/pr/2020-09-09-01/ |url-status=live }}</ref>。「COVID-19ワクチンを安全に届けることは、世界の航空貨物産業にとって今世紀の使命となるだろう。しかし、それは慎重な事前の計画なしには実現しない。そして、そのための時期は今だ。私たちは、各国政府に対し、物流チェーン全体での協力を促進するために主導権を握ることを強く求め、施設、セキュリティの手配、および国境手続きが、前途多難で複雑なタスクに備えられるようにする。」と、IATAの事務局長兼CEOである{{仮リンク|アレクサンドル・ドゥ・ジュニアック|en|Alexandre de Juniac}}は2020年9月に発言した<ref name=iata/>。 |
|||
2020年、旅客航空交通量の深刻な減少のために、航空会社は人員を削減([[レイオフ]])し、ネットワークを縮小し、航空機を長期保管庫に入れていた<ref name=murray/><ref name=iata/>。WHO COVAX施設内でのCOVID-19ワクチンの調達と供給の主導機関として、GAVIとユニセフは、これまでで最大かつ最速のワクチン展開に向けて準備を進めており、国際的な航空貨物輸送の協力、税関と国境管理、そして複数の国に1回分のワクチンを届けるための8,000機もの貨物機を必要とする可能性がある<ref name=unicef/><ref name=iata/>。 |
|||
=== 安全保障と汚職 === |
|||
医薬品は世界最大の詐欺市場であり、年間約2,000億ドルの価値があるため、COVID-19ワクチンの広範な需要は、サプライチェーン全体で[[模倣品]]、盗難、[[悪徳商法]]、サイバー攻撃に対して脆弱である<ref name=pharmiweb/><ref name="unodc">{{cite web |title=COVID-19-related trafficking of medical products as a threat to public health |url=https://www.unodc.org/documents/data-and-analysis/covid/COVID-19_research_brief_trafficking_medical_products.pdf |publisher=United Nations Office on Drugs and Crime |access-date=16 September 2020 |date=2020 |archive-date=19 September 2020 |archive-url=https://web.archive.org/web/20200919040248/https://www.unodc.org/documents/data-and-analysis/covid/COVID-19_research_brief_trafficking_medical_products.pdf |url-status=live }}</ref>。偽造ワクチンと本物のワクチンを識別し追跡するための技術的能力の低さ、アクセスの制約、効果的でない能力など、各国間で調和のとれた規制の枠組みが存在しないことは、ワクチン接種を受ける者の命を脅かす可能性があり、COVID-19のパンデミックを永続させる可能性がある<ref name=unodc/><ref name="kohler">{{cite journal | last1=Kohler | first1=Jillian Clare | last2=Dimancesco | first2=Deirdre | title=The risk of corruption in public pharmaceutical procurement: how anti-corruption, transparency and accountability measures may reduce this risk | journal=Global Health Action | volume=13 | issue=sup1 | date=2020-02-03 | issn=1654-9716 | pmid=32194011 | pmc=7170361 | doi=10.1080/16549716.2019.1694745 | page=1694745}}</ref>。包装資材に用いる追跡システム技術は、サプライチェーン全体でワクチンバイアルを追跡するため、製造業者によって使用されており<ref name=pharmiweb/> 、また、ワクチン接種チームのセキュリティを保証するためにデジタルおよび[[生体認証]]ツールを使用している<ref name=kaplan/><ref name="subra">{{cite news |first1=Samanth | last1=Subramanian | name-list-style=vanc |title=Biometric tracking can ensure billions have immunity against Covid-19 |url=https://www.bloomberg.com/features/2020-covid-vaccine-tracking-biometric/ |access-date=16 September 2020 |work=Bloomberg Businessweek |date=13 August 2020 |archive-date=16 September 2020 |archive-url=https://web.archive.org/web/20200916185242/https://www.bloomberg.com/features/2020-covid-vaccine-tracking-biometric/ |url-status=live }}</ref>。2020年12月、[[インターポール]]は、[[組織犯罪]]がワクチンのサプライチェーンに潜入し、物理的手段で製品を盗み、[[情報窃盗]]を行い、さらには偽造ワクチンを供与する可能性があると警告した<ref>[https://www.interpol.int/en/News-and-Events/News/2020/INTERPOL-warns-of-organized-crime-threat-to-COVID-19-vaccines "INTERPOL warns of organized crime threat to COVID-19 vaccines]". Interpol (Orange Notice). Retrieved December 10 2020.</ref>。 |
|||
=== 国のインフラ整備 === |
|||
WHOは「効果的なワクチン管理」システムを実施しているが<ref name="who-evm">{{cite web |title=Effective Vaccine Management (EVM) Initiative:Vaccine Management Handbook |url=https://www.who.int/immunization/programmes_systems/supply_chain/evm/en/index5.html |publisher=World Health Organization |access-date=16 September 2020 |date=9 September 2020 |archive-date=5 October 2018 |archive-url=https://web.archive.org/web/20181005102131/http://www.who.int/immunization/programmes_systems/supply_chain/evm/en/index5.html |url-status=live }}</ref>、これには、ワクチン配布のための国・準国家の人員や施設を準備するための優先順位を構築することが含まれており、これには以下のようなものがある: |
|||
*時間や温度に敏感なワクチンを扱うスタッフの育成 |
|||
*ワクチンの保管と輸送を最適化するための堅牢なモニタリング機能 |
|||
*温度管理された設備・機器 |
|||
*トレーサビリティ |
|||
*セキュリティ |
|||
個々の国内での効率的な取扱い、及び通関のための国境プロセスには、以下のものが含まれる<ref name=hessel/><ref name=who-evm/>: |
|||
*離陸と着陸の許可を容易にする |
|||
*航空乗務員の[[検疫]]要件の免除 |
|||
*効率的な国内展開のための柔軟な運用の促進 |
|||
*ワクチン温度要件を維持するための着陸優先権の付与 |
|||
== 賠償責任 == |
|||
2020年2月4日、[[アレックス・アザー]]米保健福祉長官は、COVID-19に対する医療対策のための「公共の準備と緊急事態への備えに関する法律([[:en:Public Readiness and Emergency Preparedness Act|Public Readiness and Emergency Preparedness Act]])」に基づく通知を公表した。対象を「COVID-19、またはSARS-CoV-2またはその変異ウイルスの感染を治療、診断、治癒、予防または軽減するために使用される任意のワクチン」とし、宣言は、「ワクチンの作成における製造業者の過失、または誤った投与量を処方した医療提供者の過失を主張する賠償請求は、故意の不法行為がない限り、除外される」としている<ref>{{cite web|url=https://www.phe.gov/Preparedness/legal/prepact/Pages/COVID19.aspx|title=Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19|first=Alex|last=Azar|date=4 February 2020|name-list-style=vanc|access-date=22 April 2020|archive-url=https://web.archive.org/web/20200425015411/https://www.phe.gov/Preparedness/legal/prepact/Pages/COVID19.aspx|archive-date=25 April 2020|url-status=live}}</ref> 。この宣言は米国では2024年10月1日まで有効である。 |
|||
== 誤った情報 == |
|||
{{main|2019年コロナウイルス感染症流行に関連する誤情報}} |
|||
SNSでは、COVID-19ワクチンがすでに利用可能であるという陰謀論を推進している。様々なSNSの投稿で引用された特許には、SARSコロナウイルスなどの他の株の遺伝子配列やワクチンに関する既存の特許が参照されているが、COVID-19については参照されていない<ref>{{Cite web|url=https://www.politifact.com/factchecks/2020/jan/23/facebook-posts/there-outbreak-china-wuhan-coronavirus-there-not-v/|title=No, there is no vaccine for the Wuhan coronavirus|last=Kertscher|first=Tom| name-list-style = vanc |date=23 January 2020|website=[[PolitiFact]]|publisher=[[Poynter Institute]]|url-status=live|archive-url=https://web.archive.org/web/20200207133056/https://www.politifact.com/factchecks/2020/jan/23/facebook-posts/there-outbreak-china-wuhan-coronavirus-there-not-v/|archive-date=7 February 2020|access-date=7 February 2020}}</ref><ref name="20200124factcheckA">{{Cite web|url=https://www.factcheck.org/2020/01/social-media-posts-spread-bogus-coronavirus-conspiracy-theory/|title=Social Media Posts Spread Bogus Coronavirus Conspiracy Theory|last=McDonald|first=Jessica| name-list-style = vanc |date=24 January 2020|website=[[FactCheck.org]]|publisher=[[Annenberg Public Policy Center]]|url-status=live|archive-url=https://web.archive.org/web/20200206102802/https://www.factcheck.org/2020/01/social-media-posts-spread-bogus-coronavirus-conspiracy-theory/|archive-date=6 February 2020|access-date=8 February 2020}}</ref>。 |
|||
2020年5月21日、「nCoV19 spike protein vaccine」と称するワクチンを販売していた、シアトルに本拠を置くNorth Coast Biologics社に、FDAは、中止通知を送ったことを公表した<ref>{{cite web |url=https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/north-coast-biologics-607532-05212020 |title=Warning Letter – North Coast Biologics – MARCS-CMS 607532 |publisher=U.S. [[Food and Drug Administration]] (FDA) |date=21 May 2020 |access-date=23 May 2020 |archive-url=https://web.archive.org/web/20200526221432/https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/warning-letters/north-coast-biologics-607532-05212020 |archive-date=26 May 2020 |url-status=live }}</ref>。 |
|||
== 脚注 == |
|||
=== 注釈 === |
|||
{{Reflist|group=注釈}} |
|||
=== 出典 === |
|||
{{Reflist|2}} |
|||
== 関連項目 == |
|||
*[[2009年新型インフルエンザの世界的流行#新型インフルエンザワクチン|2009年新型インフルエンザワクチン]] |
|||
*[[COVID-19に対する薬剤研究]] |
|||
*[[COVID-19に対する薬剤転用研究]] |
|||
*[[新型コロナウイルス感染症の世界的流行 (2019年-)|新型コロナウイルス感染症の世界的流行]] |
|||
== 外部リンク == |
|||
{{Medical-stub}} |
|||
{{DEFAULTSORT:COVID-19 わくちん}} |
|||
<!-- |
|||
[[Category:医学研究]] |
|||
[[Category:Formatnumの引数に数値以外が入っているページ]]--> |
|||
2020年12月15日 (火) 04:26時点における版
COVID-19ワクチン (コビッド19ワクチン、コービッド19ワクチン) は、COVID-19(新型コロナウイルス感染症 (2019年))を予防するワクチンである。
2020年代に入り、COVID-19の感染は急ピッチで広がりを見せたことから、各国の研究機関や医薬品メーカーは、新たなワクチンの開発や他のウイルス用に開発された既存ワクチンの再評価に乗り出した。世界保健機関は、2020年5月までに世界で118の計画が進行中とするリストを公表。うち8の計画は、欧米や中国で臨床試験の段階に入っている[1]。また、世界保健機関は、ワクチン開発に各国が共同出資・購入する枠組み「COVAX(コバックス)」を立ち上げた[2]。
なお、最初に開発されるワクチンについては、感染防止よりも重症化や死亡を防ぐタイプのワクチンを開発する可能性があるとしている[3]。また、高齢者にはワクチンが効きにくいと指摘する声もある[4]。
COVID-19用ワクチンの製造に当たり、新たな製造手法を模索する企業も現れた。これは、従来の鶏卵によるインフルエンザワクチンの生産手法を応用した場合、生産性が低いうえに時間がかかるというリスクがあること、また、卵に注入したウイルスが変異して、ワクチンの有効性が低下することも考えられるためである[5]。
具体的には、DNAワクチンやmRNAワクチンの開発が進められている[6]。
感染症流行対策イノベーション連合 (CEPI)
感染症流行対策イノベーション連合 (CEPI; Coalition for Epidemic Preparedness Innovations) はノルウェー政府、インド政府、ビル&メリンダ・ゲイツ財団、および公益信託団体ウェルカム・トラストの出資によって2017年にダボス会議(スイス)にて発足した、公的機関、民間機関、慈善団体および市民団体の間でのグローバルな協働体である[7]。日本の厚生労働省も創設に関わり2017年より拠出を行ってきた[8]。
2020年1月23日、CEPIは以下3研究チームがワクチン開発に向けた作業を開始し、少なくとも1種類のワクチンの臨床試験を6月までに開始すると発表した[9][8]。また、夏にも人へ臨床試験を行い、ワクチン承認は早ければ年内になるとも述べた[10]。
- 米医薬品・ワクチン開発のモデルナ (Moderna, Inc.)(英語) (MRNA.O) とアメリカ国立アレルギー・感染症研究所 (NIAID) の連携、
- 製薬会社イノビオ・ファーマシューティカルズ(Inovio Pharmaceuticals, Inc.) (INO.O) 、
- 豪クイーンズランド大学のチーム。
この他、米Vir Biotechnology社もワクチン開発計画に加わり、SARSやMERSの生存者から同定されたモノクローナル抗体(mAbs)が本ウイルスに有効かどうか調べる[11]。
イノビオはMERSの最も先進的なワクチン候補 INO-4700をもっており[12]、ウイルスのDNA塩基配列が公表されて3時間以内にウイルスをデザインできた。CEPIから最大900万ドル(約9億8000万円)の助成金を受け、2020年初夏にも中東・アフリカ現地での第II相臨床試験に入る予定[13][14]で、大規模な臨床試験は年末までに中国で行いたいという[15]。
2月3日、英グラクソ・スミスクライン (GSK) はパンデミックワクチンで確立されたアジュバント(抗原性補強剤)の基盤技術を提供するためにCEPIの協働に参加すると発表した[16]。
2月25日、モデルナは開発中のCOVID-19のワクチンを、ヒトに投与する安全性試験(第I相試験)向けに米国立アレルギー感染症研究所 (NIAID) に出荷した。ヒトへの臨床試験は2カ月以内の開始を見込むが、一般に入手できるようになるには1年半かかる可能性があるという[17]。
日本
2020年3月12日 - 田辺三菱製薬は、カナダの子会社が製造する植物由来の粒子を利用し、ワクチン開発に着手すると発表した[18]。
2020年3月5日、大阪大学発の創薬企業アンジェスは、本ウイルスのワクチンを大阪大学と共同で開発し、タカラバイオが製造すると発表した[19][20][21]。同年6月30日より治験を開始し、7月末までに30人を対象に実施する[22][23]。DNAプラスミド技術を活かしDNAワクチンという種類とするので、他の方法のワクチンよりも短期間に製造工程が作れるという。
2020年5月7日 - 塩野義製薬は、子会社のUMNファーマが国立感染症研究所と共同で、年内の臨床試験開始を目指していることを公表した。最短で2020年内の臨床試験開始を予定している。市場への投入は2021年秋になる見込みで、同年末までに3,000万人分の生産を目標とする[24][25]。
第一三共、東京大学医科学研究所は、最短で2021年3月からワクチンの臨床試験開始を目指す[25]。
2020年6月27日 - 九州大学は、九州大学発のベンチャー企業であるKAICO(福岡市)と共同で、新型コロナウイルスのワクチン候補となるたんぱく質の開発に成功したと発表した[26][27]。2021年からワクチンの臨床試験開始を目指す[27]。
中国
2020年1月26日、中国CDC(疾病管理予防センター)の関係者は、ワクチンの開発を開始したと語った[28]。1月29日、広州のロシア領事館は新型コロナウイルスのゲノムが中国からロシアに提供され、中露がワクチンの共同開発に着手したと発表した[29]。
(上記と同じものかどうかは不明であるが)開発したワクチンの治験開始が3月17日に中国で承認され、陳薇をリーダーとする中国人民解放軍軍事科学院軍事医学研究院の研究者らが治験を開始[30]。3月18日に中国中央電視台も報道した[31]。
3月23日、軍事科学院軍事医学研究院生物工程研究所と康希諾生物 (CanSino Biologics) は、独自に開発した新型コロナウイルスワクチン(アデノウイルス媒体)の108人への第1期臨床試験を開始すると報道した[32]。プロジェクト責任者は陳薇 (Chen Wei) 少将で、複製欠陥型ヒト5型アデノウイルスを媒体とし、新型ウイルスのS抗原を作る[32]。感染予防のため、陳薇チーム7人はすでに接種済みである[32]。陳薇少将はウイルスのワクチンの研究で博士号を取得しており、これまでに抗SARSウイルス製剤やエボラ出血熱のワクチン開発に成功したと発表されている[31]。
2020年5月25日 - 中華人民共和国のカンシノ・バイオロジクスは、同年3月から開始していたウイルスベクターワクチンの第1相臨床試験で、ヒトへの効果を世界で初めて確認したと報告した[33][34]。6月25日、中央軍事委員会は国産ワクチン「Ad5―nCoV」の使用を中国人民解放軍に限定して認可したことを決定した[35]。7月22日より、医療従事者らを対象にワクチンの緊急使用を開始した[36]。
ロシア
2020年8月中旬にロシア政府が国内で製造されたワクチンを薬事承認し、10月以降医療従事者などを対象とした接種を開始する予定と発表した[37]。その後、8月11日にウラジーミル・プーチン大統領が国産ワクチン「Gam-COVID-Vac」(スプートニクV)を世界に先駆けて認可したことを発表した[38]。
2020年11月11日、スプートニクVが発症を防ぐ有効性が92%に上ったとする最終第3段階の臨床試験の第1回中間結果をロシアは発表した[39]。
アメリカ合衆国
2020年1月21日、米国の感染症薬メーカー、ノババックス (Novavax Inc.) は、本ウイルスの感染予防のためのワクチンの開発をはじめたと語った[40][41]。
2020年1月29日、米医薬品・日用品大手ジョンソン・エンド・ジョンソン (J&J) は、COVID-19 ワクチンの開発に着手したと発表した。エボラ出血熱のワクチン開発に利用した技術を応用する。このワクチンは現在、コンゴ民主共和国とルワンダで投与されている[42]。。「すでに多数の研究者をワクチン開発に投入しており、1カ月以内には何らかの成果が出せると確信している。世界市場に向けた量産体制はすでに整っているので、ワクチンが完成すれば、1年以内に億単位の出荷が可能」という[43]。 2020年3月16日 - アメリカ国立衛生研究所は、アメリカ国立アレルギー・感染症研究所とバイオ医薬企業のモデルナが開発していたmRNAワクチンが治験に至ったことを発表。治験は、ワシントン州シアトル市内で始まり[44]、同年5月18日までに複数の治験参加者から抗体を確認することができた[45]。全世界に1年間で5~10億回分の供給を計画している[25]。
ファイザーのワクチンが2020年に供給開始予定。2021年までに数億人規模の接種を目指す。日本にはワクチンが完成した場合には、2021年6月までに1億2,000回分を供給することで、日本国政府と基本合意されている[25]。その後、2020年11月9日に初期の治験のデータが発表され、予防の有効性が90%越えとなった[46]。これを受け、2020年11月中にもアメリカの食品医薬品局に承認の申請を行う[46]。
ノババックスのワクチンは、1年に1億回分の生産を目標としている。生産はアメリカ合衆国の富士フイルム子会社と協力し、日本では武田薬品工業が原薬から製造し販売する予定[25]。
イギリス
アストラゼネカがオックスフォード大学と共同でワクチンを開発し、臨床試験を2020年4月から実施している。9月以降来年にかけて10億回分の生産が可能で、既に4億回分(アメリカ3億回分、イギリス1億回分)の供給を9月から開始することが予定されている[47]。その後供給計画を20億回分に増加し、日本には1億2,000万回分、うち3,000万回分は2021年3月までに供給することを、日本国政府と基本合意されている[25]。治験については、参加者の中に深刻な副反応の疑いが確認されたため、9月9日から中断していた[48]が、9月12日に再開したことを明らかにした[49]。
フランス
2020年2月18日、フランスのサノフィは、米国保健福祉省 (HHS) の生物医学先端研究開発局 (BARDA) と協力して、COVID-19 のための遺伝子組換えワクチンの速やかな開発を目指すと発表した[50]。
ワクチンの確保
2020年6月5日 - 加藤勝信厚生労働大臣は、2021年前半までにコロナワクチンの量産体制を整備していくと表明し、2020年度第2次補正予算1455億円でワクチンの開発企業に対し生産体制の整備を前倒しして進めるための費用を補助する方針を示した[51]。
2020年6月14日 - 内閣総理大臣安倍晋三は、ニコニコ生放送の番組内で「早ければ年末にワクチンを接種できるよう米モデルナ社や英アストラゼネカ社と交渉している」と回答した[52]。
アメリカ合衆国連邦政府のワクチン戦略「ワープスピード作戦」担当高官は、ワクチンについて2020年6月16日に「最優先は米国民の保護。余剰分を他国が手に入れるのは妨げない」と述べている[53]。
2020年9月30日、日本政府がコロナワクチンの接種に関して、自己負担を求めず全国民を無料とする方針を発表した[54]。
ワクチンに対する懸念
ワクチンの開発が急がれている一方、専門家からは「感染そのものを予防する効果は証明が難しい」という懸念が出ている。また、東京大学医科学研究所の石井健教授は「(ワクチン開発を)急げば急ぐほど安全性の担保はおろそかになる」と訴えている[25]。
臨床試験の段階で発熱などの副作用が発生しているケースも見られる[25]。
脚注
注釈
出典
- ^ “新型コロナの開発中ワクチン、有効性を確認”. 福井新聞 (2020年5月19日). 2020年5月26日閲覧。
- ^ “More than 150 countries engaged in COVID-19 vaccine global access facility”. WHO (2020年7月15日). 2020年12月11日閲覧。
- ^ “新型コロナ、最初のワクチンは感染防がない可能性-重症化防止に重点”. Bloomberg. (2020年6月15日)
- ^ 新型コロナワクチンが高齢者に効きにくい可能性(NATIONAL GEOGRAPHIC、2020年7月21日)
- ^ “インフルワクチン製造に使うニワトリ、米秘密農場で飼育 コロナには望み薄”. CNN (2020年4月18日). 2020年4月18日閲覧。
- ^ “新型コロナウイルス 治療薬・ワクチンの開発動向まとめ【COVID-19”. News answers (2020年4月17日). 2020年4月18日閲覧。
- ^ “CEPI ニパウイルスワクチンプロジェクト”. 東京大学 医科学研究所 実験動物研究施設 (2019年3月25日). 2020年2月2日閲覧。
- ^ a b “新型コロナウイルスに対するワクチン開発を進めます”. 厚生労働省 (2020年1月24日). 2020年2月2日閲覧。
- ^ “新型肺炎のワクチン開発へ、米など3研究チームが作業開始”. ロイター (2020年1月24日). 2020年2月2日閲覧。
- ^ “新型肺炎ワクチンの開発支援 6月にも臨床試験―国際団体”. 時事通信 (2020年1月24日). 2020年2月2日閲覧。
- ^ “Coronavirus: Vir Biotechnology and Novavax announce vaccine plans-GB” (2020年1月23日). 2020年1月26日閲覧。
- ^ “CEPIが新型コロナウイルスのワクチン開発でInovioを選定”. PR Newswire (2020年1月24日). 2020年2月2日閲覧。
- ^ “感染症治療薬や防護服のメーカーの株価急伸-新型ウイルス感染拡大で”. ブルームバーグ (2020年1月28日). 2020年2月2日閲覧。
- ^ “Inovioが2020年の臨床プログラム計画の最新情報を提供”. 共同通信 (2020年1月7日). 2020年2月2日閲覧。
- ^ “新型コロナウイルス、世界の研究者がワクチン開発急ぐ 今夏の臨床試験を視野に”. BBCニュース. (2020年1月31日) 2020年2月5日閲覧。
- ^ “GSK、アジュバントの基盤技術を提供”. QLife (2020年2月14日). 2020年2月16日閲覧。
- ^ “モデルナ株急騰、新型ウイルスワクチンを米第1相試験向けに出荷”. ブルームバーグ (2020年2月26日). 2020年2月28日閲覧。
- ^ “田辺三菱製薬、新型コロナのワクチン開発に着手へ”. 日本経済新聞 (2020年3月12日). 2020年4月18日閲覧。
- ^ “[IR] アンジェス、大阪大学が新型コロナウイルス (COVID-19) に対するDNAワクチン共同開発に着手”. アンジェス (2020年3月5日). 2020年3月5日閲覧。
- ^ “アンジェス、新型コロナのワクチン開発へ”. 日本経済新聞. (2020年3月5日)
- ^ “大阪大などが開発着手、新型コロナワクチンの効き目は?”. 日経ビジネス (2020年3月16日). 2020年4月18日閲覧。
- ^ 大阪市長(2020年6月16日)
- ^ コロナワクチン、国内初の治験開始 7月末まで30人に(朝日新聞デジタル、2020年6月30日)
- ^ “塩野義製薬、新型コロナワクチンを21年秋にも市場投入”. 日本経済新聞社 (2020年5月7日). 2020年5月13日閲覧。
- ^ a b c d e f g h 『北日本新聞』2020年8月22日付3面『開発進むコロナワクチン 政府 支援や確保急ぐ』より。
- ^ “カイコからコロナワクチン候補 「食べて接種」も? 九大など開発”. 西日本新聞. (2020年6月27日) 2020年9月29日閲覧。
- ^ a b “カイコの体内で生成 新型コロナのワクチン候補、来年度にも治験へ 九大”. 毎日新聞. (2020年6月30日) 2020年9月29日閲覧。
- ^ “China CDC developing novel coronavirus vaccine”. Xinhua (2020年1月26日). 2020年1月26日時点のオリジナルよりアーカイブ。2020年1月28日閲覧。
- ^ “ロシアと中国、新型コロナウイルスのワクチンの共同開発に着手” (日本語). ロイター. (2020年1月29日) 2020年2月3日閲覧。
- ^ “中国、新型コロナのワクチン治験開始へ”. ロイター (2020年3月17日). 2020年3月18日閲覧。
- ^ a b “「新型コロナワクチン」中国人民解放軍が世界に先駆けて開発した背景”. 講談社. (2020年3月24日)
- ^ a b c 中華人民共和国科学技術部が発行する科技日報報道。華西都市報,中国、新型コロナウイルスのワクチンのヒト臨床試験を開始AFPBB,2020年3月23日 14:31
- ^ “中国カンシノ、コロナワクチン「ヒトへの効果確認」”. ブルームバーグ (2020年5月25日). 2020年8月19日閲覧。
- ^ “カナダと「海亀」、人民解放軍で飛躍-ワクチン開発の中国カンシノ”. ブルームバーグ (2020年7月3日). 2020年8月19日閲覧。
- ^ “中国で開発中の新型コロナワクチン、軍への使用に限定して承認”. CNN (2020年7月1日). 2020年8月19日閲覧。
- ^ [中国、ワクチン緊急接種開始=医療従事者らに、実用化急ぐ―新型コロナ https://sp.m.jiji.com/article/show/2430826](時事通信ニュース、2020年8月23日)
- ^ “露、8月中旬にも国産コロナワクチン承認…安全面から懸念も”. 讀賣新聞オンライン (2020年8月3日). 2020年8月3日閲覧。
- ^ “プーチン大統領、ロシア製ワクチンに使用認可 欧米は懐疑的”. 日本経済新聞 (2020年8月12日). 2020年8月19日閲覧。
- ^ 『北日本新聞』2020年11月12日付8面『ロのワクチン有効性92% 臨床試験中間結果』より。
- ^ “Novavax developing nanoparticle vaccine for Wuhan coronavirus”. BioWorld (2020年1月21日). 2020年2月8日閲覧。
- ^ “新型コロナウイルス、多様なワクチン開発へ世界中で参入企業相次ぐ”. 日経BP (2020年1月29日). 2020年2月8日閲覧。
- ^ “ロシュ、新型ウイルス検出キットの供給困難 中国の都市閉鎖で”. ロイター (2020年1月31日). 2020年2月2日閲覧。
- ^ “J&J新型コロナのワクチン開発に自信 ギリアドも開発に乗り出す”. ミクス. (2020年2月6日) 2020年2月6日閲覧。
- ^ “米NIH、新型コロナのワクチン治験開始”. 日本経済新聞 (2020年3月17日). 2020年4月18日閲覧。
- ^ “モデルナ、コロナワクチン抗体確認 7月に大規模治験”. 日本経済新聞 (2020年5月18日). 2020年5月14日閲覧。
- ^ a b ニューヨーク=中山修志「米ファイザー、ワクチンの効果9割超に」『日本経済新聞』、2020年11月9日。2020年11月10日閲覧。
- ^ “英製薬大手「コロナワクチン9月供給予定」 臨床試験結果はまだ”. NHK (2020年5月22日). 2020年5月23日閲覧。
- ^ “アストラゼネカのワクチン治験が中断 深刻な副反応疑い”. 朝日新聞. (2020年9月9日)
- ^ “アストラゼネカ コロナのワクチン 英国内での臨床試験を再開”. NHK. (2020年9月13日)
- ^ “サノフィ、米国保健福祉省(HHS)と協働で新型コロナウイルスワクチンを開発へ”. サノフィ (2020年2月18日). 2020年3月5日閲覧。
- ^ 『北日本新聞』2020年6月6日付3面『ワクチン開発なら 量産体制21年前半 厚労相が方針』より。
- ^ “安倍首相、ワクチン年末確保へ交渉 新型コロナ”. 時事通信. (2020年6月14日)
- ^ 『北日本新聞』2020年7月12日付2面『ワクチン囲い込み過熱』より。
- ^ “コロナワクチン無料接種へ 全国民対象、国費6700億円超―政府方針”. 時事通信. (2020年9月30日)
参考文献
関連項目
外部リンク
この項目「COVID-19ワクチン」は途中まで翻訳されたものです。(原文:"COVID-19 vaccine" 11 December 2020 00:17 UTC) 翻訳作業に協力して下さる方を求めています。ノートページや履歴、翻訳のガイドラインも参照してください。要約欄への翻訳情報の記入をお忘れなく。(2020年12月) |
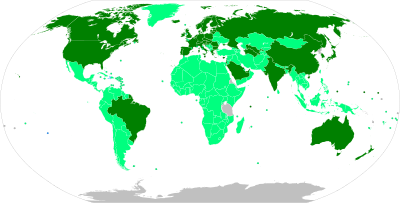
COVID‑19ワクチン(コビッド19ワクチン)は、 2019年新型コロナウイス感染症(COVID‑19)に対する獲得免疫(acquired immunity)を提供することを目的とした、いくつかの異なるワクチン技術の総称。このコロナウイルス感染症に対するワクチンを開発するための以前の研究、つまりSARSおよびMERSの研究は、コロナウイルスの構造と機能に関する知識を確立し、2020年初頭にCOVID-19ワクチンのさまざまな技術プラットフォームの開発を加速させた[1]。
2020年12月時点で、世界中で59のワクチン候補が開発されており、約42が第I/Ⅱ相試験、17が第Ⅱ/Ⅲ相試験中である [2][3][4][5]。第Ⅲ相試験を完全に終えたワクチン候補は、まだない。
世界保健機関(WHO)、感染症流行対策イノベーション連合(Coalition for Epidemic Preparedness Innovations, CEPI)、およびゲイツ財団(GF)は、COVID-19感染症の継続を防ぐためにいくつかのワクチンが必要になるという見通しのため、資金と組織のリソースを投入している[6] 。ワクチン候補の迅速な投資と開発のために20億ドルの世界基金を組織しているCEPI[7]は、9月に、ライセンス取得を支援するための臨床データが2020年末までに入手できる可能性があることを示した。2020年5月4日には、WHOが主催したテレソン(長時間特別番組)で、40カ国から81億ドルの誓約書が寄せられた [8]。同時に、WHOは、第II/III相臨床試験に到達した複数のワクチン候補の同時評価のための国際的な「連帯試験」の展開も発表した [9]。
2020年11月、バーレーンはSinopharm社製ワクチンの緊急販売承認を与え、アラブ首長国連邦がこれに続いた。12月には、バーレーンと英国がファイザー社製ワクチンを緊急時の使用を承認した[10][11]一方で、UAEとカナダは一般使用を承認した[12][13][14]。
概要と沿革
SARSとMERS
2003年現在、鳥類感染性気管支炎ウイルス(infectious bronchitis virus)、犬コロナウイルス、猫コロナウイルスなど、コロナウイルスによって引き起こされるいくつかの動物の病気に対してワクチンは製造されている[15]。ヒトに影響を与えるコロナウイルス科のウイルスに対するワクチンを開発するための以前のプロジェクトは、重症急性呼吸器症候群(SARS)と中東呼吸器症候群(MERS)を対象としていた。SARS[16]およびMERS[17]に対するワクチンは、ヒト以外の動物でテストされている。
2005年と2006年に発表された研究によると、SARSを治療するための新しいワクチンと医薬品の特定と開発は、当時の世界中の政府と衛生行政機関にとって優先事項だった [18] [19] [20]。2020年の時点で、ヒトのSARSに対して安全で効果的であることが証明されている治療法や予防ワクチンは無い [21] [22]。
MERSに対し確立されたワクチンも、存在しない[23]。MERSが普及したとき、既存のSARS研究は、MERS-CoV感染に対するワクチンと治療法を開発するための有用なテンプレートを提供する可能性があると考えられていた[21] [24] 。2020年3月現在、ヒトでの第I相臨床試験を完了した(DNAベースの)MERSワクチンが1種[25]、その他3種のワクチンが進行中であり、いずれもアデノウイルスベクター型2種(ChAdOx1-MERS、BVRS-GamVac)、MVAベクター型1種(MVA-MERS-S)である [26]。
2020年のCOVID‑19ワクチン開発
感染症のワクチンは、これまで数年以内に製造されたことがなく、ヒトのコロナウイルス感染を予防するためのワクチンは存在しない[6] 。2019年12月にコロナウイルスが検出された後 [27] COVID‑19の遺伝子配列が2020年1月11日に公開され、発生に備えて予防ワクチンの開発を早めるための緊急の国際的対応が引き起こされた [28] [29] [30]。
2020年2月、世界保健機関(WHO)は、原因ウイルスである重症急性呼吸器症候群コロナウイルス2 (SARS-CoV-2)に対するワクチンが18か月以内に利用可能になるとは予想していなかったと述べた[31]。2020年初頭に世界的にCOVID-19の感染率が急増したことで、国際的なアライアンスや政府の取り組みが刺激され、複数のワクチンを短期間で製造するためのリソースを緊急に整理し[9]、3月には4つのワクチン候補がヒト評価に入ることになりました(後述の2020年に開始される臨床試験床試験の表を参照) [28] [32]
2020年4月、WHOは、異なる技術と流通を持つ3種類以上のワクチンを開発するための総費用を80億米ドルと見積もった [9] [33] 。2020年4月までに、「19カ国のほぼ80の企業や研究機関」がこの仮想的なゴールドラッシュに取り組んでいた [34]。 また、4月には、CEPIは、COVID-19に対するワクチン候補のうち、6つのワクチンが国際的な連合によって第II-III相試験を経て開発のために選ばれ、3つのワクチンは最終的なライセンス取得に向けて規制と品質保証を経て合理化されなければならないと見積もっている [2] [32] [6]。別の分析によると、10のワクチン候補が同時に初期開発を必要とし、そのうちのいくつかがライセンス取得に向けた最終的な道筋として選ばれる前に、10のワクチン候補が同時に初期開発を必要とすると見積もっている。
2020年7月、英国国家サイバーセキュリティ―センター(National Cyber Security Centre)として、それぞれの政府および軍隊の英米諜報機関およびセキュリティ組織が、カナダ通信保安局(Communications Security Establishment)、国土安全保障省国家保護・プログラム総局(Cybersecurity Infrastructure Security Agency)、アメリカ国家安全保障局(NSA)は、ロシアの国家支援ハッカーが他の国の学術機関や製薬機関からCOVID‑19治療とワクチン研究を盗もうとした可能性があると主張した。ロシアはそれを否定した[35]。
グローバル開発
2020年の間に、年初からのCOVID-19ワクチン開発の取り組み全体の大きな変化は、多国籍製薬業界と各国政府との共同研究の増加と、COVID-19ワクチンに注力する多くの国のバイオテクノロジー企業の多様性と増加である [2]。CEPIによると、COVID-19ワクチン開発の一般的な地理的分布は、北米の組織が世界のCOVID-19ワクチン研究の約40%を占めているのに対し、アジアとオーストラリアでは30%、ヨーロッパでは26%、南米とアフリカではいくつかのプロジェクトが存在している [28]。
国際機関
ワクチン開発を加速させ、流通に備えるための国際的な提携を形成している組織があるが、その中には、5月初旬に8億米ドルの資金調達を開始し、史上前例のない規模で協力、研究の加速化、国際的なコミュニケーションを促進しているWHOも含まれている[8] 。WHOはまた、世界的なワクチン開発を調整するためのCovid-19 Vaccines Global Access(COVAX)を実施し、GAVIやCEPIと共同でAccess to COVID-19 Tools (ACT) Acceleratorのワクチンの柱となっている [2][36][37]。7月、WHOは、世界人口の最大60%を占める165カ国が、最終的な認可ワクチンの公正かつ衡平な配分のためのWHO COVAX計画に合意したことを発表した。 COVAXは、COVID-19ワクチンの開発と製造を加速し、認可ワクチンへのアクセスがすべての国に公平に提供されることを保証することを目標としている。2021年末までに、各参加国が最も脆弱な20%の人口にワクチンを接種するために、保証された分量を受け取ることを保証する。
組織は、ワクチン開発を促進し、配布の準備をするために国際的な提携を結んでいます。これには、コラボレーション、加速された研究、および歴史上前例のない規模の国際コミュニケーションを促進するWHOが含まれ、5月上旬にUS$8.1を調達します。 数十億の誓約。 [8] WHOはまた、グローバルなワクチン開発を調整するためのCovid‑19 Vaccines Global Access (COVAX)、 GAVIおよびCoalition for Epidemic Preparedness Innovations (CEPI)と協力して、 Access to COVID-19 Tools(ACT)Acceleratorのワクチンの柱を実装しました。 [2][36] [37] 7月、WHOは、世界人口の最大60%を占める165か国が、最終的に認可されたワクチンを公正かつ公平に配布するためのWHO COVAX計画に合意し、各参加国が保証された用量の割合を受け取ることを保証したと発表しました。 2021年末までに人口の最も脆弱な20%にワクチンを接種する [38]。 COVAXは、COVID‑19ワクチンの開発と製造を加速し、認可されたワクチンへのアクセスがすべての国に公平に提供されることを保証することを目標としている 。
CEPIは、国際保健当局およびワクチン開発者と協力して、さらにUS$2を作成しています。 公的、私的、慈善団体、市民社会の組織間のグローバルパートナーシップで、8つのワクチン候補の研究と臨床試験を加速するための10億の資金を提供し、2020〜21年の目標は、ライセンスの完全な開発のためにいくつかの候補を支援することです。 [2][33]英国、カナダ、ベルギー、ノルウェー、スイス、ドイツ、オランダはすでにUS$915寄付していました 5月上旬までにCEPIに100万ドル。 [8] [39]ワクチンの研究と配布を専門とする民間の慈善団体であるビル&メリンダゲイツ財団(ゲイツ財団)は、 US$250寄付しています。 COVID‑19ワクチンの研究と公教育支援のためのCEPIの支援で100万人。 [40] [41]
6月4日、英国のロンドンから、 G7およびG20諸国の35の国家元首を含む、52か国の民間および政府の代表者の間で仮想サミットが調整され、 US$8.8が調達されました。 300のCOVID‑19ワクチン接種に備えるためのワクチンと予防接種のためのグローバルアライアンス(GAVI)を支援する10億 2025年までに発展途上国の100万人の子供たち。 [42]主な寄付はUS$1.6 ゲイツ財団からの10億ドル[43]および330ポンド 英国政府による5年間で年間100万US$2.1(約US$2.1 2020年6月に10億)。
テクノロジープラットフォーム
See also: ULT freezer § Use for COVID-19 vaccine storage
CEPIの科学者は、2020年9月に、COVID-19に対する有効なワクチンを作成するために、9つの異なる技術プラットフォーム-多数の候補の技術が未定義のまま-が2020年中に研究開発中であることを報告した[2]。CEPIによると、9月時点で臨床試験中のワクチン候補のプラットフォームのほとんどは、COVID-19感染の主要抗原としてのコロナウイルススパイクタンパク質とその変異体に焦点を当てている[2]。2020年に開発中のプラットフォームには、核酸技術(RNAとDNA)、非複製ウイルスベクター、ペプチド、組換えタンパク質、弱毒生ウイルス、不活化ウイルスなどがある [1] [6] [28]。
COVID‑19のために開発されている多くのワクチン技術は、インフルエンザを予防するためにすでに使用されているワクチンとは異なり、COVID‑19感染メカニズムの精度を高めるために「次世代」戦略を使用している[1] [2]。開発中のワクチンプラットフォームは、医療従事者、高齢者、子供、妊婦、既存の免疫力が低下している人々など、感受性の高い集団サブグループにおけるCOVID-19感染のメカニズムを標的とする抗原操作の柔軟性と有効性を改善する可能性がある 。

| 分子プラットフォーム | 候補ワクチン総数 | 治験中の候補ワクチン総数 |
|---|---|---|
| 非複製型ウィルスベクター | ||
| RNAベース | ||
| 不活化ウイルス | ||
| タンパク質サブユニット | ||
| DNA-ベース | ||
| 複製ウイルスベクター | ||
| ウイルス様粒子 | ||
| 生きたまま減衰させたウイルス |
^数十の候補ワクチン向けのテクノロジーは、発表されていないか、「不明」[3]
ワクチン候補
CEPIでは、ワクチンの開発ステージを「探索的(exploratory)」(候補品を計画・設計し、生体内での評価を行わない)、「前臨床的(preclinical)」(生体内での評価を行い、ヒトで試験するための化合物を製造する準備を行う)、または健常者を対象とした第I相安全性試験の開始に分類している [2]。9月の時点で、合計321のワクチン候補が、臨床試験または初期段階の「探索的」または「前臨床」開発で確認されたプロジェクトとして開発中 。
第I相試験では、主に数十人の健康な被験者を対象に安全性と予備的投与量を試験し、第II相試験では、第I相試験の成功後、免疫原性、投与量レベル(バイオマーカーに基づく有効性)、および候補ワクチンの副作用を評価し、通常は数百人を対象とします。 第III相試験では、通常、複数の施設でより多くの参加者が参加し、対照群を含み、最適な用量での副作用をモニタリングしながら、病気を予防するためのワクチンの有効性を試験する(「介入試験」または「ピボタル試験」) [44] [45]。フェーズ I–II試験は、予備的な安全性と免疫原性試験で構成され、通常は無作為化、プラセボ対照、より正確で効果的な用量を決定します。 段階 III試験は通常、複数の場所でより多くの参加者を含み、対照群を含み、最適な用量で副作用を監視しながら、病気を予防するためのワクチンの有効性をテストします(「介入」または「重要」試験) 。第III相試験におけるワクチンの安全性、有効性、および臨床エンドポイントの定義は、副作用の程度、感染または感染量、ワクチンが中等度または重度のCOVID-19感染を予防するかどうかなど、異なる企業の試験によって異なる場合がある [46] [47] [48]。
2020年に開始された臨床試験
EUA(Emergency Use Authorization|Emergency Use Authorization) :緊急使用許可
| ワクチン候補薬、開発者、出資者 | 技術 | EUA認可 | 認可 |
|---|---|---|---|
| Tozinameran'[12][49][50] BioNTech、Fosun Pharmaceutical、ファイザー |
modRNA(RNAワクチン) | 承認(英国MHRA[10]、バーレーンNHRA[51])、サウジアラビアSFDA 保留(米国FDA,[52]、欧州連合EMA[53]、メキシコCOFEPRIS[10] Bahrain NHRA[54]、インドDCGI)、スイスSwissmedic) |
承認(カナダ保健省[55] |
| AZD1222 [a][57][58][59] オックスフォード大学、アストラゼネカ |
改変チンパンジーアデノウイルスベクター(ChAdOx1) | ||
| Ad5-nCoV CanSinoBIO, 中国陸軍医科学院, NPO Petrovax[60][b] |
組換えアデノウイルス5型ベクター | 保留(インドDCGI、カナダ、スイスSwissmedic) | |
| BBIBP-CorV[62] Sinopharm: 北京生物製品研究所、武漢生物製品研究所 |
不活化SARS-CoV-2(vero細胞) | 承認(中国[63]、バーレーン[64]、UAE[65]) | 承認(UAE) |
| CoronaVac[66][67][68] Sinovac |
不活化SARS-CoV-2 | 承認(中国[69]) | |
| Gam-COVID-Vac(Sputnik V) Gamaleya Research Institute of Epidemiology and Microbiology(商品名Sputnik V) |
非複製型ウイルスベクター | 承認(ロシア保健省[70]) | |
| mRNA-1273[71][72] モデルナ、NIAID、BARDA |
modRNAを含む脂質ナノ粒子分散液 | 保留(米国FDA[73]、欧州連合EMA、英国MHRA[74]、カナダ、スイスSwissmedic) | |
| Ad26.COV2.S[75][76][77] ヤンセン ファーマ、BIDMC |
非複製型ウイルスベクター | 保留(カナダ) | |
| NVX-CoV2373[78] Novavax |
SARS-CoV-2組換えスパイク蛋白質アジュバントナノ粒子 | ||
| BBV152 (Covaxin)Bharat Biotech、インド医学研究評議会 | 不活化SARS-CoV-2 | 保留(インドDCGI) | |
| CoVLP[154] medicago、GSK |
GSKアジュバントを用いた組換え植物性ウイルス様粒子 | ||
| 名称未定>[3][4][5][79] Anhui Zhifei Longcom Biopharmaceutical Co. Ltd. |
組換えタンパク質サブユニット | ||
| CVnCoV[80] CureVac、CEPI |
modRNA | ||
| INO-4800[c][81][82] Inovio、CEPI、韓国疾病管理本部、IVI |
エレクトロポレーションで送達されたDNAプラスミド | ||
| EpiVacCorona[83] Vector |
ペプチド抗原を用いたワクチン[83] |
他、多数
- ^ Oxford name: ChAdOx1 nCoV-19. Manufacturing in Brazil to be carried out by Oswaldo Cruz Foundation.[56]
- ^ Manufacturing partnership with the National Research Council of Canada and Canadian Center for Vaccinology, Halifax, Nova Scotia[61]
- ^ South Korean Phase I–II in parallel with Phase I in the US
サプライチェーン
2021年以降にCOVID-19ワクチン接種を展開するには、100~190億本(バイアル)の世界的な輸送と追跡が必要となる可能性があり、この取り組みは容易に史上最大のサプライチェーンの課題となる[6][84][85]。2020年9月の時点で、サプライチェーンとロジスティクス(物流)の専門家は、認可ワクチンを流通させるための国際的および国内的なネットワークが、量・緊急性ともに対応する準備ができていないと懸念を表明していて、その理由は主に2020年のパンデミックのロックダウンと供給能力を低下させるダウンサイジングの間のリソースの悪化が原因としている[84][86][87]。COVAX(The COVID-19 Vaccines Global Access)パートナーシップ、世界の製薬会社、契約ワクチンメーカー、国境を越えた輸送、保管施設、各国の保健機関など、多数の組織を調整することで直面している世界的な課題について、GAVIの最高経営責任者であるセス・バークレーは次のように述べている。"何十億ものワクチンを効率的に全世界に届けるためには、サプライチェーンに沿った非常に複雑なロジスティックとプログラム上の障害を伴うことになる”[88]。
課題の大きさを強調する例として、国際航空運送協会は、COVID-19パンデミックを経験している200カ国以上の人々に1回分の投与量のみを輸送するだけでも、8,000機の747型貨物機(精密ワクチン保冷装置を導入)が必要であると述べている[89] 。 GAVIは、「動きの速いパンデミックでは、全員が安全でなければ誰も安全ではない」と述べている[37]。
ワクチン技術や初期段階の臨床研究への数十億ドルの投資とは対照的に、ワクチンのライセンス取得後のサプライチェーンは、同様な計画、調整、セキュリティ、または投資を受けていない[84][86][90]。主な懸念は、低・中所得国、特に子どもたちへのワクチン接種のためのワクチン流通資源が不足しているか、または存在しないということである[37][91]。9月には、COVAXのパートナーシップには、172カ国がCOVID-19ワクチンのサプライチェーンを最適化するための計画を調整することが含まれており[92]、国連児童基金(ユニセフ)はCOVAXと協力して、92の開発途上国における子どもたちのワクチン接種のための、資金調達とサプライチェーンを準備することになった[93][94]。
物流
ワクチン接種のための物流サービスは、必要な機器、スタッフ、国際的な国境を越えた認可ワクチンの供給を保証するものである[95]。物流の中核には、ワクチンの取り扱いとモニタリング、コールドチェーン管理、ワクチン接種ネットワーク内での流通の安全性などが含まれる[96]。COVAX施設の目的は、製造、輸送、および全体的なサプライチェーンのインフラを統合し、参加国間の物流資源を一元化し、平等に管理することである[37][90]。ワクチン予測とニーズ推定、国内ワクチン管理、無駄遣いの可能性、および在庫管理のための物流ツールが含まれている[96]。
COVID-19 ワクチンの輸送中に国際的に実施される他の物流要因には、以下のものがある[84][97][98]:
- 個々のワクチンバイアルをバーコードによる可視化し、追跡可能にする(visibility and traceability)
- サプライヤー監査の共有化
- 製造から被接種者へのワクチンバイアル輸送証拠保全の共有化
- ワクチン温度監視ツールの使用
- 温度安定性試験と保証
- 新しい包装・配送技術
- 備蓄
- 各国内の物資調整(個人用保護具(PPE)、希釈剤、注射器、針、ゴム栓、冷蔵燃料や電源、廃棄物処理など
- 通信技術
- 各国の環境影響
あるワクチン開発者によると、いずれかの段階で物流が不足すると、サプライチェーン全体が脱線する可能性があるという[99]。ワクチンのサプライチェーンが失敗した場合、パンデミックの経済的・人的コストは何年にもわたって長期化する可能性がある[87]。
製造能力
2020年8月時点で、安全性と有効性の確立から数ヶ月が経過した段階で、いくつかのワクチン候補が第III相試験に入った段階にもかかわらず、多くの政府が50億米ドル以上の費用をかけて20億回分以上のワクチンを予約注文した[85][99][100]。英国政府からの2021年のワクチン予約注文は、1人当たり5回分であった[85]。 9月には、CEPIは、2021年末までに認可された3種のワクチンを20億回分製造するという資金調達の約束の下、9種のワクチン候補の基礎研究と臨床研究を資金面で支援している[92]。 2022年までに全体で70億~100億回分のCOVID-19ワクチンが世界中で製造される可能性があるが、富裕国による大量の事前注文(「ワクチンナショナリズム」と呼ばれる)は、より貧しい国のワクチン利用を脅かすものである[6][99][85] 。
インド血清研究所は、少なくとも10億回分のワクチンを生産する計画であるが、その半分はインドで使用されると述べている[85]。
中国は、10月にCOVAXに参加した後、2020年末までに6億回分のワクチンを生産し、2021年にはさらに10億回分のワクチンを生産することを明らかにしたが、14億人の自国の人口に対して何回分のワクチンを生産するのかは不明であった[101]。Sinopharm社は、2021年に10億用量以上の生産能力を持つ可能性があると述べている[102]。Sinovac社は、2020年末までに第2の生産施設を完成させ、CoronaVacの生産能力をそれまでの3億用量から6億用量に引き上げることを目指していると述べている[103]。
アストラゼネカのパスカル・ソリオCEOは次のように述べている。"課題はワクチンそのものの製造ではなく、バイアルへの充填にある。世界には十分なバイアルが無い」[104]バイアル製造の高い需要に備えて、アメリカのガラスメーカーは7月にバイアル工場のために1億6,300万ドルを投資した[308]。バイアル製造のためのガラスの入手可能性と、汚染物質の管理が懸念されているが[105]、手頃な価格のワクチンが求められる中、製造コストの上昇と開発者の利益の可能性の低下を示している[37][85][87]。
ワクチンは、国際的な規則を用いて取り扱われ、輸送され、ワクチン技術によって異なる温度管理された状態で維持され、保管中に劣化する前に予防接種に使用されなければならない[85][99]。COVID-19ワクチンのサプライチェーンの規模は、脆弱な集団への世界的な配送を確実にするために、膨大なものになると予想される[6][86]。このような流通のための施設を準備するための優先事項には、温度管理された施設や設備、インフラの最適化、予防接種スタッフの訓練、厳格なモニタリングが含まれる[86][88][93]。RFID技術は、製造業者からワクチン接種までのサプライチェーン全体に沿ってワクチンの投与量を追跡し、認証するために実施されている[106]。
2020年9月、グランドリバー・アセプティック・マニュファクチャリング社は、ジョンソン・エンド・ジョンソン社と、技術移転と充填・仕上げ製造を含むワクチン候補の製造を支援することで合意した[107]。 2020年10月には、2020年12月に最初の投与量を製造する予定のパートナーであるロンザグループが、スイスのフィスプでワクチン候補のモデルナを製造することが発表された[108]。新たに建設された2,000平方メートルの施設では、年間3億投与量の製造が開始される予定である。ここで製造されたものは、製造の最終段階のために、スペインのLaboratorios Farmacéuticos Rovi SAに-70℃で冷凍出荷される予定である[108]。ニューハンプシャー州ポーツマスにあるロンザの拠点は、早ければ11月にも米国専用のワクチン原料の製造を開始することを目指している[108]。
コールドチェーン
ワクチン(およびアジュバント)は、温度変化に対して本質的に不安定であり、サプライチェーン全体を通してコールドチェーン管理を必要とし、通常は2~8℃(36~46°F)の温度で保たれる[98][109]。COVID-19ワクチンの技術は、いくつかの新しい技術の中でも多様であるため、コールドチェーン管理には新たな課題があり、凍結中は安定しているが熱に弱いワクチンもあれば、凍結すべきではないワクチンもあり、また温度を超えて安定しているワクチンもある[109]。凍結による損傷や、現地での接種プロセスにおける人員のトレーニング不足が大きな懸念事項である[110] 。 複数のCOVID-19ワクチンが承認された場合、ワクチンのコールドチェーンは、気候条件や温度維持のための現地資源が変化する、異なる国の間で、これらすべての温度感受性に対応しなければならない可能性がある[109]。SinopharmとSinovacのワクチンは、既存のコールドチェーンシステムを使用して輸送できる第III相試験中の不活化ワクチンの例であるが、CoronaVac自体は凍結する必要はない[111][112]。
開発中のmodRNAワクチン技術は、大量生産や分解の制御が難しく、超低温での保管や輸送を必要とする場合がある[87]。例として、モデルナのRNAワクチン候補は、保管期間は限られるが、氷点下ぎりぎりの温度でのコールドチェーン管理を必要とし、BioNTech-PfizerのRNA候補は、ワクチンの製造から接種までの輸送保管中、-70℃以下での保管を必要とする[113][114]。
ワクチンバイアルには数回分のワクチンが入っているが、はじめの投与のために穿刺された後、6時間しか生存可能ではなく、その後廃棄されなければならないため、現地での低温保管と接種プロセスの管理に注意を払う必要がある[6][115]。 COVID-19ワクチンは、初期展開の間、多くの場所で供給が不足する可能性が高いため、接種スタッフは、一般的に供給量の30%にもなる腐敗・廃棄処分を回避しなければならない[84][115] 。 コールドチェーンはさらに、バイクやドローンなどの地方コミュニティにおけるワクチンの輸送の方法、ブースター投与の必要性、希釈剤の使用、医療従事者、子供、高齢者などの脆弱な人々へのアクセスによっても課題となっている.[6][93][116]。
航空輸送・陸上輸送
国際航空貨物の調整は、COVID-19ワクチンの、時間と温度に敏感な配布に不可欠な要素であるが、2020年9月の時点では、航空貨物ネットワークは多国籍展開の準備ができていない[86][89][117]。「COVID-19ワクチンを安全に届けることは、世界の航空貨物産業にとって今世紀の使命となるだろう。しかし、それは慎重な事前の計画なしには実現しない。そして、そのための時期は今だ。私たちは、各国政府に対し、物流チェーン全体での協力を促進するために主導権を握ることを強く求め、施設、セキュリティの手配、および国境手続きが、前途多難で複雑なタスクに備えられるようにする。」と、IATAの事務局長兼CEOであるアレクサンドル・ドゥ・ジュニアックは2020年9月に発言した[117]。
2020年、旅客航空交通量の深刻な減少のために、航空会社は人員を削減(レイオフ)し、ネットワークを縮小し、航空機を長期保管庫に入れていた[86][117]。WHO COVAX施設内でのCOVID-19ワクチンの調達と供給の主導機関として、GAVIとユニセフは、これまでで最大かつ最速のワクチン展開に向けて準備を進めており、国際的な航空貨物輸送の協力、税関と国境管理、そして複数の国に1回分のワクチンを届けるための8,000機もの貨物機を必要とする可能性がある[93][117]。
安全保障と汚職
医薬品は世界最大の詐欺市場であり、年間約2,000億ドルの価値があるため、COVID-19ワクチンの広範な需要は、サプライチェーン全体で模倣品、盗難、悪徳商法、サイバー攻撃に対して脆弱である[90][118]。偽造ワクチンと本物のワクチンを識別し追跡するための技術的能力の低さ、アクセスの制約、効果的でない能力など、各国間で調和のとれた規制の枠組みが存在しないことは、ワクチン接種を受ける者の命を脅かす可能性があり、COVID-19のパンデミックを永続させる可能性がある[118][119]。包装資材に用いる追跡システム技術は、サプライチェーン全体でワクチンバイアルを追跡するため、製造業者によって使用されており[90] 、また、ワクチン接種チームのセキュリティを保証するためにデジタルおよび生体認証ツールを使用している[106][120]。2020年12月、インターポールは、組織犯罪がワクチンのサプライチェーンに潜入し、物理的手段で製品を盗み、情報窃盗を行い、さらには偽造ワクチンを供与する可能性があると警告した[121]。
国のインフラ整備
WHOは「効果的なワクチン管理」システムを実施しているが[122]、これには、ワクチン配布のための国・準国家の人員や施設を準備するための優先順位を構築することが含まれており、これには以下のようなものがある:
- 時間や温度に敏感なワクチンを扱うスタッフの育成
- ワクチンの保管と輸送を最適化するための堅牢なモニタリング機能
- 温度管理された設備・機器
- トレーサビリティ
- セキュリティ
個々の国内での効率的な取扱い、及び通関のための国境プロセスには、以下のものが含まれる[95][122]:
- 離陸と着陸の許可を容易にする
- 航空乗務員の検疫要件の免除
- 効率的な国内展開のための柔軟な運用の促進
- ワクチン温度要件を維持するための着陸優先権の付与
賠償責任
2020年2月4日、アレックス・アザー米保健福祉長官は、COVID-19に対する医療対策のための「公共の準備と緊急事態への備えに関する法律(Public Readiness and Emergency Preparedness Act)」に基づく通知を公表した。対象を「COVID-19、またはSARS-CoV-2またはその変異ウイルスの感染を治療、診断、治癒、予防または軽減するために使用される任意のワクチン」とし、宣言は、「ワクチンの作成における製造業者の過失、または誤った投与量を処方した医療提供者の過失を主張する賠償請求は、故意の不法行為がない限り、除外される」としている[123] 。この宣言は米国では2024年10月1日まで有効である。
誤った情報
SNSでは、COVID-19ワクチンがすでに利用可能であるという陰謀論を推進している。様々なSNSの投稿で引用された特許には、SARSコロナウイルスなどの他の株の遺伝子配列やワクチンに関する既存の特許が参照されているが、COVID-19については参照されていない[124][125]。
2020年5月21日、「nCoV19 spike protein vaccine」と称するワクチンを販売していた、シアトルに本拠を置くNorth Coast Biologics社に、FDAは、中止通知を送ったことを公表した[126]。
脚注
注釈
出典
- ^ a b c Diamond, Michael S; Pierson, Theodore C (2020-05-13). “The challenges of vaccine development against a new virus during a pandemic”. Cell Host and Microbe 27 (5): 699–703. doi:10.1016/j.chom.2020.04.021. PMC 7219397. PMID 32407708.
- ^ a b c d e f g h i j Le, Tung Thanh; Cramer, Jakob P.; Chen, Robert; Mayhew, Stephen (2020-09-04). “Evolution of the COVID-19 vaccine development landscape”. Nature Reviews Drug Discovery 19 (10): 667–68. doi:10.1038/d41573-020-00151-8. ISSN 1474-1776. PMID 32887942.
- ^ a b c d e “COVID-19 vaccine development pipeline (Refresh URL to update)”. Vaccine Centre, London School of Hygiene and Tropical Medicine (2020年11月30日). 2020年12月2日閲覧。
- ^ a b c “COVID-19 vaccine tracker (Choose vaccines tab, apply filters to view select data)”. Milken Institute (2020年11月16日). 2020年11月9日閲覧。
- ^ a b c “Draft landscape of COVID 19 candidate vaccines”. World Health Organization (2020年11月12日). 2020年11月16日閲覧。
- ^ a b c d e f g h i Gates (2020年4月30日). “The vaccine race explained: What you need to know about the COVID-19 vaccine”. The Gates Notes. 2020年5月14日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。
- ^ “CEPI welcomes UK Government's funding and highlights need for $2 billion to develop a vaccine against COVID-19”. Coalition for Epidemic Preparedness Innovations, Oslo, Norway (2020年3月6日). 2020年3月22日時点のオリジナルよりアーカイブ。2020年3月23日閲覧。
- ^ a b c d Wake (2020年5月4日). “EU spearheads $8 billion virus fundraiser”. Yahoo Finance. 2020年6月29日時点のオリジナルよりアーカイブ。2020年5月4日閲覧。
- ^ a b c “Update on WHO Solidarity Trial – Accelerating a safe and effective COVID-19 vaccine”. World Health Organization (2020年4月27日). 2020年4月30日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。 “It is vital that we evaluate as many vaccines as possible as we cannot predict how many will turn out to be viable. To increase the chances of success (given the high level of attrition during vaccine development), we must test all candidate vaccines until they fail. [The] WHO is working to ensure that all of them have the chance of being tested at the initial stage of development. The results for the efficacy of each vaccine are expected within three to six months and this evidence, combined with data on safety, will inform decisions about whether it can be used on a wider scale.”
- ^ a b c “UK medicines regulator gives approval for first UK COVID-19 vaccine”. Medicines and Healthcare Products Regulatory Agency, Government of the UK (2020年12月2日). 2020年12月2日閲覧。
- ^ “Bahrain second in the world to approve the Pfizer/BioNTech Covid-19 vaccine”. Bahrain News Agency. (2020年12月4日) 2020年12月9日閲覧。
- ^ a b “Regulatory Decision Summary - Pfizer-BioNTech COVID-19 Vaccine”. Health Canada, Government of Canada (2020年12月9日). 2020年12月9日閲覧。
- ^ “Drug and vaccine authorizations for COVID-19: List of applications received”. Health Canada, Government of Canada (2020年12月9日). 2020年12月9日閲覧。
- ^ Zimmer, Carl; Corum, Jonathan; Wee, Sui-Lee (2020年6月10日). “Coronavirus Vaccine Tracker” (英語). The New York Times. ISSN 0362-4331 2020年12月10日閲覧。
- ^ “Severe acute respiratory syndrome vaccine development: experiences of vaccination against avian infectious bronchitis coronavirus”. Avian Pathology 32 (6): 567–82. (December 2003). doi:10.1080/03079450310001621198. PMC 7154303. PMID 14676007.
- ^ “Effects of a SARS-associated coronavirus vaccine in monkeys”. Lancet 362 (9399): 1895–96. (December 2003). doi:10.1016/S0140-6736(03)14962-8. PMC 7112457. PMID 14667748.
- ^ “Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice”. Vaccine 32 (45): 5975–82. (October 2014). doi:10.1016/j.vaccine.2014.08.058. PMC 7115510. PMID 25192975.
- ^ “Development and characterization of a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody that provides effective immunoprophylaxis in mice”. The Journal of Infectious Diseases 191 (4): 507–14. (February 2005). doi:10.1086/427242. PMC 7110081. PMID 15655773.
- ^ “Monoclonal antibodies to SARS-associated coronavirus (SARS-CoV): identification of neutralizing and antibodies reactive to S, N, M and E viral proteins”. Journal of Virological Methods 128 (1–2): 21–28. (September 2005). doi:10.1016/j.jviromet.2005.03.021. PMC 7112802. PMID 15885812.
- ^ “Therapy with a severe acute respiratory syndrome-associated coronavirus-neutralizing human monoclonal antibody reduces disease severity and viral burden in golden Syrian hamsters”. The Journal of Infectious Diseases 193 (5): 685–92. (March 2006). doi:10.1086/500143. PMC 7109703. PMID 16453264.
- ^ a b “Development of SARS vaccines and therapeutics is still needed”. Future Virology 8 (1): 1–2. (January 2013). doi:10.2217/fvl.12.126. PMC 7079997. PMID 32201503.
- ^ “SARS (severe acute respiratory syndrome)”. National Health Service (2020年3月5日). 2020年3月9日時点のオリジナルよりアーカイブ。2020年1月31日閲覧。
- ^ Shehata, Mahmoud M.; Gomaa, Mokhtar R.; Ali, Mohamed A.; Kayali, Ghazi (20 January 2016). “Middle East respiratory syndrome coronavirus: a comprehensive review”. Frontiers of Medicine 10 (2): 120–36. doi:10.1007/s11684-016-0430-6. PMC 7089261. PMID 26791756.
- ^ “SARS veterans tackle coronavirus”. Nature 490 (7418): 20. (October 2012). Bibcode: 2012Natur.490...20B. doi:10.1038/490020a. PMID 23038444.
- ^ “Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial”. The Lancet. Infectious Diseases 19 (9): 1013–22. (September 2019). doi:10.1016/S1473-3099(19)30266-X. PMC 7185789. PMID 31351922.
- ^ “Recent Advances in the Vaccine Development Against Middle East Respiratory Syndrome-Coronavirus”. Frontiers in Microbiology 10: 1781. (2019). doi:10.3389/fmicb.2019.01781. PMC 6688523. PMID 31428074.
- ^ “World Health Organization timeline – COVID-19”. World Health Organization (2020年4月27日). 2020年4月29日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。
- ^ a b c d Thanh Le, Tung; Andreadakis, Zacharias; Kumar, Arun; Gómez Román, Raúl; Tollefsen, Stig; Saville, Melanie; Mayhew, Stephen (9 April 2020). “The COVID-19 vaccine development landscape”. Nature Reviews Drug Discovery 19 (5): 305–06. doi:10.1038/d41573-020-00073-5. ISSN 1474-1776. PMID 32273591.
- ^ “Responding to Covid-19: A once-in-a-century pandemic?”. The New England Journal of Medicine 382 (18): 1677–79. (February 2020). doi:10.1056/nejmp2003762. PMID 32109012.
- ^ “Covid-19: Navigating the uncharted”. The New England Journal of Medicine 382 (13): 1268–69. (March 2020). doi:10.1056/nejme2002387. PMC 7121221. PMID 32109011.
- ^ Grenfell (2020年2月14日). “Here's why the WHO says a coronavirus vaccine is 18 months away”. Business Insider. 2020年11月11日閲覧。
- ^ a b “Ensuring global access to COVID‑19 vaccines”. Lancet 395 (10234): 1405–06. (May 2020). doi:10.1016/S0140-6736(20)30763-7. PMC 7271264. PMID 32243778.
- ^ a b “Landmark global collaboration launched to defeat COVID-19 pandemic”. CEPI (2020年4月24日). 2020年5月2日時点のオリジナルよりアーカイブ。2020年5月2日閲覧。 “The global nature of a pandemic means that any vaccine or medicine that is successfully developed will be needed immediately all over the world. That means that the challenge we face is not only one of R&D but one of manufacturing at scale, and equitable access.”
- ^ Schmidt, Charles (2020年6月1日). “Genetic Engineering Could Make a COVID-19 Vaccine in Months Rather Than Years”. Scientific American. オリジナルの2020年10月11日時点におけるアーカイブ。 2020年8月26日閲覧。
- ^ Fox, Chris; Kelion, Leo (2020年7月16日). “Russian spies 'target coronavirus vaccine'”. BBC News Online. オリジナルの2020年10月11日時点におけるアーカイブ。 2020年8月1日閲覧。
- ^ a b “The Access to COVID-19 Tools (ACT) Accelerator”. World Health Organization (2020年). 2020年9月25日時点のオリジナルよりアーカイブ。2020年8月29日閲覧。
- ^ a b c d e f “COVAX: Ensuring global equitable access to COVID-19 vaccines”. GAVI (2020年). 2020年9月25日時点のオリジナルよりアーカイブ。2020年8月28日閲覧。
- ^ “More than 150 countries engaged in COVID-19 vaccine global access facility”. World Health Organization (2020年7月15日). 2020年7月15日時点のオリジナルよりアーカイブ。2020年7月25日閲覧。 “COVAX is the only truly global solution to the COVID-19 pandemic. For the vast majority of countries, whether they can afford to pay for their own doses or require assistance, it means receiving a guaranteed share of doses and avoiding being pushed to the back of the queue, as we saw during the H1N1 pandemic a decade ago. Even for those countries that are able to secure their own agreements with vaccine manufacturers, this mechanism represents, through its world-leading portfolio of vaccine candidates, a means of reducing the risks associated with individual candidates failing to show efficacy or gain licensure.”
- ^ Steenhuysen, Julie; Eisler, Peter; Martell, Allison; Nebehay, Stephanie (2020年4月27日). “Special Report: Countries, companies risk billions in race for coronavirus vaccine”. Reuters. オリジナルの2020年5月15日時点におけるアーカイブ。 2020年5月2日閲覧。
- ^ Sanger, David E.; Kirkpatrick, David D.; Zimmer, Carl; Thomas, Katie; Wee, Sui-Lee (2020年5月2日). “With Pressure Growing, Global Race for a Vaccine Intensifies”. The New York Times. ISSN 0362-4331. オリジナルの2020年5月11日時点におけるアーカイブ。 2020年5月2日閲覧。
- ^ Hamilton, Isobel Asher (2020年5月1日). “Bill Gates thinks there are 8 to 10 promising coronavirus vaccine candidates and one could be ready in as little as 9 months”. Business Insider. オリジナルの2020年5月16日時点におけるアーカイブ。 2020年5月2日閲覧。
- ^ “Global Vaccine Summit 2020: World leaders make historic commitments to provide equal access to vaccines for all”. Global Alliance for Vaccines and Immunisation (2020年6月4日). 2020年6月6日時点のオリジナルよりアーカイブ。2020年6月4日閲覧。
- ^ "Bill & Melinda Gates Foundation pledges US$1.6 billion to Gavi, the Vaccine Alliance, to protect the next generation with lifesaving vaccines" (Press release). The Bill & Melinda Gates Foundation. 4 June 2020. 2020年6月4日時点のオリジナルよりアーカイブ。2020年6月4日閲覧。
- ^ “Vaccine Safety – Vaccines”. vaccines.gov. US Department of Health and Human Services. 2020年4月22日時点のオリジナルよりアーカイブ。2020年4月13日閲覧。
- ^ “The drug development process”. U.S. Food and Drug Administration (FDA) (2018年1月4日). 2020年2月22日時点のオリジナルよりアーカイブ。2020年4月12日閲覧。
- ^ Cohen, Jon (2020-06-19). “Pandemic vaccines are about to face the real test”. Science 368 (6497): 1295–96. Bibcode: 2020Sci...368.1295C. doi:10.1126/science.368.6497.1295. PMID 32554572.
- ^ “How flu vaccine effectiveness and efficacy are measured”. Centers for Disease Control and Prevention, National Center for Immunization and Respiratory Diseases, US Department of Health and Human Services (2016年1月29日). 2020年5月7日時点のオリジナルよりアーカイブ。2020年5月6日閲覧。
- ^ “Principles of epidemiology, Section 8: Concepts of disease occurrence”. Centers for Disease Control and Prevention, Center for Surveillance, Epidemiology, and Laboratory Services, US Department of Health and Human Services (2012年5月18日). 2020年4月6日時点のオリジナルよりアーカイブ。2020年5月6日閲覧。
- ^ “Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults”. ClinicalTrials.gov. United States National Library of Medicine (2020年4月30日). 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ “A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults”. EU Clinical Trials Register. European Union (2020年4月14日). 2020年4月22日時点のオリジナルよりアーカイブ。2020年4月22日閲覧。
- ^ “Bahrain becomes second country to approve Pfizer COVID-19 vaccine”. Al Jazeera. 2020年12月5日閲覧。
- ^ O'Neill, Natalie (2020年11月20日). “Pfizer applies for emergency FDA approval of COVID-19 vaccine” (英語). New York Post. 2020年11月22日閲覧。
- ^ “Pfizer-BioNTech apply for EU emergency authorization for COVID-19 vaccine”. www.msn.com. 2020年12月1日閲覧。
- ^ “Bahrain becomes second country to approve Pfizer COVID-19 vaccine”. Al Jazeera. 2020年12月5日閲覧。
- ^ MacCharles, Tonda (2020年12月3日). “Health Canada could approve COVID-19 vaccine within a week” (英語). The Star. 2020年12月7日閲覧。)
- ^ Walsh, Nick; Shelley, Jo; Duwe, Eduardo; Bonnett, William (2020年7月27日). “The world's hopes for a coronavirus vaccine may run in these health care workers' veins”. CNN (São Paulo). オリジナルの2020年8月3日時点におけるアーカイブ。 2020年8月3日閲覧。
- ^ “Investigating a Vaccine Against COVID-19”. ClinicalTrials.gov. United States National Library of Medicine (2020年5月26日). 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ “A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19”. EU Clinical Trials Register. European Union (2020年4月21日). 2020年10月5日時点のオリジナルよりアーカイブ。2020年8月3日閲覧。
- ^ O'Reilly, Peter (26 May 2020). A Phase III study to investigate a vaccine against COVID-19. doi:10.1186/ISRCTN89951424. ISRCTN89951424.
- ^ “Clinical Trial of Recombinant Novel Coronavirus Vaccine (Adenovirus Type 5 Vector) Against COVID-19”. ClinicalTrials.gov. United States National Library of Medicine (2020年11月13日). 2020年11月17日閲覧。
- ^ “The National Research Council of Canada and CanSino Biologics Inc. announce collaboration to advance vaccine against COVID-19”. National Research Council, Government of Canada (2020年5月12日). 2020年5月22日時点のオリジナルよりアーカイブ。2020年5月22日閲覧。
- ^ Chen, Wei; Al Kaabi, Nawal (18 July 2020). “A Phase III clinical trial for inactivated novel coronavirus pneumonia (COVID-19) vaccine (Vero cells)”. Chinese Clinical Trial Registry 2020年8月15日閲覧。.
- ^ “China Sinopharm's COVID-19 vaccine taken by about 1 million people in emergency use” (英語). CNA. 2020年11月22日閲覧。
- ^ “Coronavirus: Bahrain allows Sinopharm vaccine candidate use in frontline workers” (英語). Al Arabiya English (2020年11月3日). 2020年11月22日閲覧。
- ^ “Coronavirus: UAE authorises emergency use of vaccine for frontline workers” (英語). The National. 2020年11月24日閲覧。
- ^ “Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu)”. ClinicalTrials.gov. United States National Library of Medicine (2020年5月12日). 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ “Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV)”. ClinicalTrials.gov. United States National Library of Medicine (2020年7月2日). 2020年10月11日時点のオリジナルよりアーカイブ。2020年8月3日閲覧。
- ^ PT. Bio Farma (10 August 2020). “A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia”. Registri Penyakit Indonesia 2020年8月15日閲覧。.
- ^ Huizhong Wu (2020年12月6日). “China prepares large-scale rollout of domestically-produced coronavirus vaccines” (英語). The Globe and Mail 2020年12月7日閲覧。
- ^ “The Russian vaccine for COVID-19”. The Lancet. Respiratory Medicine 8 (11): e85-e86. (November 2020). doi:10.1016/S2213-2600(20)30402-1. PMID 32896274.
- ^ “A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19”. ClinicalTrials.gov. United States National Library of Medicine (2020年7月14日). 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月27日閲覧。
- ^ Palca, Joe (2020年7月27日). “COVID-19 vaccine candidate heads to widespread testing in U.S.”. NPR. オリジナルの2020年10月11日時点におけるアーカイブ。 2020年7月27日閲覧。
- ^ Jr, Berkeley Lovelace (2020年11月30日). “Moderna says new data shows Covid vaccine is more than 94% effective, plans to ask FDA for emergency clearance later Monday” (英語). CNBC. 2020年11月30日閲覧。
- ^ Kitching, Chris (2020年12月1日). “Moderna coronavirus vaccine could get UK approval within two weeks, says expert” (英語). mirror. 2020年12月1日閲覧。
- ^ “A Study of Ad26.COV2.S in Adults”. ClinicalTrials.gov, US National Library of Medicine (2020年8月4日). 2020年9月16日時点のオリジナルよりアーカイブ。2020年8月23日閲覧。
- ^ Sadoff J, Le Gars M, Shukarev G, Heerwegh D, Truyers C, de Groot AM, Stoop J, Tete S, Van Damme W, Leroux-Roels I, Berghmans P (25 September 2020). Safety and immunogenicity of the Ad26.COV2.S COVID-19 vaccine candidate: interim results of a phase 1/2a, double-blind, randomized, placebo-controlled trial. doi:10.1101/2020.09.23.20199604. S2CID 221882008. 2020年11月1日時点のオリジナルよりアーカイブ。2020年9月27日閲覧。
- ^ “A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants”. ClinicalTrials.gov. US National Library of Medicine. 2020年9月26日時点のオリジナルよりアーカイブ。2020年12月8日閲覧。
- ^ “Evaluation of the Safety and Immunogenicity of a SARS-CoV-2 rS (COVID-19) Nanoparticle Vaccine With/Without Matrix-M Adjuvant”. ClinicalTrials.gov. United States National Library of Medicine (2020年4月30日). 2020年7月14日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ “Phase I Clinical Study of Recombinant Novel Coronavirus Vaccine”. ClinicalTrials.gov. United States National Library of Medicine (2020年6月24日). 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ “GSK, Medicago launch phase 2/3 clinical trials of plant-derived COVID-19 vaccine” (英語). PMLive (2020年11月13日). 2020年11月16日閲覧。
- ^ “Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers”. ClinicalTrials.gov. United States National Library of Medicine (2020年4月7日). 2020年10月11日時点のオリジナルよりアーカイブ。2020年7月14日閲覧。
- ^ “IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO's COVID-19 DNA vaccine in South Korea”. International Vaccine Institute (2020年4月16日). 2020年4月23日閲覧。
- ^ a b “Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona)”. ClinicalTrials.gov. United States National Library of Medicine (2020年9月22日). 2020年11月16日閲覧。
- ^ a b c d e “How the massive plan to deliver the COVID-19 vaccine could make history – and leverage blockchain like never before”. World Economic Forum (2020年7月17日). 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月16日閲覧。
- ^ a b c d e f g Callaway, Ewen (27 August 2020). “The unequal scramble for coronavirus vaccines – by the numbers”. Nature 584 (7822): 506–07. Bibcode: 2020Natur.584..506C. doi:10.1038/d41586-020-02450-x. PMID 32839593.
- ^ a b c d e f Brendan Murray and Riley Griffin (2020年7月24日). “The world's supply chain isn't ready for a Covid-19 vaccine”. Bloomberg World. オリジナルの2020年8月28日時点におけるアーカイブ。 2020年9月13日閲覧。
- ^ a b c d Kominers, Scott Duke; Tabarrok, Alex (2020年8月18日). “Vaccines use bizarre stuff. We need a supply chain now”. Bloomberg Business. オリジナルの2020年8月29日時点におけるアーカイブ。 2020年9月13日閲覧。
- ^ a b “The time to prepare for COVID-19 vaccine transport is now”. UNICEF (2020年9月10日). 2020年9月13日時点のオリジナルよりアーカイブ。2020年9月13日閲覧。
- ^ a b Desai, Devika (2020年9月10日). “Transporting one single dose of COVID-19 vaccine could take up to 8,000 jumbo planes, says aviation body”. National Post 2020年9月13日閲覧. "The IATA estimated that 8,000 747 cargo planes, at minimum, would be needed to transport a single dose of the vaccine worldwide, but more equipment could be required as administering the vaccine might mean several doses. Vaccines would also have to be stored at a temperature range between two and eight degrees Celsius, which could rule out the use of some types of planes."
- ^ a b c d Quelch, Rich (2020年8月14日). “COVID-19 vaccine delivery – overcoming the supply chain challenges”. PharmiWeb.com. 2020年9月13日閲覧。 “Delivering a new vaccine for COVID-19 worldwide will be one of the greatest challenges faced by modern pharma. The difficulties are intensified by pre-existing shortcomings in the supply chain.”
- ^ Seidman, Gabriel; Atun, Rifat (2017). “Do changes to supply chains and procurement processes yield cost savings and improve availability of pharmaceuticals, vaccines or health products? A systematic review of evidence from low-income and middle-income countries”. BMJ Global Health 2 (2): e000243. doi:10.1136/bmjgh-2016-000243. ISSN 2059-7908. PMC 5435270. PMID 28589028.
- ^ a b “172 countries and multiple candidate vaccines engaged in COVID-19 Vaccine Global Access Facility”. GAVI (2020年9月4日). 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月15日閲覧。
- ^ a b c d “UNICEF to lead procurement and supply of COVID-19 vaccines in world's largest and fastest ever operation of its kind”. UNICEF (2020年9月4日). 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月15日閲覧。
- ^ “UNICEF to lead supply chain for COVID-19 vaccine”. Manufacturing (2020年9月4日). 2020年11月1日時点のオリジナルよりアーカイブ。2020年9月13日閲覧。
- ^ a b Hessel, Luc (2009). “Pandemic influenza vaccines: meeting the supply, distribution and deployment challenges”. Influenza and Other Respiratory Viruses 3 (4): 165–70. doi:10.1111/j.1750-2659.2009.00085.x. ISSN 1750-2640. PMC 4634681. PMID 19627373.
- ^ a b “Vaccine management and logistics support”. World Health Organization (2020年). 2020年9月13日時点のオリジナルよりアーカイブ。2020年9月14日閲覧。
- ^ Jarrett, Stephen; Yang, Lingjiang; Pagliusi, Sonia (2020-06-09). “Roadmap for strengthening the vaccine supply chain in emerging countries: Manufacturers' perspectives”. Vaccine X 5: 100068. doi:10.1016/j.jvacx.2020.100068. ISSN 2590-1362. PMC 7394771. PMID 32775997.
- ^ a b Lloyd, John; Cheyne, James (2017). “The origins of the vaccine cold chain and a glimpse of the future”. Vaccine 35 (17): 2115–20. doi:10.1016/j.vaccine.2016.11.097. ISSN 0264-410X. PMID 28364918.
- ^ a b c d “How can we make enough vaccine for 2 billion people?”. World Economic Forum (2020年8月25日). 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月16日閲覧。
- ^ “Coronavirus vaccine pre-orders worldwide top 5 billion”. The Japan Times. (2020年8月12日). オリジナルの2020年9月20日時点におけるアーカイブ。 2020年9月13日閲覧。
- ^ C, Hannah (2020年10月10日). “China Commits to Producing 600 Million Vaccine Doses by the End of 2020”. Science Times. 2020年10月10日時点のオリジナルよりアーカイブ。2020年10月10日閲覧。
- ^ Staff, Reuters (2020年10月20日). “Sinopharm says may be able to make over 1 billion coronavirus vaccine doses in 2021” (英語). Reuters 2020年12月7日閲覧。
- ^ Staff, Reuters (2020年12月7日). “Sinovac secures $515 million to boost COVID-19 vaccine production” (英語). Reuters 2020年12月7日閲覧。
- ^ “Vaccine makers turn to microchip tech to beat glass shortages”. Wired (2020年6月26日). 2020年9月16日時点のオリジナルよりアーカイブ。2020年9月17日閲覧。
- ^ Burger, Ludwig; Blamont, Matthias (2020年6月11日). “Bottlenecks? Glass vial makers prepare for COVID-19 vaccine”. Reuters. オリジナルの2020年9月29日時点におけるアーカイブ。 2020年9月17日閲覧。
- ^ a b “3 applications for RFID in the fight against COVID-19”. Supply Chain Dive (2020年7月7日). 2020年10月2日時点のオリジナルよりアーカイブ。2020年9月17日閲覧。
- ^ Kristin Brooks (2020年11月3日). “Ramping Up COVID-19 Vaccine Fill and Finish Capacity”. Contract Pharma. 2020年11月25日閲覧。
- ^ a b c “Swiss factory rushes to prepare for Moderna Covid-19 vaccine”. SwissInfo (2020年10月7日). 2020年11月1日閲覧。
- ^ a b c Kartoglu, Umit; Milstien, Julie (2014-05-28). “Tools and approaches to ensure quality of vaccines throughout the cold chain”. Expert Review of Vaccines 13 (7): 843–54. doi:10.1586/14760584.2014.923761. ISSN 1476-0584. PMC 4743593. PMID 24865112.
- ^ Hanson, Celina M.; George, Anupa M.; Sawadogo, Adama; Schreiber, Benjamin (2017-04-19). “Is freezing in the vaccine cold chain an ongoing issue? A literature review”. Vaccine 35 (17): 2127–33. doi:10.1016/j.vaccine.2016.09.070. ISSN 0264-410X. PMID 28364920.
- ^ “There are clear frontrunners in the COVID-19 vaccine race — but getting it to a clinic is a challenge in itself”. Australian Broadcasting Corporation (2020年10月24日). 2020年11月15日閲覧。
- ^ “CoronaVac: Doses will come from China on nine flights and can...” (アラビア語). AlKhaleej Today (2020年11月1日). 2020年11月15日閲覧。
- ^ “Pfizer, Moderna's coronavirus shot rollouts could freeze up, experts say, citing cold-storage needs”. FiercePharma, Questex LLC (2020年8月28日). 2020年11月11日閲覧。
- ^ O'Donnell, Carl (2020年11月9日). “Why Pfizer's ultra-cold COVID-19 vaccine will not be at the local pharmacy any time soon”. Reuters 2020年11月11日閲覧。
- ^ a b Weise, Elizabeth (2020年9月6日). “'Mind-bogglingly complex': Here's what we know about how COVID-19 vaccine will be distributed when it's approved”. USA Today. オリジナルの2020年9月12日時点におけるアーカイブ。 2020年9月13日閲覧。
- ^ “The extra mile: preparing a supply chain for a COVID-19 vaccine”. European Pharmaceutical Review (2020年6月29日). 2020年9月11日時点のオリジナルよりアーカイブ。2020年9月13日閲覧。
- ^ a b c d “The time to prepare for COVID-19 vaccine transport is now”. International Air Transport Association (2020年9月9日). 2020年9月12日時点のオリジナルよりアーカイブ。2020年9月13日閲覧。
- ^ a b “COVID-19-related trafficking of medical products as a threat to public health”. United Nations Office on Drugs and Crime (2020年). 2020年9月19日時点のオリジナルよりアーカイブ。2020年9月16日閲覧。
- ^ Kohler, Jillian Clare; Dimancesco, Deirdre (2020-02-03). “The risk of corruption in public pharmaceutical procurement: how anti-corruption, transparency and accountability measures may reduce this risk”. Global Health Action 13 (sup1): 1694745. doi:10.1080/16549716.2019.1694745. ISSN 1654-9716. PMC 7170361. PMID 32194011.
- ^ Subramanian, Samanth (2020年8月13日). “Biometric tracking can ensure billions have immunity against Covid-19”. Bloomberg Businessweek. オリジナルの2020年9月16日時点におけるアーカイブ。 2020年9月16日閲覧。
- ^ "INTERPOL warns of organized crime threat to COVID-19 vaccines". Interpol (Orange Notice). Retrieved December 10 2020.
- ^ a b “Effective Vaccine Management (EVM) Initiative:Vaccine Management Handbook”. World Health Organization (2020年9月9日). 2018年10月5日時点のオリジナルよりアーカイブ。2020年9月16日閲覧。
- ^ Azar, Alex (2020年2月4日). “Notice of Declaration under the Public Readiness and Emergency Preparedness Act for medical countermeasures against COVID-19”. 2020年4月25日時点のオリジナルよりアーカイブ。2020年4月22日閲覧。
- ^ Kertscher, Tom (2020年1月23日). “No, there is no vaccine for the Wuhan coronavirus”. PolitiFact. Poynter Institute. 2020年2月7日時点のオリジナルよりアーカイブ。2020年2月7日閲覧。
- ^ McDonald, Jessica (2020年1月24日). “Social Media Posts Spread Bogus Coronavirus Conspiracy Theory”. FactCheck.org. Annenberg Public Policy Center. 2020年2月6日時点のオリジナルよりアーカイブ。2020年2月8日閲覧。
- ^ “Warning Letter – North Coast Biologics – MARCS-CMS 607532”. U.S. Food and Drug Administration (FDA) (2020年5月21日). 2020年5月26日時点のオリジナルよりアーカイブ。2020年5月23日閲覧。
関連項目
外部リンク
警告: 既定のソートキー「COVID-19 わくちん」が、その前に書かれている既定のソートキー「COVID-19わくちん」を上書きしています。
