ケトジェニック・ダイエット
ケトジェニック・ダイエット(英語: The Ketogenic Diet)とは、ケトン体濃度を持続的に増加させ、ケトーシス(Ketosis)への誘導を目的に、十分な量のタンパク質と、大量の脂肪を摂取し、炭水化物を可能な限り避ける食事療法の一種である。「ケトン食」「ケトン生成食」「ケトン誘発食」「ケトジェニック食」「ケトン・ダイエット」「ケトン食療法」「ケトジェニック療法」とも呼ばれる。ハーバード大学医学部は、ケトン食は不健康[1]で重大なリスクがあると警告している[2]。
概要
[編集]元々は、アメリカ合衆国ミネソタ州ロチェスター市にあるメイヨー・クリニックの医師、ラッセル・モース・ワイルダー(Russell Morse Wilder, 1885~1959)が癲癇(てんかん)を治療する目的で1920年代前半に開発した食事法である[3][4]。
この食事法の潜在的副作用としては、栄養不足、気分不良[2]、便秘、成長の遅延、高コレステロール血症、腎臓結石がある[5]。
砂糖、甘い果物全般、デンプンが豊富なもの全般を避け、各種ナッツ、生クリーム、バターの摂取を増やす[6]。食べ物に含まれる脂肪分は、「長鎖中性脂肪」(Long-Chain Triglycerides, LCT)と呼ばれる分子で構成されるが、このLCTよりも短い炭素鎖からなる「中鎖中性脂肪」(Medium-Chain Triglycerides, MCT)は、ケトン体の産生量を増やすため、MCTが豊富なココナッツオイルを摂取する場合もある。脂肪の摂取比率を減らし、タンパク質の摂取を増やすケトン食もある[7][8]。小児癲癇用のケトン食では、年齢と身長を考慮し、身体の成長と修復に必要な量のタンパク質を摂取する。
ラッセル・ワイルダーが開発したケトン食における栄養素の構成比率は、「脂肪(4):タンパク質と炭水化物(1)」である。脂肪分が90%、タンパク質が6%で、炭水化物の摂取は可能な限り避ける[9]。
ハリウッドの映画プロデューサー、ジム・エイブラハムズ(Jim Abrahams)の息子のチャーリーは重度の癲癇を患っていたが、この食事を処方されたことで、その発作が劇的に改善された。これを受けて、エイブラハムズはケトジェニック療法を普及させるため、『チャーリー基金』(The Charlie Foundation)を設立した。NBCテレビによる番組への出演や、1997年に放映されたテレビ向け映画『First Do No Harm』(邦題:『誤診』)の製作も、この食事療法と基金の宣伝を兼ねていた。基金はこの食事療法の研究を支援し、その研究結果が発表されると、この食事療法への科学的な関心が新たに高まるようになった[6] 。
癲癇以外では、頭痛、身体的苦痛、筋萎縮性側索硬化症、自閉症、各種の癌[10]、パーキンソン病[11]、アルツハイマー病[12]、鬱病[13]、神経外傷、睡眠障害といった様々な病気や神経障害に対して、この食事療法がもたらす作用や効果についての研究が進んでいる[14]。しかし、小児の発作以外の神経疾患では、人体実験の証拠がないことが多い[15]。
癲癇治療
[編集]癲癇は、脳卒中のあとに惹き起こされる最も一般的な神経障害の1つであり[16]、世界中で約5000万人がこれを患っていると見られている[17]。症状の頻発が見られない人が診断される。皮質ニューロンが過剰に、かつ超同時的に発火し、正常な脳機能を一時的な混乱状態に追いやる。これは筋肉、感覚、意識、もしくは全身に影響を与える。発作は、限局性(脳の一部のみに限定される)であったり、脳全体に広がり、意識の喪失をもたらす場合もある。発作の形態については、「癲癇症候群」(Epileptic Syndromes)という分類があり、癲癇症状の発症は小児期に見られることが多い。抗癲癇薬を2つ以上使っても症状が抑制できない場合、不応性(refractory)と見なされる。癲癇患者の約60%は薬剤で症状を抑制できるが、残りは不可能である。
「薬が効かない」と判断された場合、選択肢として、癲癇手術(Epilepsy Surgery)、迷走神経刺激(Vagus Nerve Stimulation)、ケトジェニック療法が選ばれる[16]。
歴史
[編集]ケトジェニック療法は、空腹中の癲癇患者に対して実施される投薬や手術以外の治療法の1つとして開発された食事療法である。1920年代に開発されて以降、10年間はこれが処方され続けたが、抗癲癇薬が新たに出てくると、徐々に使われなくなった[6]。患者の多くは薬剤の投与で発作を抑制できるが、全患者のうちの20~30%は複数の薬剤を投与しても抑制できない[18]。
2つ以上の薬剤を服用しても症状が抑制できない患者、とくに子供の癲癇患者に対してはこのケトジェニック療法が効果を発揮し、癲癇治療の手段としてこの食事法が再評価された[6][19]。
断食・絶食療法
[編集]
古代ギリシアの時代、医師たちが実践していた病気の治療法は、「食事を変えること」であった。『ヒポクラーテス全集』(『The Hippocratic Corpus』)に収録されている学術論文『On the Sacred Disease』(『神聖不可侵な病』)では、紀元前5世紀における癲癇治療を取り上げている。ヒポクラーテスは癲癇に対して「食事療法こそが、治療の確たる基礎となる」という姿勢を取っており、「癲癇が発症するのは人知の及ばぬものであり、手に負えない病気である」とする当時の一般的な見解に異を唱えていた[20]。同書に収録されている『Epidemic』(『伝染病』) では、飲食を断つことにより、癲癇発作が発症したときと同じぐらいの早さで治った男性の事例を紹介している[21]。王室専属の医師で解剖学者のエラシストラートゥス(Ἐρασίστρατος)は、「癲癇の症状が現れた場合は何があろうと断食を行い、食事制限をしなさい」と明言した[22]。臨床医のガレノス(Γαληνός)は、「絶食[23]は、軽度の癲癇患者を治癒し、それ以外の病気に対しても有益であるかもしれない」と考えた[24]。
癲癇の治療手段としての絶食・断食についての研究は、1911年にフランスで行われている[25]。あらゆる年齢層の癲癇患者20人に対し、摂取エネルギーを低くした菜食、断食、そして、(下剤による)腸内の異物除去を組み合わせることで、「解毒」できたという。被験者のうちの2人には有益な効果が見られたが、課された制限を順守できた者はほとんどいなかった。臭化カリウムは被験者を悄然とさせたのに対し、食事療法は被験者の意思能力を改善させた[26]。
このころ、アメリカ合衆国における身体鍛錬の象徴的存在であったベルナール・マクファデン(Bernarr Macfadden)は、身体の健康のために断食を普及させた。マクファデンの教え子で、ミシガン州バトルクリーク在住のヒュー・ウィリアム・コンクリン(Hugh William Conklin)は、癲癇患者の治療に断食を取り入れ始めた。腸内のパイエル板(Peyer's Patches)から毒素が分泌され、それが血中に放出されたときに癲癇の発作が起こるのではないか、とコンクリンは推測した。この毒素を消滅させる目的で、コンクリンは患者に18~25日間の断食の継続を奨めた。コンクリンはかなりの数の癲癇患者を『水断食』(Water Diet)で治療した。子供の癲癇患者の90%はこれで治癒できたが、成人の患者では50%に下がった。その後、コンクリンによる患者の症例記録の分析では、患者の20%は発作から解放され、50%はいくらかの改善が見られた[19]。コンクリンが行っていた絶食療法は、開業した神経内科医に採用された。
1916年、T・E・マクマリー(T. E. McMurray)は、『ニューヨーク・メディカル・ジャーナル』(The New York Medical Journal)に、「1912年以降、断食療法で癲癇治療に成功し、その後はデンプンや砂糖を加えない食事を処方している」と記述している。1921年、内分泌学者のヘンリー・ロウル・ガイエレン(Henry Rawle Geyelin,1883~1942)は、アメリカ医師会(American Medical Association)が開催した定期学術集会に出席し、自身の経験を報告した。ガイエレンは、コンクリンによる癲癇治療の成功を目の当たりにしたことで、自身の患者36人で試した。短期間ではあったが、同様の結果になったという。1920年代に行われた更なる研究では、癲癇の発作は断食後に再発することがあるという。
コンクリンによる絶食療法で癲癇治療に成功した患者の1人で、ニューヨークの顧問弁護士、チャールズ・プレンティス・ハウランド(Charles Prentice Howland, 1869~1932)は、自身の弟、ジョン・エライアス・ハウランド(John Elias Howland. 1873~1926)に、『The Ketosis of Starvation』(『絶食状態におけるケトーシス』)を研究する資金として5000ドルを贈った。ジョンズ・ホプキンス病院(Johns Hopkins Hospital)の小児科の教授でもあったジョンは、兄から贈られた資金を、神経内科医のスタンリー・カブ(en:Stanley Cobb, 1887~1968)とその助手、ウィリアム・ゴードン・レノックス(en:William Gordon Lennox, 1884~1960)が行っていた研究のために提供した[19]。
ケトン食療法
[編集]1921年、医師のローリン・ターナー・ウディヤット(Rollin Turner Woodyatt, 1878~1953)は、食事と糖尿病に関する研究を行った。その研究で明らかになったのは、健康体の人間が、
- 絶食状態にある
- 極度の低糖質かつ高脂肪な食事を摂っている
このいずれかの状態にあるとき、肝臓が、「ケトン体」(Ketone Bodies)と総称される水溶性化合物(β-ヒドロキシ酪酸〈β-Hydroxybutyrate〉、アセト酢酸〈Acetoacetate〉、アセトン〈Acetone〉)の産生量を増やすということであった[19]。
メイヨー・クリニック(Mayo Clinic)の医師、ラッセル・モース・ワイルダー(Russell Morse Wilder, 1885~1959)は、ウディヤットによる研究を参考に、この食事法を「ケトン食」「ケトジェニック・ダイエット」(The Ketogenic Diet)と命名した。ワイルダーは、「炭水化物の摂取を抑え、大量の脂肪分を摂取することで血中のケトン体の濃度を上昇させるケトーシス状態に導く食事法だ」と説明した。ワイルダーは、絶食しているときと同じ効果が得られる食事療法が無いかどうかを模索していた。1921年、ワイルダーは少数の癲癇患者に対し、癲癇の治療手段としてケトン食を初めて処方した[19]。
ワイルダーの同僚で小児科医のマイニー・グスタフ・ピーターマン(Mynie Gustav Peterman, 1896~1971 )は、体重1kgにつき、1gのタンパク質、炭水化物の1日の摂取量を10~15gに抑え、残りの栄養素は全て脂肪から摂取する食事を処方した。1920年代のピーターマンによるケトン食の研究は、この食事法の導入とその維持手段を確立させた。この食事法を実践することによる好ましい効果(注意力・普段の振舞い・睡眠が改善された)と副作用(吐き気)の両方を記録した。この食事法は、とくに子供に対して非常に効果的であることが分かった。1925年、ピーターマンは、「若い患者37人にこの食事を処方したところ、95%の患者は発作の頻度が低下し、60%の患者は発作が見られなくなった」と報告した。

1930年までに、10代の青少年や成人に対するこの食事法の効果についての研究が行われた。メイヨー・クリニックの医師、クリフォード・ジョゼフ・バーボルカ(Clifford Joseph Barborka, 1894~1971)は、「高齢の患者の56%が、この食事法で健康状態が改善し、12%は発作が起こらなくなった」と報告した。バーボルカは、「成人はこの食事法で利益を得られる可能性がもっとも低い」と結論付け、成人患者に対するケトン食の処方の研究は、1999年まで行われなかった[19][27]。
抗癲癇薬の開発
[編集]1920年代から1930年代にかけて処方され続けてきたケトジェニック療法であるが、徐々に処方されなくなっていく。1857年に発見された鎮静性臭化物や、1912年に開発された抗癲癇薬のフェノバルビタール(Phenobarbital)の存在があった。1938年、神経内科医のH・ヒューストン・メリット(H. Houston Merritt, 1902~1979)と、トレイスィー・パトナム(Tracy Putnam, 1894~1975)の2人がフェニトインを開発すると、癲癇治療の研究の焦点は新薬の開発に移るようになった。1970年代にバルプロ酸ナトリウム(Sodium Valproate)が導入されると、神経内科医は、癲癇症候群および複数の癲癇発作に効果のある薬を利用・入手できるようになった。この時までに、ケトン食の処方は「レノックス・ガストー症候群」(Lennox–Gastaut Syndrome)のような難病の症例のみに限定されており、さらに処方されなくなった[19]。
中鎖中性脂肪
[編集]1960年代には、「中鎖中性脂肪」(Medium-Chain Triglyceride,MCT)には、多くの脂肪分に含まれる「長鎖中性脂肪」(Long-Chain Triglycerides, LCT)に比べてケトン体の産生量がエネルギー単位で多いことが判明した[28]。MCTは体内に効率良く吸収され、リンパ系(Lymphatic System)ではなく肝門脈系(Hepatic Portal System)を経由して肝臓に迅速に輸送されていく[29]。1971年、小児神経内科医のピーター・ホトゥンロハー(Peter Huttenlocher, 1931~2013)は、エネルギーの60%をMCTから摂取するケトン食を考案した。MCTオイルの2倍の量の脱脂粉乳と混ぜて冷やし、少しずつ飲んだり、食べ物に加える。子供と青少年12人にこのケトン食を試したところ、発作の抑制と注意力の改善の両方が見られ、本来のケトン食を処方したときに近い結果となった。患者の1人が消化管の不調を訴え、途中で食事を止めたが、それ以外の患者には受け入れられた[28]。MCTを組み込んだ食事療法は、多くの病院で本来のケトン食に代わって処方されたが、この2つを組み合わせた食事も考案された[19]。
効能
[編集]ケトン食を処方された患者の半数は、癲癇発作が発生する頻度が半減し、患者全体の三分の一は、9割の確率で発作の頻度が低下する[30]。
難治性癲癇を患っている小児の場合、抗癲癇薬よりもケトン食を処方するほうが恩恵を受けられる可能性は高くなる[6]。青少年や成人であっても、この食事による恩恵を得られる可能性があることを示す証拠もある[18]。
子供の四分の三は2週間以内に好反応を見せる。ケトン食の専門家は、「効果が無い」と決めてかかる前に、少なくとも3か月は続けることを推奨している[18]。
臨床試験
[編集]1925年初期に行われた臨床試験(Clinical Studies)では、患者の60%は発作が見られなくなり、別の患者群の35%は、発作の頻度が50%低下した。これらの試験は、一般には医師たちが行ってきた研究を遡及する形でコホート研究(Cohort Study)を行い、食事制限の順守に成功した患者を選択する。
しかしながら、これらの臨床試験は、現代で行われているものとの比較が困難である。
理由の1つには、過去に行われた実験や研究では、選択に偏重が生じていた点がある。食事制限を維持できなかった患者や食事療法自体が不可能であった患者を除外し、より良い結果が得られそうだと判断された患者が選ばれた。偏りが起こるのを防ぐため、治療を開始する前に研究対象となる患者を選び、治療が開始できたか、完了したかどうかに関係なく、全ての患者の治療結果を提示する追跡調査が選択されることが多い。これは『治療意図解析』(Intent-to-Treat Analysis)と呼ばれる[31]。
2つ目の理由としては、ケトジェニック療法を処方する患者の類型が、時間とともに変化してきている点にある。ラッセル・ワイルダーが開発し、処方したケトン食は、癲癇を治療するうえでの「最後の手段」というわけではなかった。現代における癲癇治療においては、数多くの抗癲癇薬を投与しては失敗に終わる、というのが繰り返されており、ケトジェニック療法を知らない者には「治療が困難な病気」と見做される場合もある。治療計画が変更されたことに伴い、研究も当時とは異なっている。古いやり方は、長期間に亘る断食であり、体重の5~10%を減らすものであった。子供の健康と身体の成長を懸念する形で、食事制限は緩和された[31]。水分制限も課せられたことがあるが、これは便秘や腎臓結石を起こしやすくなり、もはや有益であるとはみなされない[30]。
普及
[編集]ハリウッドの映画プロデューサー、ジム・エイブラハムズ(Jim Abrahams)は、息子のチャーリーが重度の癲癇を患い、苦しんでいたことに悩んでいた。息子の癲癇は、当時主流とされていた治療法でも代替治療でも治せなかった。癲癇の手引書の中にケトン食療法に関する記述があるのを発見したエイブラハムズは、チャーリーを連れて、ジョンズ・ホプキンス病院のジョン・マーク・フリーマン(John Mark Freeman, 1933~2014)のもとを訪れた。ケトン食療法により、チャーリーの癲癇発作は急速に抑制され、身体は再び成長し始めた。1994年、エイブラハムズは、この食事療法の普及と研究資金を集める目的で、『チャーリー基金』(The Charlie Foundation)を設立した[19]。未来を見据えた形でケトジェニック療法の研究が始まり、その研究結果は1996年にアメリカ癲癇学会(The American Epilepsy Society)で発表され、1998年に公表された[32]。
1994年10月、NBCによる番組に出演したジム・エイブラハムズが、息子チャーリーの癲癇発作の事例とケトジェニック療法について公表すると、ケトジェニック療法はアメリカ全土に知れ渡るようになり、この食事療法に対して科学的な関心が劇的に高まるようになった。1997年に制作・放映されたテレビ向け映画『First Do No Harm』(邦題:『誤診』)では、難治性の癲癇発作のある少年がケトジェニック療法で治っていく過程が描かれている[6]。2007年までに、ケトジェニック療法は45か国中75の医療施設で処方されるようになり、年長の子供や成人に対しては、ケトン食に類似する食事法である『修正アトキンス・ダイエット』(Modified Atkins Diet)も処方されるようになった。ケトジェニック療法は、癲癇以外の様々な病気に対する作用や可能性についても調査が行われるようになった[6]。
治療の成果
[編集]前向き(将来的に起こる事象を収集するという意味)に行われた治療意図の研究は、1998年にジョンズ・ホプキンス病院の研究チームが発表し[33]、2001年にはその追跡調査の研究結果についてまとめた報告書を公表している[34]。他のケトジェニック療法の研究に見られるように、比較対照群(治療を受けなかった患者)は用いなかった。この研究には、子供の患者150人を被験者として登録した。実験開始から3か月後、患者全体の83%はこの食事法を続け、26%は発作の良好な減少が、31%は非常に優れた形での発作の減少が確認され、3%は発作が無くなった。「発作の良好な減少」は、「発作を起こす頻度が50~90%以上に低下する」、「非常に優れた減少」は、「発作の頻度が90~99%以上に低下する」と定義されている。
実験開始から12か月後では、55%がこの食事法を続け、23%は良好な反応を、20%は非常に優れた反応を見せ、7%は発作が無くなった。この段階でこの食事法を中止した患者も出たが、それはこの食事法の効果が出なかったり、病気のためにこの食事法そのものを止めたためである。それ以外の患者の多くは、この食事療法による恩恵を得られた。実験開始から2年、3年、4年と経過した時点でもこの食事法を続けていた患者の割合は、それぞれ39%、20%、12%であった。実験期間中、この食事法の中止に至った理由でもっとも一般的なものは、「発作が治った」「症状が目に見えて改善された」が挙げられる。実験開始から4年目、患者150人のうち、16%は発作の良好な減少が、14%は非常に優れた減少が見られ、13%は発作が無くなった。これらの数字には、この食事療法を続行中の患者も含まれる。この期間を過ぎてもこの食事法を続けている患者の場合、発作が無くなったわけではないが、非常に優れた反応を示した[34][35]。
複数の小規模な研究の結果を組み合わせることで、個別の研究のみで得られる結果に比べて、より説得力のある証拠を生み出せるようになる。これはメタ解析と呼ばれる統計的手法である。2006年に行われた4つのメタ解析のうちの1つでは、患者数の合計が1084人にのぼる19の研究について調べたものがある[36]。このうちの3つ目のメタ解析研究では、「患者の発作の頻度は非常に優れた形で減少し、患者の半数は発作の良好な減少が見られた」と結論付けている[30]。
2018年にコクラン共同計画が行った論文研究では、薬剤では発作の抑制には至らなかった癲癇患者に対して処方されたケトジェニック療法のランダム化比較試験11件について分析している[37]。このうちの6件の試験では、ケトジェニック療法に割り当てられた群とそうでない群とを比較した。他の試験では、食事法を導入することでどこまで持ちこたえるかを比較した[37]。対照群を用いないケトン食療法を取り扱った最大規模の試験[29]においては、ケトン食に割り当てられなかった群6%と比べて、ケトン食に割り当てられた群の小児と若者の38%は、発作を起こす確率が半分以下に低下した。ケトン食と比較する目的で行われた修正アトキンス・ダイエットを取り入れた2件の大規模試験でも似たような結果が示され、50%以上の子供が、対照群10%と比べて発作を起こす確率が半分以下に低下した[37]。
2018年に行われた論文研究では、成人に処方したケトン食療法についての16の研究を精査しており、「ケトジェニック療法は、より一般的な治療法になりつつあり、子供にも大人にもほぼ同じ効果を発揮し、その副作用は比較的軽度である」と結論付けている。しかしながら、患者の多くは様々な理由でこの食事法を途中で中止し、その医学的根拠および臨床結果の質は、小児研究に比べて低くなっている傾向にある。健康上の問題については、低密度リポタンパク(Low-Density Lipoprotein)の上昇、総コレステロール値の上昇、体重減少がある[38]。
適応と禁忌
[編集]
ケトジェニック療法は、「薬剤の効き目が薄い」と判断された子供に対して処方されることがある[40][41]。スコットランド[41]、ウェールズおよびイングランド[40]において、ケトジェニック療法が国家規模で診療指針に組み込まれ、アメリカの保険会社においてはケトジェニック療法に保険が適用される[42]。(癲癇のきっかけとなる)脳内で発生する単一箇所での異常反応を示す限局性の障害持ちの子供の場合は手術を受ける必要がありそうだと判断され、その場合はケトン食の処方よりも手術を受けるほうが発作が消える可能性がある[18][43]。ケトン食を処方する癲癇施設のうち、約三分の一は、成人患者に対して食事療法を処方している。青少年や成人に対しては、血糖値の上昇の度合いが低いと判断された食べ物を出したり、修正アトキンス・ダイエットを処方するほうが適切だと考える臨床医もいる[18]。固形物ではなく、流動食にして処方するケトン食は、授乳中の乳児や経管栄養(Tube-Fed, 食べ物の経口摂取が不可能あるいは不十分な患者に対し、消化管内にチューブを通して流動食を投与する)を受けている子供にとっては容易に摂取可能であり、身体に負担はかからない[8][44]。薬剤の投与が効き目を発揮する可能性はわずか10%であり、食事療法による効能を確信する者たちはケトジェニック療法の実践を真剣に推奨している[18][45][46]。
特定の治療法が効く可能性がある癲癇症状や遺伝性疾患(Genetic Syndromes)に対してはケトン食療法の処方が検討される。これにはドラベ症候群(Dravet Syndrome, 乳幼児期に発症する癲癇症状である乳児痙攣〈Infantile Spasms〉、間代性筋痙攣(自分の意思とは一切関係なく発生する筋肉の急激な収縮)を伴う癲癇症状(Myoclonic Astatic Epilepsy)、結節性硬化症(Tuberous Sclerosis Complex)が挙げられる[18][47]。
2005年にアメリカの医師88人に対して行われた調査では、3つ以上の薬剤を投与しても効果が出ない場合は食事療法に切り替えるようにした医師は36%、最終手段として食事療法を処方した医師は24%、「まれに」食事療法を処方した医師は24%、食事療法をまったく処方しなかった医師は16%であったという。研究で得られた医学的根拠と実際の臨床診療の現場におけるこの乖離については、説明が可能な要因がある[48]。1つには、ケトジェニック療法を組み込んだ治療計画を実践するために十分な訓練を受けた栄養士が不足している点が挙げられる[45]。ケトジェニック療法は、身体の代謝を変化させる目的で処方される食事療法であり、ピルビン酸脱水素酵素(Pyruvate Dehydrogenase)とブドウ糖輸送体1の欠損症(Glucose Transporter 1 deficiency)[49]といった、一部の先天性の代謝性疾患を患っている小児患者に対しては真っ先に処方される重要な治療法である。身体は炭水化物ではなく、脂肪および脂肪を消費して合成するケトン体を常に燃料にする体質になる。ケトン食療法は、これらの疾患の発作や他の症状に治療に対しても非常に有益な効果をもたらす確かな治療法である[50]。
ただし、「ピルビン酸カルボキシ基転移酵素欠損症」(en:Pyruvate carboxylase deficiencyPyruvate Carboxylase Deficiency)、ポルフィリン症(Pophyria)、「脂質代謝における先天性の代謝異常」(en:Inborn errors of lipid metabolism)を患っている場合、ケトン食は決して処方してはならない[18]。脂肪酸の酸化の不全を惹き起こしている患者の体内では、炭水化物を脂肪に置き換えたところで脂肪代謝ができなくなっており、身体は貯蔵しておいたタンパク質を消費し、「ケトアシドーシス」(en:Ketoacidosis, 通常のケトーシスとは異なる代謝面での異常な状態)を発症して昏睡状態に陥り、死に至ることがある[51]。
相互作用
[編集]ケトジェニック療法は、抗癲癇薬による投薬療法との組み合わせで処方されるが、ケトン食の効果が表れた場合、薬剤投与は中止となる場合がある。迷走神経刺激装置か、ゾニサミドと併用した場合、相乗効果の発現が確認されているが、フェノバルビタールを投与された小児患者には、ケトン食の効果が薄れる可能性がある[30]。
副作用
[編集]ケトジェニック療法は、万能薬というわけではない。薬物療法と同様に、合併症を惹き起こす場合もある[42]が、抗癲癇薬による副作用や手術に伴う合併症に比べれば、そこまで重篤ではなく、頻度も少ない[42]。短期間でしばしば見られる副作用としては、便秘、軽度の酸血症(Acidosis)、絶食を開始して間もないころに起こる低血糖症(Hypoglycaemia)が挙げられる。血中の脂質の濃度の上昇は、子供の場合、60%が何らかの形で影響を受け、血中のコレステロール値は30%上昇する可能性がある[52]。変化が見られない場合、摂取する脂肪を飽和脂肪酸(Saturated Fats)から多価不飽和脂肪酸(Polynsaturated Fats)に変え、ケトン体の産生比率を下げることで治療できるようになる[52]。ビタミンやミネラルのような微量栄養素の不足が見られる場合は、それへの対処手段としてサプリメントの服用も許される[30]。
小児患者に対してかなりの長期間に亘ってケトン食を処方し続けていると、成長・発育不全、骨折、腎臓結石を惹き起こすリスクが増加し[30]、身体の成長に重要なホルモンとなるインスリン様成長因子1(Insulin-like Growth Factor 1)の濃度を低下させる場合もある。多くの抗癲癇薬と同様に、長期に亘るケトン食の処方は骨の健康に悪影響を及ぼす場合がある。軽度の酸血症の発現や成長ホルモンの抑制といった他の要因が絡む可能性がある[52]。
ケトン食の処方を受け続けている子供の約20人に1人は、腎臓結石を発症する可能性がある(一般人口では数千人に1人)。「炭酸脱水酵素阻害剤」(トピラマート、ゾニサミド、いずれも抗癲癇薬)として知られるこれらの薬剤の類は、腎臓結石を発症する危険を高めるが、ケトン食と組み合わせた場合、ケトン食のみを処方した場合に起こり得るリスクよりも低い場合がある[53]。だが腎臓結石は治療が可能な病気であり、腎臓結石を発症したからといってケトン食をすぐに中止すべき根拠にはならない[53]。ジョンズ・ホプキンス病院では、ケトジェニック療法を処方されている患者全員に、経口クエン酸カリウムのサプリメントを提供しており、腎臓結石を発症するリスクを七分の一に抑えている[54]。
しかしながら、この経験的治療法は、将来を見据えた形での対照実験では検証がなされていない[18]。腎結石症は、以下の4つの要因が関わってくる[53]。
- 高カルシウム尿症(en:Hypercalciuria)・・・尿中に過剰な量のカルシウムが流出する。これは酸血症に伴う骨の脱灰(Demineralisation)の頻度が上昇していることを意味する。骨は主にリン酸カルシウムで構成されており、リン酸は酸と作用しあい、腎臓からのカルシウムの排出を促す[53]
- 低クエン酸尿症(Hypocitraturia)・・・尿のクエン酸濃度が異常に低く、遊離カルシウム(Free Calcium)の溶解を促す[53]
- 尿のpH値(水素イオン指数。その液体が酸性か、アルカリ性かの度合いを示す)は低く、尿酸の溶解は止まり、カルシウム結石の形成の病巣と化し、結石の原因となる[53]
- かつては多くの施設で、1日に必要な水分の摂取量を80%に制限するよう患者に勧告していた[53]が、もはやこれは奨励されてはいない[30]
青少年および成人の患者に見られる副作用は、男性では体重減少・便秘・脂質異常症(Dyslipidemia)、女性では月経困難症(Dysmenorrhea, 月経の際に強い痛みが起こる)が一般的である[55]。
実践
[編集]ケトジェニック療法は、さまざまな学問分野からの参加者が関与する医学的栄養療法(Medical Nutrition Therapy)である。食事計画の調整を担当する公認の小児栄養士も含まれる。これはケトン食を提供した経験を持つ神経内科医であり、小児癲癇に精通した登録看護師が担当する。追加支援については、その患者の家族と一緒にいる医療ソーシャルワーカー(Medical Social Worker)と、食べ物に含まれる炭水化物の含有量についての助言ができるほどの知識を持つ薬剤師が挙げられる。患者の両親と介護士は、この食事療法を実践するにあたって多くの知識を身に付けねばならない[8]。食事計画とその調整の関与に時間を注ぎ込むことになり、患者と介護士は大変な苦労を味わう可能性がある。予定外の食事は、身体に必要な栄養バランスを破壊する可能性があり、困難であるが続けるだけの価値があるこの食事療法を維持できるようにするための訓練を受ける者もいる。この食事療法を「厳し過ぎる」と感じた場合、修正アトキンス・ダイエットやグリセミック指数(Glycemic Index, その食べ物を摂取したあとに血糖値がどれほど上昇するかの度合いを示した大まかな指標 )の低い食べ物の摂取に切り替えるか、あるいはこの食事療法そのものを止める者もいる[56]。
ケトン食導入
[編集]ケトジェニック療法を導入するにあたっては、ジョンズ・ホプキンス病院が発表した診療指針が採用されている[57]。患者と介護士に対して、短期間の入院に備えての話し合いが必要になる[31]。ケトジェニック療法を続けている最中に合併症が発生するリスクに備えて、大抵の医療施設では、医師による厳重な監理下でケトン食療法を開始する[18]。最初に診察を受ける際、患者はケトジェニック療法を実践して問題ないかどうかの検査を受ける。患者が今まで食べてきたものや、どのような食事がいかなる影響を及ぼすのかについて念入りに調べる(タンパク質と炭水化物に対するケトン産生比率に関わる脂肪の摂取量、水分の摂取量)[31]。入院する前日の患者は、炭水化物の摂取比率が減少する可能性があり、夕食後に空腹を覚えることが多い[31]。入院中は、カロリーが無く、カフェインも含まない飲み物は自由に飲んで構わない[51]。夕食の際には、特製のエッグノッグ(Eggnog)が提供される。ケトーシス状態に誘導するために摂取するエッグノッグは、「脂肪分を48%以上含むホイップクリーム」(Heavy Whipping Cream)を60g、低温殺菌した生卵を25g、カロリーがゼロの甘味料、わずかな量のバニラ香料を加えて作る。砂糖は使わない。このエッグノッグの栄養素の構成比率は、「脂肪(4):タンパク質と炭水化物(1)」であり、脂肪が24g、タンパク質が4g、炭水化物が2gとなる(24:6 = 4:1)[32]。このエッグノッグは、カスタードやアイスクリームの材料にもなり、冷凍保存する[51]。翌日の夕食では、最初に出された時よりも量を増やしたエッグノッグが提供され、3日目までは一般的なケトン食が提供される。4日目の朝にケトン食を摂ってから、患者は退院する。可能であれば、患者が服用している薬は炭水化物を含まないものに変更される[31]。入院中の患者の血糖値の測定は1日を通して複数回行なわれ、酸血症の兆候を示さないかどうか検査される。エネルギー不足と倦怠感がしばしば見られるが、それらは2週間以内に解消される[32]。患者の家族は、栄養管理、食事療法のやり繰り、各食事の準備、病気への処置、砂糖をいかに避けるかについて、まる3日間の講義に出席する[31]。患者の両親に要求されるケトジェニック療法の実践に必要な知識と献身の水準は、投薬治療におけるそれよりも遥かに高くなる[58]。
ジョンズ・ホプキンス病院が公表しているケトジェニック療法は、方式は複数あれど診療における大まかな点は共通している。ケトン食療法を開始するにあたっては、必ずしも入院の必要は無く、外来通院しながらでも実行可能である。一部の医療施設では、最初の3日間では食事の摂取量は維持するが、「脂肪:タンパク質・炭水化物」の摂取比率を「2:1」から「4:1」に変更する[18]。ケトン食の恩恵を得ている患者であれば、開始して5日以内に発作の頻度が低下(1~2日間の絶食を組み合わせた場合)し、患者の四分の三は2週間以内に、23日も経過すれば患者の90%は発作の頻度が低下する。絶食を取り入れない場合、症状の改善が見られるまで時間(2週間)がかかるが、長期に亘っての発作の減少率には影響しない[58]。患者の両親は、ケトン食療法の効能について最終的な結論を下すまで、少なくとも3か月はこの食事療法を続けることを推奨される[18]。
ケトン食の維持
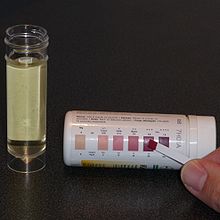
[編集]ケトジェニック療法を開始したら、定期的に通院し、神経内科医と栄養士による診断と精密な検査を受ける。検査は最初の1年間で3か月ごとに1度、その後は半年に1度の間隔で行われる。1歳未満の乳児の場合は2~4週間に一度の間隔で通院し、何度となく検査を行う[18]。一定状態のケトーシスを維持しても問題のない状態にし、患者の身体がこの食事に適応できるようにするため、食事の微調整を行う期間が必要になる。この微調整は、大抵は病院にいる栄養士と電話しながら行われる[31]。摂取カロリーやケトン体産生比率を変更したり、MCTオイルやココナッツオイルの摂取の追加も含まれる[30]。ケトン体の濃度は、癲癇による痙攣発作を抑える効果とは相関しないが、ケトーシスになっているかどうか、患者が毎日この食事法を続けているかどうかを確認するため、尿中のケトン体の濃度を毎日検査する[31]。尿中のケトン体を検出する際には、専用のディップスティック(Dipstick)である「尿中ケトン体試験紙」を用いて行い、試験紙の色が「淡黄色」(薄い黄色に茶色が少し混ざったような色)から「エビ茶色」(赤みと紫を帯びた薄い茶色)に変化した場合、ケトン体が尿中に出ている証拠となる。これは無機化合物の1つでケトン体検出薬としても用いられているニトロプルシド(Nitroprusside)が、尿中のアセト酢酸(Acetoacetic Acid, ケトン体の一種)に反応して変色するためである[59]。
病気を患っている間や、ケトン体の濃度の変動が起こっているときには、発作の頻度が一時的に増加する可能性がある。発作を起こす頻度が高いままであったり、患者の体重が減少している場合、食事の内容を少し変えることもある[31]。
なお、予期せぬ要因から、発作が制御不能に陥ることがある。「無糖」とされている食べ物であっても、マルトデキストリン(Maltodextrin)、ソルビトール(Sorbitol)、デンプン(Starch)、果糖(Fructose)といった糖分を含んでいる場合がある。日焼け止め化粧水や肌荒れを防ぐ製品に含有されるソルビトールが皮膚を通して体内に吸収され、これによってケトーシス状態を台無しにするだけの十分な潜在能力を秘めている[45]。
発作消滅後
[編集]ケトン食療法を続ける小児患者の20%は発作が無くなり、患者の多くは抗癲癇薬の投与を減らすか、あるいは薬が完全に不要となる[30]。通常、ケトン食療法を開始して2年が経過するか、もしくは発作が見られなくなってから半年が経ったころに、2~3か月かけて、ケトン食を徐々に中止していく。尿からケトン体が検出されなくなるまでケトン体の産生比率を下げていき、摂取エネルギーの制限をやめていく[60]。ケトン食をやめるべき時宜とその方法については、抗癲癇薬による投薬療法で発作が無くなった子供に対する場合とよく似ている。特定の代謝性疾患を治療する際にケトン食の処方が必要だと判断された場合、ケトン食の続行は延長される。ケトン食療法をいつまで続けるかは、ケトン食療法に取り組む医療側と、患者の両親次第である。ケトン食を12年間続けた研究では、有益な結果をもたらしている[18]。
発作が消えてからケトン食をやめた場合、発作が再発する可能性は約20%である。再発するまでの期間については大いにばらつきがあるが、平均すると2年である。再発の可能性については、脳の一部を切除する手術を受けた場合は10%、抗癲癇薬による投薬療法をやめた場合は30~50%にまでなる。発作が再発した患者の半数以上は、抗癲癇薬の投与、もしくはケトン食療法を再開することで発作が消える可能性が出てくる。発作が起こっていない状態で脳波に癲癇スパイク(Epileptiform Spike)が見られる場合、脳内で癲癇活動 (Epileptiform Activity)が起こっており、再発しやすくなる。結節性硬化症(Tuberous Sclerosis Complex)を患っている子供が「MRI」(Magnetic Resonance Imaging, 核磁気共鳴画像法)による精密検査で病巣の異常が見付かった場合も再発の可能性が高まる。そのような場合は、ケトン食療法を続けることで発作が消える可能性があり、結節性硬化症を患っている子供で発作が消えたあとも無期限に続けられる[60]。
種類
[編集]ケトジェニック・メニュー
[編集]ケトン食は、患者の食事を担当する栄養士が1人1人計画する。年齢、身長、体重、日々の身体活動水準、患者の文化的背景、食べ物への嗜好、これらの要素はすべて食事計画に影響を及ぼす。
1日の摂取エネルギーは、患者の年齢を考慮したうえで、普段の80~90%に設定する(高脂肪食は、高糖質食に比べて、身体がそれを処理するのに必要なエネルギー量が少なくてすむ)。活動量の多い子供や、筋肉の痙縮が見られる子供の場合は、摂取エネルギーをより多くする必要がある。
食事における栄養素の摂取比率は、通常は「脂肪:タンパク質・炭水化物」で「4:1」となる。生後18か月未満、12歳以上、もしくは肥満体の子供の場合、比率は「3:1」で開始する。脂肪の摂取量は、1日の摂取エネルギーおよびケトン体産生比率から計算する。タンパク質の摂取量は、体重1kgにつき、1gとなる。薬剤やサプリメントに含まれる炭水化物は、ここから差し引かねばならない。脂肪:タンパク質・炭水化物の摂取の比率は、1日を通して順守する[51]。ケトン食のレシピは、「ケト・キャルキュレーター』(『KetoCalculator』)を使うことで作成可能[61]。
ケトン食は、食べられるものがかなり制限される。
電子計測器で計る際には、1g単位での正確さが要求される。
出されたものは残さず食べきること。1日を通して、間食も組み込む。MCTオイルを摂取することで便秘の改善やケトーシスを促進する[51]。患者の年齢に合わせて、各種ビタミンを無糖のサプリメントで摂取する[30]。
1日を通してのケトン食は、以下の表を参考にされたし[42]。

| 食事 | 食事内容 | 材料 |
|---|---|---|
| 朝食 | ベーコンと卵 | |
| 間食 | ピーナッツバター・ボール
(約14g) |
|
| 昼食 | ツナサラダ | |
| 午後の間食 | ケトン・ヨーグルト
(約37g) |
|
| 夕食 | バンズを使わないチーズバーガー | |
| 夜の間食 | ケトン・カスタード
約34g |
|
MCTオイル
[編集]食べ物に含まれる脂肪分は、「長鎖中性脂肪」((Long-Chain Triglycerides, LCT)と呼ばれる分子で構成されるが、このLCTよりも短い炭素鎖からなる「中鎖中性脂肪」(Medium-Chain Triglycerides, MCT)は、ケトン体の産生量を増やすため、MCTが豊富なココナッツオイルを摂取する場合もある。これらの脂肪を摂取しつつ、タンパク質の摂取を増やしたり[30]、食事における一人前の分量を増やすことも可能[7]。ピーター・ホトゥンロハー(Peter Huttenlocher)が1970年代に開発したMCTオイルを組み込んだケトン食では、全エネルギーの60%をMCTオイルから摂取する[28]。この量のMCTオイルを摂取したのち、腹痛、下痢、嘔吐に見舞われた小児患者も出た。脂肪の摂取エネルギーを45%にした場合、良好なケトーシス状態に誘導できるだけでなく、消化管の不調も最小限に抑えられる。脂肪の摂取比率が90%に及ぶ本来のケトン食、MCTオイルを組み込んだケトン食、どちらも同じように効果的であり、「どちらのほうが続けやすいか」といった議論は問題にならない[18]。
なお、MCTオイルを使ったケトン食は、アメリカ合衆国ではあまり人気が無いようである。MCTオイル自体が他の脂肪分に比べて高価であり、保険も適用されない[30]。
修正アトキンス・ダイエット
[編集]2003年に、アトキンス・ダイエットを少し変更した食事法で癲癇を治療する、という報告がなされている。患者と患者の両親が、アトキンス・ダイエットを開始してケトーシスに誘導する時期に発作の抑制が見られたことに気付いたのが契機となり、この考えが浮かんだという。ジョンズ・ホプキンス病院のケトン食療養チームは、目標を「体重を減らす」ことではなく、ケトーシスを無期限に延長し、脂肪代謝を促進することにした。ケトジェニック療法に比べると、修正アトキンス・ダイエットは、脂肪はおろか、タンパク質の摂取量と食べる量にも制限は設けず、1日を通してケトン体産生比率を維持する必要も無い。入院する必要も、絶食状態から始める必要も無く、栄養士による支援も少なくてすむ。炭水化物の1日の摂取量は、子供なら10g以内に、成人であれば20g以内に制限され、発作の抑制の具合に応じて、摂取量を微調整する。本来のケトジェニック療法と同じく、ビタミンとミネラルのサプリメントを用意し、患者の容態を外来通院で注意深く見極める[62]。修正アトキンス・ダイエットを続けることで、患者の43%は発作の頻度が半減し、27%は9割の確率で発作が減少する[30]。長期的な研究は行われていないが、副作用については報告されていない[62]。より小さな規模でひとまとまりのデータ(5つの医療施設で、11件の研究から、対象人数126人、2009年)ではあるが、本来のケトン食と比べても、良好な結果であった[30]。
低GI食
[編集]グリセミック指数(Glycemic Index, その食べ物を摂取したあとに血糖値がどれほど上昇するかの度合いを示した大まかな指標)に基づき、血糖値の上昇が緩やかになる食べ物を中心に摂取する。これは低グリセミック指数治療(The Low Glycemic Index Treatment, LGIT)と呼ばれる[63]。ケトン食を実践しているときと同様に、血糖値を安定させることを目的とするが、ケトン食療法やアトキンス・ダイエットに比べると、食べ物の制限は緩やかになる。血糖値を安定させることで、ケトン体を産生する機序と同じ効果が得られる可能性がある、という仮説が出ている[18]。炭水化物を制限したうえで高脂肪な食事を摂ると、身体への吸収や血糖値の上昇が穏やかになり、ケトーシス誘導に寄与する[8]。基本的には高脂肪食(脂肪による摂取エネルギーが約60%)[8]であるが、炭水化物の1日の摂取量が40~60gとなっており、ケトジェニック療法やアトキンス・ダイエットに比べると、摂取制限は緩い[30]。ただし、口にできるものは血糖指数50未満のものに限られる。低GI食治療は、外来通院でも可能であり、食べる量の綿密な計算や、栄養士による支援は必要ない。ケトジェニック療法を処方している医療施設ではこれも処方されており、青少年の患者にはとくに重要な食事療法として処方している医療施設もある[18]。
短期間の研究であるが、患者全体の約半数が、癲癇の発作頻度が50%以上に減り、血液検査の数値も、ケトン食を摂っている患者のそれに近い結果が出た。2009年までの時点で、ある医療施設にいた76人の子供から得られたデータでは、ケトン食に比べると副作用は少なく、美味しさも同時に味わえたことで、より受け入れられたという[30][64]。
薬剤処方
[編集]
経管栄養(Tube-Fed)を受けている患者に対しても、ケトン食は処方可能である。ケトン食用の粉末を液体に混ぜて流動食にし、チューブを通して与える。市販されているものでは『ケトカル』(『KetoCal』)がある[31]。胃瘻管(Gastrostomy)による人工的な栄養補給法は、患者の食べ物への嗜好を考慮する必要は無くなり、哺乳瓶で育った乳児はケトン食を容易に受け入れるようになる[45]。一部では、固形のケトン食よりもこの流動食のほうが、総コレステロール値が低いことと関連していることが分かっている研究結果もある[30]。ケトカルは、アミノ酸、脂肪、微量の炭水化物、ビタミン、ミネラル、微量元素(Trace Elements)、乳タンパクを含む完全食である。1年以上に亘り、本来のケトン食に相当する栄養を処方するために用いられる。「脂肪:タンパク質・炭水化物」の比率は「3:1」か「4:1」で、味付けをしないバニラ香料(もしくはゼロカロリーの甘味料で甘くする)のケトン食を処方し、経口投与する[65]。ケトカル以外のケトン食用粉末には、『ケトヴォルヴ』(『Ketovolve』)[66]、『ケトニア』(『Ketonia』)[67]がある。もしくは、『マイクロリピッド』(『Microlipid』)と『ポリコース』(『Polycose』)を混ぜて作る『ロス・カーボハイドレート・フリー・ソイ・フォーミュラ』(『Ross Carbohydrate Free Soy Formula』)を処方する[67]。
ケトン食が実践できない場合
[編集]理論的には、ケトン食はどこでも実行可能であり、抗癲癇薬よりも費用は掛からない。しかしながら、ケトン食を始めるにあたって、絶食を取り入れたり、食事を変化させることについては、宗教的及び文化的問題の影響を受けることになる。祖父母が料理を用意したり、何らかの助けを得る必要がある文化のもとでは、周りの人間にこの食事法について知ってもらう必要が出てくる。家族と一緒に食事を摂り、同じものを食べている場合、1人だけケトン食を実践するのは困難になる。大抵の国では、ある食品に各栄養素がどれほど含有されているかを明記する義務は無いため、炭水化物・タンパク質・脂肪の摂取量の計算は不可能に近い。糖分を含まない医薬品やサプリメントを見付けたり、電子計測器やMCTオイルを購入すること自体が困難な国もある[68]。
アジア圏においては、日常の食事における食べ物は米と麺類で占められており、それらの排除は不可能に近い。とくにインドにおいては、食生活に対して宗教が強い影響を及ぼすだけでなく、子供に断食をやらせるのは奨励されていない。高糖質・低脂肪な食事であれば、ケトン食に比べて脂肪の摂取比率はかなり低くなる。だが、やり方次第ではケトン食と同じぐらい効果的なようである[68]。大抵の発展途上国では、肉や乳製品の値段は、穀物、野菜、果物のそれよりも高い。だが、ケトン食に費用がかかる国々では修正アトキンス・ダイエットが推奨されており、食事における原理や準備は難しくはなく、栄養士による支援を必要としない[69]。
作用機序
[編集]ケトジェニック療法が身体に作用する際の機序について説明している仮説が数多く出ているが、検証されてはおらず、不明な点も多い。全身で起こっているケトアシドーシス、電解質の変化、低血糖症が挙げられるが、これらはいずれも反証されている[31]。ケトン食を摂取しているヒトの脳内では数多くの生化学的な変化が起こっていることが確認されているが、いずれの作用が癲癇発作を抑制しているのかについてまでは分かっていない。抗癲癇薬が脳に及ぼす機序の解明についても類似している[70]。
ケトジェニック療法では炭水化物の摂取を厳格に制限する代わりに脂肪の摂取は制限しないため、身体は脂肪酸を主要な燃料源として消費するようになる。脂肪酸は、細胞のミトコンドリア(Mitochondria)による酸化作用を通して消費される。これをβ酸化(Beta Oxidation)と呼ぶ。人体には糖新生(Gluconeogenesis)と呼ばれる経路があり、炭水化物や砂糖を食べずともブドウ糖を自ら生産する機能が備わっている。アミノ酸も糖新生の材料として使われるが、脂肪酸は材料にできない[71]。
だが、アミノ酸(Amino Acids)は身体の成長と修復に必要な材料となるタンパク質を作る際に欠かせない材料であり、糖新生のためだけに消費されることは無い。脂肪酸はそのままの形では血液脳関門(The Blood–Brain Barrier)を通過しない。肝臓は長鎖脂肪酸を材料に、β-ヒドロキシ酪酸(β-Hydroxybutyrate)、アセト酢酸(Acetoacetate)、アセトン(Acetone)、これらのケトン体を合成する。肝臓が合成したこれらのケトン体は脳内に入り、エネルギー源として消費される[70]。ケトン体は抗癲癇薬と同様の作用をもたらす。動物実験においては、アセト酢酸とアセトンが発作を抑制したことが確認されている。ケトジェニック療法は、脳のエネルギー代謝を適応的に変化させ、エネルギーが途切れないよう促進する。ブドウ糖に比べると、ケトン体はエネルギーの浪費が起こりにくい燃料となり、ミトコンドリアの増加を促す。発作が起こっている最中にエネルギーの需要が増加することで、ニューロンが安定した状態を維持するのに役立ち、それに伴ってニューロンの神経保護作用(Neuroprotective Effect)をもたらす可能性がある[70]。
ケトジェニック療法について、齧歯動物(ネズミ目)14匹を用いた動物実験による研究がおこなわれている。それらの動物実験でも、ケトジェニック療法が癲癇から脳を保護する作用が確認され、従来から使われてきた抗癲癇薬とはまた別の形で癲癇発作を抑制する作用があることが分かった。臨床の現場で抗癲癇薬としては用いられてはいない「フェノフィブラート」(Fenofibrate)と呼ばれる薬剤があるが、成体のラットに対して実験的に投与したところ、ケトン食に匹敵するほどの癲癇発作の抑制効果が見られた[72]。薬剤を半ダース分投与しても発作の抑制が不可能であった患者に対する有効性を示す研究であるとして、他に類を見ない作用機序を示している[70]。また、ラットにケトン食を取らせたところ、癲癇発作の抑制が確認された[70]。
その他の用途
[編集]ケトン食療法は、癲癇以外の神経障害に対しても適用できる治療法として研究されている。具体的には、頭痛、身体的苦痛、筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis)、自閉症(Autism)、脳癌(Brain Cancer)、パーキンソン病(Parkinson's Disease)、アルツハイマー病(Alzheimer's Disease)、神経外傷、睡眠障害(Sleep Disorders)といった様々な病気に対して、ケトン食がもたらす作用や効果についての研究が進んでいる[14]。癌細胞(Cancer Cells)はケトン体をエネルギー源にはできないため、ケトン食療法を「癌の治療手段として採用すべきだ」と考えている研究者もいる[73][74]。
2018年に行われた論文研究では、癌の治療に対して実施された前臨床試験(Preclinical Studies)および臨床試験(Clinical Studies)で得られた研究結果が注目された。ヒトにおける臨床研究は大抵は小規模であり、とくに膠芽腫( Glioblastoma, 脳内にできる悪性腫瘍の一種)に対するケトン食療法はわずかに効果が得られたが、他の癌に対しては、抗腫瘍効果は見受けられなかった。時には相矛盾する結果も出るが、前臨床試験で得られた結果の多くは、ケトジェニック療法は固形癌(Solid Cancer)に対して腫瘍の形成を促進するのではなく、むしろ癌を治療するのに役立つであろうと見られている[75]。
だが、これらの臨床結果は、病気治療に対してケトジェニック療法が有益であることを示してはいるが、この食事法が臨床治療で推奨されるほどの水準に達していることを意味するわけではなく、研究は未だ不十分である[18]。
参考
[編集]- ^ Corliss, Julie (2024年5月1日). “Keto diet is not healthy and may harm the heart” (英語). Harvard Health. 2024年4月27日閲覧。
- ^ a b “Should you try the keto diet?” (英語). Harvard Health (2018年10月1日). 2024年4月27日閲覧。
- ^ Dana Sparks (16 January 2015). “A Line in the Sand – Mayo Clinic’s Role in Early Insulin Research”. Mayo Clinic News Network. 28 October 2019閲覧。
- ^ Beth Schultz (11 April 2019). “Feeding our brains to reduce memory loss”. The Associated Press( APNEWS ). 28 October 2019閲覧。
- ^ Kossoff EH, Wang HS. Dietary therapies for epilepsy. Biomed J. 2013 Jan-Feb;36(1):2-8. doi:10.4103/2319-4170.107152 PMID 23515147
- ^ a b c d e f g Freeman JM, Kossoff EH, Hartman AL. The ketogenic diet: one decade later. Pediatrics. 2007 Mar;119(3):535–43. doi:10.1542/peds.2006-2447. PMID 17332207
- ^ a b Liu YM. Medium-chain triglyceride (MCT) ketogenic therapy. Epilepsia. 2008 Nov;49 Suppl 8:33–6. doi:10.1111/j.1528-1167.2008.01830.x. PMID 19049583
- ^ a b c d e Zupec-Kania BA, Spellman E. An overview of the ketogenic diet for pediatric epilepsy. Nutr Clin Pract. 2008 Dec–2009 Jan;23(6):589–96. doi:10.1177/0884533608326138. PMID 19033218
- ^ “CLASSIC KETO”. Charlie Foundation. 28 October 2019閲覧。
- ^ The ketogenic diet for the treatment of malignant gliomaEric C Woolf, Adrienne C Scheck. J Lipid Res. 2015 Jan;56(1):5-10. doi:10.1194/jlr.R046797. Epub 2014 Feb 6. PMID 24503133; PMC 4274070.
- ^ Low-fat versus ketogenic diet in Parkinson's disease: A pilot randomized controlled trialPhillips MCL, Murtagh DKJ, Gilbertson LJ, Asztely FJS, Lynch CDP. Low-fat versus ketogenic diet in Parkinson's disease: A pilot randomized controlled trial. Mov Disord. 2018 Aug;33(8):1306-1314. doi:10.1002/mds.27390. Epub 2018 Aug 11. Erratum in: Mov Disord. 2019 Jan;34(1):157. PMID 30098269, PMC 6175383.
- ^ Ketogenic Diet in Alzheimer's DiseaseRusek M, Pluta R, Ułamek-Kozioł M, Czuczwar SJ. Ketogenic Diet in Alzheimer's Disease. Int J Mol Sci. 2019 Aug 9;20(16):3892. doi:10.3390/ijms20163892. PMID 31405021, PMC 6720297.
- ^ Mechanisms of action of the ketogenic diet in depressionAdam Włodarczyk, Wiesław Jerzy Cubała. Neurosci Biobehav Rev. 2019 Dec;107:422-423. doi:10.1016/j.Neubiorev.2019.09.038. Epub 2019 Sep 27. PMID 31568812.
- ^ a b Gano LB, Patel M, Rho JM. Ketogenic diets, mitochondria, and neurological diseases. J Lipid Res. 2014 Nov;55(11):2211-28. doi:10.1194/jlr.R048975. PMID 24847102.
- ^ “Ketogenic diet: Is the ultimate low-carb diet good for you?” (英語). Harvard Health (2017年7月27日). 2024年4月27日閲覧。
- ^ a b Stafstrom CE. An introduction to seizures and epilepsy. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. ISBN 1-58829-295-9.
- ^ de Boer HM, Mula M, Sander JW. The global burden and stigma of epilepsy. Epilepsy Behav. 2008 May;12(4):540–6. doi:10.1016/j.yebeh.2007.12.019. PMID 18280210
- ^ a b c d e f g h i j k l m n o p q r s Kossoff EH, Zupec-Kania BA, Amark PE, Ballaban-Gil KR, Bergqvist AG, Blackford R, et al. Optimal clinical management of children receiving the ketogenic diet: recommendations of the International Ketogenic Diet Study Group. Epilepsia. 2009 Feb;50(2):304–17. doi:10.1111/j.1528-1167.2008.01765.x. PMID 18823325
- ^ a b c d e f g h i Wheless JW. History and origin of the ketogenic diet (PDF). In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. ISBN 1-58829-295-9.
- ^ Hippocrates, On the Sacred Disease, ch. 18; vol. 6.
- ^ Hippocrates, Epidemics, VII, 46; vol. 5.
- ^ Galen, De venae sect. adv. Erasistrateos Romae degentes, c. 8; vol. 11.
- ^ Galen, De victu attenuante, c. 1.
- ^ Temkin O. The falling sickness: a history of epilepsy from the Greeks to the beginnings of modern neurology. 2nd ed. Baltimore: Johns Hopkins University Press; 1971. p. 33, 57, 66, 67, 71, 78. ISBN 0-8018-4849-0.
- ^ Guelpa G, Marie A. La lutte contre l'epilepsie par la desintoxication et par la reeducation alimentaire. Rev Ther med-Chirurg. 1911; 78: 8–13. As cited by Bailey (2005).
- ^ Bailey EE, Pfeifer HH, Thiele EA. The use of diet in the treatment of epilepsy. Epilepsy Behav. 2005 Feb;6(1):4–8. doi:10.1016/j.yebeh.2004.10.006. PMID 15652725
- ^ Kossoff EH. Do ketogenic diets work for adults with epilepsy? Yes! epilepsy.com. 2007, March. Cited 24 October 2009.
- ^ a b c Huttenlocher PR, Wilbourn AJ, Signore JM. Medium-chain triglycerides as a therapy for intractable childhood epilepsy. Neurology. 1971 Nov;21(11):1097–103. doi:10.1212/wnl.21.11.1097. PMID 5166216
- ^ a b Neal EG, Chaffe H, Schwartz RH, Lawson MS, Edwards N, Fitzsimmons G, et al. The ketogenic diet for the treatment of childhood epilepsy: a randomised controlled trial. Lancet Neurol. 2008 Jun;7(6):500–6. doi:10.1016/S1474-4422(08)70092-9. PMID 18456557
- ^ a b c d e f g h i j k l m n o p q Kossoff EH, Zupec-Kania BA, Rho JM. Ketogenic diets: an update for child neurologists. J Child Neurol. 2009 Aug;24(8):979–88. doi:10.1177/0883073809337162. PMID 19535814
- ^ a b c d e f g h i j k l Hartman AL, Vining EP. Clinical aspects of the ketogenic diet. Epilepsia. 2007 Jan;48(1):31–42. doi:10.1111/j.1528-1167.2007.00914.x PMID 17241206
- ^ a b c Vining EP, Freeman JM, Ballaban-Gil K, Camfield CS, Camfield PR, Holmes GL, et al. A multicenter study of the efficacy of the ketogenic diet. Arch Neurol. 1998 Nov;55(11):1433–7. doi:10.1001/archneur.55.11.1433. PMID 9823827
- ^ Freeman JM, Vining EP, Pillas DJ, Pyzik PL, Casey JC, Kelly LM. The efficacy of the ketogenic diet—1998: a prospective evaluation of intervention in 150 children. Pediatrics. 1998 Dec;102(6):1358–63. doi:10.1542/peds.102.6.1358. PMID 9832569. https://web.archive.org/web/20040629224858/http://www.hopkinsmedicine.org/press/1998/DECEMBER/981207.HTM Lay summary]—JHMI Office of Communications and Public Affairs. Updated 7 December 1998. Cited 6 March 2008.
- ^ a b Hemingway C, Freeman JM, Pillas DJ, Pyzik PL. The ketogenic diet: a 3- to 6-year follow-up of 150 children enrolled prospectively. Pediatrics. 2001 Oct;108(4):898–905. doi:10.1542/peds.108.4.898. PMID 11581442
- ^ Kossoff EH, Rho JM. Ketogenic diets: evidence for short- and long-term efficacy. Neurotherapeutics. 2009 Apr;6(2):406–14. doi:10.1016/j.nurt.2009.01.005 PMID 19332337.
- ^ Henderson CB, Filloux FM, Alder SC, Lyon JL, Caplin DA. Efficacy of the ketogenic diet as a treatment option for epilepsy: meta-analysis. J Child Neurol. 2006 Mar;21(3):193–8. doi:10.2310/7010.2006.00044. PMID 16901419
- ^ a b c Martin-McGill KJ, Jackson CF, Bresnahan R, Levy RG, Cooper PN. Ketogenic diets for drug-resistant epilepsy. Cochrane Database Syst Rev. 2018 Nov 7;11:CD001903. doi:10.1002/14651858.CD001903.pub4. PMID 30403286
- ^ Liu H, Yang Y, Wang Y, Tang H, Zhang F, Zhang Y, Zhao Y. Ketogenic diet for treatment of intractable epilepsy in adults: A meta-analysis of observational studies. Epilepsia Open. 2018 Feb 19;3(1):9–17. doi:10.1002/epi4.12098. PMID 29588983.
- ^ Bergqvist AGC. Indications and Contraindications of the Ketogenic diet. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 53–61. ISBN 1-58829-295-9.
- ^ a b Epilepsies: diagnosis and management. National Institute for Health and Care Excellence (NICE). Published January 2012. Updated February 2016. Cited March 2018. ISBN 978-1-4731-1790-7.
- ^ a b Scottish Intercollegiate Guidelines Network. Guideline 81, Diagnosis and management of epilepsies in children and young people. A national clinical guideline (PDF). Edinburgh: Royal College of Physicians; 2005. ISBN 1-899893-24-5.
- ^ a b c d Turner Z, Kossoff EH. The ketogenic and Atkins diets: recipes for seizure control (PDF). Pract Gastroenterol. 2006 Jun;29(6):53, 56, 58, 61–2, 64.
- ^ Stainman RS, Turner Z, Rubenstein JE, Kossoff EH. Decreased relative efficacy of the ketogenic diet for children with surgically approachable epilepsy. Seizure. 2007 Oct;16(7):615–9. doi:10.1016/j.seizure.2007.04.010. PMID 17544706
- ^ Kossoff EH, McGrogan JR, Freeman JM. Benefits of an all-liquid ketogenic diet. Epilepsia. 2004 Sep;45(9):1163. doi:10.1111/j.0013-9580.2004.18504.x. PMID 15329084.
- ^ a b c d Kossoff EH, Freeman JM. The ketogenic diet—the physician's perspective. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 53–61. ISBN 1-58829-295-9.
- ^ Spendiff S. The diet that can treat epilepsy. Guardian. 2008 Aug 15;Sect. Health & wellbeing.
- ^ Wang S, Fallah A. Optimal management of seizures associated with tuberous sclerosis complex: current and emerging options. Neuropsychiatr Dis Treat. 2014 Oct 23;10:2021–30. doi:10.2147/NDT.S51789. PMID 25364257
- ^ Mastriani KS, Williams VC, Hulsey TC, Wheless JW, Maria BL. Evidence-based versus reported epilepsy management practices. J Child Neurol. 2008 Feb 15;23(5):507–14. doi:10.1177/0883073807309785. PMID 18281618
- ^ Wang D, Pascual JM, De Vivo D. Glucose Transporter Type 1 Deficiency Syndrome. In: Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJH, Stephens K, Amemiya A, editors. GeneReviews. Seattle (WA): University of Washington, Seattle; 1993–2018. 2002 Jul 30 [updated 2018 Mar 1]. PMID 20301603.
- ^ Huffman J, Kossoff EH. State of the ketogenic diet(s) in epilepsy (PDF). Curr Neurol Neurosci Rep. 2006 Jul;6(4):332–40. doi:10.1007/s11910-006-0027-6. PMID 16822355
- ^ a b c d e Zupec-Kania B, Werner RR, Zupanc ML. Clinical Use of the Ketogenic Diet—The Dietitian's Role. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 63–81. ISBN 1-58829-295-9.
- ^ a b c Bergqvist AG. Long-term monitoring of the ketogenic diet: Do's and Don'ts. Epilepsy Res. 2011 Aug 18;100(3):261–6. doi:10.1016/j.eplepsyres.2011.05.020. PMID 21855296.
- ^ a b c d e f g Sampath A, Kossoff EH, Furth SL, Pyzik PL, Vining EP. Kidney stones and the ketogenic diet: risk factors and prevention (PDF). J Child Neurol. 2007 Apr;22(4):375–8. doi:10.1177/0883073807301926. PMID 17621514
- ^ McNally MA, Pyzik PL, Rubenstein JE, Hamdy RF, Kossoff EH. Empiric use of potassium citrate reduces kidney-stone incidence with the ketogenic diet. Pediatrics. 2009 Aug;124(2):e300–4. doi:10.1542/peds.2009-0217. PMID 19596731
- ^ Kossoff E. Is there a role for the ketogenic diet beyond childhood? In: Freeman J, Veggiotti P, Lanzi G, Tagliabue A, Perucca E. The ketogenic diet: from molecular mechanisms to clinical effects. Epilepsy Res. 2006 Feb;68(2):145–80. doi:10.1016/j.eplepsyres.2005.10.003. PMID 16523530
- ^ Vogelstein F. Epilepsy's Big, Fat Miracle. New York Times. 2010 Nov 17.
- ^ Kim DY, Rho JM. The ketogenic diet and epilepsy. Curr Opin Clin Nutr Metab Care. 2008 Mar;11(2):113–20. doi:10.1097/MCO.0b013e3282f44c06. PMID 18301085
- ^ a b Kossoff EH, Laux LC, Blackford R, Morrison PF, Pyzik PL, Hamdy RM, et al. When do seizures usually improve with the ketogenic diet? (PDF). Epilepsia. 2008 Feb;49(2):329–33. doi:10.1111/j.1528-1167.2007.01417.x. PMID 18028405
- ^ Musa-Veloso K, Cunnane SC. Measuring and interpreting ketosis and fatty acid profiles in patients on a high-fat ketogenic diet. In: Stafstrom CE, Rho JM, editors. Epilepsy and the ketogenic diet. Totowa: Humana Press; 2004. p. 129–41. ISBN 1-58829-295-9.
- ^ a b Martinez CC, Pyzik PL, Kossoff EH. Discontinuing the ketogenic diet in seizure-free children: recurrence and risk factors. Epilepsia. 2007 Jan;48(1):187–90. doi:10.1111/j.1528-1167.2006.00911.x. PMID 17241227
- ^ Zupec-Kania B. KetoCalculator: a web-based calculator for the ketogenic diet. Epilepsia. 2008 Nov;49 Suppl 8:14–6. doi:10.1111/j.1528-1167.2008.01824.x. PMID 19049577
- ^ a b Kossoff EH, Dorward JL. The modified Atkins diet. Epilepsia. 2008 Nov;49 Suppl 8:37–41. doi:10.1111/j.1528-1167.2008.01831.x. PMID 19049584
- ^ Pfeifer, Heidi H. Low glycemic index treatment. Epilepsy Foundation. 22 August 2013. Cited 31 March 2018.
- ^ Muzykewicz DA, Lyczkowski DA, Memon N, Conant KD, Pfeifer HH, Thiele EA. Efficacy, safety, and tolerability of the low glycemic index treatment in pediatric epilepsy. Epilepsia. 2009 May;50(5):1118–26. doi:10.1111/j.1528-1167.2008.01959.x. PMID 19220406
- ^ KetoCal Product Information. Nutricia North America. Cited 8 June 2018.
- ^ KetoVOLVE: 4:1 Ratio Powder. Solace Nutrition. Cited 17 June 2013.
- ^ a b Kossoff EH. The Ketogenic Diet ... in a bottle?. Keto News. Epilepsy.com. Updated July 2009. Cited 29 November 2009.
- ^ a b Kossoff EH, McGrogan JR. Worldwide use of the ketogenic diet. Epilepsia. 2005 Feb;46(2):280–9. doi:10.1111/j.0013-9580.2005.42704.x. PMID 15679509.
- ^ Kossoff EH, Dorward JL, Molinero MR, Holden KR. The modified Atkins diet: a potential treatment for developing countries. Epilepsia. 2008 Sep;49(9):1646–7. doi:10.1111/j.1528-1167.2008.01580_6.x PMID 18782218
- ^ a b c d e Hartman AL, Gasior M, Vining EP, Rogawski MA. The neuropharmacology of the ketogenic diet. Pediatr Neurol. 2007 May;36(5):281–292. doi:10.1016/j.pediatrneurol.2007.02.008. PMID 17509459
- ^ Kerndt PR, Naughton JL, Driscoll CE, Loxterkamp DA. Fasting: the history, pathophysiology and complications. West J Med. 1982 Nov;137(5):379–99. PMID 6758355
- ^ Porta N, Vallée L, Lecointe C, Bouchaert E, Staels B, Bordet R, Auvin S. Fenofibrate, a peroxisome proliferator-activated receptor-alpha agonist, exerts anticonvulsive properties. Epilepsia. 2009 Apr;50(4):943–8. doi:10.1111/j.1528-1167.2008.01901.x. PMID 19054409.
- ^ Barañano KW, Hartman AL. The ketogenic diet: uses in epilepsy and other neurologic illnesses. Curr Treat Options Neurol. 2008;10(6):410–9. doi:10.1007/s11940-008-0043-8. PMID 18990309
- ^ Allen BG, Bhatia SK, Anderson CM, et al. Ketogenic diets as an adjuvant cancer therapy: History and potential mechanism. Redox Biol. 2014 Aug 7;2C:963–70. doi:10.1016/j.redox.2014.08.002. PMID 25460731
- ^ Weber DD, Aminazdeh-Gohari S, Kofler B. Ketogenic diet in cancer therapy. Aging (Albany NY). 2018 Feb 11;10(2):164–165. doi:10.18632/aging.101382. PMID 29443693 PMC 5842847.
文献
[編集]- Freeman JM, Kossoff EH, Freeman JB, Kelly MT. The Ketogenic Diet: A Treatment for Children and Others with Epilepsy. 4th ed. New York: Demos; 2007. ISBN 1-932603-18-2.
関連項目
[編集]外部リンク
[編集]- Diet Review: Ketogenic Diet for Weight Loss, from the Harvard University School of Public Health
- ケトジェニック・ダイエット - Curlie
- Matthew's Friends, a UK charity and information resource
- The Charlie Foundation, a US charity and information resource
- Epilepsy.com: Dietary Therapies & Ketogenic News, information and regular research news updates
- A Talk with John Freeman: Tending the Flame, an interview discussing the ketogenic diet that appeared in BrainWaves, Fall 2003, Volume 16, Number 2.
- Lurie Children's Hospital: How the Ketogenic Diet Works.
- Ketogenic diets and physical performance
- Effects of a ketogenic diet on the quality of life in 16 patients with advanced cancer: A pilot trial
- THE EFFECTS ON HUMAN BEINGS OF A TWELVE MONTHS' EXCLUSIVE MEAT DIET July 6, 1929
- Adventures in Diet by Arctic Explorer Vilhjalmur Stefansson initially published by Harper's Monthly Magazine, November 1935
- Eskimos Prove An All-Meat Diet Provides Excellent Health Adventures in Diet Part 2 By Vilhjalmur Stefansson Harper's Monthly Magazine, December 1935