「輸血」の版間の差分
Anesth Earth (会話 | 投稿記録) 英語版ウィキペディア Blood transfusion(2024年3月23日 (土) 02:43(UTC))版の翻訳により記事強化。 Wikipedia 翻訳支援ツール Ver1.32使用。元記事の信頼できる情報源に基づく記載は残置。それ以外は上書き。 タグ: サイズの大幅な増減 2017年版ソースエディター |
|||
| 1行目: | 1行目: | ||
{{Infobox medical intervention |
|||
{{更新|date=2023年1月|「輸血の歴史」の節以外}}{{参照方法|date=2012年8月11日 (土) 11:58 (UTC)}} |
|||
| Name = Blood transfusion |
|||
{{Infobox interventions |
|||
| Image = Erythrozytenkonzentrat neu.jpg |
|||
| Name = 輸血 |
|||
| Caption = {{仮リンク|濃厚赤血球|en|packed red blood cells|redirect=1|}} 製剤は[[クエン酸]]・[[リン酸]]・[[ブドウ糖]]・[[アデニン]](CPDA)溶液の入ったビニール袋に充填されている。 |
|||
| Image = Blausen 0087 Blood Transfusion.png |
|||
| alt = Plastic bag {{Nowrap|0.5–0.7 liters}} containing packed red blood cells in citrate, phosphate, dextrose, and adenine (CPDA) solution |
|||
| Caption = |
|||
| alt = Plastic bag {{nowrap|0.5–0.7 liters}} containing packed red blood cells in citrate, phosphate, dextrose, and adenine (CPDA) solution |
|||
| ICD10 = |
| ICD10 = |
||
| ICD9 = 99.0 |
| ICD9 = 99.0 |
||
| 12行目: | 11行目: | ||
| OtherCodes = |
| OtherCodes = |
||
}} |
}} |
||
'''輸血'''(ゆけつ、{{Lang-en|Blood transfusion}})とは、[[血液]]成分の不足を自他の血液から補う治療法のこと。血液を臓器のひとつとしてみれば、最も頻繁に行われている[[移植 (医療)|臓器移植]]であるといえる。輸血の提供者は'''ドナー'''({{Lang-en-short|donor}})ないしは'''供血者'''と呼ばれる。 |
|||
'''輸血'''(ゆけつ、{{Lang-en-short|blood transfusion}})とは、[[末梢静脈カテーテル|静脈内カテーテル]]を介してドナーの血液をレシピエントに投与する医療処置である<ref>{{Cite web|url=https://www.nhlbi.nih.gov/health-topics/blood-transfusion|title=Blood Transfusion {{!}} National Heart, Lung, and Blood Institute (NHLBI)|website=www.nhlbi.nih.gov|access-date=2019-06-16}}</ref>。 |
|||
通常は他人の血液から調製された輸血製剤を[[点滴静脈注射|点滴]]投与することを指す。[[感染症]]や[[移植片対宿主病]](GVHD)に罹る危険を減らすため、[[手術]]や[[化学療法 (悪性腫瘍)|化学療法]]を行う際に、あらかじめ採血し保存しておいた自己の血液を使うことがあり、これを特に[[自己血輸血]]と言う。 |
|||
== |
== 概要 == |
||
輸血は、失われた血液成分を補うために、さまざまな病状に用いられる。かつては、[[全血]]が使用されていたが、現代の医療では、[[赤血球]]、[[血漿]]、[[血小板]]、その他の[[凝固因子]]など、血液の成分のみを使用するのが一般的である。[[血液製剤]]は一般的にその量を「単位(Unit)」と呼称される。日本と海外ではその規格が異なっている。日本では全血200mLから1単位の血液製剤、海外では全血450mLから1単位の血液製剤が作られる<ref>{{Cite web |url=https://www.wam.go.jp/gyoseiShiryou-files/documents/2005/11252/E-5_6.pdf |title=MAPとFFP、アルブミン、グロブリンとの比率について |access-date=2024-04-03 |publisher=[[独立行政法人]][[福祉医療機構]]}}</ref>。すなわち、日本の2単位がおよそ、海外での1単位に相当する<ref>{{Cite web |url=https://medical.nikkeibp.co.jp/leaf/mem/pub/series/yakushiji/202309/581248.html |title=悩み多き輸血の判断 |access-date=2024-04-03 |publisher=[[日経メディカル]] |author=薬師寺 泰匡(薬師寺慈恵病院院長)}}</ref>。本項では、断りが無い限り国際規格に統一して記載するものとする。輸血は一種の臓器移植であり、血液を提供する側はドナー('''供血者''')、提供される側はレシピエント('''受血者''')と呼ばれる。 |
|||
歴史上の輸血に類する試みで文書に残るのは、17世紀の年代記作家、Stefano Infessuraの記述に遡ることができる。1492年、ローマ教皇[[インノケンティウス8世 (ローマ教皇)|インノケンティウス8世]]の臨終に際して、3人の10歳の少年の血が医師の提案で、口から与えられた。少年たちには金銭が与えられる約束であったが、教皇だけでなく3人の少年も死んだとされる。Infessuraの作り話であるとする人々もある。ハーベーの血液循環説から、17世紀には、動物を使った実験が行われるようになり、1666年には[[リチャード・ロウアー]]が犬から犬への輸血で失血させた犬に輸血を行い、回復させることに成功した{{要出典|date=2022年11月}}。 |
|||
赤血球(RBC)は[[ヘモグロビン]]を含み、体内の細胞に[[酸素]]を供給する。[[白血球]]は輸血にはあまり用いられないが、免疫システムの一部であり、[[感染症]]と戦う役割を持つ。血漿は血液の「黄色っぽい」液体部分で、[[緩衝液]]の役割を果たし、[[タンパク質]]や体全体の健康に必要なその他の重要物質を含んでいる。[[血小板]]は血液凝固に関与し、体内の[[出血]]を防ぐ。 |
|||
[[血液型]]は一般的には赤血球の表面抗原の分類を意味し、A型、B型、AB型、O型の4種に分類される<ref name=":18">{{Cite web |title=血液型について|兵庫県赤十字血液センター|日本赤十字社 |url=https://www.bs.jrc.or.jp/kk/hyogo/ |website=兵庫県赤十字血液センター |access-date=2024-04-28 |language=ja}}</ref>。さらにRH分類法により、これら4種それぞれがRH(+)、RH(-)に分類される<ref name=":18" />。これらの分類以外の{{仮リンク|ヒトの血液型|en|human blood group systems|redirect=1|label=まれな血液型}}もある<ref name=":18" />。血液型が適合しない輸血は[[赤血球]]の破壊、すなわち[[溶血]]を引き起こす。不適合輸血を回避するため、緊急時以外は受血者にはあらかじめ、[[血液型|血液型判定]]、[[不規則抗体|抗体スクリーニング]]、そして[[交差適合試験]]を行う。緊急時はO型のRH(-)型の血液が投与される。 |
|||
人への輸血の試みは、国王[[ルイ14世 (フランス王)|ルイ14世]]の医師を務めた[[ジャン=バティスト・デニ]]が、1667年6月15日に15歳の少年に12オンス(約400cc)の羊の血を輸血し、次に労働者にも羊の血を輸血した。これらの被験者は生き延びたが、輸血の量が少なく、拒絶反応に体が耐えられたためだと考えられる。3人目の被験者が死に、その後、スキャンダルに巻き込まれ1670年にフランスでは輸血の試みは禁止された。1667年にロウアーも人への数100ccの羊の血の輸血をおこなうが、被験者は生き延びた。動物の血のヒトへの輸血は1875年頃、[[レオナルト・ランドイス]]らが、異種の動物の血液輸血が溶血反応などを起こすことを、試験管内と動物の生体実験で証明するまで300例以上も実施された<ref>http://voxsangman.seesaa.net/article/275860943.html</ref>。 |
|||
[[ファイル:Vidro para transfusão de sangue, Centro de Memórias do Curso de Enfermagem da UFES (2).jpg|サムネイル|古代の輸血法に使われたガラス。]] |
|||
人から人への輸血に成功したのは、イギリスの[[ジェームズ・ブランデル]]で、1818年12月22日に内出血で死にかかっている女性患者に夫の血、4オンスを注射器を使って輸血した。患者は2日半ほど元気を取り戻した後死亡し、1825年から1830年の間に合計10人の患者に輸血を行い、その内5人が生き延びた。南北戦争で2回の輸血が行われ、普仏戦争でも戦場で輸血が行われたが、血液型の不適合の問題や、血液の凝固の問題で、多くの失敗例がうまれた<ref>『医学の歴史』ルチャーノ・ステルペローネ(著)小川煕(訳)原書房、(2009年)</ref>。[[カール・ラントシュタイナー]]によって血液型が発見されるのは1901年のことであり、この発見が輸血の危険性を減少させることとなった。20世紀初頭の輸血に関する技術に貢献したのは[[アレクシス・カレル]]や[[ジョージ・ワシントン・クライル]]で、血液の凝固を防ぐために、患者の静脈にドナーの動脈を外科的に接続する方法で患者を救った。クライルは1905年に直接接合による輸血法で成功を収めた<ref>[http://what-when-how.com/inventions/blood-transfusion-inventions/ Blood transfusion (Inventions)]</ref>。1910年代にベルギーの医学者[[アルベール・ユスタン]]らによって、血液抗凝固剤の開発が行われ、第一次世界大戦では多くの負傷した兵士の生命を救うこととなった。 |
|||
血液は体外で速やかに凝固するため、歴史上、初期の輸血は供血者から受血者に対して、血管同士を吻合するか、何らかの器具を介して送り込む直接輸血が行われていた<ref>{{Cite journal|author=松田 利夫、清水 勝|year=2011|title=明治時代の「輸血学」|url=https://www.blood-sub.jp/file/archives/019_2012_03.pdf|journal=人工血液|volume=19|pages=89-98}}</ref>。後年、血液を体外で凝固させずに保存する技術が開発されいったん体外に血液を取り出してから、輸血する間接輸血が行われるようになった。このための血液の貯蔵・供給施設が{{仮リンク|血液バンク|en|blood bank|redirect=1}}である。 |
|||
日本における輸血の実施は第一次世界大戦に日本赤十字社の救護班を率いてパリに派遣された[[塩田広重]]が、輸血の効果を体験し、1919年、日本で子宮筋腫の患者に行って成功した。塩田は1930年に右翼の青年に狙撃された[[浜口雄幸]]首相を輸血を行い手術して救った<ref>医学探偵の歴史事件簿 小長谷正明(著) 岩波新書 (2014年)ISBN 978-4004314745</ref>。日本では[[1974年]]以降、輸血用血液はすべて[[献血]]でまかなわれている。以下の項では特に断りがない限り日本の状況について述べている。 |
|||
血液型不適合輸血の副作用は致死的でありながら、血液型が存在することは長年知られず、輸血は賭博的な医療行為であった。[[カール・ラントシュタイナー]]によって、20世紀初頭にO、A、B、AB型の4種の血液型が発見された後、輸血の安全性は飛躍的に向上した。{{TOC limit}} |
|||
== 輸血の供給源 == |
|||
;枕元輸血 |
|||
[[昭和20年代]]まで頻繁に行われていた方法で、輸血の必要な患者のあったとき近親者や知人、もしくは供血斡旋業者が派遣した供血者がその場で血液を提供するもの。[[血液型]]の合う人がいない場合があることや、感染症をチェックできないこと、[[移植片対宿主病|GVHD]]の危険性が高いことから現在はほぼ絶無である。1948年には輸血を受けた女性が[[梅毒]]に感染した[[東大病院輸血梅毒事件]]が発生、枕元輸血に代わり保存血輸血に移行するきっかけとなった<ref>[https://doi.org/10.3925/jjtc1958.26.1 日本輸血学会25周年記念講演] 『日本輸血学会雑誌』 1980年 26巻 1-3号 p.1-15, {{doi|10.3925/jjtc1958.26.1}}</ref><ref>{{Cite journal|和書|author=根本晋一 |date=2007 |url=http://www2.dent.nihon-u.ac.jp/bulletin/kiyou35/35-13.pdf |format=PDF |title=高度歯科医療に関する医療過誤訴訟の研究- -インプラント植立手術を素材として |journal=日本大学歯学部紀要 |ISSN=1348818X |publisher=日本大学歯学部 |issue=35 |pages=101-112 |CRID=1520290882410127232}}</ref>。 |
|||
== 輸血の種類 == |
|||
;血液銀行 |
|||
{{Main|血液製剤}} |
|||
いわゆる'''[[売血]]'''で、血液を提供する代わりに謝礼が受け取れるもの。しかし、[[麻薬]]常習者など感染症のリスクの明らかに高い提供者も金目当てに参加するため、当時はまだ知られていなかった[[C型肝炎]]の汚染が蔓延した。1964年の[[エドウィン・O・ライシャワー#「ライシャワー事件」|ライシャワー事件]]により危険性が大きくクローズアップされ、善意の提供者による献血制度へ移行することとなった。 |
|||
[[ファイル:FreshFrozenPlasma.JPG|thumb|alt=photograph of a bag containing one unit of fresh frozen plasma|[[新鮮凍結血漿]]の輸血バッグ]]全成分をそのまま輸血する「全血輸血」、赤血球、血小板、血漿成分および凝固因子などの成分毎に分けた「成分輸血」がある<ref name="jstmct">[http://yuketsu.jstmct.or.jp/general/about_transfusion/ 輸血について] 日本輸血・細胞治療学会</ref>。血液由来感染症の防止及び[[献血]]された血液の有効利用の観点から今日では「全血輸血」は行われない<ref name="msd.pro">[https://www.msdmanuals.com/ja-jp/プロフェッショナル/11-血液学および腫瘍学/輸血療法/血液製剤 血液製剤] MSDマニュアル プロフェッショナル版</ref>。成分輸血には以下の製剤がある<ref>{{Cite web |title=輸血について {{!}} 一般社団法人 日本輸血・細胞治療学会 |url=http://yuketsu.jstmct.or.jp/general/about_transfusion/ |website=yuketsu.jstmct.or.jp |access-date=2024-04-29}}</ref>。 |
|||
* {{仮リンク|濃厚赤血球|en|Packed red blood cells|redirect=1|}}: 略称はRBC({{Lang-en-short|Packed red blood cells}})。旧略称はRCC(Red Cells Concentrates)又は MAP(Mannitol Adenine Phosphate)<ref>{{Cite web|和書 |date=2014-07 |title=2014年8月1日より「赤血球液-LR(RBC-LR)[日赤]」に商品名変更(旧称「赤血球濃厚液-LR(RCC-LR)[日赤]」) |publisher=日本赤十字社 |url=http://www.jrc.or.jp/mr/product/information/pdf/info_H2607_RBC.pdf |format=PDF |accessdate=2018-06-15}}</ref><ref>{{Cite web|和書 |date=2013-12 |title=生物学的製剤基準の改正に基づく添付文書等の改訂及び赤血球製剤の販売名変更について |publisher=日本赤十字社 |url=http://www.jrc.or.jp/mr/product/information/pdf/iyakuhin_oshirase1312_131225.pdf |format=PDF |accessdate=2018-06-15}}</ref>等。 |
|||
;献血 |
|||
* {{仮リンク|新鮮凍結血漿|en|fresh frozen plasma|redirect=1}}: 略称はFFP({{Lang-en-short|Fresh Frozen Plasma}})。 |
|||
健康人が無償で血液を提供する寄付行為。報酬としては簡単な血液検査、通算回数の多い献血者に対して記念品を贈る表彰、他に献血による貧血解消のためのドリンクやお菓子など。あくまでも人の善意に頼る面が強いことから、血液の安定供給という点で課題が残っているが、現時点では最も安全で、金銭のやりとりがないため、[[倫理]]的な問題もクリアしているといえる。ただし献血血液が売血より安全だという古くからの定説は今日の[[問診]]検査の水準を考慮すると疑問が残る。 |
|||
* {{仮リンク|濃厚血小板|en|Platelet concentrate|redirect=1}}: 略称はPC({{Lang-en-short|Platelet Concentrates}})。 |
|||
他に、{{仮リンク|ヒト血清アルブミン|en|Human serum albumin|redirect=1|label=アルブミン}}、{{仮リンク|クリオプレピシテート|en|cryoprecipitate|redirect=1}}、[[免疫グロブリン]](抗体)など。 |
|||
== 適応 == |
|||
== 輸血(輸血製剤)の種類 == |
|||
[[ファイル:Blood transfusion B.jpg|thumb|輸血は[[点滴]]から投与される。]] |
|||
全成分をそのまま輸血する「全血輸血」、赤血球、血小板、血漿成分および凝固因子などの成分毎に分けた「成分輸血」がある<ref name="jstmct">[http://yuketsu.jstmct.or.jp/general/about_transfusion/ 輸血について] 日本輸血・細胞治療学会</ref>。血液由来感染症の防止及び[[献血]]された血液の有効の観点から「全血輸血」は行われない<ref name="msd.pro">[https://www.msdmanuals.com/ja-jp/プロフェッショナル/11-血液学および腫瘍学/輸血療法/血液製剤 血液製剤] MSDマニュアル プロフェッショナル版</ref>。 |
|||
[[ファイル:Blood bag 2020.jpg|thumb|献血された血液は直後に保存処理される。]] |
|||
[[ファイル:Blood unit during transfusion.jpg|alt=Blood bag during a blood transfusion procedure|thumb|点滴セットに接続された輸血バッグ]] |
|||
歴史的には、ヘモグロビン濃度が10g/dLを下回るか、[[ヘマトクリット値]]が30%を下回ると、{{仮リンク|濃厚赤血球|en|Packed red blood cells|redirect=1||label=赤血球輸血}} が考慮されてきた<ref>{{Cite journal |vauthors=Adams RC, Lundy JS | year = 1942 | title = Anesthesia in cases of poor surgical risk. Some suggestions for decreasing risk | journal = Surg Gynecol Obstet | volume = 74 | pages = 1011–1019 }}</ref><ref name="AABB2012">{{Cite journal | vauthors = Carson JL, Grossman BJ, Kleinman S, Tinmouth AT, Marques MB, Fung MK, Holcomb JB, Illoh O, Kaplan LJ, Katz LM, Rao SV, Roback JD, Shander A, Tobian AA, Weinstein R, Swinton McLaughlin LG, Djulbegovic B | display-authors = 6 | title = Red blood cell transfusion: a clinical practice guideline from the AABB* | journal = Annals of Internal Medicine | volume = 157 | issue = 1 | pages = 49–58 | date = July 2012 | pmid = 22751760 | doi = 10.7326/0003-4819-157-1-201206190-00429 | doi-access = free | others = Clinical Transfusion Medicine Committee of the, AABB }}</ref>。 輸血1単位ごとにリスクが伴うため、現在では、それよりも低い7~8g/dLのヘモグロビン値下限が通常使用されており、[[転帰]]も良いとされている<ref name="AABBfive">{{Citation |date= 24 April 2014 |title= Five Things Physicians and Patients Should Question |publisher= American Association of Blood Banks |work= {{仮リンク|Choosing Wisely|en|Choosing Wisely|redirect=1|label=Choosing Wisely}}: an initiative of the {{仮リンク|ABIM Foundation|en|ABIM Foundation|redirect=1|label=ABIM Foundation}} |url= http://www.choosingwisely.org/doctor-patient-lists/american-association-of-blood-banks |access-date= 25 July 2014}}</ref><ref>{{Cite journal | vauthors = Carson JL, Stanworth SJ, Dennis JA, Trivella M, Roubinian N, Fergusson DA, Triulzi D, Dorée C, Hébert PC | display-authors = 6 | title = Transfusion thresholds for guiding red blood cell transfusion | journal = The Cochrane Database of Systematic Reviews | volume = 12 | issue = 12 | pages = CD002042 | date = December 2021 | pmid = 34932836 | pmc = 8691808 | doi = 10.1002/14651858.CD002042.pub5 }}</ref>。出血していない入院患者に対しては、1単位の赤血球輸血がよく行われ、この治療後に、症状やヘモグロビン値を再評価する<ref name="AABBfive" />。[[酸素飽和度]]の低い患者は、より多くの輸血を必要とする可能性がある<ref name="AABBfive" />。 より重度の貧血に対してのみ輸血を使用するという勧告的注意は、多量の輸血を行うと転帰が悪化するという[[エビデンス (医学)|エビデンス]]によるところもある<ref>{{Cite journal | vauthors = Villanueva C, Colomo A, Bosch A, Concepción M, Hernandez-Gea V, Aracil C, Graupera I, Poca M, Alvarez-Urturi C, Gordillo J, Guarner-Argente C, Santaló M, Muñiz E, Guarner C | display-authors = 6 | title = Transfusion strategies for acute upper gastrointestinal bleeding | journal = The New England Journal of Medicine | volume = 368 | issue = 1 | pages = 11–21 | date = January 2013 | pmid = 23281973 | doi = 10.1056/NEJMoa1211801 | doi-access = free }}</ref> 。[[胸痛]]や[[息切れ]]などの[[心血管疾患]]の症状がある患者に対しては、輸血を考慮してもよい<ref name="AABB2012" /> 。 他の血液製剤の適応は凝固障害への{{仮リンク|新鮮凍結血漿|en|fresh frozen plasma|redirect=1}}や血小板減少への{{仮リンク|濃厚血小板|en|Platelet concentrate|redirect=1}}などである<ref>{{Cite web |url=https://ashpublications.org/hematology/article/2013/1/638/20793/Transfusion-guidelines-when-to-transfuse |title=Transfusion guidelines: when to transfuse |access-date=2024-04-28 |publisher=American Society of Hematology}}</ref>。 |
|||
== 手技 == |
|||
輸血製剤の量は「単位」で表記する。日本では200 mlの献血から作られる量が1単位で、国により量が異なる。かつては[[白血球#白血球の種類|顆粒球]]輸血も行われていたが、副作用が多いこと、[[顆粒球コロニー刺激因子|G-CSF]]が発見され投与されるようになったことなどから現在では少数派となりつつある。しかし小児や、なかなか[[顆粒球コロニー刺激因子|G-CSF]]の効果が現れないような症例の場合には非常に有効となるので、現在でも[[京都大学|京大]]などの一部の医療機関では行われている。 |
|||
[[ファイル:Blausen 0087 Blood Transfusion.png|thumb|輸血を行っている状況のイラスト]] |
|||
=== 濃厚赤血球 === |
|||
=== 献血の供給源 === |
|||
略称はRBC、RBC-LR、RCC、RCC-LR、RC-M.A.P.(RBC:Red Blood Cells, 旧略称RCC:Red Cells Concentrates, MAP:Mannitol Adenine Phosphate)<ref>{{Cite web|和書|date = 2014-07 | title = 2014年8月1日より「赤血球液-LR(RBC-LR)[日赤]」に商品名変更(旧称「赤血球濃厚液-LR(RCC-LR)[日赤]」)| publisher = 日本赤十字社 |url = http://www.jrc.or.jp/mr/product/information/pdf/info_H2607_RBC.pdf|format=PDF|accessdate = 2018-06-15}}</ref><ref>{{Cite web|和書|date = 2013-12 | title = 生物学的製剤基準の改正に基づく添付文書等の改訂及び赤血球製剤の販売名変更について | publisher = 日本赤十字社 |url = http://www.jrc.or.jp/mr/product/information/pdf/iyakuhin_oshirase1312_131225.pdf|format=PDF|accessdate = 2018-06-15}}</ref>等。全血から、赤血球のみを取り出し、MAPなどの保存液を添加したもの。極度の[[貧血]](鉄欠乏やビタミンB<sub>12</sub>欠乏など薬物治療が有効でないものに限る)や外傷・手術による[[出血]]に対して用いる。2007年2月より全白血球除去となり、薬価も4000円ほど (400 ml) 高くなった。しかし、全く白血球が残存していないことが保証されているわけではない。保存期間は2 - 6℃で28日間 (2023年3月13日以降の製剤より、採血後21日間から採血後28日間へと変更された)。通常は2単位を1時間で点滴する{{要出典|date=2022年11月}}。他の低張な[[輸液]]製剤と混ぜると溶血することがあるので注意が必要である。1単位は血液200 mlを遠心分離によって区分けし、保存液などを合わせて140 mLとしている。マップ (MAP) と略称されることがあるが、その言葉は、全く濃厚赤血球を意味しない。また、日本国内で製造、販売されている濃厚赤血球は、ほとんどすべてが、「照射赤血球液-LR」という製品であり、製造元で使用されている略称は、「Ir-RBC-LR」である。「Ir」とは、放射線を照射(Irradiation)することにより、僅かに含まれている白血球を不活化し、[[GVHD]]の発症を予防している事を示す。「LR」は、白血球除去処理済み (Leukocytes Reduced) の略語である。 |
|||
{{Main|献血|売血}} |
|||
輸血される血液の供給源には、[[レシピエント]]自身([[自己血輸血]])と、それ以外の人(同種間輸血)がある。後者が前者よりもはるかに多い。他人の血液を使用するには、まず[[献血]]からはじまる。献血は、[[静脈]]から[[全血]]として提供され、[[抗凝固剤]]を混和される。先進国では、供血者は通常、レシピエントに対して秘匿されているが、{{仮リンク|血液バンク|en|blood bank|redirect=1}}に保管されている血液製剤は、献血、検査、成分分離、保管、レシピエントへの投与という全サイクルを通じて、常に個別に追跡可能である。これにより、輸血に関連した疾病感染や[[輸血反応]]が疑われる場合の管理や調査が可能になる。 |
|||
;濃厚赤血球の適正使用 |
|||
循環血液量の15 - 20%の出血なら細胞外補充液、20 - 50%なら人工膠質液を投与し、赤血球不足による酸素供給不足が疑われればRBCを投与する。通常、慢性貧血でも日常生活(QOL)などに支障が無ければ輸血は行われない。また、AIHA(自己免疫性溶血性貧血)でも最初は副腎皮質ステロイド薬が第一選択となる。輸血開始から長くても約6時間以内に輸血を完了させるのが望ましい。 |
|||
研究によると、献血の主な動機付けは社会貢献(利他主義、無私、慈善など)である傾向がある一方、主な阻害因子には恐怖、不信感<ref>{{Cite journal |last1=Edwards |first1=Patrick W. |last2=Zeichner |first2=Amos |date=January 1985 |title=Blood donor development: Effects of personality, motivational and situational variables |url=http://dx.doi.org/10.1016/0191-8869(85)90085-6 |journal=Personality and Individual Differences |volume=6 |issue=6 |pages=743–751 |doi=10.1016/0191-8869(85)90085-6 |issn=0191-8869}}</ref><ref name=":43">{{Cite journal |last1=Muthivhi |first1=Tshilidzi |last2=Olmsted |first2=M. |last3=Park |first3=H. |last4=Sha |first4=Mandy |date=August 2015 |title=Motivators and deterrents to blood donation among Black South Africans: a qualitative analysis of focus group data |journal=Transfusion Medicine |language=en |volume=25 |issue=4 |pages=249–258 |doi=10.1111/tme.12218 |issn=0958-7578 |pmc=4583344 |pmid=26104809}}</ref> 、あるいは歴史的文脈における人種差別意識などがある<ref name=":43" /> |
|||
;濃厚赤血球の投与量計算 |
|||
。 |
|||
RBC-LRの1単位のHb値は19g/dl、容量は140ml(2単位なら280ml)なので1単位あたり19g/dl×140ml/100=約26gのHbが含まれている。また循環血液量は70mL/kgなので |
|||
世界で集められた1億1,850万件の献血のうち、40%は世界人口の16%が住む高所得国で集められている<ref name=":23">{{Cite web |title=Blood safety and availability |url=https://www.who.int/news-room/fact-sheets/detail/blood-safety-and-availability |website=www.who.int |access-date=2024-04-28 |language=en}}</ref>。低所得国では、輸血の最大54%が5歳未満の子供に投与されている<ref name=":23" />。一方、高所得国では、最も頻繁に輸血される患者グループは60歳以上であり、すべての輸血の最大76%を占めている<ref name=":23" />。2008年から2018年にかけて、合計で79カ国が、血液供給の90%以上を自発的な無給献血者から集めている<ref name=":23" />。しかし、54カ国では、血液供給の50%以上を家族/代替ドナーまたは有償ドナーから集めている<ref name=":23" />。 |
|||
予測上昇Hb値(g/dl)=投与Hb量(g)/体重(kg)×(70ml/kg) /100 |
|||
=== 献血の処理と検査 === |
|||
例えば体重70kgの患者に2単位のRBCを投与した場合、上記の式より |
|||
献血された血液は通常、特定の患者集団での使用に適するように、採取後に処理される。採取された血液は、遠心分離によって[[赤血球]]、[[血漿]]、[[血小板]]、{{仮リンク|ヒト血清アルブミン|en|Human serum albumin|redirect=1|label=アルブミン}}[[タンパク質]]、凝固因子濃縮物、{{仮リンク|クリオプレピシテート|en|cryoprecipitate|redirect=1}}、[[フィブリノゲン]]濃縮物、[[免疫グロブリン]](抗体)などの血液成分に分離される。血漿や血小板は[[アフェレーシス]]と呼ばれるより複雑なプロセスを経て、個別に献血することもできる<ref name=":8">{{Cite web |title=ドナーアフェレシスとは? |url=https://www.apheresis-jp.org/143011.html |website=日本アフェレシス学会 |access-date=2024-04-07}}</ref>。これを成分献血という<ref name=":8" />。 |
|||
*[[世界保健機関]](WHO)は、提供されたすべての血液について、輸血感染症の検査を行うことを推奨している。これらの感染症には、[[ヒト免疫不全ウイルス|HIV]]、[[B型肝炎]]、[[C型肝炎]]、[[梅毒]](Treponema pallidum)、および関連する場合には、[[クルーズトリパノソーマ]]([[シャーガス病]])や[[マラリア原虫]]など、血液供給の安全性にリスクをもたらすその他の感染症が含まれる<ref>{{Cite book |title=Screening donated blood for transfusion-transmissible infections: recommendations |date=2009 |publisher=World Health Organization |isbn=978-92-4-154788-8 |url=http://apps.who.int/iris/bitstream/10665/44202/1/9789241547888_eng.pdf |archive-url=https://ghostarchive.org/archive/20221009/http://apps.who.int/iris/bitstream/10665/44202/1/9789241547888_eng.pdf |archive-date=2022-10-09 |url-status=live}}</ref>: WHOによると、10カ国では、HIV、B型肝炎、C型肝炎、梅毒の1つ以上について、すべての献血血液をスクリーニングできていない<ref name=":0">{{Cite web |title=Blood safety and availability Fact sheet 279 |url=https://www.who.int/mediacentre/factsheets/fs279/en/ |publisher=World Health Organization |access-date=21 January 2016}}</ref>。 その主な理由のひとつは、検査キットが常に利用できるわけではないからである<ref name=":0" />。しかし、輸血感染症の[[有病率]]は、中所得国や高所得国に比べて低所得国の方がはるかに高い<ref name=":0" />。未知の病原体による感染症のリスクは排除できない<ref>水野樹、「[[doi:10.2199/jjsca.30.925|術中回収式自己血輸血:産科手術]]」 『日本臨床麻酔学会誌』 2010年 30巻 7号 p.925-930, {{doi|10.2199/jjsca.30.925}}, P.925</ref>。 |
|||
* すべての提供血液が、患者に、確実に適合する血液を輸血されるために、[[ABO式血液型]]と[[Rh因子|Rh式血液型]]についても検査されるべきである<ref>{{Cite web|title=Testing of donated blood|url=https://www.who.int/bloodsafety/donation_testing/en/|archive-url=https://web.archive.org/web/20110318122653/http://www.who.int/bloodsafety/donation_testing/en/|url-status=dead|archive-date=March 18, 2011|website=World Health Organization|access-date=21 January 2016}}</ref>。 |
|||
予測上昇Hb値(g/dL)= 19g/dl×280ml/100/70kg×(70ml/kg) /100 |
|||
* さらに、血小板製剤は、室温で保存されるために汚染されやすいため、細菌感染についても検査される国もある<ref>{{Cite journal|date=April 2014|title=The international experience of bacterial screen testing of platelet components with an automated microbial detection system: a need for consensus testing and reporting guidelines|journal=Transfusion Medicine Reviews|volume=28|issue=2|pages=61–71|doi=10.1016/j.tmrv.2014.01.001|pmid=24636779|vauthors=Benjamin RJ, McDonald CP|author3=ISBT Transfusion Transmitted Infectious Disease Bacterial Workgroup}}</ref><ref>{{Cite web |title=Bacterial Detection Testing by Blood and Blood Collection Establishments and Transfusion Services to Enhance the Safety and Availability of Platelets for Transfusion |url=https://www.fda.gov/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/Guidances/Blood/ucm426310.htm |website=FDA U.S. Food and Drug Administration |access-date=21 January 2016}}</ref>。[[移植 (医療)|臓器移植]]やHIV感染者など、特定の免疫不全レシピエントに投与された場合のリスクを考慮して、[[サイトメガロウイルス]](CMV)の有無も検査されることがある。しかし、CMV陰性の血液は、患者のニーズを満たすために一定量しか必要とされないため、すべての血液がCMV検査されるわけではない。CMV陽性以外では、感染症陽性と判定された製品は使用されない<ref>{{Cite journal|date=February 2014|title=Prevention of Transfusion-Transmitted Cytomegalovirus Infections: Which is the Optimal Strategy?|journal=Transfusion Medicine and Hemotherapy|volume=41|issue=1|pages=40–44|doi=10.1159/000357102|pmc=3949610|pmid=24659946|vauthors=Ziemann M, Hennig H}}</ref>。 |
|||
<nowiki>=</nowiki>約1.08g/dlとなる |
|||
* 白血球除去(Leukocyte reduction: LR)とは、濾過によって白血球を除去することである。LR血液製剤は、[[ヒト白血球型抗原|ヒト白血球型抗原(HLA)]]{{仮リンク|同種免疫|en|alloimmunization|redirect=1}}、{{仮リンク|発熱性非溶血性輸血反応|en|Febrile non-hemolytic transfusion reaction|redirect=1}}、[[サイトメガロウイルス|サイトメガロウイルス感染]]、および{{仮リンク|血小板輸血不応症|en|platelet-transfusion refractoriness|redirect=1}}を引き起こす可能性が低い<ref name=":3">{{Cite journal | vauthors = Bassuni WY, Blajchman MA, Al-Moshary MA | title = Why implement universal leukoreduction? | journal = Hematology/Oncology and Stem Cell Therapy | volume = 1 | issue = 2 | pages = 106–123 | year = 2008 | pmid = 20063539 | doi = 10.1016/s1658-3876(08)50042-2 | doi-access = free }}</ref>。[[日本赤十字社]]製造の血液製剤では、血液採取バッグに白血球除去フィルターが具備されており、採血の段階で白血球除去を達成しており、従来輸血時に必要とされた白血球除去フィルターは不要となっている<ref>{{Cite web |title=保存前白血球除去|安全対策|輸血用血液製剤|医薬品情報|日本赤十字社 |url=http://www.jrc.or.jp/mr/blood_product/safety/leu_reduction/ |website=www.jrc.or.jp |access-date=2024-04-07 |language=ja}}</ref>。 |
|||
=== 濃厚血小板 === |
|||
* 輸血用血液製剤中のリンパ球が、レシピエントの組織を非自己と認識し、レシピエントの体内で増殖してレシピエントを攻撃することがあり、これを[[移植片対宿主病]]([[輸血後移植片対宿主病|献血後GVHD]])という<ref name=":9">{{Cite web |title=製剤への放射線照射|安全対策|輸血用血液製剤|医薬品情報|日本赤十字社 |url=http://www.jrc.or.jp/mr/blood_product/safety/irradiation/ |website=www.jrc.or.jp |access-date=2024-04-07 |language=ja}}</ref>。リンパ球を不活化するためには、血液製剤に放射線照射が行われる<ref name=":9" />。 |
|||
略称はPC(英語名のPlatelet Concentratesから)。 |
|||
20 - 24℃で振盪して保存する。2004年10月より全製剤白血球除去(1バッグあたり10の6乗以下)となっている。さらに有効期間は2007年11月に「採血後72時間以内」から「採血後4日間」と延長された。使用対象の疾患が複雑で、普通は血小板不足による出血に対して用いるが、中には禁忌の疾患もある。輸血による副作用を防ぐ目的で洗浄血小板が使用される<ref>麻田真由美, 菅野知恵美, 川本佳代 ほか、「[https://doi.org/10.3925/jjtc1958.48.32 洗浄血小板による輸血副作用の防止]」 『日本輸血学会雑誌』 2002年 48巻 1号 p.32-36, {{doi|10.3925/jjtc1958.48.32}}</ref>。 |
|||
* 他には、{{仮リンク|リボフラビンと紫外線による血液製剤の病原体低減|en|Pathogen Reduction Using Riboflavin and UV Light|redirect=1}}が、GVHDを予防する方法として放射線照射の代替として提案されている<ref>{{Cite journal|date=September 2006|title=Mirasol PRT treatment of donor white blood cells prevents the development of xenogeneic graft-versus-host disease in Rag2-/-gamma c-/- double knockout mice|journal=Transfusion|volume=46|issue=9|pages=1553–1560|doi=10.1111/j.1537-2995.2006.00939.x|pmid=16965583|vauthors=Fast LD, DiLeone G, Cardarelli G, Li J, Goodrich R|s2cid=13065820}}</ref><ref>{{Cite journal|date=July 2011|title=Inactivation of human white blood cells in platelet products after pathogen reduction technology treatment in comparison to gamma irradiation|journal=Transfusion|volume=51|issue=7|pages=1397–1404|doi=10.1111/j.1537-2995.2010.02984.x|pmid=21155832|vauthors=Fast LD, DiLeone G, Marschner S|s2cid=34154946}}</ref><ref>{{Cite journal|date=April 2008|title=Toxicity testing of a novel riboflavin-based technology for pathogen reduction and white blood cell inactivation|journal=Transfusion Medicine Reviews|volume=22|issue=2|pages=133–153|doi=10.1016/j.tmrv.2007.12.003|pmid=18353253|vauthors=Reddy HL, Dayan AD, Cavagnaro J, Gad S, Li J, Goodrich RP}}</ref>。[[リボフラビン]]を添加し、その後[[紫外線]]を照射する病原体低減処理が、血液製剤中の病原体(ウイルス、細菌、寄生虫、そして白血球も)を不活化するのに有効であることが示されている<ref>{{Cite journal | vauthors = Hardwick CC, Herivel TR, Hernandez SC, Ruane PH, Goodrich RP | title = Separation, identification and quantification of riboflavin and its photoproducts in blood products using high-performance liquid chromatography with fluorescence detection: a method to support pathogen reduction technology | journal = Photochemistry and Photobiology | volume = 80 | issue = 3 | pages = 609–615 | year = 2004 | pmid = 15382964 | doi = 10.1562/0031-8655(2004)080<0609:TNSIAQ>2.0.CO;2 | s2cid = 198154059 }}</ref><ref>{{Cite journal | title = A randomized controlled clinical trial evaluating the performance and safety of platelets treated with MIRASOL pathogen reduction technology | journal = Transfusion | volume = 50 | issue = 11 | pages = 2362–2375 | date = November 2010 | pmid = 20492615 | doi = 10.1111/j.1537-2995.2010.02694.x | s2cid = 28186229 | first23 = J. | first22 = R.P. | first20 = P. | first26 = B. | first25 = R.J. | first19 = Gines | first18 = Paolo | first12 = D. | first13 = R. | first24 = C. | first16 = T. | first17 = J. | first14 = J.-D. | first15 = L. }}</ref><ref>{{Cite journal | vauthors = Goodrich RP, Edrich RA, Li J, Seghatchian J | title = The Mirasol PRT system for pathogen reduction of platelets and plasma: an overview of current status and future trends | journal = Transfusion and Apheresis Science | volume = 35 | issue = 1 | pages = 5–17 | date = August 2006 | pmid = 16935562 | doi = 10.1016/j.transci.2006.01.007 }}</ref> 。 |
|||
;濃厚血小板の適正使用 |
|||
=== 血液適合性試験 === |
|||
{{Main|{{仮リンク|血液適合性試験|en|Blood compatibility testing|redirect=1}}}} |
|||
受血者の輸血前の検査には以下の3つが含まれる<ref>{{Citation|title=Pretransfusion Testing|last=Basavarajegowda|first=Abhishekh|last2=Shastry|first2=Shamee|date=2024|url=http://www.ncbi.nlm.nih.gov/books/NBK585033/|publisher=StatPearls Publishing|pmid=36251808|access-date=2024-04-28}}</ref>。 |
|||
# [[血液型]]検査(タイピング) |
|||
血小板が5万/uL以上あれば重篤な出血は無い{{要出典|date=2022年11月}}。 |
|||
# 抗体スクリーニング |
|||
:大量出血、[[再生不良性貧血]]、白血病、その他放射線や化学治療により骨髄がダメージを受けた場合(急性白血病の寛解導入療法では血小板数が急激に低下するため、1 - 2万/ul以上は維持する)。 |
|||
# [[交差適合試験]](クロスマッチング) |
|||
;場合により使用を検討する疾患 |
|||
:DIC、先天性血小板機能異常症、その他手術での希釈性凝固障害など。 |
|||
;禁忌、もしくは効果がない疾患 |
|||
:TTP(血栓性血小板減少性紫斑病)、ITP(特発性血小板減少性紫斑病)、輸血後紫斑病、脾臓機能亢進症、ヘパリン起因性血小板減少症(HIT)、溶血性尿毒症症候群 |
|||
輸血が行われる前の最初のステップは、レシピエントの血液型検査と抗体スクリーニングである。これを'''タイプ&スクリーン'''('''T & S''')という<ref name=":25">{{Cite web |title=Type & Screenについて|北海道赤十字血液センター|日本赤十字社 |url=https://www.bs.jrc.or.jp/hkd/hokkaido/ |website=北海道赤十字血液センター |access-date=2024-04-29 |language=ja |last=北海道赤十字血液センター}}</ref>。レシピエントの血液型を判定することで、ABOとRhの血液型が判明する。その後、ドナーの血液と反応する可能性のある[[不規則抗体]]のスクリーニングが行われる<ref name=":25" /><ref name="uutah">Blood Processing. [[ユタ大学|University of Utah]]. Available at: http://library.med.utah.edu/WebPath/TUTORIAL/BLDBANK/BBPROC.html. Accessed on: December 15, 2006.</ref> 。不規則抗体とは抗A、抗B、抗A・B以外の赤血球同種抗原に対する抗体の総称である<ref>{{Cite web |url=https://www.jrc.or.jp/mr/news/pdf/1511-145%E3%80%90%E6%A0%A1%E4%BA%86%E3%80%91.pdf |title=不規則抗体の臨床的意義と抗原陰性血の選択について |access-date=2024-04-29 |publisher=[[日本赤十字社]]}}</ref>。使用される方法によっても異なるが、[[ユタ大学]]では完了までには約45分かかる<ref name="uutah" />。血液バンクの技師はまた、レシピエントの特別な要求(例えば、血球洗浄、放射線照射、CMV陰性の血液の必要性)や、過去に確認された抗体やその他の血清学的異常の有無を確認するために患者の病歴をチェックする。 |
|||
;濃厚血小板の投与量計算 |
|||
:予測血小板増加数(/ul)=輸血血小板総数/{循環血液量(ml)×(10の3乗)}×(2/3) |
|||
:またPC10単位あたりの血小板数は2×(10の11乗) |
|||
[[ファイル:Serology interpretation of antibody panel for blood group antigens.jpg|thumb|300px|抗体パネル検査|左]] |
|||
例えば体重70kgの患者に10単位のPCを投与した場合、上記の式より |
|||
[[スクリーニング (医学)|スクリーニング]]が陽性であれば、臨床的に重要な意味を持つかどうかを判断するために抗体パネル検査を行う必要がある。抗体パネルは、一般的に遭遇する臨床的に重要なアロ抗体に対応する抗原について表現型が決定されているドナーの市販のO型赤血球懸濁液から構成される。ドナー細胞はホモ接合体(例えばK+k+)、ヘテロ接合体(K+k-)、あるいは様々な抗原を発現していない(K-k-)場合がある。検査される全ドナー細胞の表現型はチャートで示される。レシピエントの[[血清]]が、様々なドナー細胞に対して検査される。ドナー細胞に対するレシピエントの血清の反応に基づいて、1つ以上の抗体の存在を確認するパターンが現れる。すべての抗体が臨床的に重要である(すなわち、輸血反応、HDNなどを引き起こす)わけではない。レシピエントが臨床的に重要な抗体を発現したら、将来の輸血反応を予防するために抗原陰性の赤血球を投与することが重要である。抗体検査の一環として、直接抗グロブリン試験([[クームス試験]])も行われる<ref>{{Cite book | vauthors = Harmening D |title=Modern Blood Banking and Transfusion Practices |location=Philadelphia |publisher=F. A. Davis |edition=4th |year=1999 |isbn=978-0-8036-0419-3 |url-access=registration |url=https://archive.org/details/isbn_9780803604193 }}</ref>。 |
|||
:予測血小板増加数(/ul)= 2×(10の11乗)/{70kg×(70ml/kg)×(10の3乗)}×(2/3) |
|||
:<nowiki>=</nowiki>約27000/ulとなる |
|||
レシピエント血清にドナーへの抗体が存在しない場合、即時スピン[[交差適合試験]]またはコンピュータ支援交差適合試験が行われ、 レシピエント血清とドナー赤血球が[[インキュベーター (生物学)|インキュベート]]される。即時スピン法では、2滴の患者血清を試験管に入れた3~5%のドナー細胞懸濁液1滴と反応させ、卓上[[遠心分離機]]でスピンさせる。試験管内の凝集または[[溶血]](すなわちクームス試験陽性)が認められれば、陽性反応であり、輸血すべきでない。 |
|||
;CCI(補正血小板増加数)の計算 |
|||
輸血効果はCCI(補正血小板増加数)で判定される。 |
|||
レシピエント血清に抗体の存在が疑われる場合、まずドナーの血液製剤の表現系を把握して対応する抗原をスクリーニングする必要がある。抗原陰性の製剤は、さらに、反応性を高めて検査を容易にするために、37℃で抗グロブリン/間接クロスマッチ法を用いて患者血漿に対して検査される。 |
|||
1時間後に7500(/ul)、24時間後でも4500(/ul)を下回れば無効。その場合はHLA抗体の存在が疑われ、HLA適合血小板の輸血が必要となる。 |
|||
:CCI=増加血小板数(/ul) ×体表面積(m2)/輸血血小板総数 (×10の11乗) |
|||
クロスマッチングが完了せず、患者で発生しているヘモグロビン低下のリスク(主に出血)がクロスマッチングしていない血液を輸血するリスクを上回る緊急の場合は、O型RH陰性血液を使用し、その後できるだけ早くクロスマッチングを行う。O型陰性輸血は小児や妊娠可能な年齢の女性にも使用される。このような場合、検査室は輸血前に血液サンプルを採取し、血液型決定とスクリーニングを行い、患者の実際の血液型を決定し、同種抗体をチェックすることが望ましい。 |
|||
例えば体表面積14m2の患者のPC10単位投与1時間後に10000(/ul)上昇していた場合、上記の式より |
|||
:CCI=10000(/ul) ×1.4(m2)/2.0(×10の11乗) |
|||
:<nowiki>=</nowiki>7000(/ul)となり、7500以下なので無効となる。 |
|||
====赤血球輸血におけるABO血液型並びにRH血液型の適合==== |
|||
=== 新鮮凍結血漿 === |
|||
この表は、ABO式とRh式を用いて、ドナーとレシピエント間の輸血で適合する可能性のある血液を示したものである。記号[[ファイル:Blood drop plain.svg|25px]]は適合輸血を示す<ref>{{Cite web |title=Which blood types are compatible with each other: Blood type compatibility |url=https://www.blood.ca/en/stories/blood-type-compatibility-which-blood-types-are-compatible-each-other |website=www.blood.ca |access-date=2024-04-29 |language=en}}</ref>。 |
|||
略称はFFP(英語名のFresh-frozen Plasmaから)。採血後分離した血漿成分を6時間以内に-20℃で凍結したもの。使用直前に30 - 37℃で融解し、融解後は直ちに使用する。直ちに使用できない場合は、2~6℃で保存し、融解後24時間以内に使用する。血漿中には[[アルブミン]]などの血漿蛋白や種々の[[凝固因子]]が含まれる。血中[[蛋白質|蛋白]]の不足だけならば[[アルブミン]]製剤で補えるので、新鮮凍結血漿が必要になるのは[[播種性血管内凝固症候群|DIC]]など凝固因子が枯渇している場合である。 |
|||
{| class="wikitable" style="text-align: center" |
|||
!colspan=2 rowspan=2| |
|||
! colspan="8" |ドナー血液型 |
|||
|- |
|||
!O−!!O+!!B−!!B+!!A−!!A+!!AB−!!AB+ |
|||
|- |
|||
! rowspan="8" |レシピエント血液型 |
|||
!AB+ |
|||
|[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]] |
|||
|- |
|||
!AB− |
|||
|[[ファイル:Blood drop plain.svg|25px]]||||[[ファイル:Blood drop plain.svg|25px]]||||[[ファイル:Blood drop plain.svg|25px]]||||[[ファイル:Blood drop plain.svg|25px]]|| |
|||
|- |
|||
!A+ |
|||
|[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||||||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]|||| |
|||
|- |
|||
!A− |
|||
|[[ファイル:Blood drop plain.svg|25px]]||||||||[[ファイル:Blood drop plain.svg|25px]]|||||| |
|||
|- |
|||
!B+ |
|||
|[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]|||||||| |
|||
|- |
|||
!B− |
|||
|[[ファイル:Blood drop plain.svg|25px]]||||[[ファイル:Blood drop plain.svg|25px]]|||||||||| |
|||
|- |
|||
!O+ |
|||
|[[ファイル:Blood drop plain.svg|25px]]||[[ファイル:Blood drop plain.svg|25px]]|||||||||||| |
|||
|- |
|||
!O− |
|||
|[[ファイル:Blood drop plain.svg|25px]]|||||||||||||| |
|||
|} |
|||
[[ファイル:Agglutinatie rode bloedcellen libtheora.ogg|thumb|不適合輸血による赤血球の凝集(顕微鏡画像)]] |
|||
== 副作用 == |
|||
[[2005年]]から、採血後6か月間の貯留保管が実施されており、現在、医療現場で使用されているFFPは全て採血後6か月間の貯留保管期間を経過した製剤である。保存期間は-20℃以下で1年間。 |
|||
医薬品の安全性が{{仮リンク|ファーマコビジランス|en|pharmacovigilance|redirect=1}}ファーマコビジランスによって監督されるのと同様に、血液および血液製剤の安全性はhaemovigilanceヘモビジランスによって監督される。これは、世界保健機関(WHO)によって、「輸血の安全性、有効性、効率性を高めるために、ドナーからレシピエントまでの輸血流通路のすべての活動を網羅し、輸血に関連する望ましくない事象の発生または再発を特定し、防止する」ためのシステム と定義されている。このシステムには、輸血および血液製剤製造に関連する [[ヒヤリ・ハット|ヒヤリハット]]および有害事象の監視、特定、報告、調査、分析が含まれるべきである<ref>{{Cite web|url=https://www.who.int/bloodsafety/haemovigilance/en/ |archive-url=https://web.archive.org/web/20110318122450/http://www.who.int/bloodsafety/haemovigilance/en/ |url-status=dead |archive-date=March 18, 2011 |title=WHO | Haemovigilance |publisher=Who.int |date=2013-06-25 |access-date=2013-12-11}}</ref> 。英国では、このデータはSHOT(Serious Hazards Of Transfusion)と呼ばれる独立組織によって収集されている<ref>{{Cite web |url=http://www.shotuk.org/home/shot-organisation/141-2/ |title=SHOT Terms of Reference |publisher=Shotuk.org |access-date=22 August 2014 |archive-date=30 September 2020 |archive-url=https://web.archive.org/web/20200930013157/https://www.shotuk.org/home/shot-organisation/141-2/ |url-status=dead }}</ref>。 |
|||
血液製剤の輸血はいくつかの合併症と関連しており、その多くは免疫学的または感染に分類される。保存中の潜在的な品質劣化については議論がある<ref>Wang, SS. "What's the Shelf Life of Blood? Focus on Whether Older Donations Impair Recovery of Transfusion Recipients". ''The Wall Street Journal''. 2009 Dec. 1.</ref>。 |
|||
;新鮮凍結血漿の適正使用 |
|||
=== 有害作用 === |
|||
一般的に出血量100%以上で希釈性凝固障害が起きた際に使用される。また、凝固因子「[[第V因子]]」「[[第XI因子]]」欠乏症に対する濃縮製剤は無いため、これを補充するにはFFPを使うしかない。[[血栓性血小板減少性紫斑病]] (TTP) の場合、TTPは血清中にADAMTS13に対する自己抗体ができ、そのためフォン・ウィルブランド因子マルチマーを切断できず血小板血栓が生じる疾患なのでFFPで血漿交換療法を行う。L―[[アスパラギナーゼ]]投与に伴う出血には適応となるが、逆に[[クマリン]]系薬剤に伴う出血の場合、これは[[肝臓]]で第、II、VII、IX、X因子を合成する際に必要なビタミンK依存性酸素反応の阻害剤なので、これらの欠乏にはFFPではなくビタミンKの補充を行う。融解後直ちに輸血を開始するのが望ましい。これは融解してから凝固因子の活性低下が始まることに起因している。 |
|||
* {{仮リンク|急性溶血性輸血反応|en|Acute hemolytic transfusion reaction|redirect=1}} は、英国のSerious Hazards of Transfusion (SHOT)によると、「輸血後24時間以内の発熱およびその他の症状ないしは溶血徴候を指し、Hbの低下、[[乳酸脱水素酵素]](LDH)の上昇、直接抗グロブリン試験(DAT)陽性、[[クロスマッチ]]陽性のうちいずれか1つ以上によって確認されるもの」と定義されている<ref name=":1">{{Cite book|title = The 2014 Annual SHOT Report (2015)| vauthors = Bolton-Maggs PH, Poles D |publisher = SHOT|year = 2015|isbn = 978-0-9558648-7-2 |collaboration = Serious Hazards of Transfusion (SHOT) Steering Group|url = http://www.shotuk.org/wp-content/uploads/report-2014.pdf|access-date = 2016-01-21|archive-url = https://web.archive.org/web/20160127114949/http://www.shotuk.org/wp-content/uploads/report-2014.pdf|archive-date = 2016-01-27|url-status = dead}}</ref> 。これは、事前に形成されたレシピエント抗体によるドナー赤血球の破壊によるものである。 多くの場合、事務的なミスまたは不適切な[[ABO式血液型|ABO式血液型判定]]とクロスマッチングにより、ドナーとレシピエントのABO式血液型が不適合となるために起こる。症状としては、[[発熱]]、[[悪寒]]、[[胸痛]]、{{仮リンク|背部痛|en|back pain|redirect=1}}<ref name="LauraDean"/>、出血、[[頻脈|心拍数の増加]]、[[呼吸困難|息切れ]]、急激な[[低血圧|血圧低下]]などがある。不適合輸血が疑われる場合には、輸血を直ちに中止し、溶血の有無を評価するために血液を検査に送る必要がある。治療は対症療法である。溶血反応の影響により腎障害が起こることがある(色素腎症)<ref name=":2">{{Cite web|url = https://www.hhs.gov/ash/bloodsafety/2011-nbcus.pdf|title = The 2011 National Blood Collection and Utilization Survey Report|access-date = 21 January 2016|publisher = Department of Health and Human Services|archive-date = 19 March 2016|archive-url = https://web.archive.org/web/20160319015943/http://www.hhs.gov/ash/bloodsafety/2011-nbcus.pdf|url-status = dead}}</ref> 。輸血反応の重症度は、輸血されるドナーの抗原量、ドナーの抗原の性質、レシピエントの抗体の性質と量に依存する<ref name="LauraDean"/>。 |
|||
* {{仮リンク|遅発性溶血性輸血反応|en|Delayed hemolytic transfusion reaction|redirect=1}} は輸血後24時間以上経過してから起こる。通常、輸血後28日以内に起こる。遅発性溶血反応は、輸血開始前に存在した抗体のレベルが低く、輸血前検査では検出できないか、または輸血された血液中の抗原に対する新しい抗体が発現するために起こります。したがって、遅延溶血反応は、反応を引き起こすのに十分な抗体が利用できるようになる24時間後まで現れない。赤血球は[[マクロファージ]]によって血液循環から肝臓や脾臓に除去され、破壊される。その結果、血管外溶血が起こる。このプロセスは通常、抗Rh抗体と抗Kidd抗体によって媒介される。しかし、このタイプの輸血反応は、急性溶血性輸血反応と比較すると重症度は低い<ref name="LauraDean"/>。 |
|||
;新鮮凍結血漿の投与量計算 |
|||
* {{仮リンク|アレルギー性輸血反応|en|Allergic transfusion reaction|redirect=1}}はIgE抗アレルゲン抗体によって引き起こされる。抗体がその抗原と結合すると、[[肥満細胞]]や[[好塩基球]]から[[ヒスタミン]]が放出される。ドナー側またはレシピエント側のIgE抗体のいずれもがアレルギー反応を引き起こす可能性がある。[[花粉症]]のようなアレルギー疾患を持つ患者に多くみられる。患者はかゆみやじんましんを生じることがあるが、症状は通常軽度で、輸血を中止して[[抗ヒスタミン薬|抗ヒスタミン剤]]を投与することでコントロールできる<ref name="LauraDean" />。 |
|||
予測上昇凝固因子活性値(%)=FFP投与量(ml)×血管回収率(%)/循環血漿量(ml) |
|||
* {{仮リンク|発熱性非溶血性輸血反応|en|Febrile non-hemolytic transfusion reaction|redirect=1}} は、アレルギー性輸血反応と並んで最も一般的なタイプの輸血反応であり、保存されているドナーの血液中の白血球が放出する[[サイトカイン]]<ref name=":3" /> 、またはレシピエントの抗体によるドナーの白血球への攻撃のために起こる<ref name="LauraDean">{{Cite book| vauthors = Laura D |title= Blood Groups and Red Cell Antigens|date=2005|publisher=National Center for Biotechnology Information|location=Bethesda, United States|url=https://www.ncbi.nlm.nih.gov/books/NBK2261/|access-date=4 October 2017}}</ref> 。このタイプの反応は、輸血の約7%で起こる。 発熱は一般に短時間で、[[解熱薬|解熱剤]]で治療され、急性溶血反応が除外される限り輸血は完遂される。これが、赤血球製剤からドナーの白血球を濾過する白血球除去(leukoreduction: LR )が現在広く行われている理由である<ref name=":3" />。 |
|||
例えば体重70kgでヘマトクリット60%の患者にFFP4単位(480ml)投与すると、血管回収率を80%とすると、循環血漿量は70mL/kg×(1-Ht)なので、 |
|||
:予測上昇凝固因子活性値(%)=480(ml)×0.8/70kg×70mL/kg×(1-0.6) |
|||
:<nowiki>=</nowiki>約19.6%上昇する。 |
|||
* [[アナフィラキシー]]反応は、IgA抗血漿蛋白抗体によって引き起こされる、生命を脅かすまれなアレルギー症状である。{{仮リンク|選択的免疫グロブリンA欠損症|en|selective immunoglobulin A deficiency|redirect=1}}では、反応はドナーの血漿中のIgA抗体によって引き起こされると推定される。患者は発熱、[[呼気性喘鳴|喘鳴]]、咳、息切れ、[[ショック]]の症状を呈する。{{仮リンク|アドレナリン (薬剤)|en|epinephrine (medication)|redirect=1|label=アドレナリン}}による緊急治療が必要である<ref name="LauraDean" />。 |
|||
=== アルブミン製剤 === |
|||
急性の[[低蛋白血症]]に基づく病態や他の治療では、管理が困難な慢性低蛋白血症による病態に対して、一時的な病態改善を図るために使用する。25%製剤として献血アルブミン「ベネシス」、赤十字アルブミン、アルブミナー、5%製剤として献血アルブミン「ニチヤク」、献血アルブミン「ベネシス(JB)」などが有名である。かつては術後2日間は細胞外液と血清アルブミン濃度の減少がみられるため、様々な輸血製剤が用いられてきたが現在は細胞外液以外の補充は必要ないとされている。乏尿が出現し、細胞外液を負荷するのを躊躇する呼吸障害や低アルブミン血症が見られる場合は、細胞外液とアルブミン製剤を併用する場合はある。 |
|||
* {{仮リンク|輸血後紫斑病|en|Post-transfusion purpura|redirect=1|label=輸血後紫斑病(Post-transfusion purpura: PTP)}}は、血液製剤の輸血後に起こる極めてまれな合併症で、患者の血液中に、ドナーとレシピエントの両方の{{仮リンク|ヒト血小板抗原|en|Human platelet antigen|label=ヒト血小板抗原(Human platelet antigen: HPA)|redirect=1}}に対する抗体が存在することに関連している。このタンパク質を欠くレシピエントは、以前の輸血や以前の[[妊娠]]によってこのタンパク質に[[感作]]され、次の輸血で[[血小板減少症]]や皮膚への出血を発症し、{{仮リンク|紫斑|en|purpura|redirect=1}}として知られる皮膚の紫色の変色を示すことがあう。免疫グロブリン静注療法(IVIG)が選択される<ref name="LauraDean" /><ref>{{Cite book|title = Practical Transfusion Medicine| vauthors = Murphy M |publisher = Wiley-Blackwell|year = 2013|pages = 127–130|chapter = Post-transfusion purpura|edition = 4th| veditors = Murphy M, Pamphilon D, Heddle N }}</ref>。 |
|||
;アルブミン製剤の適正使用 |
|||
* {{仮リンク|輸血関連急性肺障害|en|Transfusion-related acute lung injury|redirect=1|label=輸血関連急性肺障害(Transfusion-related acute lung injury: TRALI)}} は、[[急性呼吸窮迫症候群]](ARDS)に類似した症候群であり、血漿含有血液製剤の輸血中または輸血後6時間以内に発症する。発熱、低血圧、息切れ、頻脈がこの種の反応でしばしば起こる。確定診断のためには、輸血後6時間以内に症状が発現し、[[低酸素血症]]が存在し、両側浸潤の[[胸部X線]]所見があり、左房圧負荷(体液過多)の所見がないことが必要である<ref name=":5">{{Cite web|url=https://www.cdc.gov/nhsn|title=NHSN {{!}} CDC|date=2017-12-29|website=www.cdc.gov|language=en-us|access-date=2018-09-18}}</ref>。 輸血患者の15%に発生し、死亡率は5〜10%とされる。レシピエントの危険因子には、末期肝疾患、敗血症、血液学的悪性腫瘍、[[機械換気 (医学)|人工呼吸]]患者などがある。ヒト好中球抗原(HNA)およびヒト白血球抗原(HLA)に対する抗体が、この種の輸血反応と関連している。ドナーの抗体が抗原陽性のレシピエント組織と相互作用すると、炎症性サイトカインが放出され、肺毛細血管漏出が生じる。治療は[[対症療法]]である<ref>{{Cite journal | vauthors = Kim J, Na S | title = Transfusion-related acute lung injury; clinical perspectives | journal = Korean Journal of Anesthesiology | volume = 68 | issue = 2 | pages = 101–105 | date = April 2015 | pmid = 25844126 | pmc = 4384395 | doi = 10.4097/kjae.2015.68.2.101 }}</ref>。 |
|||
50 - 100%の出血では、濃度低下による肺水腫や乏尿を防ぐため使用する。またギランバレー症候群に対する血漿交換の置換液としても使用される。投与後の目標血清アルブミン濃度としては、急性の場合は3.0g/dL以上、慢性の場合は 2.5g/dl以上とする。 |
|||
* {{仮リンク|輸血関連循環過負荷|en|Transfusion associated circulatory overload|redirect=1|label=輸血関連循環過負荷(Transfusion associated circulatory overload: TACO)}}は、一般的ではあるが、見落とされがちな、輸血中止後6時間以内の以下の症状の3つの新規発症または増悪からなる、輸血に対する反応である<ref name=":5" />。 |
|||
人工心肺使用後の低アルブミン血症は一時的なので、また肝硬変による慢性的な低アルブミン血症の場合にも使用されない。 |
|||
;アルブミン製剤の投与量計算 |
|||
# 急性の呼吸困難 |
|||
アルブミンの血管回収率は40%、また循環血漿量は70ml/kg×(1-Ht)なので |
|||
# [[脳性ナトリウム利尿ペプチド]](BNP)上昇 |
|||
:必要投与量(g)=期待上昇量(g/dL)×体重(kg)×70ml/kg×(1-Ht) /100×2.5 |
|||
# [[中心静脈圧]](CVP)の上昇 |
|||
# 左心不全の兆候 |
|||
# 体液バランス陽性負荷の兆候 |
|||
# [[肺水腫]]の[[胸部X線写真]]所見。 |
|||
* [[輸血後移植片対宿主病]]は、レシピエントの体がドナーの[[T細胞]]を排除できなかった免疫不全患者で起こりやすい。ドナーのT細胞がレシピエントの細胞を攻撃してしまう。輸血1週間後に生じる<ref name="LauraDean" />。このタイプの輸血反応では、発熱、発疹、下痢を伴うことが多い。死亡率は高く、患者の89.7%が24日後に死亡している。免疫抑制療法が最も一般的な治療法である<ref>{{Cite journal | vauthors = Kopolovic I, Ostro J, Tsubota H, Lin Y, Cserti-Gazdewich CM, Messner HA, Keir AK, DenHollander N, Dzik WS, Callum J | display-authors = 6 | title = A systematic review of transfusion-associated graft-versus-host disease | journal = Blood | volume = 126 | issue = 3 | pages = 406–414 | date = July 2015 | pmid = 25931584 | doi = 10.1182/blood-2015-01-620872 | doi-access = free }}</ref>。T細胞がレシピエントの細胞を攻撃するのを防ぐために、ハイリスク患者には血液製剤の照射と白血球除去が必要である<ref name="LauraDean" />。 |
|||
例えば体重70kg、ヘマトクリット60%の患者のアルブミンを1g/dL上げたい場合、上記の式より |
|||
:必要投与量(g)=1g/dl×70kg×70ml/kg×(1-0.6) /100×2.5 |
|||
:<nowiki>=</nowiki>40gとなる |
|||
=== 感染 === |
|||
これは5%250ml製剤では、49/(0.05×250ml)=3.92 切り上げで4本必要となる |
|||
赤血球輸血の大量使用と、感染症のリスクには関連があるものの、入院患者に対して輸血を制限してもしなくても、感染症の全体的なリスクには[[メタアナリシス]]で有意な差が示されていない(制限輸血は重症感染のリスクは減らす)<ref>{{Cite journal | vauthors = Rohde JM, Dimcheff DE, Blumberg N, Saint S, Langa KM, Kuhn L, Hickner A, Rogers MA | display-authors = 6 | title = Health care-associated infection after red blood cell transfusion: a systematic review and meta-analysis | journal = JAMA | volume = 311 | issue = 13 | pages = 1317–1326 | date = April 2014 | pmid = 24691607 | pmc = 4289152 | doi = 10.1001/jama.2014.2726 }}</ref>。 |
|||
=== 自己血輸血 === |
|||
{{Main|自己血輸血}} |
|||
近年注目されている技術に、[[自己血輸血]]がある。これはあらかじめ自身の血液を摂取保存しておき、出血が見込まれる手術などに遭遇した場合、その血液を用いて副作用のリスクを軽減させるという目的がある。しかし、近年、多くの外科的手術では、技術の発達によって必要な輸血量が減少しつつあり、大量出血が見込まれる整形外科的分野(主に骨の手術)や[[分娩]]を扱う産科分野と、適応は限定されている。 |
|||
;貯血式自己輸血 |
|||
:手術前に自身の血液をあらかじめ保存しておく方式。簡便で大量に対応できる。[[エリスロポエチン]]を利用すると[[貧血]]患者にも対応可能<ref name="jsat_I">{{Cite web|和書|url=http://www.jsat.jp/jsat_web/jissai/kaisyu.html |title=回収式自己血輸血の概要と実際 |publisher=日本自己血輸血学会 |accessdate=2017-12-29 }}「I インフォームド・コンセント」(PDF)P.3</ref>。 |
|||
;希釈式自己輸血 |
|||
:希釈効果で出血時の赤血球などの血液成分の損失を低減させる方式。貯血式に比べると手術前に自己血採血を行う必要が無く、患者の負担が少ない。しかし採血量には限度があるため大量出血にはこれ単独では対応できない<ref name="jsat_I" />。 |
|||
;回収式自己輸血 |
|||
:出血した血液を回収して患者に戻す方式。手術中の大量出血に対応できるが、機器、要員など負担が重い。回収した血液に細菌などが混入する可能性もある<ref name="jsat_I" />。 |
|||
まれに血液製剤が細菌に汚染されることがある。これは、輸血による細菌感染症(transfusion-transmitted bacterial infection)として知られる、生命を脅かす感染症を引き起こす可能性がある。重症細菌感染のリスクは、血小板輸血では約5万回に1回、赤血球輸血では約50万回に1回と推定されている(2002年)<ref name=":17" />。血小板輸血が他の血液製剤よりも汚染されやすい理由は、室温で保存され、これが細菌の増殖にも好適であるからである<ref name=":17" />。汚染源としては以下が挙げられる<ref>{{Cite web |title=Transfusion-transmitted bacterial infection {{!}} Lifeblood |url=https://www.lifeblood.com.au/health-professionals/clinical-practice/adverse-events/transfusion-transmitted-bacterial-infection |website=www.lifeblood.com.au |access-date=2024-04-28 |language=en}}</ref>。 |
|||
=== 全血輸血 === |
|||
略称はWB(英語名のWhole Bloodから)。 |
|||
* 採血中のドナーの皮膚からの細菌 |
|||
採集された血液をそのまま輸血する方法。現在はあまり一般的ではない。なぜなら、血液成分は[[赤血球]]・[[血小板]]・[[血漿]]それぞれが保存条件が異なるため、分離しないままでは極端に保存期間が短くなるからである。ただし、一度に複数の系統の血液成分を補う必要がある場合には全血輸血の理論的[[適応 (医学)|適応]]がある。複数の血液製剤を使うよりも感染を受ける機会を減らすことができるからである。しかしながら、現在では[[赤十字血液センター|血液センター]]からの全血供給は注文制であり、限られている。 |
|||
* ドナーの[[菌血症]] |
|||
* 環境中の細菌 |
|||
* 採血器具や処理装置の汚染 |
|||
* [[新鮮凍結血漿]]解凍中の汚染。 |
|||
汚染源微生物は多様で、皮膚細菌叢、腸内細菌叢、環境中の微生物などが含まれる<ref name=":17" />。アルコール綿棒単独使用か、アルコール綿棒に続いて消毒薬を使用するか、どちらが供血者からの献血汚染を減らせるかは不明である<ref>{{Cite journal|date=February 2015|title=Skin preparation with alcohol versus alcohol followed by any antiseptic for preventing bacteraemia or contamination of blood for transfusion|journal=The Cochrane Database of Systematic Reviews|volume=2015|issue=2|pages=CD007948|doi=10.1002/14651858.CD007948.pub3|pmc=7185566|pmid=25674776|vauthors=Webster J, Bell-Syer SE, Foxlee R|collaboration=Cochrane Wounds Group}}</ref>。献血センターや検査室では、汚染のリスクを減らすために多くの戦略が実施されている。輸血性細菌感染症の確定診断は、レシピエントにおける培養陽性の同定、およびドナー血液における同一菌の同定によってなされ、代替診断法はない<ref name=":17">{{Cite journal | vauthors = Blajchman MA | title = Incidence and significance of the bacterial contamination of blood components | journal = Developments in Biologicals | volume = 108 | issue = 2 | pages = 59–67 | year = 2002 | pmid = 12220143 }}</ref>。 |
|||
== 血液準備量の計算 == |
|||
{{出典の明記| date = 2023年1月| section = 1}} |
|||
;T&S |
|||
術中の予想出血量が500 - 600で輸血の可能性が30%以下の待機的手術で、ABO型が判明しており、かつRh(D)陽性で不規則抗体陰性の場合は交差適合試験をしない方式。もし必要になれば生食法、もしくは製剤のABO型確認だけで出庫する。 |
|||
HIVに感染した血液を輸血されると90%がHIVに感染する<ref>{{Cite journal|last=Donegan|first=Elizabeth|date=1990-11-15|title=Infection with Human Immunodeficiency Virus Type 1 (HIV-1) among Recipients of Antibody-Positive Blood Donations|url=http://annals.org/article.aspx?doi=10.7326/0003-4819-113-10-733|journal=Annals of Internal Medicine|volume=113|issue=10|pages=733|language=en|doi=10.7326/0003-4819-113-10-733|issn=0003-4819}}</ref>。しかし、先進国では、ドナーの選択とHIVスクリーニングが改善されており、輸血によってHIVに感染するリスクは極めて低い。日本では8400万輸血に一件<ref>{{Cite web |title=よくあるご質問 輸血によりウイルス肝炎などに罹ることもあると聞きました。輸血による感染症のリスクを教えてください? {{!}} 愛知医科大学病院 |url=https://www.aichi-med-u.ac.jp/hospital/sh15/sh1503/sh150303/sh15030301/sh15030301_02.html |website=www.aichi-med-u.ac.jp |access-date=2024-04-28}}</ref>程度とされ、2013年の1件を最後に2022年まで感染確認はない<ref name=":24">{{Cite web |title=ウイルス|感染症|輸血の副作用|医薬品情報|日本赤十字社 |url=http://www.jrc.or.jp/mr/reaction/infection/virus/ |website=www.jrc.or.jp |access-date=2024-04-28 |language=ja}}</ref>。 |
|||
;MSBOS |
|||
過去データから術式別の輸血量(T)と準備量(C)を調べ、C/T比が1.5以下になるように製剤を準備する。 |
|||
輸血を介したC型肝炎の感染も日本では、2013年以降2022年まで感染確認はない<ref name=":24" />。[[B型肝炎]]は毎年1例前後発生している<ref name=":24" />。 |
|||
;SBOE |
|||
患者の術前Hb値、輸血開始Hb値、術式別平均出血量から準備量を計算する。 |
|||
:血液準備量(単位)=術式別平均出血量/200-(術前Hb値-輸血開始HB値)/(40/体重) |
|||
この結果が0.5以下ならT&S、それより大きければ四捨五入で単位数を算出。 |
|||
その他のまれな感染には、[[梅毒]]<ref name=":17" />、[[シャーガス病]]、[[サイトメガロウイルス]]感染症(免疫不全患者に起こる)、[[HTLV]]、{{仮リンク|バベシア|en|Babesia|redirect=1}}などがある。 |
|||
;コンピュータクロスマッチ |
|||
コンピュータ支援により、一切の交差適合試験をしない方式。ただし下記の3つの条件がある。 |
|||
* 輸血業務がコンピュータ化されていること |
|||
* 患者のID番号と血液型(2回以上異なる検体で検査)が登録されており、不規則抗体は陰性であること |
|||
* 製剤のABO血液型が自施設で再確認されていること |
|||
===比較表=== |
|||
利点はABO不適合防止、迅速な出庫、省力化、製剤の有効利用など。 |
|||
{|class="wikitable" |
|||
|+ 発熱を特徴とする輸血反応の症状の比較<ref name="Transfusion reactions / M.A. Popovsky 1996 p. ">Unless otherwise specified in boxes, reference is: {{Cite book | title=Transfusion reactions / M.A. Popovsky | publisher=Karger | location=Basel | year=1996 | isbn=978-3-8055-6509-7 | oclc=40288753 }}</ref> |
|||
欠点は不規則抗体の繰り返しの測定が必要なことと、保険請求不可。 |
|||
|colspan=5| + =時折現れる症状 ++ =頻発症状 |
|||
== 輸血用製剤の保存条件と有効期限 == |
|||
{| class="wikitable" style="margin:auto; text-align:left;" |
|||
|- style="text-align:left; background-color:#CCCCCC;" |
|||
!nowrap|輸血用血液!!nowrap|保存条件!!nowrap|有効期間 |
|||
|- |
|- |
||
! !! {{仮リンク|発熱性非溶血性輸血反応|en|Febrile non-hemolytic transfusion reaction|redirect=1}}!! {{仮リンク|輸血関連急性肺障害|en|Transfusion-related acute lung injury|redirect=1|label=TRALI}}!! {{仮リンク|急性溶血性輸血反応|en|Acute hemolytic transfusion reaction|redirect=1}}!! 血液製剤の細菌汚染 |
|||
|赤血球LR||rowspan=4|2 - 6℃||28日 |
|||
|- |
|- |
||
! 輸血中または輸血後の症状の出現時間 |
|||
|洗浄赤血球LR||48時間 |
|||
| 通常、自然に解熱する。 |
|||
5-10%は2時間後まで続く。 |
|||
| 早期 (10–15 ml投与後) || 早期 (50–100 ml投与後) || 輸血後最大8時間 |
|||
|- |
|- |
||
! 発熱 |
|||
|解凍赤血球LR||4日 |
|||
| + || ++ || ++ || ++ |
|||
|- |
|- |
||
! [[悪寒|寒気]] |
|||
|合成血液LR||48時間 |
|||
| ++ || ++ || ++ || +++ |
|||
|- |
|- |
||
! 冷感 |
|||
|血小板濃厚液||20 - 24℃||4日 |
|||
| ++ || - || + || - |
|||
|- |
|- |
||
! 不快感 |
|||
|新鮮凍結血漿||-20℃以下||製造から1年 |
|||
| ++ || - || - || - |
|||
|- |
|- |
||
! 硬直 |
|||
|アルブミン製剤||室温||rowspan=2|製造から2年 |
|||
| + || - || - || - |
|||
|- |
|- |
||
! 頭痛 |
|||
|凝固因子製剤||凍結せず10℃以下 |
|||
| + || - || + || - |
|||
|- |
|||
! 嘔気嘔吐 |
|||
| + || - || ++ || - |
|||
|- |
|||
! [[呼吸困難]] |
|||
| + || ++ || ++ || - |
|||
|- |
|||
! [[チアノーゼ]] |
|||
| - || ++ || ++ || - |
|||
|- |
|||
! [[低血圧]] / [[ショック]] |
|||
| - || ++ || ++ || ++ |
|||
|- |
|||
! [[播種性血管内凝固症候群|播種性血管内凝固]] |
|||
| - || - || ++ || ++ |
|||
|- |
|||
! [[血色素尿症|ヘモグロビン尿]] |
|||
| - || - || ++ || + |
|||
|- |
|||
! [[腎不全]] |
|||
| - || - || ++ || ++ |
|||
|- |
|||
! 背部痛 |
|||
| - || - || ++ || - |
|||
|} |
|} |
||
通常の輸液と異なり、血液製剤は、急速に大量に血管内に注入する必要がある場合がある。また、特に濃厚赤血球は冷却して保存されるため、冷たいRBCを急速に輸血した場合の血管痛を低減するため、また、体温の低下を防ぐため、加温しながら輸血を行うことが現在でも一般的である。そのための専用の輸血ライン用ヒーターが存在する。 |
|||
== 輸血 |
=== 輸血不応 === |
||
輸血不応(Transfusion inefficacy)または血液製剤の有効性不足は、それ自体は「[[合併症]]」ではないが、輸血がその臨床目的を完全にまたは部分的に達成できないことに加えて、間接的に合併症を引き起こす可能性がある。このことは、[[集中治療室]]や新生児などの特定の患者群にとって特に重大な意味を持つ。 |
|||
輸血用製剤の[[添付文書]]では、「重大な基本的注意」の冒頭に「輸血は[[支持療法]]であり、根治治療ではない。」と特記されている。これは、輸血という治療が下記の副作用の危険性、献血者が自身を傷つけるという自己犠牲のもとに成り立っている治療であり、万やむを得ない場合にのみ行われるべきとする文言であり、実際に臨床現場では(献血者の減少もあり)そうされている。 |
|||
赤血球(RBC)は、輸血されることが圧倒的に多い血液製剤であるが、保存中に起こる様々な生化学的・生体力学的変化、いわゆる'''保存障害'''(storage lesion)によって損傷した赤血球が輸血効果を低下させることがある。赤血球の場合、これは生存率と組織酸素化能力を低下させる可能性がある<ref>{{Cite journal | vauthors = Zubair AC | title = Clinical impact of blood storage lesions | journal = American Journal of Hematology | volume = 85 | issue = 2 | pages = 117–122 | date = February 2010 | pmid = 20052749 | doi = 10.1002/ajh.21599 | s2cid = 205293048 | doi-access = free }}</ref>。生化学的変化の一部は輸血後に可逆的<ref>{{Cite journal | vauthors = Heaton A, Keegan T, Holme S | title = In vivo regeneration of red cell 2,3-diphosphoglycerate following transfusion of DPG-depleted AS-1, AS-3 and CPDA-1 red cells | journal = British Journal of Haematology | volume = 71 | issue = 1 | pages = 131–136 | date = January 1989 | pmid = 2492818 | doi = 10.1111/j.1365-2141.1989.tb06286.x | s2cid = 43303207 }}</ref>であるが、生体力学的変化はそうではなく<ref>{{Cite journal | vauthors = Frank SM, Abazyan B, Ono M, Hogue CW, Cohen DB, Berkowitz DE, Ness PM, Barodka VM | display-authors = 6 | title = Decreased erythrocyte deformability after transfusion and the effects of erythrocyte storage duration | journal = Anesthesia and Analgesia | volume = 116 | issue = 5 | pages = 975–981 | date = May 2013 | pmid = 23449853 | pmc = 3744176 | doi = 10.1213/ANE.0b013e31828843e6 }}</ref>、赤血球の若返り効果を持つとする製剤はまだこの現象を十分に逆転させることができない<ref name="pmid25053933">{{Cite journal | vauthors = Barshtein G, Gural A, Manny N, Zelig O, Yedgar S, Arbell D | title = Storage-induced damage to red blood cell mechanical properties can be only partially reversed by rejuvenation | journal = Transfusion Medicine and Hemotherapy | volume = 41 | issue = 3 | pages = 197–204 | date = June 2014 | pmid = 25053933 | pmc = 4086768 | doi = 10.1159/000357986 }}</ref>。血液製剤の保存期間が輸血有効性の要因であるかどうか、特に「古い」血液が直接または間接的に合併症のリスクを増加させるかどうかについては、論争が続いている<ref>{{Cite news| url=http://well.blogs.nytimes.com/2013/03/11/the-shelf-life-of-donor-blood/ | work=The New York Times | vauthors = Bakalar N | title=The Shelf Life of Donor Blood | date=2013-03-11}}</ref><ref>{{Cite news| url=https://www.wsj.com/articles/SB10001424052748703939404574567771148801570 | work=The Wall Street Journal | title=What's the Shelf Life of Blood? | vauthors = Wang SS | date=2009-12-01}}</ref>。この疑問に対する研究結果は一貫しておらず、古い血液は確かに有効性が低いことを示すものもあれば、そのような差がないことを示すものもある<ref>{{Cite journal | vauthors = Aubron C, Nichol A, Cooper DJ, Bellomo R | title = Age of red blood cells and transfusion in critically ill patients | journal = Annals of Intensive Care | volume = 3 | issue = 1 | pages = 2 | date = January 2013 | pmid = 23316800 | pmc = 3575378 | doi = 10.1186/2110-5820-3-2 | doi-access = free }}</ref>。 |
|||
術中での輸血では |
|||
;循環血液量の15 - 20%の出血の場合 |
|||
:細胞外補液(乳酸リンゲル液)を出血量の2 - 3倍投与する。 |
|||
;20 - 50% |
|||
:人工膠質液(HES、デキストランなど)を投与する。また、RBCもこの段階から輸血する。 |
|||
;50 - 100% |
|||
:人工物では浸透圧などを維持できなくなるので等張アルブミンを投与する。 |
|||
;100%以上 |
|||
:凝固因子補充のためFFPを投与する。 |
|||
;150%以上 |
|||
:止血のためPCを投与する。 |
|||
最大保存期間(現在42日間)、最大自己溶血閾値(現在米国で1%、欧州で0.8%)、輸血後生体内赤血球生存率の最低レベル(現在24時間後で75%)など、赤血球の保存障害を最小限に抑えるための一定の規制措置が設けられている<ref>{{Cite journal | vauthors = Hod EA, Zhang N, Sokol SA, Wojczyk BS, Francis RO, Ansaldi D, Francis KP, Della-Latta P, Whittier S, Sheth S, Hendrickson JE, Zimring JC, Brittenham GM, Spitalnik SL | display-authors = 6 | title = Transfusion of red blood cells after prolonged storage produces harmful effects that are mediated by iron and inflammation | journal = Blood | volume = 115 | issue = 21 | pages = 4284–4292 | date = May 2010 | pmid = 20299509 | pmc = 2879099 | doi = 10.1182/blood-2009-10-245001 }}</ref>。しかし、これらの基準はすべて普遍的な方法で適用されており、製品の単位ごとの違いは考慮されていない<ref>{{Cite journal | vauthors = Hess JR | title = Scientific problems in the regulation of red blood cell products | journal = Transfusion | volume = 52 | issue = 8 | pages = 1827–1835 | date = August 2012 | pmid = 22229278 | doi = 10.1111/j.1537-2995.2011.03511.x | s2cid = 24689742 }}</ref>。例えば、生体内での輸血後赤血球生存率の試験は、健康なボランティアのサンプルで行われ、その後、普遍的な処理基準(GMP)に基づいて、すべての赤血球単位について適合が推定される(赤血球生存率自体は有効性を保証するものではないが、細胞機能にとって必要な前提条件であるため、規制上の代用として機能する)。生体内([[in vivo]])の患者における輸血の有効性を判断する「最良の」方法については、さまざまな意見がある<ref>{{Cite journal | vauthors = Pape A, Stein P, Horn O, Habler O | title = Clinical evidence of blood transfusion effectiveness | journal = Blood Transfusion = Trasfusione del Sangue | volume = 7 | issue = 4 | pages = 250–258 | date = October 2009 | pmid = 20011636 | pmc = 2782802 | doi = 10.2450/2008.0072-08 }}</ref>。一般に、輸血前の特定の赤血球製剤単位について、品質を評価したり有効性を予測したりするための[[in vitro]]検査はまだ存在しないが、{{仮リンク|赤血球変形能|en|erythrocyte deformability|redirect=1}}<ref>{{Cite journal | vauthors = Burns JM, Yang X, Forouzan O, Sosa JM, Shevkoplyas SS | title = Artificial microvascular network: a new tool for measuring rheologic properties of stored red blood cells | journal = Transfusion | volume = 52 | issue = 5 | pages = 1010–1023 | date = May 2012 | pmid = 22043858 | doi = 10.1111/j.1537-2995.2011.03418.x | s2cid = 205724851 }}</ref>や{{仮リンク|赤血球脆弱性|en|erythrocyte fragility|redirect=1}}<ref>{{Cite journal | vauthors = Raval JS, Waters JH, Seltsam A, Scharberg EA, Richter E, Daly AR, Kameneva MV, Yazer MH | display-authors = 6 | title = The use of the mechanical fragility test in evaluating sublethal RBC injury during storage | journal = Vox Sanguinis | volume = 99 | issue = 4 | pages = 325–331 | date = November 2010 | pmid = 20673245 | doi = 10.1111/j.1423-0410.2010.01365.x | s2cid = 41654664 }}</ref>などの赤血球膜特性に基づく潜在的に関連性のある検査は検討されている。 |
|||
== 輸血過誤対策 == |
|||
輸血ミスは最悪の場合、患者の[[死]]をもたらすので重大な問題である。そのため各医療施設はいかにこれを防ぐかをマニュアル化している。 |
|||
医師は、輸血にかかる直接的および間接的なコストが非常に高いことに加え、保存障害を取り巻く不確実性が指摘されていることもあり、輸血を最小限に抑える、いわゆる「制限プロトコール」を採用している<ref name="Missingor">{{Cite journal | vauthors = Shander A, Hofmann A, Gombotz H, Theusinger OM, Spahn DR | title = Estimating the cost of blood: past, present, and future directions | journal = Best Practice & Research. Clinical Anaesthesiology | volume = 21 | issue = 2 | pages = 271–289 | date = June 2007 | pmid = 17650777 | doi = 10.1016/j.bpa.2007.01.002 }}</ref><ref>{{Cite web |
|||
最も主な輸血ミスの原因は患者取り違えなので、一般的に「[[血液型]]検査用の検体」と「[[交差適合試験]]用の検体」は別々のタイミングで採血される。 |
|||
| title = Transfusion Overuse: Exposing an International Problem and Patient Safety Issue |
|||
| url = https://patientsafetymovement.org/wp-content/uploads/2022/03/Action-Plan-RBC-Overuse-January-13-2013.pdf |
|||
| website = Patient Safety Movement Foundation |
|||
| date = 2013 |
|||
| access-date = 15 March 2022 |
|||
| archive-date = 1 April 2022 |
|||
| archive-url = https://web.archive.org/web/20220401033720/https://patientsafetymovement.org/wp-content/uploads/2022/03/Action-Plan-RBC-Overuse-January-13-2013.pdf |
|||
| url-status = dead |
|||
}}</ref><ref>{{Cite web|url=http://www.cap.org/apps/cap.portal?_nfpb=true&cntvwrPtlt_actionOverride=%2Fportlets%2FcontentViewer%2Fshow&_windowLabel=cntvwrPtlt&cntvwrPtlt{actionForm.contentReference}=cap_today%2F0409%2F0409d_easy_does_it.html&_state=maximized&_pageLabel=cntvwr |publisher=College of American Pathologists |title=Easy does it – showing caution with RBC transfusions |date=April 2009 |access-date=22 August 2014}}</ref>。しかし、組織の酸素化を速やかに回復させるために最善の努力を必要とするような、特に重症の患者には、制限的なプロトコールは選択できない。 |
|||
血小板の輸血は(赤血球に比べて)はるかに少ないが、血小板の保存障害とそれに伴う有効性の低下が懸念事項である<ref>{{Cite journal | vauthors = Devine DV, Serrano K | title = The platelet storage lesion | journal = Clinics in Laboratory Medicine | volume = 30 | issue = 2 | pages = 475–487 | date = June 2010 | pmid = 20513565 | doi = 10.1016/j.cll.2010.02.002 }}</ref>。 |
|||
これは一回の採血で得た血液を2本の容器に分注するとして、その採血を取り違えてしまうと異型輸血の危険性が高まるからであり、まず[[血液型]]が確定していれば、次に「[[交差適合試験]]用の検体」を違う患者から採血してしまっても、交差試験でエラーとなるので異型輸血は避けることができる、という考えに基づいている。実際、日本で起こった患者取り違えによる輸血ミスの多くは、これを理解できなかった医療従事者によって引き起こされている{{要出典|date=2022年11月}}。 |
|||
=== その他 === |
|||
== 輸血に関わる法律 == |
|||
* 大腸がんでは、術中輸血とがんの再発が関連していることが知られている<ref>{{Cite journal | vauthors = Cata JP, Wang H, Gottumukkala V, Reuben J, Sessler DI | title = Inflammatory response, immunosuppression, and cancer recurrence after perioperative blood transfusions | journal = British Journal of Anaesthesia | volume = 110 | issue = 5 | pages = 690–701 | date = May 2013 | pmid = 23599512 | pmc = 3630286 | doi = 10.1093/bja/aet068 }}</ref>。肺がんでは、術中輸血は、がんの早期再発、生存率の悪化、肺切除後の転帰の悪化と関連している<ref>{{Cite journal | vauthors = Wang T, Luo L, Huang H, Yu J, Pan C, Cai X, Hu B, Yin X | display-authors = 6 | title = Perioperative blood transfusion is associated with worse clinical outcomes in resected lung cancer | journal = The Annals of Thoracic Surgery | volume = 97 | issue = 5 | pages = 1827–1837 | date = May 2014 | pmid = 24674755 | doi = 10.1016/j.athoracsur.2013.12.044 | doi-access = free }}</ref><ref>{{Cite journal | vauthors = Churchhouse AM, Mathews TJ, McBride OM, Dunning J | title = Does blood transfusion increase the chance of recurrence in patients undergoing surgery for lung cancer? | journal = Interactive Cardiovascular and Thoracic Surgery | volume = 14 | issue = 1 | pages = 85–90 | date = January 2012 | pmid = 22108935 | pmc = 3420304 | doi = 10.1093/icvts/ivr025 }}</ref> 。輸血による免疫系の障害は、輸血と[[自然免疫系]]および[[適応免疫]]系と完全に関連している10種類以上のがんを引き起こす主な要因の1つに分類される<ref name="Transfusion and Apheresis Science">{{Cite journal | vauthors = Kormi SM, Seghatchian J | title = Taming the immune system through transfusion in oncology patients | journal = Transfusion and Apheresis Science | volume = 56 | issue = 3 | pages = 310–316 | date = June 2017 | pmid = 28651910 | doi = 10.1016/j.transci.2017.05.017 }}</ref>。輸血は、{{仮リンク|腫瘍減量手術|en|cytoreductive surgery|redirect=1|label=腫瘍減量手術(cytoreductive surgery: CRS)}}や{{仮リンク|腹腔内温熱化学療法|en|Hyperthermic intraperitoneal chemotherapy|redirect=1|label=腹腔内温熱化学療法(Hyperthermic intraperitoneal chemotherapy: HIPEC)}}後の転帰を悪化させる<ref>{{Cite journal | vauthors = Soldevila-Verdeguer C, Segura-Sampedro JJ, Pineño-Flores C, Sanchís-Cortés P, González-Argente X, Morales-Soriano R | title = Hepatic resection and blood transfusion increase morbidity after cytoreductive surgery and HIPEC for colorectal carcinomatosis | journal = Clinical & Translational Oncology | volume = 22 | issue = 11 | pages = 2032–2039 | date = November 2020 | pmid = 32277348 | doi = 10.1007/s12094-020-02346-2 | s2cid = 215724889 }}</ref> 一方、同種輸血は、[[T細胞]]、骨髄由来抑制細胞(MDSC)、[[腫瘍関連マクロファージ]](TAM)、[[ナチュラルキラー細胞]](NKC)、[[樹状細胞]](DC)を含む5つの主要なメカニズムを通じて、レシピエントの防御機構を助けることができるともされる<ref name="Transfusion and Apheresis Science" />。列挙した各項目の役割には、{{仮リンク|抗腫瘍|en|antitumor|redirect=1}}CD8+[[細胞傷害性T細胞]](CD8+/CTL)の活性化、[[制御性T細胞]](Treg)の一時的不活性化、[[シグナル伝達兼転写活性化因子3]](STAT3)による[[シグナル伝達]]の不活性化、抗腫瘍[[免疫応答]]を増強するための細菌の使用、細胞性[[免疫療法]]などが含まれる<ref name="Transfusion and Apheresis Science" />。 |
|||
[[血液法]]、および[[医薬品医療機器等法]]が知られている。しかしながら、医薬品医療機器等法は、ロットを構成する医薬品に適切な法律であり、ロットを構成しない輸血用血液に適用することが適切か問題を含んでいる。血液法および医薬品医療機器等法の要点は、安全な血液を安定供給する、国内自給を達成する、責務を明示するということである。特に医療従事者の責務としては適正輸血の推進、安全情報の提供、[[インフォームドコンセント]]の取得、投与記録の保管、調査の協力、輸血管理体制の構築が求められている。 |
|||
* [[低体温症]]は、通常低温で保存されている血液製剤を大量に輸血した場合に起こることがある<ref name=":11">{{Cite web |title=その他|非溶血性副作用|輸血の副作用|医薬品情報|日本赤十字社 |url=http://www.jrc.or.jp/mr/reaction/non_hemolytic/other/ |website=www.jrc.or.jp |access-date=2024-04-21 |language=ja}}</ref>。予防には、輸血前に血液製剤を温めることが必要である{{Efn|輸血製剤で最も多く使われる[[濃厚赤血球]]液は冷蔵、[[新鮮凍結血漿]]は冷凍保存されており、後者は解凍して用いられる。}}<ref name=":11" />。 |
|||
== 輸血に関わる検査 == |
|||
{{Main|輸液加温器}} |
|||
=== 献血時 === |
|||
* 大量の赤血球輸血は、重篤な出血および/または輸血不応(上記参照)のいずれであれ、出血傾向の原因となる<ref name=":13">{{Cite journal|last=Vagholkar|first=Ketan|last2=Iyengar|first2=Madhavan|last3=Vagholkar|first3=Suvarna|last4=Maurya|first4=Inder|date=2015-10-31|title=Complications of Massive Blood Transfusion|url=http://dx.doi.org/10.18535/jmscr/v3i10.58|journal=Journal of Medical Science And clinical Research|doi=10.18535/jmscr/v3i10.58|issn=2347-176X}}</ref>。その機序は、レシピエントの血小板や凝固因子の希釈とともに、[[播種性血管内凝固症候群|播種性血管内凝固]]によるものと考えられている<ref name=":13" />。厳重な[[モニタリング (医学)|モニタリング]]を行い、必要に応じて[[濃厚血小板]]や[[新鮮凍結血漿]]の輸血を行う<ref name=":13" />。 |
|||
*感染症スクリーニング - 輸血用血液はすべて、感染症に対するスクリーニングが行われている。2005年時点、[[B型肝炎ウイルス]]、[[C型肝炎ウイルス]]、[[ヒトTリンパ好性ウイルス|HTLV]]-1、[[ヒト免疫不全ウイルス|HIV]]、[[ヒトパルボウイルス]]B19および[[梅毒トレポネーマ]]に対し行われている。 |
|||
* 大量輸血では、血液製剤中に含まれているクエン酸塩が重炭酸塩に分解されるため、[[代謝性アルカローシス]]が起こることがある。 |
|||
HBV(B型肝炎ウイルス)はNAT感度以下の低ウイルス量でも感染する可能性があるためNATだけでなく、抗HBc抗体も測定されている。HBV,HCVのそれぞれの平均ウインドウ期間は34日、23日である。HIVについてはウインドウ期間 (window period) が11日と短縮された。海外渡航などのリスクがあれば34日以上は献血を避けるべきである。 |
|||
* 大量輸血では、クエン酸と血清カルシウムが複合体を形成するため、[[低カルシウム血症]]も起こりうる。0.9mmol/L未満の血清カルシウム値は治療すべきである<ref>{{Cite web |title=Damage Control Resuscitation and Management in Severe Hemorrage/Shock in the Prehospital Setting |url=https://internationaltraumalifesupport.remote-learner.net/pluginfile.php/8291/mod_resource/content/1/Position%20Paper%20-%20Damage%20Control%20Resuscitation%20-%202019.pdf |archive-url=https://ghostarchive.org/archive/20221009/https://internationaltraumalifesupport.remote-learner.net/pluginfile.php/8291/mod_resource/content/1/Position%20Paper%20-%20Damage%20Control%20Resuscitation%20-%202019.pdf |archive-date=2022-10-09 |website=internationaltraumalifesupport.remote-learner.net |publisher=ITLA |date=May 2019 |access-date=2022-10-09 |deadlinkdate=2024-04-28}}</ref>。 |
|||
=== 輸血前 === |
|||
*[[血液型]]検査([[亜型検査]]) |
|||
*[[不規則抗体]]スクリーニング |
|||
*[[交差適合試験]] - 供血者の血液と受血者の血液を混ぜ合わせ、[[抗原抗体反応]]が起きないことを確かめる検査。赤血球製剤を投与する際に行われる。 |
|||
* {{仮リンク|血液ドーピング|en|Blood doping|redirect=1}}は、アスリート<ref>{{cite web |url=http://autobus.cyclingnews.com/news.php?id=news/2007/aug07/aug09news |title=Kashechkin tests positive for blood doping |publisher=Cyclingnews.com |access-date=August 9, 2007}}</ref>や軍人<ref>{{cite book |last=Pugliese |first=David |title=Canada's Secret Commandos |isbn=978-1-895896-18-3 |year=2002 |publisher=Esprit de Corps Books |location=Ottawa}}</ref>が、肉体的スタミナを増強するため、あるいは単に任務時間中に活動的で警戒心を維持するためなどの理由で、それぞれ行われることがある。過度の血液ドーピングは血液の粘性が過剰に高まって組織への酸素供給が逆に減少する{{仮リンク|過粘稠度症候群|en|Hyperviscosity syndrome|redirect=1}}を生じることがある<ref>{{cite journal|last1=Smith|first1=DA|last2=Perry|first2=PJ|year=1992|title=The efficacy of ergogenic agents in athletic competition. Part II: Other performance-enhancing agents|journal=Ann Pharmacother|volume=26|issue=5|pages=653–659|doi=10.1177/106002809202600510|pmid=1591427|s2cid=44926399}}</ref>。 |
|||
== 輸血に伴う反応 == |
|||
{{Main|{{仮リンク|血液ドーピング|en|Blood doping|redirect=1}}|{{仮リンク|過粘稠度症候群|en|Hyperviscosity syndrome|redirect=1}}}} |
|||
輸血に伴う反応を理解するには[[血液製剤]]の作り方を考えると理解しやすい。血液製剤は[[採血]]によって得た血液を[[遠心分離]]することで成分を分離して作っている。赤血球製剤の場合は全てが赤血球というわけではなく、分離し切れなかった[[血漿]]、[[白血球]]、[[サイトカイン]]、血漿蛋白、保存液が含まれており、これが様々な作用をおこす。例えば[[アレルギー]]やアナフィラキシーは血漿蛋白が誘因となり、発熱はサイトカインが誘因となる。[[移植片対宿主病|GVHD]]はリンパ球がおこし、TRALIや血小板不能は抗HLA抗体や抗顆粒球抗体が引き起こすと考えられている。原因がわかっているため現在も有害作用の除外が改善されている。例えば、2007年現在は製剤をつくる過程で白血球がフィルター除去されているため、サイトカインも少なく輸血後発熱の頻度はかなり低下した(これをLR製剤という)。またGVHD(輸血後7 - 14日ころに発熱、紅斑、[[下痢]]、肝機能障害、血小板減少)の予防として放射線照射が行われている(但し、溶血しやすくなったため、今後腎障害の報告が増える可能性がある)。この効果は細胞の核に傷をつけることで[[細胞分裂]]を阻害し、GVHDを引き起こすだけのリンパ球が蓄積しないようにするということである。感染を防ぐため従来の抗原抗体反応よりも[[ウインドウ期]]の短いNAT(Nucleic acid Amplification Test, [[核酸増幅検査]])が導入されている。またさらに血漿蛋白を除外したい場合は洗浄赤血球という製剤も用意されている。 |
|||
== 輸血の使用数 == |
|||
世界全体では、1年間に約8500万単位の赤血球製剤が輸血されている<ref name=AABB2012 />。 |
|||
*濃厚赤血球溶液は粘度が高く、その輸注を受けると心拍出量が低下する。 |
|||
*新鮮凍結血漿の輸注により血液の[[浸透圧]]が上昇し、組織間液が血管内に浸透する。低浸透圧による[[胸水]]や[[腹水]]の改善が期待される。 |
|||
米国では、2011年の入院中に約300万回の輸血が行われ、ありふれた処置となっている。輸血を伴う入院の割合は1997年からほぼ倍増し、人口1万人当たり40回の入院から95回の入院となった。輸血は、2011年に45歳以上の患者に行われた最も一般的な処置であり、1~44歳の患者では最も一般的な処置の上位5位に入っていた<ref name="pmid24354027">{{Cite book | vauthors = Pfuntner A, Wier LM, Stocks C | chapter = Most Frequent Procedures Performed in U.S. Hospitals, 2011 | date = October 2013 | title = Healthcare Cost and Utilization Project (HCUP) Statistical Briefs [Internet]. | location = Rockville (MD) | publisher = Agency for Healthcare Research and Quality | id = Statistical Brief #165 | pmid = 24354027 | url = https://www.ncbi.nlm.nih.gov/books/NBK174682/ }}</ref>。 |
|||
=== 合併症 === |
|||
==== 溶血性輸血副作用 ==== |
|||
*ABO不適合輸血(事故):血液型検査ミスより患者や血液製剤の取り違えなど事務的ミスでおきることが多い。メジャー不適合でも死亡率は10%程度。早期に発見して処置すれば助かる。 |
|||
[[ニューヨーク・タイムズ]]紙によれば、「医学の進歩により、何百万回もの輸血の必要性がなくなっており、かつて大量の血液を必要とした冠動脈バイパスなどの処置を受ける患者にとっては朗報である」。一方、「[[血液バンク]]の収入は減少しており、その減少は2008年の最高額50億ドルから今年(2014年)は年間15億ドルに達するかもしれない"。[[赤十字社]]によれば、今後3年から5年の間に、雇用損失は業界全体のおよそ4分の1にあたる12,000人に達するだろう」<ref name="Transfusions Decline">{{Cite news| vauthors = Wald ML |title=Blood Industry Shrinks as Transfusions Decline|url=https://www.nytimes.com/2014/08/23/business/blood-industry-hurt-by-surplus.html|access-date=2014-08-24|work=[[ニューヨーク・タイムズ|The New York Times]] Newspaper|agency=New York Times|issue=Web Edition|date=2014-08-24|ref=39}}</ref>。 |
|||
そのため、ガイドラインでは輸血開始後15分間は輸血速度1ml/m、15分後からは5ml/mにし、[[看護師]]がベッドサイドにいて観察することが必要となっている([[医師]]による観察は必要ない)。 |
|||
==歴史== |
|||
==== 非溶血性輸血副作用 ==== |
|||
[[ウィリアム・ハーヴェイ]]の血液循環に関する実験に始まり、輸血に関する記録された研究は17世紀に始まり、動物間での輸血実験に成功した。しかし、動物の血液をヒトに輸血する医師による相次ぐ試みは、結果にばらつきがあり、しばしば致命的な結果をもたらした<ref>{{Cite book|url=https://books.google.com/books?id=RmM9AQAAIAAJ&q=carbonic+oxide|title=Scientific American|date=1869-02-20|publisher=Munn & Company|pages=122|language=en}}</ref>。 |
|||
*PC、次いでRBCの順に非溶血性輸血副作用が多く報告されており、副作用の種類は報告が多い順に「蕁麻疹」、「アナフィラキシーショック」、「呼吸困難」である。頻度はもっとも多く、0.5 - 2% |
|||
[[インノケンティウス8世 (ローマ教皇)|教皇インノケンティウス8世]] は、主治医のジャコモ・ディ・サン・ジェネシオから「世界初の輸血」を受けたと言われることがある。彼は教皇に10歳の少年3人の血を飲ませた。少年たちはその後死亡し、教皇自身も死亡した。しかし、この話の証拠は信用できず、反ユダヤ的な[[血の中傷]]の可能性があると考えられている<ref>Jacalyn Duffin, ''History of Medicine: A scandalously short introduction'', University of Toronto Press, 1999, p. 171.{{ISBN missing|date=2024年4月}}</ref>。 |
|||
[[蕁麻疹]]、かゆみ、発熱はいずれも抗原・抗体反応を基盤としておこると考えられている。 |
|||
=== 初期の試み === |
|||
また、血圧低下は40%が輸血開始後10分以内に起き、30分以内では76%を占める。 |
|||
==== インカ帝国 ==== |
|||
最初に成功したと報告された輸血は、1500年代にはインカ帝国において行われていた<ref>{{Cite book| vauthors = Lusardi DM |title=The New Book of Knowledge|publisher=Scholastic Library Publishing|year=2002|pages=260}}</ref>。16世紀に到着したスペインの[[コンキスタドール|征服者]]たちは、輸血を目撃している<ref name=":6">{{Cite book| vauthors = Lee R |title=The Eureka! Moment: 100 Key Scientific Discoveries of the 20th Century|year=2016|publisher=Routledge |isbn=9781136714764}}{{要ページ番号|date=June 2022}}</ref>。アンデス地域の先住民の間では、O型の血液型が多かったことから、このような処置は、ヨーロッパにおける初期の試みの失敗の一因となった、血液型が適合しない集団間での輸血の試みよりもリスクが少なかったと考えられている<ref name=":6" />{{Efn|O型の血液型保持者は、万能供血者とも呼ばれ、不適合輸血のリスクが低い<ref>{{Cite web |title=輸血の概要 - 13. 血液の病気 |url=https://www.msdmanuals.com/ja-jp/%E3%83%9B%E3%83%BC%E3%83%A0/13-%E8%A1%80%E6%B6%B2%E3%81%AE%E7%97%85%E6%B0%97/%E8%BC%B8%E8%A1%80/%E8%BC%B8%E8%A1%80%E3%81%AE%E6%A6%82%E8%A6%81 |website=MSDマニュアル家庭版 |access-date=2024-04-07 |language=ja-JP}}</ref>。}}。 |
|||
*[[移植片対宿主病]] (graft versus host disease: GVHD) :受血者血液中で残存した供血者リンパ球が受血者組織を攻撃しておこす病態、血液製剤の放射線照射で防止できる |
|||
*同種感作:血液製剤中の白血球がもつ[[ヒト白血球型抗原|HLA]]などにより抗体ができる。血小板輸血不応などの原因になる。現在血小板製剤は白血球が1バッグ当たり10の6乗以下となっているが、患者が経産婦や輸血経験者の場合ではこの程度の除去では防止することができない。 |
|||
*[[鉄過剰症]]:骨髄異形成症候群・再生不良性貧血といった難治性貧血の治療で輸血を受け鉄が過剰に体に取り込まれることによって発症する。 |
|||
*[[高カリウム血症]]:溶血した血球からカリウムが漏れ出すことにより起きる。 |
|||
*クエン酸中毒:抗凝固薬として添加されている[[クエン酸]]により、[[低カルシウム血症]]、[[代謝性アシドーシス]]を起こす。 |
|||
*濃厚赤血球液を1日10単位以上輸注すると相対的に[[血小板]]や[[凝固因子]]が低下し、凝固障害を起こす。 |
|||
*輸血関連[[急性肺傷害]](Transfusion-related acute lung injury: TRALI、トラリ):おそらくは白血球抗体による反応のために急性の呼吸困難をおこす病態。 |
|||
==== 動物同士の輸血 ==== |
|||
==== TRALI(輸血関連急性肺障害)とTACO(輸血関連循環過負荷)の比較 ==== |
|||
[[ファイル:Richard Lower.jpg|thumb|[[リチャード・ロウアー]]は1665年に動物同士、1667年に動物からヒトへの輸血を行った。]] |
|||
{| class="wikitable" |
|||
1660年代、[[王立協会]]に勤務していた医師[[リチャード・ロウアー]]は、血液量の変化が循環機能に及ぼす影響を調べ始め、動物における交差循環研究の方法を開発した。彼が考案した新しい器具のおかげで、王立協会の著名な同僚たちの前で、確実に記録された最初の輸血を成功させることができたとされる<ref name="Acta Anaesthesiologica Belgica" />。 |
|||
| '''特徴''' || ''' TRALI ''' || '''TACO''' |
|||
|- |
|||
|体温||発熱||変化無し |
|||
|- |
|||
|血圧||低下||上昇 |
|||
|- |
|||
|呼吸症状||呼吸困難||呼吸困難 |
|||
|- |
|||
|頸静脈||変化無し||怒張 |
|||
|- |
|||
|聴診||ラ音||ラ音 |
|||
|- |
|||
|心エコー||正常 - 低下||低下 |
|||
|- |
|||
|肺水腫||滲出液(細胞・蛋白は多い)||漏出液(細胞・蛋白は少ない) |
|||
|- |
|||
|利尿剤の効果||なし||あり |
|||
|- |
|||
|白血球数||減少||変化なし |
|||
|- |
|||
|BNP||<200pg/ml||>1200pg/ml |
|||
|- |
|||
|白血球抗体||+||- |
|||
|- |
|||
|} |
|||
ロウアーの記述によれば、「...1665年2月の終わり頃、(私は)中型の犬を一匹選び、その頸静脈を開いて、犬の力がほとんど抜けるまで血を抜いた。それから、この犬の大損失を2頭目の血液で補うために、1頭目と並んで固定されていたかなり大きな[[マスティフ|マスチフ]]の頸動脈から血液を導入した。彼が「頸静脈を縫合」した後、その動物は「不快感や不満を示すことなく」回復した<ref name="Acta Anaesthesiologica Belgica" />。 |
|||
==== 感染症 ==== |
|||
* 輸血後肝炎:献血者の血液が持つ[[B型肝炎]]ウイルスや[[C型肝炎]]ウイルスがスクリーニングをすり抜けて受血者に感染する。頻度は1万 - 10万に1回の割合で発生する。 |
|||
* HIV感染:確実例は3回4例で、NAT検査導入後は1回のみ。 |
|||
* [[敗血症]]:血液製剤が細菌で汚染されていた場合、室温保存の血小板製剤で可能性が高い。輸血前に血液製剤の色調、混濁、溶血をチェックすることで防止できる。 |
|||
*: 赤血球製剤の場合は特にセグメントチューブ(輸血バッグに付いた細いソーセージ状のチューブ。[[交差適合試験]]のための検体を採取する)内はバッグ本体内よりも腐敗が早期に現れるので、ここを観察すると良い。 |
|||
*: 赤血球ではアクネ菌が多いが、これは弱毒で敗血症をおこさない。 |
|||
* 未知の病原体による感染症のリスクは排除できない<ref>水野樹、「[https://doi.org/10.2199/jjsca.30.925 術中回収式自己血輸血:産科手術]」 『日本臨床麻酔学会誌』 2010年 30巻 7号 p.925-930, {{doi|10.2199/jjsca.30.925}}, P.925</ref>。 |
|||
その後、彼は「高名な(ロバート・)[[ロバート・ボイル|ボイル]]から......王立協会に実験全体の手順を知らせるよう要請され」、1665年12月に王立協会の[[フィロソフィカル・トランザクションズ]](Philosophical Transactions)誌に掲載した<ref name="Acta Anaesthesiologica Belgica">{{Cite journal | vauthors = Rivera AM, Strauss KW, van Zundert A, Mortier E | title = The history of peripheral intravenous catheters: how little plastic tubes revolutionized medicine | journal = Acta Anaesthesiologica Belgica | volume = 56 | issue = 3 | pages = 271–282 | year = 2005 | pmid = 16265830 | url = http://www.sarb.be/fr/journal/artikels_acta_2005/artikels_acta_56_3/acta_56_3_rivera.pdf | url-status = dead | archive-url = https://web.archive.org/web/20140715002449/http://www.sarb.be/fr/journal/artikels_acta_2005/artikels_acta_56_3/acta_56_3_rivera.pdf | archive-date = 2014-07-15 }}</ref>。 |
|||
==== 血管迷走神経反射 (VVR) ==== |
|||
献血や自己血採血時の副作用でもっとも重要。転倒による死亡事故も起きている。 |
|||
==== 動物からヒトへの輸血 ==== |
|||
{| class="wikitable" |
|||
動物から人への最初の輸血は、1667年6月15日、フランス国王ルイ14世の高名な侍医であった[[ジャン=バティスト・デニ]]によって行われた<ref name=":10">{{Cite web|url=http://www.heart-valve-surgery.com/heart-surgery-blog/2009/01/03/first-blood-transfusion|title=The First Blood Transfusion? |publisher=Heart-valve-surgery.com |date=2009-01-03 |access-date=2010-02-09}}</ref>。彼は[[ヒツジ|羊]]の血を15歳の青年に輸血し、彼は生き延びた<ref name=":10" /><ref name="anes">{{Cite web|url=https://www.anesthesia.wisc.edu/AHA/Calendar/June.html |title=This Month in Anesthesia History (archived) |access-date=2016-03-05 |url-status=dead |archive-url=https://web.archive.org/web/20110720122419/https://www.anesthesia.wisc.edu/AHA/Calendar/June.html |archive-date=July 20, 2011 }}</ref>。デニは、9オンスの羊の血を、精神疾患の青年に輸血した<ref name="Acta Anaesthesiologica Belgica" />。当初、患者はこの輸血によく耐えたが、その後の輸血で、記録されている最初の[[有害事象]]が発生した<ref name="Acta Anaesthesiologica Belgica" />。デニは、今日の血液学者なら誰でも輸血反応として認めるであろうことを、驚くべき正確さで描写している。『血液が彼の静脈に入り始めるとすぐに、彼は腕に沿って、そして脇の下のあたりが熱くなるのを感じた。[[脈拍]]はすぐに上昇し、すぐに顔全体に大量の汗をかいた。この瞬間、脈拍は極端に変化し、[[腎臓]]に激痛が走り、胃の調子が悪くなり、自由にさせないと窒息しそうだと訴えた...。目を覚ますと......コップ一杯の大小便をし、その色はまるで煙突の煤が混じったような黒色だった』<ref name="Acta Anaesthesiologica Belgica" />。患者の妻はドニを故意に毒殺しようとした罪で訴えたたが、デニの容疑は晴れ、一転して妻自身が夫の毒殺の罪で訴えられた<ref name="Acta Anaesthesiologica Belgica" />。デニはまた、もう一人、ある労働者に輸血を行い、彼も生き延びた。どちらの例も、実際にこれらの人々に輸血された血液の量が少なかったために、輸血による反応に耐えられたためと考えられている。 |
|||
| '''判定基準''' || '''基本症状''' || '''その他の症状''' |
|||
|- |
|||
|I度||徐脈(>40/分)、血圧低下||顔面蒼白、冷汗、悪心など |
|||
|- |
|||
|II度||徐脈(≦40/分)、血圧低下(<90Pa)さらに意識喪失||嘔吐 |
|||
|- |
|||
|III度||II度に加え痙攣、失禁、脱糞|| |
|||
|} |
|||
デニによって輸血を受けた3人目の患者は、スウェーデンの{{仮リンク|グスタフ・ボンデ|en|Gustaf Bonde (1620–1667)|redirect=1|label=グスタフ・ボンデ(Gustaf Bonde)}}男爵だった。彼は2回の輸血を受けたが、2回目の輸血の後、ボンデは死亡した<ref name="pbs.org">{{Cite web|url=https://www.pbs.org/wnet/redgold/innovators/bio_denis.html |title=Red Gold . Innovators & Pioneers . Jean-Baptiste Denis |publisher=PBS |access-date=2010-02-09}}</ref>。1667年の冬、デニは他の患者には、子牛の血液による輸血も数回行った。3回目の輸血でその患者は死亡した<ref>{{Cite book|doi=10.1002/9780470986868|title=Mollison's Blood Transfusion in Clinical Medicine|year=2005|veditors=Klein HG, Anstee DJ|isbn=978-0-470-98686-8|url=http://digitool.hbz-nrw.de:1801/webclient/DeliveryManager?pid=5489767&custom_att_2=simple_viewer|page=406}}{{リンク切れ|date=March 2024 |bot=InternetArchiveBot |fix-attempted=yes }}</ref>。 |
|||
== 記録と輸血同意書 == |
|||
「血液製剤等に係る遡及調査ガイドライン」では主にHBV、HCV、HIVの検査のため輸血前後の患者血清(血漿)は2mL程度、-20℃以下で3ヶ月以上保管するよう言っている。 |
|||
デニの実験の6ヵ月後、ロウアーはロンドンで、英国初の動物血液の輸血を行った。「王立協会の会合で、(患者の)腕に羊の血液を何オンスか、いろいろな時間に注入するのを監督した。その患者はアーサー・コガという、"無害な精神異常の患者 "であった。羊の血が使われたのは、種間の血液交換の価値についての憶測があったからである。穏やかな子羊の血は、興奮した人の気性の荒い精神を静めるかもしれないし、内気な人はもっと社交的な生き物の血によって外向的になるかもしれないと示唆されていた。コガは実験に参加するために20シリング(2021年の183ポンドに相当)を受け取った<ref>{{Cite web| vauthors = Yale E |title=First Blood Transfusion: A History|url=http://daily.jstor.org/first-blood-transfusion/|website=[[JSTOR|JSTOR]]|access-date=22 April 2015|date=2015-04-22}}</ref>。 |
|||
また特定生物由来製品の使用対象者の製剤名、ロット番号、氏名、住所などの記録は20年間の保管義務がある。 |
|||
ロウアーはその後、血流の正確なコントロールと輸血のための新しい器具を開発し、その設計は現代の[[注射器]]や[[カテーテル]]と実質的に同じであった<ref name="Acta Anaesthesiologica Belgica" />。まもなくロウアーはロンドンに移り、そこで診療を行うようになり、ほどなくして研究をやめてしまった<ref>{{Cite journal | vauthors = Felts JH | title = Richard Lower: anatomist and physiologist | journal = Annals of Internal Medicine | volume = 132 | issue = 5 | pages = 420–423 | date = March 2000 | pmid = 10691601 | doi = 10.7326/0003-4819-132-5-200003070-00023 | s2cid = 21469192 }}</ref>。 |
|||
近年は輸血の施行の際に同意書をとることが一般的である。輸血の副作用で患者に傷害が生じた場合、[[PL法]]に基づくと[[日本赤十字社]]が賠償するべきだが、日本赤十字社を訴えるということが難しいということから、医療機関が訴えられることが多い。輸血製剤に病原菌が混入し、輸血を受けた患者が死亡したとき(菌の混入は輸血製剤の性状が変化するほどのものでないと確認できない)、その輸血製剤を使用した病院と医師が有罪になったこともある。輸血同意書には大抵は以下のようなことが記載されている。 |
|||
;特定生物由来製品の説明とそのリスク |
|||
;採血国と献血、非献血の提示と選択 |
|||
;副作用の救済制度とその適応 |
|||
;血液製剤の必要性と使用した場合のリスクとベネフィット |
|||
;使用を予定する製剤の種類と使用量 |
|||
輸血は確かに危険は伴うが、「重大な副作用が起こるリスクは交通事故の遭遇率より低いため同意書をとるほどのことなのか」という疑問が業界内にはある。 |
|||
これらの動物血液を使った初期の実験は、イギリスとフランスで激しい論争を引き起こした<ref name="pbs.org" />。 ついに1668年、王立協会とフランス政府はこの実験を禁止した。[[バチカン]]も1670年にこれらの実験を非難した。その後150年間、輸血は不確実な治療手段に留まり続けた。 |
|||
== 輸血管理料 == |
|||
現在、適切な輸血に応じ医療機関に報酬が与えられている。IとIIがあり、下記で区別されている。 |
|||
==== ヒトからの輸血 ==== |
|||
(FFP輸血量-血漿交換に使用したFFP輸血量/2)/RBC輸血量=0.54未満 |
|||
[[ファイル:James Blundell (physician).jpg|thumb|[[ジェームズ・ブランデル]]は1818年にヒト同士の輸血に成功した。]] |
|||
19世紀初頭、イギリスの[[産科医]][[ジェームズ・ブランデル]]は、注射器を用いたヒト血液の輸血による出血治療に取り組んだ。1818年、動物を使った実験の後、彼は[[分娩後出血]]の治療に初めてヒトの血液を輸血することに成功した。ブランデルは患者の夫をドナーとして使い、彼の腕から4[[オンス]]の血液を採取して妻に輸血した。1825年から1830年にかけて、ブランデルは10回の輸血を行い、そのうち5回は有益であり、その結果を出版した。彼はまた、輸血のための多くの器具を発明した<ref name="Ellis">{{Cite journal | vauthors = Ellis H | title = James Blundell, pioneer of blood transfusion. | journal = British Journal of Hospital Medicine | date = August 2005 | volume = 68 | issue = 8 | page = 447 | url = http://www.bjhm.co.uk/cgi-bin/go.pl/library/article.cgi?uid=24500;article=hm_68_8_447 | doi = 10.12968/hmed.2007.68.8.24500 | pmid = 17847699 }}</ref>。彼はこの努力によって、およそ200万ドル(現代の5,000万ドル相当)という相当な金額を稼いだ。<ref>{{Cite book|title = Bridge Across the Abyss: Medical Myths and Misconceptions| vauthors = Madbak F |publisher = Universal-Publishers|year = 2008|isbn = 978-1-58112-987-8|page = 22}}</ref> |
|||
1840年、[[ロンドン大学セント・ジョージズ]]医学部で、{{仮リンク|サミュエル・アームストロング・レーン|en|Samuel Armstrong Lane|redirect=1}}が、ブランデルの助力を得て、[[血友病]]治療のための全血輸血を初めて成功させた<ref>{{Cite web |title=History of Blood Transfusion Medicine - BloodBook, Blood Information for Life |url=https://www.bloodbook.com/trans-history.html |website=www.bloodbook.com |access-date=2024-04-28}}</ref>。 |
|||
かつAlb輸血量/RBC輸血量=2未満 が輸血管理料I |
|||
しかし、初期の輸血は危険を伴い、その多くが患者の死につながった。19世紀後半になると、輸血は危険で怪しげな処置とみなされ、医学界からはほとんど敬遠されるようになった。 |
|||
(FFP輸血量-血漿交換に使用したFFP輸血量/2)/RBC輸血量=0.27未満 |
|||
ジェームス・ブランデルを模倣する研究はエジンバラでも続けられた。1845年、Edinburgh Journal誌は、重度の子宮出血の女性への輸血が成功したことを紹介した。その後の輸血は、[[ジェームズ・シンプソン|ジェームス・シンプソン]]教授の患者にも成功し、この教授にちなんでエディンバラの{{仮リンク|Simpson Memorial Maternity Pavilion|en|Simpson Memorial Maternity Pavilion|redirect=1|label=Simpson Memorial Maternity Pavilion}}シンプソン記念マタニティ・パビリオンが命名された<ref name=":4">{{Cite book|title = The History of the Blood Transfusion Service In Edinburgh| vauthors = Masson A |year = 1993|location = Edinburgh}}</ref>。 |
|||
かつAlb輸血量/RBC輸血量=2未満 が輸血管理料II |
|||
19世紀末には、輸血に成功したというさまざまな単独の報告が現れた<ref>{{Cite book|url=https://books.google.com/books?id=6ok9AQAAIAAJ|title=Scientific American, "A Successful Case of Transfusion of Blood"|year=1880|publisher=Munn & Company|pages=281|language=en}}</ref>。 初期の輸血成功の最大の一連の報告は、1885年から1892年にかけて{{仮リンク|Royal Infirmary of Edinburgh|en|Royal Infirmary of Edinburgh|redirect=1|label=Edinburgh Royal Infirmary}}エディンバラ王立診療所で行われた。エジンバラは後に、最初の献血と輸血サービスの拠点となった<ref name=":4" />。[[ファイル:William Stewart Halsted.jpg|thumb|[[ウィリアム・スチュワート・ハルステッド]](1852-1922)は、米国で最初の輸血を行った医師の一人である。]][[ウィリアム・スチュワート・ハルステッド]](1852-1922)はアメリカの[[外科医]]で、1881年にアメリカでおそらく初の輸血を行った<ref>{{Cite web |title=William Stewart Halsted |url=https://prabook.com/web/william_stewart.halsted/730128 |website=prabook.com |access-date=2024-04-21 |language=en-EN}}</ref>。ハルステッドは、出産した妹を診察し、妹が[[産後出血]]で衰弱しているのを発見し、大胆にも自分の血液を抜いて妹に輸血し、妹を手術して命を救った<ref>{{Cite journal|last=Osborne|first=Michael P|date=2007-03|title=William Stewart Halsted: his life and contributions to surgery|url=https://doi.org/10.1016/S1470-2045(07)70076-1|journal=The Lancet Oncology|volume=8|issue=3|pages=256–265|doi=10.1016/s1470-2045(07)70076-1|issn=1470-2045}}</ref>。 |
|||
アルブミン製剤の使用量を求めるには、各アルブミンを使用重量(g)に換算する。例えば、5%250mlなら12.5gとなる。これらを3で割った値が単位数である。 |
|||
== |
===20世紀=== |
||
オーストリアの[[カール・ラントシュタイナー]]は、1901年、赤血球がヒトによって異なる表面抗原を持ち、これに他のヒトの血液の抗体が結合することによって免疫反応が起こり、赤血球が凝集して破壊されることを発見した<ref name=":19">{{Cite web |title=Karl Landsteiner Biography: Discoverer of Blood Groups {{!}} BroadBiography |url=https://broadbiography.com/biography/medicine/karl-landsteiner-biography/ |date=2023-08-07 |access-date=2024-04-28 |language=en-US}}</ref>。[[溶血|赤血球が破壊される]]と遊離[[ヘモグロビン]]が血液中に放出され、致命的な結果をもたらす。更に彼は、1909年にヒトの血液をA、B、AB、Oの4種に分類した<ref name=":19" />。ラントシュタイナーの研究によって血液型の判定が可能になり、輸血がより安全に行われるようになった。この発見により、彼は1930年に[[ノーベル生理学・医学賞]]を受賞した<ref name=":19" />。 |
|||
医療機関が輸血をする際に確認する項目を述べる。この項目が正確になされていないと輸血製剤に問題があった場合も医療機関は輸血製剤の不適切使用として訴えられ敗訴するという判例がある。{{main|防衛医療}} |
|||
{{仮リンク|ジョージ・W・クライル|en|George Washington Crile|redirect=1}}は、[[ケース・ウェスタン・リザーブ大学]]の外科教授であった1906年、クリーブランドのセント・アレクシス病院で、直接輸血による最初の手術を行ったことで知られている<ref>{{Cite journal | vauthors = Nathoo N, Lautzenheiser FK, Barnett GH | title = The first direct human blood transfusion: the forgotten legacy of George W. Crile | journal = Neurosurgery | volume = 64 | issue = 3 Suppl | pages = ons20–26; discussion ons26–27 | date = March 2009 | pmid = 19240569 | doi = 10.1227/01.NEU.0000334416.32584.97 | quote = [...] the first successful blood transfusion performed between 2 brothers on August 6, 1906, at St. Alexis Hospital, Cleveland, OH. | s2cid = 2339938 }}</ref>。すなわち、血液の凝固を防ぐために、患者の静脈にドナーの動脈を外科的に接続する方法で患者を救った<ref>[http://what-when-how.com/inventions/blood-transfusion-inventions/ Blood transfusion (Inventions)]</ref>。 |
|||
;[[血液型]]の一致(患者本人の確認) |
|||
;製剤の一致(オーダーされた血液と適合検査の確認) |
|||
;製剤確認(有効期限、放射線照射の有無、色調、バッグの異常) |
|||
;輸血中の観察(バイタル確認、[[副作用]]発現の確認) |
|||
;輸血後の確認(副作用なく、終了したことの確認) |
|||
{{仮リンク|ヤン・ヤンスキー|en|Jan Janský|redirect=1|label=ヤン・ヤンスキー (Jan Janský)}}もヒトの血液型を発見しており、1907年に血液型をI、II、III、IVの4つのグループに分類した<ref>{{Lang | cs | "Hematologická studie u psychotiků"}}</ref>。1901年にABO血液型を発見したラントシュタイナーは、この時点では血液型はA、B、Oの3種であると考えており、現在知られている血液型4種を先に発見したのはヤンスキーであると見なされている<ref>{{Cite book |last=Mole |first=Sara |url=https://books.google.com/books?id=iViwAAAAQBAJ&dq=%22Hematological+study+of+psychotics%22+Jan+Jansk%C3%BD&pg=PA12 |title=The Neuronal Ceroid Lipofuscinoses (Batten Disease) |last2=Williams |first2=Ruth |last3=Goebel |first3=Hans |date=2011-03-10 |publisher=OUP Oxford |isbn=978-0-19-101558-8 |language=en}}</ref>。 |
|||
赤血球MAP-LRの場合は2単位を1時間で点滴する場合が多いが、有効期限は点滴が終了する時間まで満たされていないと不正使用と認定されることがある。特に血小板濃厚液は有効期限が短いので注意が必要である。点滴がつまり、予定が狂ってしまうことはよくあるからである。 |
|||
ウィリアム・ロレンゾ・モス(William Lorenzo Moss's)博士(1876-1957)の1910年のモス血液型検査法は、[[第二次世界大戦]]まで広く使用されていた<ref>["Studies on isoagglutinins and isohemolysins". ''Bulletin Johns Hopkins Hospital'' 21: 63–70.]</ref><ref>{{Cite web |url=http://onlineathens.com/stories/090501/ath_drmoss.shtml |title=Dr. William Lorenzo Moss |access-date=2014-02-22 |archive-url=https://web.archive.org/web/20140228170325/http://onlineathens.com/stories/090501/ath_drmoss.shtml |archive-date=2014-02-28 |url-status=dead }}</ref>。 |
|||
[[2004年]]から、ウイルスマーカーが陽転した献血者血液の遡及が始まり、患者に告知されているが、{{誰範囲2|そのリスクとコスト、心理的影響を考えると問題なしとしない|date=2012年4月}}。特に変異型[[クロイツフェルト・ヤコブ病]] (vCJD) に関する遡及([[イギリス|英国]]滞在者からの輸血)は{{要出典範囲|科学的にも容認しがたい|date=2012年4月|}}。 |
|||
== |
==== 血液バンク ==== |
||
{{Main|{{仮リンク|血液バンク|en|Blood bank|redirect=1}}}} |
|||
[[感染症]]に対する恐れや信条により([[エホバの証人]])、輸血を避ける人もいる。 |
|||
[[ファイル:Agote 1a transfusión.jpg|thumb|1914年、安全で効果的な最初の輸血を監督する[[ルイス・アゴーテ]]医師(右から2人目)。]] |
|||
{{main|輸血拒否}} |
|||
[[ファイル:Vidro para transfusão de sangue, Centro de Memórias do Curso de Enfermagem da UFES (2).jpg|thumb|かつて輸血に用いられたガラス容器]] |
|||
最初の輸血は、凝固する前に供血者から受血者へ直接行わなければならなかったが、[[抗凝固剤]]を添加し、血液を[[冷蔵]]保存することで数日間保存できることが発見され、{{仮リンク|血液バンク|en|blood bank|redirect=1}}の発展への道が開かれた。{{仮リンク|ジョン・ブラクストン・ヒックス|en|John Braxton Hicks|redirect=1}}は、19世紀後半にロンドンの{{仮リンク|セント・メアリー病院(ロンドン)|en|St Mary's Hospital, London|redirect=1|label=セント・メアリー病院}}で、血液の凝固を防ぐ化学的方法を初めて実験した。しかし、{{仮リンク|リン酸ナトリウム塩|en|Sodium phosphates|redirect=1}}を用いた彼の試みは失敗に終わった。 |
|||
1914年3月27日、[[ベルギー]]の医師[[アルベール・ユスタン]]は、初めて非直接的な輸血を行ったが、これは希釈した血液であった。同年11月には、[[アルゼンチン]]の医師[[ルイス・アゴーテ]]が、もっと希釈度の低い輸血液を使用した。どちらも抗凝固剤として{{仮リンク|クエン酸一ナトリウム|en|Monosodium citrate|redirect=1}}を使用した<ref>{{Cite journal|doi= 10.1001/jama.1940.02810160078030|title= Effect of External Temperature on Sedimentation Rate of Red Blood Corpuscles|year= 1940| vauthors = Gordon MB |journal= Journal of the American Medical Association|volume= 114|issue= 16}}</ref>。 |
|||
== ヒト以外の動物における輸血 == |
|||
{{main|en:Blood type (non-human)}} |
|||
新鮮血全血輸血が一般的であり、輸血を必要とするほどの病態ではその効果は即効的に現れる。保存血の使用はヒトに比べるとあまり一般的ではない。しかし、施設によっては赤血球輸血、新鮮血漿輸血など成分輸血を行うこともある。 |
|||
[[第一次世界大戦]](1914-1918)は、血液バンクと輸血技術を急速に発展させるきっかけとなった。[[ロックフェラー大学]](当時はロックフェラー医学研究所)の [[ペイトン・ラウス]] とジョセフ・R・ターナーは、血液の凝集(凝固)を避けるためには血液型検査が必要であり、血液サンプルは化学処理によって保存できるという最初の重要な発見をした<ref name=":32">{{Cite web |date=2010 |title=The Rockefeller University Hospital Centennial – The First Blood Bank |url=https://centennial.rucares.org/index.php?page=blood_bank |access-date=2022-03-18 |website=centennial.rucares.org |publisher=The Rockefeller University}}</ref><ref name=":12">{{Cite news | vauthors = Brody JE |date=1970-02-17 |title=Dr. Peyton Rous, Nobel Laureate, Dies |language=en-US |pages=43 |work=The New York Times |url=https://www.nytimes.com/1970/02/17/archives/dr-peyton-rous-nobel-laureate-dies.html |access-date=2022-03-18 |issn=0362-4331}}</ref>。 1915年3月の彼らの最初の報告では、[[ゼラチン]]、[[寒天]]、血清抽出物、[[デンプン]]、牛アルブミンが役に立たない保存剤であることが証明された<ref>{{Cite journal | vauthors = Rous P, Turner JR |date= March 1915 |title=On the preservation in vitro of living erythrocytes |url=http://ebm.sagepub.com/lookup/doi/10.3181/00379727-12-74 |journal=Experimental Biology and Medicine |language=en |volume=12 |issue=6 |pages=122–124 |doi=10.3181/00379727-12-74 |issn=1535-3702 |s2cid=88016286}}</ref>。 |
|||
動物においても血液型の差異による[[同種免疫]]は存在するが、犬では初回の輸血では血液型が不適合であっても副作用発生の確率は低いとされている。しかし、100%安全であるとは言えない。自然抗体がある場合には輸血副作用が発生するリスクはある。従って、輸血液の相性をみる交差適合試験は不可欠となる。 |
|||
しかし、同じ実験を基に、彼らは[[クエン酸ナトリウム]]とグルコース([[ブドウ糖]])の混合溶液が完璧な保存剤であることを発見した。保存された血液は新鮮血とほぼ同じであり、「体内に再導入されたときに優れた機能を発揮する」と『''{{仮リンク|Journal of Experimental Medicine|en|Journal of Experimental Medicine|redirect=1|label=Journal of Experimental Medicine誌}}''』2月号で報告された''<ref name=":02">{{Cite journal | vauthors = Rous P, Turner JR | title = The Preservation of Living Red Blood Cells in Vitro | journal = The Journal of Experimental Medicine | volume = 23 | issue = 2 | pages = 219–237 | date = February 1916 | pmid = 19867981 | pmc = 2125399 | doi = 10.1084/jem.23.2.219 }}</ref>''。血液は4週間まで保存可能となった。クエン酸-[[スクロース]]混合物を用いた追加実験も成功し、血球を2週間維持することができた<ref>{{Cite journal | vauthors = Rous P, Turner JR | title = The Preservation of Living Red Blood Cells in Vitro | journal = The Journal of Experimental Medicine | volume = 23 | issue = 2 | pages = 239–248 | date = February 1916 | pmid = 19867982 | pmc = 2125395 | doi = 10.1084/jem.23.2.239 }}</ref>。このクエン酸塩と糖類の混合物は、ラウス・ターナー 溶液としても知られ、血液バンクの発展と輸血法の改善の基礎となった<ref>{{Cite journal | vauthors = Hess JR | title = An update on solutions for red cell storage | journal = Vox Sanguinis | volume = 91 | issue = 1 | pages = 13–19 | date = July 2006 | pmid = 16756596 | doi = 10.1111/j.1423-0410.2006.00778.x | s2cid = 35894834 }}</ref><ref>{{Cite journal | vauthors = Hanigan WC, King SC | title = Cold blood and clinical research during World War I | journal = Military Medicine | volume = 161 | issue = 7 | pages = 392–400 | date = July 1996 | pmid = 8754712 | doi = 10.1093/milmed/161.7.392 | doi-access = free }}</ref>。 |
|||
供血側の動物は、供血動物という<ref name=koku>{{Cite web|和書|url=https://crd.ndl.go.jp/reference/detail?page=ref_view&id=1000106507 |title=犬に血液型はあるか。 |access-date=2023-05-24 |last=国立国会図書館 |website=レファレンス協同データベース |language=ja}}</ref>。1992年の資料では、人間のような{{ill2|血液バンク|en|Blood bank}}や犬血液型判定キットなどは不足しているとされる<ref>{{Cite web |url=https://pubmed.ncbi.nlm.nih.gov/1472772/ |title=Canine blood transfusions |access-date=2023-05-24 |last=Hohenhaus |first=A. E. |date=1992-12 |website=Problems in Veterinary Medicine |pages=612–624}}</ref>。そのため、日本では供血犬・供血猫などを動物病院で飼育、もしくはボランティアで提供してくれる飼い主を募集していたりする<ref>{{Cite web|和書|url=https://sippo.asahi.com/article/14336226 |title=健康な猫から、病気の仲間への贈り物 「供血猫」登録は助け合いの輪を広げること | 犬・猫との幸せな暮らしのためのペット情報サイト「sippo」 |access-date=2023-05-24 |last=Company |first=The Asahi Shimbun |date=2021-04-28 |website=sippo |language=ja-JP}}</ref><ref>{{Cite web|和書|url=https://www.tokyo-np.co.jp/article/112934 |title=ペットを救うために働く「供血犬」に穏やかな暮らしを 八王子の英会話講師が引退後の飼い主を探す活動:東京新聞 TOKYO Web |access-date=2023-05-24 |website=東京新聞 TOKYO Web |language=ja}}</ref>。 |
|||
ラウスとターナーによる、以下のもう一つの発見([[交差適合試験]])は、輸血の安全性において最も重要なステップであった。ラウスは、ラントシュタイナーの血液型の概念がまだ実用的な価値を見いだせないことをよく知っていた:「ラントシュタイナーの努力の運命は、ヒトの血液における群間差の実用的な意義に注意を喚起するものであったが、これは知識が技術に時を刻むという絶妙な例を示している。輸血は、(少なくとも1915年までは)血液凝固の危険性が大きすぎたため、まだ行われていなかった」<ref name=":42">{{Cite journal | vauthors = Rous P |author-link=Francis Peyton Rous |year=1947 |title=Karl Landsteiner. 1868-1943 |journal={{仮リンク|Obituary Notices of Fellows of the Royal Society|en|Obituary Notices of Fellows of the Royal Society|redirect=1|label=Obituary Notices of Fellows of the Royal Society}} |volume=5 |issue=15 |pages=294–324 |doi=10.1098/rsbm.1947.0002 |s2cid=161789667}}</ref>。1915年6月、彼らは[[Journal of the American Medical Association]]誌に、ドナーとレシピエントの血液サンプルを事前に検査すれば凝集を避けられるという重要な報告を行った。クエン酸ナトリウムを血液サンプルの希釈に用い、レシピエントとドナーの血液を9:1と1:1の割合で混ぜた後、15分後には、血液が凝集するか、状態が変わらないままのどちらかであった。この方法を彼らは血液型適合性判定のための迅速簡易検査と呼んだ。彼らのアドバイスによると、固まらない血液を「可能であれば常に選択すべきである」<ref>{{Cite journal | vauthors = Rous P, Turner JR |date=1915 |title=A rapid and simple method of testing donors for transfusion |journal=Journal of the American Medical Association |volume=LXIV |issue=24 |pages=1980–1982 |doi=10.1001/jama.1915.02570500028011|url=https://zenodo.org/record/2520617 }}</ref>。 |
|||
;馬 |
|||
:馬の血液型は、A式、C式、D式、K式、P式、Q式、U式の7種類ある。多くの馬へ血液が提供できる馬はユニバーサルドナーと呼ばれ、「Aa抗原およびQa抗原のいずれも持たない馬」および「Aa抗原およびQa抗原に対する抗体を保有していない馬」であることが条件である<ref name=hidaka>{{Cite web|和書|url=https://blog.jra.jp/shiryoushitsu/2019/11/post-03ec.html |title=馬の輸血とユニバーサルドナー |access-date=2023-05-24 |website=馬の資料室(日高育成牧場)}}</ref>。この条件を満たしやすい種として、ポニーの一種である{{ill2|ハフリンガー|en|Haflinger}}種は約8割が条件を満たす<ref name=hidaka/><ref>[http://www.nlbc.go.jp/kachikukairyo/eiseikanri/katikueiseituusin/eiseituusin_23.pdf 重種馬の新たな価値~ユニバーサルドナー~] NLBC 家畜衛生通信 第23号 令和4年11月 著:十勝牧場 衛生課</ref>。 |
|||
カナダ人医師、{{仮リンク|ローレンス・ロバートソン|en|Lawrence Bruce Robertson|redirect=1}}[[中尉]]は、{{仮リンク|現場救護所|en|Casualty Clearing Station|redirect=1}}で輸血を採用するよう{{仮リンク|王立陸軍医療軍団 |en|Royal Army Medical Corps|redirect=1|label=王立陸軍医療軍団 (Royal Army Medical Corps: RAMC)}}を説得するのに尽力した。1915年10月、ロバートソンは榴散弾による[[多発外傷]]の患者に、戦時中初の輸血を[[注射器]]で行った。彼はこの後、数ヶ月の間に4回の輸血を行い、その成功は[[イギリス医学研究審議会]]の議長であった{{仮リンク|ウォルター・フレッチャー|en|Walter Morley Fletcher|redirect=1}}に報告された<ref name="star2016">[https://www.thestar.com/news/insight/2016/07/09/a-canadian-kept-blood-flowing-in-wwi-an-american-got-credit.html "A Canadian kept blood flowing in WWI. An American got credit"]. ''Toronto Star''. July 9, 2016. Katie Daubs</ref>。 |
|||
;犬 |
|||
:犬の血液型は13種類あり、犬赤血球抗原(Dog Erythrocyte Antigens)は8種類ある<ref name=koku/>。その中で、DEA1.1が陰性であるものがユニバーサルドナーであり、供血犬となる<ref name=koku/>。 |
|||
[[ファイル:Direct-blood-transfusion.jpg|thumb|left|第二次世界大戦中のロシア製、ヒト間直接輸血用注射器]] |
|||
;猫 |
|||
ロバートソンは1916年にその研究成果を[[British Medical Journal]]誌に発表し、志を同じくする少数の人々(高名な医師{{仮リンク|エドワード・ウィリアム・アーチボルド|en|Edward William Archibald|redirect=1}}を含む)の協力を得て、英国当局に輸血のメリットを説得することができた。ロバートソンは1917年の春、[[西部戦線 (第一次世界大戦)|西部戦線]]の傷病兵救護所に最初の輸血装置を設置した<ref name=star2016 /><ref name="Pelis">{{Cite journal | vauthors = Pelis K | title = Taking credit: the Canadian Army Medical Corps and the British conversion to blood transfusion in WWI | journal = Journal of the History of Medicine and Allied Sciences | volume = 56 | issue = 3 | pages = 238–277 | date = July 2001 | pmid = 11552401 | doi = 10.1093/jhmas/56.3.238 | s2cid = 34956231 }}</ref>。しかし、ロバートソンは[[交差適合試験]]を行わなかったため、1916年の輸血では1人が[[溶血]]で死亡し、1917年には3人が死亡した<ref>{{Cite journal | vauthors = Stansbury LG, Hess JR | title = Blood transfusion in World War I: the roles of Lawrence Bruce Robertson and Oswald Hope Robertson in the "most important medical advance of the war" | journal = Transfusion Medicine Reviews | volume = 23 | issue = 3 | pages = 232–236 | date = July 2009 | pmid = 19539877 | doi = 10.1016/j.tmrv.2009.03.007 }}</ref>。 |
|||
:猫の血液型は、A型、B型、AB型の3種である。A型、B型は互いに相性が悪く、B型血液の猫にA型を輸血するとA型の猫にB型の血液を輸血する場合より重篤な症状を引き起こすため、それぞれの型にあった血液を輸血する必要がある<ref>{{Cite web|和書|url=https://jamc.co.jp/cat_colum/759/ |title=愛猫の血液型知っていますか? - 日本動物医療センター |access-date=2023-05-24 |date=2017-02-09 |website=日本動物医療センター - 24時間夜間救急も可}}</ref>。 |
|||
医学研究者で[[アメリカ陸軍|米陸軍]]将校だった{{仮リンク|オズワルド・ホープ・ロバートソン|en|Oswald Hope Robertson|redirect=1}}は、1917年にRAMCに所属し、予想される[[第3次イーペルの戦い]]に備えて最初の血液バンクの設立に尽力した<ref>{{Cite web |url=https://www.pbs.org/wnet/redgold/history/timeline3.html |title=Red Gold: the Epic Story of Blood |publisher=PBS |access-date=2024-04-28 |archive-url=https://archive.org/details/red_gold |archive-date=2023-12-03 |deadlinkdate=2024-04-28 |date=2002-06-23}}</ref>。彼は抗凝固剤として{{仮リンク|クエン酸一ナトリウム|en|Monosodium citrate|redirect=1}}を使用し、血液は静脈の穿刺により採取され、戦線に沿って配置された英米の負傷者救護所で瓶に保管された。ロバートソンはまた、分離した赤血球を氷で冷やした瓶に保存する実験も行った<ref name="Pelis" />。イギリスの外科医{{仮リンク|Geoffrey Keynes|en|Geoffrey Keynes|redirect=1|label=Geoffrey Keynes}}ジェフリー・ケインズは、輸血をより簡単に行えるようにするため、血液を保存できる携帯型の機械を開発した。 |
|||
;血液バンク |
|||
:台湾では、2016年7月5日[[国立屏東大学]]に置かれたものが最初である<ref>{{Cite web |url=https://www.reuters.com/article/us-taiwan-animals-bloodbank-idUSKCN0ZO233 |title=Wagging tails for Taiwan's first veterinary blood bank |access-date=2023-05-24 |date=2016-07-08 |website=Reuters |language=en}}</ref>。 |
|||
==== 発展 ==== |
|||
;動物の血を人間に輸血する例 |
|||
[[ファイル:A A Bogdanov.jpg|thumb|[[アレクサンドル・ボグダーノフ]]は、1925年にモスクワで輸血の影響を研究するための科学研究所を設立した。]] |
|||
{{main|異種移植}} |
|||
英国赤十字の事務局長であった{{仮リンク|パーシー・レーン・オリバー|en|Percy Lane Oliver|redirect=1|label=パーシー・レーン・オリバー(Percy Lane Oliver)}}は、1921年に世界初の献血サービスを設立した。その年、オリバーは、献血者を緊急に必要としていた{{仮リンク|キングス・カレッジ病院|en|King's College Hospital|redirect=1}}から連絡を受けた<ref>{{Cite book|url= https://books.google.com/books?id=n0_Vqz-V_T8C|title= The Great Ormond Street Hospital Manual of Children's Nursing Practices| vauthors = Macqueen S, Bruce E, Gibson F |year= 2012|publisher= John Wiley & Sons|page= 75|isbn= 978-1-118-27422-4}}</ref>。 献血者を提供した後、オリバーは、{{仮リンク|ジェフリー・ケインズ|en|Geoffrey Keynes|redirect=1}}卿を医学顧問に任命し、ロンドン周辺の診療所で自発的に献血者を登録するシステムの組織化に着手した。ボランティアは、[[血液型]]を確定するために一連の検査を受けた。オリバーの命名による{{仮リンク|NHSBT|en|NHS Blood and Transplant|redirect=1|label=ロンドン輸血サービス}}は無料であり、最初の数年間で急速に拡大した<ref name=":21" />。1925年までにほぼ400人の会員を擁し、1926年には英国赤十字の組織に組み込まれた<ref name=":21" />。このサービスの活動は国際的な注目を集めるようになっり、多くの国に対してオリバーは助言を行った<ref name=":21">{{Cite web |url=https://www.pbs.org/wnet/redgold/innovators/bio_oliver.html |title=Percy Oliver |publisher=Red Gold: The Eipc Story of Blood |access-date=2024-04-28 |archive-url=https://web.archive.org/web/20021018052205/https://www.pbs.org/wnet/redgold/innovators/bio_oliver.html |archive-date=2002-10-18 |deadlinkdate=2024-04-28}}</ref>。 |
|||
* {{ill2|打鶏血|zh|鸡血疗法}} - 1960年代から文化革命初期まで存在した中国の健康法。1年未満のニワトリの血を輸血する。 |
|||
* [[ジャン=バティスト・デニ]] - 1667年に羊の血を人間に輸血した。2人までは少量で副作用が出なかったが、3人目で死亡者が出て問題になった。 |
|||
[[アレクサンドル・ボグダーノフ]]は1925年、モスクワに輸血学専門の学術機関を設立した。ボグダーノフの動機の少なくとも一端は、[[永遠の若さ]]を求めてのことであり、11回の[[全血]]輸血を受けた後、1928年に死亡した<ref>Bernice Glatzer Rosenthal. ''New Myth, New World: From Nietzsche to Stalinism'', Pennsylvania State University, 2002, {{ISBN2| 0-271-02533-6}}, pp. 161–162.</ref>。 おそらく、複数回の輸血によって抗体が形成され、免疫反応による溶血が起こったのであろうと考えられている<ref name=":14">{{Cite journal|last=Huestis|first=Douglas W.|date=2007-10-01|title=Alexander Bogdanov: The Forgotten Pioneer of Blood Transfusion|url=https://www.sciencedirect.com/science/article/pii/S0887796307000478|journal=Transfusion Medicine Reviews|volume=21|issue=4|pages=337–340|doi=10.1016/j.tmrv.2007.05.008|issn=0887-7963}}</ref>。ボグダーノフは、政府に輸血の重要性を認識させ、彼の死後数年で、ソ連は輸血に使用する血液を病院で採取・保管する施設のネットワークを最初に確立した国となった<ref name=":14" />。先駆者ボグダーノフに続いて、ソ連のウラジミール・シャモフ(Vladimir Shamov)と{{仮リンク|セルゲイ・ユージン|en|Sergei Yudin (surgeon)|redirect=1|label=セルゲイ・ユージン(Sergei Yudin)}}は、死亡したばかりのドナーからの輸血、すなわち{{仮リンク|死体血輸血|en|Cadaveric blood transfusion|redirect=1}}を開拓した<ref name=":15">{{Citation|title=The History of Fluid Resuscitation for Bleeding|last=Thompson|first=Patrick|last2=Strandenes|first2=Geir|date=2020|url=https://doi.org/10.1007/978-3-030-20820-2_1|publisher=Springer International Publishing|editor-last=Spinella|editor-first=Philip C.|pages=3–29|isbn=978-3-030-20820-2|language=en|doi=10.1007/978-3-030-20820-2_1|pmc=PMC7123228|access-date=2024-04-28}}</ref>。 ユージンは1930年3月23日、初めてこのような輸血を成功させ、9月にハリコフで開催された第4回ウクライナ外科学会で、死体血による最初の7回の臨床輸血を報告した<ref name=":15" />。1932年までに、ユージンは死体から3週間保管された血液による輸血を100回報告し、1937年には死体血液の使用を1,000回以上報告した<ref name=":15" />{{Efn|今日では、死者は献血ドナーの条件である「健康な成人」という条件から大きな隔たりがある。}}。 |
|||
== 脚注 == |
|||
{{Reflist|2}} |
|||
[[ファイル:Blood transfusion ww2 poster.jpg|thumb|left| 戦争のための献血を呼びかける1944年のイギリスのポスター]] |
|||
== 参考文献 == |
|||
{{仮リンク|フレデリック・デュラン・ジョルダ|en|Frederic Durán-Jordà|redirect=1|label=フレデリック・デュラン・ジョルダ(Frederic Durán-Jordà)}}は、1936年の[[スペイン内戦]]中に、初期の血液バンクのひとつを設立した。デュランは戦争開始と同時にバルセロナの[[サン・パウ病院]]の輸血部に従事したが、病院はすぐに血液の需要とドナーの不足に圧倒された。{{仮リンク|スペイン共和国軍|en|Spanish Republican Army|redirect=1|label=スペイン共和国軍(Spanish Republican Army)}}の衛生局の支援を受けて、デュランは負傷兵と民間人のための血液バンクを設立した。採取された300~400mLの血液は、改良型デュランエルレンマイヤーフラスコで10%クエン酸溶液と混合された。血液は2℃で滅菌ガラス容器に陽圧封入されて保存された。バルセロナの輸血サービスは、30ヶ月の作業の間に、ほぼ30,000人のドナーを登録し、9,000リットルの血液を処理した<ref> |
|||
{{Cite book|url= https://books.google.com/books?id=3QwXx_enKbcC|title= Blood Banking and Transfusion Medicine: Basic Principles & Practice| vauthors = Hillyer CD |year= 2007|publisher= Elsevier Health Sciences|isbn= 978-0-443-06981-9}}</ref>。 |
|||
1937年、シカゴの[[クック郡病院]]の治療部長であった{{仮リンク|バーナード・ファンタス|en|Bernard Fantus|redirect=1}}は、米国初の病院血液バンクを設立した。ドナーの血液を保存し、冷蔵し、保管する病院の検査室を設立したことで、ファンタスは「血液バンク」"blood bank". という言葉を生み出した。数年のうちに、病院や地域の血液バンクが全米に設立された<ref>{{Cite book|vauthors= Kilduffe R, DeBakey M |title= The blood bank and the technique and therapeutics of transfusion|publisher= St. Louis: The C.V.Mosby Company|year= 1942|pages= 196–197}}</ref>。 |
|||
ジョルダは1938年にイギリスに逃れ、ハマースミス病院の{{仮リンク|王立大学院医学部|en|Royal Postgraduate Medical School|redirect=1}}の{{仮リンク|ジャネット・ヴォーン|en|Janet Vaughan|redirect=1}}医師と協力して、ロンドンに全国規模の血液バンクのシステムを構築した<ref>{{Cite book| vauthors = Starr D |title= Blood: An Epic History of Medicine and Commerce|year= 1998|publisher= Little, Brown and Company|isbn= 0-316-91146-1|pages= 84–87}}</ref>。 1938年に第二次世界大戦の勃発が間近に迫ると、[[戦争省]]はブリストルに陸軍血液補給廠(Army Blood Supply Depot: ABSD)を創設し、{{仮リンク|ライオネル・ウィットビー|en|Lionel Whitby|redirect=1}}が責任者となり、国内4か所の大規模な血液廠を管理した。戦争を通じて英国の方針は、アメリカやドイツが前線の部隊が必要な血液を供給したのとは対照的に、中央の貯血所から軍人に血液を供給することであった。英国の方法は、すべての必要量を十分に満たすことに成功し、戦争期間中に70万人以上のドナーが献血した。このシステムは、1946年に設立された{{仮リンク|NHSBT|en|NHS Blood and Transplant |redirect=1|label=全国輸血サービス組織(National Blood Transfusion Service)}}へと発展した<ref>{{Cite journal | vauthors = Giangrande PL | title = The history of blood transfusion | journal = British Journal of Haematology | volume = 110 | issue = 4 | pages = 758–767 | date = September 2000 | pmid = 11054057 | doi = 10.1046/j.1365-2141.2000.02139.x | s2cid = 71592265 | doi-access = free }}</ref>。 |
|||
第二次世界大戦中、東欧で[[ナチス]]が捕虜の子どもたちに繰り返し血液を無理やり提供させたという話がある<ref> |
|||
For example: |
|||
{{Cite news |
|||
|url= https://books.google.com/books?id=65e0AAAAMAAJ |
|||
|title= Free World |
|||
|volume= 8 |
|||
|year= 1944 |
|||
|publisher= Free World, Incorporated |
|||
|page= 442 |
|||
|access-date= 16 August 2019 |
|||
|quote= [...] Nazis chose the healthiest Polish children and transported them to German field hospitals where they used them for constant blood transfusions [...]. |
|||
}} |
|||
</ref> |
|||
。 |
|||
==== 医療の進歩 ==== |
|||
[[ファイル:Private Roy W. Humphrey of Toledo, Ohio is being given blood plasma after he was wounded by shrapnel in Sicily on 8-9-43 - NARA - 197268.jpg|thumb|[[シチリア]]で血漿製剤を投与される負傷兵(1943年)]] |
|||
1940年、米国で採血計画が開始され、{{仮リンク|エドウィン・コーン|en|Edwin Cohn|redirect=1}}が{{仮リンク|血液分画|en|blood fractionation|redirect=1|label=血液分画(blood fractionation)}}の先駆者となった。彼は[[血漿]]中の{{仮リンク|血清アルブミン|en|serum albumin|redirect=1}}を分離する技術を開発した<ref>{{Cite journal|last=Cohn|first=E. J.|last2=Strong|first2=L. E.|last3=Hughes|first3=W. L.|last4=Mulford|first4=D. J.|last5=Ashworth|first5=J. N.|last6=Melin|first6=M.|last7=Taylor|first7=H. L.|date=1946-03|title=Preparation and Properties of Serum and Plasma Proteins. IV. A System for the Separation into Fractions of the Protein and Lipoprotein Components of Biological Tissues and Fluids 1a,b,c,d|url=https://pubs.acs.org/doi/abs/10.1021/ja01207a034|journal=Journal of the American Chemical Society|volume=68|issue=3|pages=459–475|language=en|doi=10.1021/ja01207a034|issn=0002-7863}}</ref>。血清アルブミンは血管内の[[膠質浸透圧]]を維持し、血管の虚脱を防ぐのに不可欠である。 |
|||
ゴードン・R・ウォードは''[[ブリティッシュ・メディカル・ジャーナル|British Medical Journal]]''誌の通信欄に寄稿し、早くも1918年には、全血の代用として、また輸血の目的で[[血漿]]を使用することを提案していた。第二次世界大戦が始まると、英国では液体血漿が使用されるようになった。アメリカでは、「英国に血を」"Blood for Britain"と呼ばれる大規模なプロジェクトが1940年8月に開始され、血漿を英国に輸出するために[[ニューヨーク]]の病院で採血が行われた。[[凍結乾燥]]された血漿のパッケージが、陸海軍の外科総監によって、[[全米アカデミーズ]]と協力して開発され<ref>{{Cite book |url=https://books.google.com/books?id=bmtV2HTcZh0C |title=United States Naval Medical Bulletin |date=1942 |publisher=U.S. Government Printing Office |language=en}}</ref>、破損が減少し、輸送、包装、保管がはるかに簡単になった<ref>{{Cite book | chapter-url = http://history.amedd.army.mil/booksdocs/wwii/blood/chapter1.htm | archive-url = https://web.archive.org/web/20060111115330/http://history.amedd.army.mil/booksdocs/wwii/blood/chapter1.htm | archive-date = 11 January 2006 | work = Office of Medical History | chapter = Transfusion Before World War I | vauthors = Kendrick DB | title = Blood program in world war II. | publisher = Office of the Surgeon General, Department of the Army | date = 1964 }}</ref>。 |
|||
[[ファイル:Charles R Drew portrait.png|thumb|left|{{仮リンク|チャールズ・ドリュー|en|Charles R. Drew|redirect=1}}は、第二次世界大戦中にイギリスに出荷するための血漿の生産を監督した。]] |
|||
出来上がった乾燥血漿のパッケージは、400mLのボトルが入った2つのブリキ缶に入っていた。一方のボトルには、もう一方のボトルに入っている乾燥血漿を溶かして復元するのに十分な[[蒸留水]]が入っていた。 。約3分で、血漿は使用可能になり、約4時間新鮮に保つことができた<ref>{{Cite book | chapter-url = http://history.amedd.army.mil/booksdocs/wwii/blood/chapter7.htm | archive-url = https://web.archive.org/web/20060208034909/http://history.amedd.army.mil/booksdocs/wwii/blood/chapter7.htm | archive-date = 8 February 2006 | work = Office of Medical History | chapter = Plasma Equipment and Packaging, and Transfusion Equipment | vauthors = Kendrick DB | title = Blood program in world war II. | publisher = Office of the Surgeon General, Department of the Army | date = 1964 }}</ref>。 {{仮リンク|チャールズ・ドリュー|en|Charles R. Drew|redirect=1}}医師が監督者に任命され、試験管法を大量生産のための最初の成功技術に変えることができた。 |
|||
1937年から40年にかけて、[[カール・ラントシュタイナー]](1868-1943)、アレックス・ウィーナー(Alex Wiener)、フィリップ・レヴィン(Philip Levine)、R.E.ステットソン(R.E. Stetson)が、それまでの輸血反応の大半の原因であった[[Rh因子|RH因子]]を発見したことも、重要なブレークスルーとなった。その3年後、{{仮リンク|ジョン・ルーティト|en|John Freeman Loutit|redirect=1|label=ジョン・ルーティト(John Loutit)}}Jとパトリック・モリソン(Patrick L. Mollison)によって、抗凝固剤の量を減らす{{仮リンク|ACD液|en|acid–citrate–dextrose|redirect=1|label=クエン酸-ブドウ糖(acid–citrate–dextrose: ACD液)}}が導入され、より大量の輸血が可能になり、より長期間の保存が可能になった<ref>{{cite journal|last1=Loutit|first1=J. F.|last2=Mollison|first2=P. L.|last3=Young|first3=I. Maureen|last4=Lucas|first4=E. J.|date=16 December 1943|title=Citric Acid-Sodium Citrate-Glucose Mixtures for Blood Storage|journal=Quarterly Journal of Experimental Physiology and Cognate Medical Sciences|volume=32|issue=3|pages=183–202|doi=10.1113/expphysiol.1943.sp000882|doi-access=free}}</ref><ref>{{Cite journal|last=Loutit|first=J. F.|last2=Mollison|first2=P. L.|date=1943-12-11|title=Disodium-Citrate-Glucose Mixture as a Blood Preservative|url=https://pubmed.ncbi.nlm.nih.gov/20785169/|journal=British Medical Journal|volume=2|issue=4327|pages=744–745|doi=10.1136/bmj.2.4327.744|issn=0007-1447|pmc=2285557|pmid=20785169}}</ref>。 |
|||
カール・ウォルターとW.P.マーフィー・ジュニアは、1950年に採血用プラスチックバッグを発表した。割れやすいガラス瓶を[[ポリ塩化ビニル|PVC]]製の丈夫なプラスチックバッグに置き換えることで、1単位の全血から複数の血液成分を安全かつ容易に調製できる採血システムが進化した。 |
|||
{{仮リンク|がん手術|en|cancer surgery|redirect=1}}の分野では、大量出血への体液補充が大きな問題となった。[[心停止]]率は高かった。1963年、C・ポール・ボヤンとウィリアム・S・ハウランドは、血液の温度と注入速度が生存率に大きく影響することを発見し、[[手術]]に[[輸液加温器|血液加温]]を導入した<ref>{{Cite journal | vauthors = Boyan CP, Howland WS | title = Cardiac arrest and temperature of bank blood | journal = JAMA | volume = 183 | pages = 58–60 | date = January 1963 | pmid = 14014662 | doi = 10.1001/jama.1963.63700010027020 }}</ref><ref>{{Cite book |isbn= 978-3-540-13255-4 | vauthors = Rupreht J, van Lieburg MJ, Lee JA, Erdman W |publisher= Springer-Verlag |year= 1985 |pages= 99–101 |title= Anaesthesia: essays on its history}}</ref>。 |
|||
保存血液の保存期間を42日までさらに延長したのは、1979年に導入された抗凝固保存剤CPDA-1であり、これにより血液供給量が増加し、血液バンク間の資源共有が容易になった<ref>{{Cite journal | vauthors = Sugita Y, Simon ER | title = The Mechanism of Action of Adenine in Red Cell Preservation | journal = The Journal of Clinical Investigation | volume = 44 | issue = 4 | pages = 629–642 | date = April 1965 | pmid = 14278179 | pmc = 292538 | doi = 10.1172/JCI105176 }}</ref><ref>{{Cite journal | vauthors = Simon ER, Chapman RG, Finch CA | title = Adenine in red cell preservation | journal = The Journal of Clinical Investigation | volume = 41 | issue = 2 | pages = 351–359 | date = February 1962 | pmid = 14039291 | pmc = 289233 | doi = 10.1172/JCI104489 }}</ref> |
|||
。 |
|||
2006年の時点で、米国では年間約1,500万単位の血液製剤が輸血されていた<ref>{{Cite news |url=http://www.post-gazette.com/pg/07010/752655-28.stm |title=New rules may shrink ranks of blood donors |date=2007-01-10 |vauthors=Landro L |newspaper=Wall Street Journal |access-date=2008-04-05 |archive-date=2009-08-04 |archive-url=https://web.archive.org/web/20090804060528/http://www.post-gazette.com/pg/07010/752655-28.stm |url-status=dead}}</ref>]。2013年までに、その数は約1,100万単位まで減少した<ref name="Transfusions Decline" />。その理由は、[[腹腔鏡手術]]やその他の外科手術の進歩と、多くの輸血が不必要であることを示す研究結果によるものである<ref name="Transfusions Decline" />。例えば、[[人工股関節置換術]]では、では出血量が750mLから200mLに減少した<ref name="Transfusions Decline" />。 |
|||
=== 日本の輸血史 === |
|||
日本における輸血の実施は[[九州大学]]の[[後藤七郎]]と東京大学の[[塩田広重]]が、1919年にそれぞれ行って成功したのが最初とされる<ref>{{Cite journal|author=安部勝美|year=2000|title=輸血医学と検査の変遷|journal=医学検査|volume=49|page=1267-1276}}</ref>。塩田は1930年に右翼の青年に狙撃された[[浜口雄幸]]首相を輸血を行い手術して救った<ref>医学探偵の歴史事件簿 小長谷正明(著) 岩波新書 (2014年)ISBN 978-4004314745</ref>。この当時の輸血は、注射器で採取した血液を感染症検査などを行わず、そのまま輸血する「枕元輸血」と呼ばれる方法であった<ref name=":20">{{Cite web |title=血液事業のあゆみ|関連情報|医薬品情報|日本赤十字社 |url=http://www.jrc.or.jp/mr/relate/history/ |website=www.jrc.or.jp |access-date=2024-04-28 |language=ja}}</ref>。日本では血液バンクが整備されるきっかけとなったのは1948年に東京大学分院で輸血を受けた女性が梅毒に感染したことが契機である<ref>[[doi:10.3925/jjtc1958.26.1|日本輸血学会25周年記念講演]] 『日本輸血学会雑誌』 1980年 26巻 1-3号 p.1-15, {{doi|10.3925/jjtc1958.26.1}}</ref><ref>{{Cite journal|和書|author=根本晋一|date=2007|title=高度歯科医療に関する医療過誤訴訟の研究- -インプラント植立手術を素材として|url=http://www2.dent.nihon-u.ac.jp/bulletin/kiyou35/35-13.pdf|journal=日本大学歯学部紀要|issue=35|pages=101-112|publisher=日本大学歯学部|format=PDF|CRID=1520290882410127232|ISSN=1348818X}}</ref>。しかし、これらの血液バンクは商業目的であり、生活困窮者が金銭目的に供血を繰り返したことから血液製剤は低質で、輸血を介した肝炎ウイルス感染も多かった<ref>{{Cite web |title=「黄色い血」から献血へ、運動支えた学生団体が60周年で解散へ…「今の若者に思い託す」 |url=https://www.yomiuri.co.jp/local/kyushu/news/20230817-OYTNT50121/ |website=読売新聞オンライン |date=2023-08-18 |access-date=2024-04-28 |language=ja}}</ref>。1964年、[[エドウィン・O・ライシャワー|ライシャワー]]駐日米国大使が暴漢に刺され、輸血を受けた際に輸血後肝炎に感染した。これを契機に輸血用血液を献血で賄う機運が高まり、献血体制の確立が閣議決定された<ref name=":20" />。その後、献血の体制が急速に構築され、1968年には売血は影を潜めた<ref name=":22">{{Cite web |title=血液事業の歴史|大阪府赤十字血液センター|日本赤十字社 |url=https://www.bs.jrc.or.jp/kk/osaka/ |website=大阪府赤十字血液センター |access-date=2024-04-28 |language=ja}}</ref>。しかしながら、当初の献血は、 |
|||
{{Quote|あなたやあなたのご家族が輸血を必要とされるとき、この手帳で輸血が受けられます|4=献血手帳}} |
|||
つまり献血というより預血であった<ref name=":22" />。必要預血量を達成したとする団体が献血を辞退しはじめて献血量が伸び悩む一方、輸血の需要は増加の一途を辿った<ref name=":22" />。1982年、献血手帳のこの文言が削除され、献血がボランティアであることが明確化された<ref name=":22" />。しかし、血液製剤のうち、血漿分画製剤は国内の献血のみでは需要をまかなえず、海外からの輸入に現在まで依存している<ref name=":22" />。 |
|||
{{Seealso|売血|献血}} |
|||
== 特殊な状況 == |
|||
=== 新生児 === |
|||
小児患者への輸血の安全性を確保するため、感染を避けるためのさらなる予防措置が講じられており、[[サイトメガロウイルス]](CMV)陰性が保証された特別に検査された小児用血液製剤の使用が好まれている。ほとんどの[[ガイドライン (医学)|ガイドライン]]では、免疫系が十分に発達していない新生児や低出生体重児には、単に白血球を除去した血液成分ではなく、CMV陰性の血液成分を提供することを推奨している<ref name="neonatal-CMV">{{Cite web |url=http://www.cps.ca/english/statements/fn/fn02-02.htm#What%20type%20of%20RBCs%20should%20be%20used |title=Red blood cell transfusions in newborn infants: Revised guidelines |publisher=Canadian Paediatric Society (CPS) |access-date=2007-02-02 |url-status=dead |archive-url=https://web.archive.org/web/20070203095445/http://www.cps.ca/english/statements/FN/fn02-02.htm#What%20type%20of%20RBCs%20should%20be%20used |archive-date=2007-02-03 }}</ref>。このような特定の要件により、新生児用に献血できる献血者にはさらなる制限が設けられている。 |
|||
新生児輸血は通常2つのカテゴリーに分類される。 |
|||
* 血液検査による損失や貧血の補正を補うために輸血が行われることがある<ref>{{Cite web |url=https://www.hopkinsmedicine.org/-/media/files/allchildrens/clinical-pathways/blood-product-transfusion-clinical-pathway-2022.pdf |title=Red Blood Cell Transfusion in the Neonate Clinical Pathway |access-date=2024-04-27 |publisher=Johns Hopkins all children's hospital}}</ref>。 |
|||
* [[ビリルビン]]の除去、抗体の除去、赤血球の補充([[サラセミア]]やその他の{{仮リンク|ヘモグロビン異常症|en|Hemoglobinopathy|redirect=1}}に続発する貧血など)のために輸血が行われる(交換輸血という)<ref>{{Cite journal | vauthors = Radhakrishnan KM, Chakravarthi S, Pushkala S, Jayaraju J | title = Component therapy | journal = Indian Journal of Pediatrics | volume = 70 | issue = 8 | pages = 661–666 | date = August 2003 | pmid = 14510088 | doi = 10.1007/BF02724257 | s2cid = 42488187 }}</ref>。 |
|||
=== 大量出血 === |
|||
大量輸血プロトコール( ''massive transfusion protocol: '''MTP''')''は、10単位以上の血液が必要な{{仮リンク|重症外傷|en|major trauma|redirect=1}}など、著しい出血がある場合に使用される。一般的には、{{仮リンク|濃厚赤血球|en|packed red blood cells|redirect=1}}、{{仮リンク|新鮮凍結血漿|en|fresh frozen plasma|redirect=1}}、[[濃厚血小板]]が投与される<ref name="EMB11">{{Cite journal | vauthors = Cherkas D | title = Traumatic hemorrhagic shock: advances in fluid management | journal = Emergency Medicine Practice | volume = 13 | issue = 11 | pages = 1–19; quiz 19–20 | date = November 2011 | pmid = 22164397 | url = http://www.ebmedicine.net/store.php?paction=showProduct&catid=8&pid=244 | url-status = dead | archive-url = https://web.archive.org/web/20120118152838/http://www.ebmedicine.net/store.php?paction=showProduct&catid=8&pid=244 | archive-date = 2012-01-18 }}</ref>。通常、新鮮凍結血漿と濃厚血小板が濃厚赤血球に比して比率が高い<ref name="EMB11" />。一部の地域では、大量失血による予防可能な死亡を減らすために、病院搬送前に輸血が行われる。例えば、妊娠中の母親に大量出血が起こったとき、救急車は血液バンクにあるような、FDA([[アメリカ食品医薬品局|米国食品医薬品局]])規格のポータブル血液冷蔵庫に保存された血液を携えて出動可能である<ref>{{Cite news |last1=Villalpando |first1=Nicole |title=Whole blood program saves Cedar Park mom's life |url=https://www.statesman.com/videos/news/healthcare/2023/11/09/whole-blood-program-saves-cedar-park-moms-life/71517999007/}}</ref>。米国では、病院前輸血が広く行われていれば助かったはずの患者が、年間31,000人も失血死している<ref>{{Cite news |last1=Caruba |first1=Lauren |title=Bleeding Out: A new series exploring America's urgent health crisis |url=https://www.dallasnews.com/news/investigations/2023/11/27/bleeding-out-a-new-series-exploring-americas-urgent-health-crisis/#:~:text=For%20more%20than%20two%20years,shootings%2C%20falls%20and%20other%20accidents.}}</ref>。 |
|||
=== 血液型が不明の場合 === |
|||
血液型O(-)は誰とでも適合するため、しばしば過剰に使用され、供給不足に陥っている<ref name="AABBfive-5">{{Citation |author1 = American Association of Blood Banks |author1-link = American Association of Blood Banks |date = 24 April 2014 |title = Five Things Physicians and Patients Should Question |publisher = American Association of Blood Banks |work = {{仮リンク|Choosing Wisely|en|Choosing Wisely|redirect=1|label=Choosing Wisely}}: an initiative of the {{仮リンク|ABIM Foundation|en|ABIM Foundation|redirect=1|label=ABIM Foundation}} |url = http://www.choosingwisely.org/doctor-patient-lists/american-association-of-blood-banks/ |access-date = 25 July 2014 |archive-url = https://web.archive.org/web/20140924075027/http://www.choosingwisely.org/doctor-patient-lists/american-association-of-blood-banks/ |archive-date = 24 September 2014 |url-status = dead }}, which cites |
|||
*{{Cite web|author1=The Chief Medical Officer's National Blood Transfusion Committee|title=The appropriate use of group O RhD negative red cells|url=http://hospital.blood.co.uk/library/pdf/nbtc_bbt_o_neg_red_cells_recs_09_04.pdf |archive-url=https://ghostarchive.org/archive/20221009/http://hospital.blood.co.uk/library/pdf/nbtc_bbt_o_neg_red_cells_recs_09_04.pdf |archive-date=2022-10-09 |url-status=live|publisher=[[国民保健サービス|National Health Service]]|access-date=25 July 2014|year=c. 2008}}</ref>。{{仮リンク|AABO (医学)|en|AABB|redirect=1|label=血液と生物学的治療推進のための協会(Association for the Advancement of Blood and Biotherapies: AABO)}}によれば、この血液型のヒト自身は、他の血液型が適合しないため、O(-)の輸血はO(-)の血液型の人、および妊娠している可能性があり、緊急治療を行う前に血液型検査を行うことが不可能な女性に制限されるべきである<ref name="AABBfive-5" />。可能な限り、AABBは、より希少性の低い代替を特定するための血液型検査を使用することにより、O(-)の血液を温存することを推奨している<ref name="AABBfive-5" />。 |
|||
=== 宗教的輸血拒否 === |
|||
[[エホバの証人]]は、血液は神聖なものであるという信念から、[[輸血拒否|輸血を拒否]]することがある<ref>{{Cite book|url=https://books.google.com/books?id=cGBaz0hp_fcC&pg=PA279|title=Transfusion Medicine and Hemostasis: Clinical and Laboratory Aspects| vauthors = Hillyer CD, Shaz BH, Zimring JC, Abshire TC |year=2009|publisher=Elsevier|isbn=9780080922300|page=279|language=en}}</ref>。 |
|||
== 輸血の代替 == |
|||
{{See also|代替血液}} |
|||
赤血球輸血が臨床的に唯一の適切な選択肢である臨床状況もあるが、臨床医は代替案が実行可能かどうかを検討する。これには、患者の安全性、経済的負担、血液の不足などいくつかの理由がある。ガイドラインでは、貧血の程度にもよるが、輸血は貧血・出血のために心血管系が不安定、または緊急性の高い患者のために温存されるべきであると勧告している<ref name=":16">{{Cite journal | vauthors = Goddard AF, James MW, McIntyre AS, Scott BB | title = Guidelines for the management of iron deficiency anaemia | journal = Gut | volume = 60 | issue = 10 | pages = 1309–1316 | date = October 2011 | pmid = 21561874 | doi = 10.1136/gut.2010.228874 | doi-access = free | collaboration = British Society of Gastroenterology }}</ref><ref>{{Cite journal | vauthors = Shander A, Fink A, Javidroozi M, Erhard J, Farmer SL, Corwin H, Goodnough LT, Hofmann A, Isbister J, Ozawa S, Spahn DR | display-authors = 6 | title = Appropriateness of allogeneic red blood cell transfusion: the international consensus conference on transfusion outcomes | journal = Transfusion Medicine Reviews | volume = 25 | issue = 3 | pages = 232–246.e53 | date = July 2011 | pmid = 21498040 | doi = 10.1016/j.tmrv.2011.02.001 | others = International Consensus Conference on Transfusion Outcomes Group }}</ref>。 慢性期の鉄欠乏性貧血患者には、鉄剤の投与が推奨される<ref name=":16" />。 |
|||
人工的な[[代替血液]]は研究段階に留まっており、少なくとも2022年時点では実用化されていない<ref>{{Cite web |title=人工血液について Q10 {{!}} 日本人工臓器学会 |url=https://www.jsao.org/public/faq/faq03/ |access-date=2023-11-23 |language=ja}}</ref><ref>{{Cite web |title=Q7. 血液は人工的に造れないの?|東海北陸ブロック血液センター|日本赤十字社 |url=https://www.bs.jrc.or.jp/tkhr/bbc/ |website=東海北陸ブロック血液センター |access-date=2023-11-23 |language=ja}}</ref><ref>{{Cite web |title=次世代医療の切り札となる「人工血液」 中央大学・小松晃之研究室{{!}}SDGs@大学{{!}}朝日新聞EduA |url=https://www.asahi.com/edua/article/14788812 |website=www.asahi.com |access-date=2023-11-23 |language=ja}}</ref> |
|||
== 薬物乱用目的の特殊な輸血 == |
|||
南アフリカでは、[[ニャオペ]](麻薬の一種)中毒者の一部が、麻薬が引き起こす高揚感を経済的に共有するために、口語的にBluetoothingとして知られる、[[Bluetooth|同名の無線技術]]にちなんで命名された少量の輸血を行っている<ref>{{Cite news|url=http://www.iol.co.za/news/crime-courts/bluetooth-drug-craze-sweeps-townships-7574716|title='Bluetooth' drug craze sweeps townships {{!}} IOL| vauthors = Tshipe L |date=1 February 2017|access-date=2017-02-02|via=Pretoria News}}</ref>。 |
|||
== 獣医学領域の輸血 == |
|||
{{Main|{{仮リンク|血液型 (ヒト以外)|en|Blood type (non-human)|redirect=1}}}} |
|||
動物間でも[[獣医師]]により輸血は行われる。適合することを確実にするための必要な検査は動物種により異なる。例えば、猫の既知の血液型は3種類<ref name=":7">{{Cite web |title=Blood types |url=https://eclinpath.com/hemostasis/transfusion-medicine/blood-types/ |access-date=2023-10-21 |website={{仮リンク|Cornell University College of Veterinary Medicine|en|Cornell University College of Veterinary Medicine|redirect=1|label=Cornell University College of Veterinary Medicine}} eClinpath}}</ref>、牛は11種類<ref name=":7" />、犬は少なくとも13種類<ref>{{Cite web |last=Cotter |first=Susan M. |date=October 2022 |title=Blood Groups and Blood Transfusions in Dogs - Dog Owners |url=https://www.msdvetmanual.com/dog-owners/blood-disorders-of-dogs/blood-groups-and-blood-transfusions-in-dogs |access-date=2023-10-21 |website=MSD Veterinary Manual}}</ref>、豚は16種類<ref>{{Cite journal |last1=Smith |first1=Douglas M. |last2=Newhouse |first2=Michael |last3=Naziruddin |first3=Bashoo |last4=Kresie |first4=Lesley |date=May 2006 |title=Blood groups and transfusions in pigs |url=https://onlinelibrary.wiley.com/doi/10.1111/j.1399-3089.2006.00299.x |journal=Xenotransplantation |volume=13 |issue=3 |pages=186–194 |doi=10.1111/j.1399-3089.2006.00299.x |pmid=16756561 |s2cid=29174596 |issn=0908-665X}}</ref>、馬は30種類以上<ref name=":7" />である。しかし、多くの動物種(特に馬と犬)では、非自己細胞表面抗原に対する抗体は最初からは発現していないため、つまり、輸血された血液に対する免疫反応を起こす前に動物が[[感作]]される必要があるため、最初の輸血の前に必ずしも[[交差適合試験]]を行う必要はない<ref>{{Cite web |date=2019-02-26 |title=Crossmatch Testing |url=https://www.vet.cornell.edu/animal-health-diagnostic-center/testing/protocols/immunology/crossmatch |access-date=2023-10-21 |website={{仮リンク|Cornell University College of Veterinary Medicine|en|Cornell University College of Veterinary Medicine|redirect=1|label=Cornell University College of Veterinary Medicine}}}}</ref>。 |
|||
供血側の動物は、供血動物という<ref name="koku">{{Cite web|和書 |url=https://crd.ndl.go.jp/reference/detail?page=ref_view&id=1000106507 |title=犬に血液型はあるか。 |access-date=2023-05-24 |last=国立国会図書館 |website=レファレンス協同データベース |language=ja}}</ref>。1992年の資料では、人間のような{{ill2|血液バンク|en|Blood bank}}や犬血液型判定キットなどは不足しているとされる<ref>{{Cite web |url=https://pubmed.ncbi.nlm.nih.gov/1472772/ |title=Canine blood transfusions |access-date=2023-05-24 |last=Hohenhaus |first=A. E. |date=1992-12 |website=Problems in Veterinary Medicine |pages=612–624}}</ref>。そのため、日本では供血犬・供血猫などを動物病院で飼育、もしくはボランティアで提供してくれる飼い主を募集していたりする<ref>{{Cite web|和書|犬・猫との幸せな暮らしのためのペット情報サイト「sippo」 |url=https://sippo.asahi.com/article/14336226 |title=健康な猫から、病気の仲間への贈り物 「供血猫」登録は助け合いの輪を広げること |access-date=2023-05-24 |last=Company |first=The Asahi Shimbun |date=2021-04-28 |website=sippo |language=ja-JP}}</ref><ref>{{Cite web|和書 |url=https://www.tokyo-np.co.jp/article/112934 |title=ペットを救うために働く「供血犬」に穏やかな暮らしを 八王子の英会話講師が引退後の飼い主を探す活動:東京新聞 TOKYO Web |access-date=2023-05-24 |website=東京新聞 TOKYO Web |language=ja}}</ref>。 |
|||
=== 馬 === |
|||
: 馬の血液型は、A式、C式、D式、K式、P式、Q式、U式の7種類ある。多くの馬へ血液が提供できる馬はユニバーサルドナーと呼ばれ、「Aa抗原およびQa抗原のいずれも持たない馬」および「Aa抗原およびQa抗原に対する抗体を保有していない馬」であることが条件である<ref name="hidaka">{{Cite web|和書 |url=https://blog.jra.jp/shiryoushitsu/2019/11/post-03ec.html |title=馬の輸血とユニバーサルドナー |access-date=2023-05-24 |website=馬の資料室(日高育成牧場)}}</ref>。この条件を満たしやすい種として、ポニーの一種である{{ill2|ハフリンガー|en|Haflinger}}種は約8割が条件を満たす<ref name="hidaka" /><ref>[http://www.nlbc.go.jp/kachikukairyo/eiseikanri/katikueiseituusin/eiseituusin_23.pdf 重種馬の新たな価値~ユニバーサルドナー~] NLBC 家畜衛生通信 第23号 令和4年11月 著:十勝牧場 衛生課</ref>。 |
|||
=== 犬 === |
|||
: 犬の血液型は13種類あり、犬赤血球抗原(Dog Erythrocyte Antigens)は8種類ある<ref name="koku" />。その中で、DEA1.1が陰性であるものがユニバーサルドナーであり、供血犬となる<ref name="koku" />。 |
|||
=== 猫 === |
|||
: 猫の血液型は、A型、B型、AB型の3種である。A型、B型は互いに相性が悪く、B型血液の猫にA型を輸血するとA型の猫にB型の血液を輸血する場合より重篤な症状を引き起こすため、それぞれの型にあった血液を輸血する必要がある<ref>{{Cite web|和書 |url=https://jamc.co.jp/cat_colum/759/ |title=愛猫の血液型知っていますか? - 日本動物医療センター |access-date=2023-05-24 |date=2017-02-09 |website=日本動物医療センター - 24時間夜間救急も可}}</ref>。 |
|||
; 血液バンク |
|||
: 台湾では、2016年7月5日[[国立屏東大学]]に置かれたものが最初である<ref>{{Cite web |url=https://www.reuters.com/article/us-taiwan-animals-bloodbank-idUSKCN0ZO233 |title=Wagging tails for Taiwan's first veterinary blood bank |access-date=2023-05-24 |date=2016-07-08 |website=Reuters |language=en}}</ref>。 |
|||
== 脚注 == |
|||
{{脚注ヘルプ}} |
|||
=== 注釈 === |
|||
{{Notelist}} |
|||
=== 出典 === |
|||
{{Reflist|colwidth=30em}} |
|||
==関連文献== |
|||
* {{Cite book|title=Blood Work: A Tale of Medicine and Murder in the Scientific Revolution|url=https://archive.org/details/bloodworktaleofm0000tuck|url-access=registration|year=2012| vauthors = Tucker H |isbn=978-0393342239|publisher=W. W. Norton & Company}} |
|||
* "[https://books.google.com/books?id=p4o9AQAAIAAJ Milk as a Substitute for Blood Transfusion]", historical account, [[サイエンティフィック・アメリカン|Scientific American]], 13 July 1878, p. 19 |
|||
* 輸血学 第3版 遠山博ほか(中外出版社) |
* 輸血学 第3版 遠山博ほか(中外出版社) |
||
* 最新版 献血と輸血のすべて 霜山龍志(丸善札幌SC)2012年 |
* 最新版 献血と輸血のすべて 霜山龍志(丸善札幌SC)2012年 |
||
== 関連項目 == |
== 関連項目 == |
||
* {{仮リンク|アルノー・ツァンク|en|Arnault Tzanck|redirect=1|label=アルノー・ツァンク(Arnault Tzanck)}} - フランスにおける輸血の組織化に貢献した。 |
|||
* [[血液製剤]] |
|||
* {{ill2|打鶏血|zh|鸡血疗法}} - 1960年代から文化革命初期まで存在した中国の健康法。1年未満のニワトリの血を輸血する。 |
|||
* [[献血]] |
|||
* [[無輸血治療]] |
* [[無輸血治療]] |
||
* {{ill2|胎児輸血|en|Intrauterine transfusion}} |
* {{ill2|胎児輸血|en|Intrauterine transfusion}}- 子宮内での胎児への輸血 |
||
* [[血液型]] |
|||
* [[ヒト白血球型抗原|HLA]] |
|||
* [[亜型検査]] |
* [[亜型検査]] |
||
* [[不規則抗体]] |
|||
* [[認定輸血検査技師]] |
* [[認定輸血検査技師]] |
||
* {{ill2|国際輸血学会|en|International Society of Blood Transfusion}}(ISBT) |
* {{ill2|国際輸血学会|en|International Society of Blood Transfusion}}(ISBT) |
||
* [[医療識別票]] - |
* [[医療識別票]] - 意識不明になった場合、蘇生拒否などの希望や、[[稀血]]・血液型などの輸血に必要な情報、注意すべき持病などを医療関係者に伝える装身具 |
||
* {{ill2| |
* {{ill2|若者からの輸血|en|Young blood transfusion|redirect=1}} - 若者の血を輸血すると若返るとした疑似科学健康法。 |
||
* {{仮リンク|ウィンドウ期間|en|window period}} - 最初の感染から検査がその感染を確実に検出できるようになるまでの期間。この間には献血を行うべきでは無い。 |
|||
* [[シャーガス病]] - 輸血により感染するため、一定期間伝染病がある地域にいた人は献血を行えない。 |
* [[シャーガス病]] - 輸血により感染するため、一定期間伝染病がある地域にいた人は献血を行えない。 |
||
* {{ill2|血液ドーピング|en|Blood doping}} - マラソン選手などの持久性種目の選手が事前に採血をして、処理した血液を自分に輸血することで血液が酸素を運ぶ能力を高められる。 |
|||
* [[抗凝固剤]]([[クエン酸ナトリウム#クエン酸三ナトリウム|クエン酸ナトリウム]]、{{ill2|ACD (血液抗凝固剤)|en|Acid-citrate-dextrose}}) |
|||
* [[代替血液]] |
|||
== |
==外部リンク== |
||
{{Commonscat|Blood transfusion}} |
|||
* [http://yuketsu.jstmct.or.jp/ 日本輸血・細胞治療学会] |
|||
* [http://www.transfusionevidencelibrary.com/ Transfusion Evidence Library] - 輸血に関する[[エビデンス (医学)|エビデンス]]検索(英語) |
|||
* {{Kotobank}} |
* {{Kotobank}} |
||
=== 輸血関連学会 === |
|||
* [https://www.bbts.org.uk/ British Blood Transfusion Society] (BBTS) - 英国輸血学会 |
|||
* [http://yuketsu.jstmct.or.jp/ 日本輸血・細胞治療学会] |
|||
=== 書籍 === |
|||
* [https://www.ncbi.nlm.nih.gov/books/NBK2261 ''Blood Groups and Red Cell Antigens''] Free online book at [[アメリカ国立生物工学情報センター|NCBI]] Bookshelf ID: NBK2261 |
|||
* [https://www.transfusionguidelines.org/document-library/documents/transfusion-handbook-5th-edition/download-file/5th%20Handbook%20of%20Transfusion%20Medicine.pdf ''Handbook of Transfusion Medicine''] {{Webarchive|url=https://web.archive.org/web/20230314175248/https://www.transfusionguidelines.org/document-library/documents/transfusion-handbook-5th-edition/download-file/5th%20Handbook%20of%20Transfusion%20Medicine.pdf |date=2023-03-14 }} - 英国で出版された輸血学のハンドブック第5版 |
|||
=== ガイドライン === |
|||
* [https://www.blood.gov.au/pbm-guidelines Australian National Blood Authority Patient Blood Management Guidelines] -オーストラリアの輸血管理ガイドライン(英語) |
|||
* [https://www.nice.org.uk/guidance/ng24 National Institute for Health and Care Excellence Blood Transfusion Guidance] - 英国の輸血ガイドライン |
|||
=== 患者向け === |
|||
* [https://www.nhsbt.nhs.uk/what-we-do/blood-services/blood-transfusion/ Blood Transfusion Leaflets] - 英国(英語) |
|||
* [https://bhnog.wales.nhs.uk/patient-information-leaflets/ Blood Transfusion Leaflets] - ウェールズ(英語) |
|||
* [https://www.nss.nhs.scot/blood-tissues-and-cells/snbts-transfusion-team/national-policies-factsheets-and-patient-information/ Blood Transfusion Information] - スコットランド(英語) |
|||
* [https://www.cancer.org/treatment/treatments-and-side-effects/treatment-types/blood-transfusion-and-donation/what-are-transfusions.html Blood Transfusion Information] - アメリカ癌学会(英語) |
|||
{{Medical resources}} |
|||
<!-- |
|||
[[:en:Template:transfusion medicine] |
|||
[[en:Blood transfusion]] --> |
|||
[[Category:血液]] |
|||
{{Normdaten}} |
{{Normdaten}} |
||
{{DEFAULTSORT:ゆけつ}} |
{{DEFAULTSORT:ゆけつ}} |
||
[[Category:輸血|*]] |
[[Category:輸血|*]] |
||
[[Category: |
[[Category:血液学]] |
||
[[Category:獣医外科学]] |
[[Category:獣医外科学]] |
||
[[Category:麻酔科学]] |
[[Category:麻酔科学]] |
||
[[Category:腎臓学]] |
|||
2024年4月29日 (月) 06:25時点における版
| Blood transfusion | |
|---|---|
| 治療法 | |
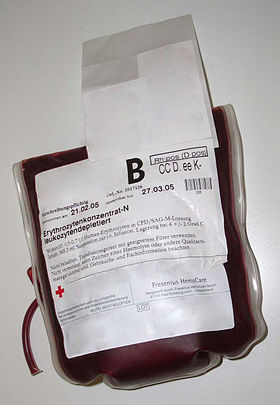 | |
| ICD-9-CM | 99.0 |
| MeSH | D001803 |
| OPS-301 code | 8-80 |
| MedlinePlus | 000431 |
輸血(ゆけつ、英: blood transfusion)とは、静脈内カテーテルを介してドナーの血液をレシピエントに投与する医療処置である[1]。
概要
輸血は、失われた血液成分を補うために、さまざまな病状に用いられる。かつては、全血が使用されていたが、現代の医療では、赤血球、血漿、血小板、その他の凝固因子など、血液の成分のみを使用するのが一般的である。血液製剤は一般的にその量を「単位(Unit)」と呼称される。日本と海外ではその規格が異なっている。日本では全血200mLから1単位の血液製剤、海外では全血450mLから1単位の血液製剤が作られる[2]。すなわち、日本の2単位がおよそ、海外での1単位に相当する[3]。本項では、断りが無い限り国際規格に統一して記載するものとする。輸血は一種の臓器移植であり、血液を提供する側はドナー(供血者)、提供される側はレシピエント(受血者)と呼ばれる。 赤血球(RBC)はヘモグロビンを含み、体内の細胞に酸素を供給する。白血球は輸血にはあまり用いられないが、免疫システムの一部であり、感染症と戦う役割を持つ。血漿は血液の「黄色っぽい」液体部分で、緩衝液の役割を果たし、タンパク質や体全体の健康に必要なその他の重要物質を含んでいる。血小板は血液凝固に関与し、体内の出血を防ぐ。
血液型は一般的には赤血球の表面抗原の分類を意味し、A型、B型、AB型、O型の4種に分類される[4]。さらにRH分類法により、これら4種それぞれがRH(+)、RH(-)に分類される[4]。これらの分類以外のまれな血液型もある[4]。血液型が適合しない輸血は赤血球の破壊、すなわち溶血を引き起こす。不適合輸血を回避するため、緊急時以外は受血者にはあらかじめ、血液型判定、抗体スクリーニング、そして交差適合試験を行う。緊急時はO型のRH(-)型の血液が投与される。
血液は体外で速やかに凝固するため、歴史上、初期の輸血は供血者から受血者に対して、血管同士を吻合するか、何らかの器具を介して送り込む直接輸血が行われていた[5]。後年、血液を体外で凝固させずに保存する技術が開発されいったん体外に血液を取り出してから、輸血する間接輸血が行われるようになった。このための血液の貯蔵・供給施設が血液バンクである。
血液型不適合輸血の副作用は致死的でありながら、血液型が存在することは長年知られず、輸血は賭博的な医療行為であった。カール・ラントシュタイナーによって、20世紀初頭にO、A、B、AB型の4種の血液型が発見された後、輸血の安全性は飛躍的に向上した。
輸血の種類

全成分をそのまま輸血する「全血輸血」、赤血球、血小板、血漿成分および凝固因子などの成分毎に分けた「成分輸血」がある[6]。血液由来感染症の防止及び献血された血液の有効利用の観点から今日では「全血輸血」は行われない[7]。成分輸血には以下の製剤がある[8]。
- 濃厚赤血球: 略称はRBC(英: Packed red blood cells)。旧略称はRCC(Red Cells Concentrates)又は MAP(Mannitol Adenine Phosphate)[9][10]等。
- 新鮮凍結血漿: 略称はFFP(英: Fresh Frozen Plasma)。
- 濃厚血小板: 略称はPC(英: Platelet Concentrates)。
他に、アルブミン、クリオプレピシテート、免疫グロブリン(抗体)など。
適応

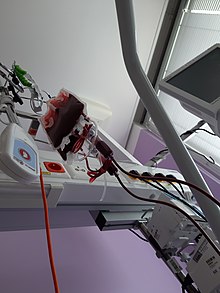

歴史的には、ヘモグロビン濃度が10g/dLを下回るか、ヘマトクリット値が30%を下回ると、赤血球輸血 が考慮されてきた[11][12]。 輸血1単位ごとにリスクが伴うため、現在では、それよりも低い7~8g/dLのヘモグロビン値下限が通常使用されており、転帰も良いとされている[13][14]。出血していない入院患者に対しては、1単位の赤血球輸血がよく行われ、この治療後に、症状やヘモグロビン値を再評価する[13]。酸素飽和度の低い患者は、より多くの輸血を必要とする可能性がある[13]。 より重度の貧血に対してのみ輸血を使用するという勧告的注意は、多量の輸血を行うと転帰が悪化するというエビデンスによるところもある[15] 。胸痛や息切れなどの心血管疾患の症状がある患者に対しては、輸血を考慮してもよい[12] 。 他の血液製剤の適応は凝固障害への新鮮凍結血漿や血小板減少への濃厚血小板などである[16]。
手技

献血の供給源
輸血される血液の供給源には、レシピエント自身(自己血輸血)と、それ以外の人(同種間輸血)がある。後者が前者よりもはるかに多い。他人の血液を使用するには、まず献血からはじまる。献血は、静脈から全血として提供され、抗凝固剤を混和される。先進国では、供血者は通常、レシピエントに対して秘匿されているが、血液バンクに保管されている血液製剤は、献血、検査、成分分離、保管、レシピエントへの投与という全サイクルを通じて、常に個別に追跡可能である。これにより、輸血に関連した疾病感染や輸血反応が疑われる場合の管理や調査が可能になる。
研究によると、献血の主な動機付けは社会貢献(利他主義、無私、慈善など)である傾向がある一方、主な阻害因子には恐怖、不信感[17][18] 、あるいは歴史的文脈における人種差別意識などがある[18] 。
世界で集められた1億1,850万件の献血のうち、40%は世界人口の16%が住む高所得国で集められている[19]。低所得国では、輸血の最大54%が5歳未満の子供に投与されている[19]。一方、高所得国では、最も頻繁に輸血される患者グループは60歳以上であり、すべての輸血の最大76%を占めている[19]。2008年から2018年にかけて、合計で79カ国が、血液供給の90%以上を自発的な無給献血者から集めている[19]。しかし、54カ国では、血液供給の50%以上を家族/代替ドナーまたは有償ドナーから集めている[19]。
献血の処理と検査
献血された血液は通常、特定の患者集団での使用に適するように、採取後に処理される。採取された血液は、遠心分離によって赤血球、血漿、血小板、アルブミンタンパク質、凝固因子濃縮物、クリオプレピシテート、フィブリノゲン濃縮物、免疫グロブリン(抗体)などの血液成分に分離される。血漿や血小板はアフェレーシスと呼ばれるより複雑なプロセスを経て、個別に献血することもできる[20]。これを成分献血という[20]。
- 世界保健機関(WHO)は、提供されたすべての血液について、輸血感染症の検査を行うことを推奨している。これらの感染症には、HIV、B型肝炎、C型肝炎、梅毒(Treponema pallidum)、および関連する場合には、クルーズトリパノソーマ(シャーガス病)やマラリア原虫など、血液供給の安全性にリスクをもたらすその他の感染症が含まれる[21]: WHOによると、10カ国では、HIV、B型肝炎、C型肝炎、梅毒の1つ以上について、すべての献血血液をスクリーニングできていない[22]。 その主な理由のひとつは、検査キットが常に利用できるわけではないからである[22]。しかし、輸血感染症の有病率は、中所得国や高所得国に比べて低所得国の方がはるかに高い[22]。未知の病原体による感染症のリスクは排除できない[23]。
- さらに、血小板製剤は、室温で保存されるために汚染されやすいため、細菌感染についても検査される国もある[25][26]。臓器移植やHIV感染者など、特定の免疫不全レシピエントに投与された場合のリスクを考慮して、サイトメガロウイルス(CMV)の有無も検査されることがある。しかし、CMV陰性の血液は、患者のニーズを満たすために一定量しか必要とされないため、すべての血液がCMV検査されるわけではない。CMV陽性以外では、感染症陽性と判定された製品は使用されない[27]。
- 白血球除去(Leukocyte reduction: LR)とは、濾過によって白血球を除去することである。LR血液製剤は、ヒト白血球型抗原(HLA)同種免疫、発熱性非溶血性輸血反応、サイトメガロウイルス感染、および血小板輸血不応症を引き起こす可能性が低い[28]。日本赤十字社製造の血液製剤では、血液採取バッグに白血球除去フィルターが具備されており、採血の段階で白血球除去を達成しており、従来輸血時に必要とされた白血球除去フィルターは不要となっている[29]。
- 輸血用血液製剤中のリンパ球が、レシピエントの組織を非自己と認識し、レシピエントの体内で増殖してレシピエントを攻撃することがあり、これを移植片対宿主病(献血後GVHD)という[30]。リンパ球を不活化するためには、血液製剤に放射線照射が行われる[30]。
- 他には、リボフラビンと紫外線による血液製剤の病原体低減が、GVHDを予防する方法として放射線照射の代替として提案されている[31][32][33]。リボフラビンを添加し、その後紫外線を照射する病原体低減処理が、血液製剤中の病原体(ウイルス、細菌、寄生虫、そして白血球も)を不活化するのに有効であることが示されている[34][35][36] 。
血液適合性試験
受血者の輸血前の検査には以下の3つが含まれる[37]。
輸血が行われる前の最初のステップは、レシピエントの血液型検査と抗体スクリーニングである。これをタイプ&スクリーン(T & S)という[38]。レシピエントの血液型を判定することで、ABOとRhの血液型が判明する。その後、ドナーの血液と反応する可能性のある不規則抗体のスクリーニングが行われる[38][39] 。不規則抗体とは抗A、抗B、抗A・B以外の赤血球同種抗原に対する抗体の総称である[40]。使用される方法によっても異なるが、ユタ大学では完了までには約45分かかる[39]。血液バンクの技師はまた、レシピエントの特別な要求(例えば、血球洗浄、放射線照射、CMV陰性の血液の必要性)や、過去に確認された抗体やその他の血清学的異常の有無を確認するために患者の病歴をチェックする。

スクリーニングが陽性であれば、臨床的に重要な意味を持つかどうかを判断するために抗体パネル検査を行う必要がある。抗体パネルは、一般的に遭遇する臨床的に重要なアロ抗体に対応する抗原について表現型が決定されているドナーの市販のO型赤血球懸濁液から構成される。ドナー細胞はホモ接合体(例えばK+k+)、ヘテロ接合体(K+k-)、あるいは様々な抗原を発現していない(K-k-)場合がある。検査される全ドナー細胞の表現型はチャートで示される。レシピエントの血清が、様々なドナー細胞に対して検査される。ドナー細胞に対するレシピエントの血清の反応に基づいて、1つ以上の抗体の存在を確認するパターンが現れる。すべての抗体が臨床的に重要である(すなわち、輸血反応、HDNなどを引き起こす)わけではない。レシピエントが臨床的に重要な抗体を発現したら、将来の輸血反応を予防するために抗原陰性の赤血球を投与することが重要である。抗体検査の一環として、直接抗グロブリン試験(クームス試験)も行われる[41]。
レシピエント血清にドナーへの抗体が存在しない場合、即時スピン交差適合試験またはコンピュータ支援交差適合試験が行われ、 レシピエント血清とドナー赤血球がインキュベートされる。即時スピン法では、2滴の患者血清を試験管に入れた3~5%のドナー細胞懸濁液1滴と反応させ、卓上遠心分離機でスピンさせる。試験管内の凝集または溶血(すなわちクームス試験陽性)が認められれば、陽性反応であり、輸血すべきでない。
レシピエント血清に抗体の存在が疑われる場合、まずドナーの血液製剤の表現系を把握して対応する抗原をスクリーニングする必要がある。抗原陰性の製剤は、さらに、反応性を高めて検査を容易にするために、37℃で抗グロブリン/間接クロスマッチ法を用いて患者血漿に対して検査される。
クロスマッチングが完了せず、患者で発生しているヘモグロビン低下のリスク(主に出血)がクロスマッチングしていない血液を輸血するリスクを上回る緊急の場合は、O型RH陰性血液を使用し、その後できるだけ早くクロスマッチングを行う。O型陰性輸血は小児や妊娠可能な年齢の女性にも使用される。このような場合、検査室は輸血前に血液サンプルを採取し、血液型決定とスクリーニングを行い、患者の実際の血液型を決定し、同種抗体をチェックすることが望ましい。
赤血球輸血におけるABO血液型並びにRH血液型の適合
この表は、ABO式とRh式を用いて、ドナーとレシピエント間の輸血で適合する可能性のある血液を示したものである。記号![]() は適合輸血を示す[42]。
は適合輸血を示す[42]。
| ドナー血液型 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| O− | O+ | B− | B+ | A− | A+ | AB− | AB+ | ||
| レシピエント血液型 | AB+ | ||||||||
| AB− | |||||||||
| A+ | |||||||||
| A− | |||||||||
| B+ | |||||||||
| B− | |||||||||
| O+ | |||||||||
| O− | |||||||||
副作用
医薬品の安全性がファーマコビジランスファーマコビジランスによって監督されるのと同様に、血液および血液製剤の安全性はhaemovigilanceヘモビジランスによって監督される。これは、世界保健機関(WHO)によって、「輸血の安全性、有効性、効率性を高めるために、ドナーからレシピエントまでの輸血流通路のすべての活動を網羅し、輸血に関連する望ましくない事象の発生または再発を特定し、防止する」ためのシステム と定義されている。このシステムには、輸血および血液製剤製造に関連する ヒヤリハットおよび有害事象の監視、特定、報告、調査、分析が含まれるべきである[43] 。英国では、このデータはSHOT(Serious Hazards Of Transfusion)と呼ばれる独立組織によって収集されている[44]。
血液製剤の輸血はいくつかの合併症と関連しており、その多くは免疫学的または感染に分類される。保存中の潜在的な品質劣化については議論がある[45]。
有害作用
- 急性溶血性輸血反応 は、英国のSerious Hazards of Transfusion (SHOT)によると、「輸血後24時間以内の発熱およびその他の症状ないしは溶血徴候を指し、Hbの低下、乳酸脱水素酵素(LDH)の上昇、直接抗グロブリン試験(DAT)陽性、クロスマッチ陽性のうちいずれか1つ以上によって確認されるもの」と定義されている[46] 。これは、事前に形成されたレシピエント抗体によるドナー赤血球の破壊によるものである。 多くの場合、事務的なミスまたは不適切なABO式血液型判定とクロスマッチングにより、ドナーとレシピエントのABO式血液型が不適合となるために起こる。症状としては、発熱、悪寒、胸痛、背部痛[47]、出血、心拍数の増加、息切れ、急激な血圧低下などがある。不適合輸血が疑われる場合には、輸血を直ちに中止し、溶血の有無を評価するために血液を検査に送る必要がある。治療は対症療法である。溶血反応の影響により腎障害が起こることがある(色素腎症)[48] 。輸血反応の重症度は、輸血されるドナーの抗原量、ドナーの抗原の性質、レシピエントの抗体の性質と量に依存する[47]。
- 遅発性溶血性輸血反応 は輸血後24時間以上経過してから起こる。通常、輸血後28日以内に起こる。遅発性溶血反応は、輸血開始前に存在した抗体のレベルが低く、輸血前検査では検出できないか、または輸血された血液中の抗原に対する新しい抗体が発現するために起こります。したがって、遅延溶血反応は、反応を引き起こすのに十分な抗体が利用できるようになる24時間後まで現れない。赤血球はマクロファージによって血液循環から肝臓や脾臓に除去され、破壊される。その結果、血管外溶血が起こる。このプロセスは通常、抗Rh抗体と抗Kidd抗体によって媒介される。しかし、このタイプの輸血反応は、急性溶血性輸血反応と比較すると重症度は低い[47]。
- アレルギー性輸血反応はIgE抗アレルゲン抗体によって引き起こされる。抗体がその抗原と結合すると、肥満細胞や好塩基球からヒスタミンが放出される。ドナー側またはレシピエント側のIgE抗体のいずれもがアレルギー反応を引き起こす可能性がある。花粉症のようなアレルギー疾患を持つ患者に多くみられる。患者はかゆみやじんましんを生じることがあるが、症状は通常軽度で、輸血を中止して抗ヒスタミン剤を投与することでコントロールできる[47]。
- 発熱性非溶血性輸血反応 は、アレルギー性輸血反応と並んで最も一般的なタイプの輸血反応であり、保存されているドナーの血液中の白血球が放出するサイトカイン[28] 、またはレシピエントの抗体によるドナーの白血球への攻撃のために起こる[47] 。このタイプの反応は、輸血の約7%で起こる。 発熱は一般に短時間で、解熱剤で治療され、急性溶血反応が除外される限り輸血は完遂される。これが、赤血球製剤からドナーの白血球を濾過する白血球除去(leukoreduction: LR )が現在広く行われている理由である[28]。
- アナフィラキシー反応は、IgA抗血漿蛋白抗体によって引き起こされる、生命を脅かすまれなアレルギー症状である。選択的免疫グロブリンA欠損症では、反応はドナーの血漿中のIgA抗体によって引き起こされると推定される。患者は発熱、喘鳴、咳、息切れ、ショックの症状を呈する。アドレナリンによる緊急治療が必要である[47]。
- 輸血後紫斑病(Post-transfusion purpura: PTP)は、血液製剤の輸血後に起こる極めてまれな合併症で、患者の血液中に、ドナーとレシピエントの両方のヒト血小板抗原(Human platelet antigen: HPA)に対する抗体が存在することに関連している。このタンパク質を欠くレシピエントは、以前の輸血や以前の妊娠によってこのタンパク質に感作され、次の輸血で血小板減少症や皮膚への出血を発症し、紫斑として知られる皮膚の紫色の変色を示すことがあう。免疫グロブリン静注療法(IVIG)が選択される[47][49]。
- 輸血関連急性肺障害(Transfusion-related acute lung injury: TRALI) は、急性呼吸窮迫症候群(ARDS)に類似した症候群であり、血漿含有血液製剤の輸血中または輸血後6時間以内に発症する。発熱、低血圧、息切れ、頻脈がこの種の反応でしばしば起こる。確定診断のためには、輸血後6時間以内に症状が発現し、低酸素血症が存在し、両側浸潤の胸部X線所見があり、左房圧負荷(体液過多)の所見がないことが必要である[50]。 輸血患者の15%に発生し、死亡率は5〜10%とされる。レシピエントの危険因子には、末期肝疾患、敗血症、血液学的悪性腫瘍、人工呼吸患者などがある。ヒト好中球抗原(HNA)およびヒト白血球抗原(HLA)に対する抗体が、この種の輸血反応と関連している。ドナーの抗体が抗原陽性のレシピエント組織と相互作用すると、炎症性サイトカインが放出され、肺毛細血管漏出が生じる。治療は対症療法である[51]。
- 輸血関連循環過負荷(Transfusion associated circulatory overload: TACO)は、一般的ではあるが、見落とされがちな、輸血中止後6時間以内の以下の症状の3つの新規発症または増悪からなる、輸血に対する反応である[50]。
- 急性の呼吸困難
- 脳性ナトリウム利尿ペプチド(BNP)上昇
- 中心静脈圧(CVP)の上昇
- 左心不全の兆候
- 体液バランス陽性負荷の兆候
- 肺水腫の胸部X線写真所見。
- 輸血後移植片対宿主病は、レシピエントの体がドナーのT細胞を排除できなかった免疫不全患者で起こりやすい。ドナーのT細胞がレシピエントの細胞を攻撃してしまう。輸血1週間後に生じる[47]。このタイプの輸血反応では、発熱、発疹、下痢を伴うことが多い。死亡率は高く、患者の89.7%が24日後に死亡している。免疫抑制療法が最も一般的な治療法である[52]。T細胞がレシピエントの細胞を攻撃するのを防ぐために、ハイリスク患者には血液製剤の照射と白血球除去が必要である[47]。
感染
赤血球輸血の大量使用と、感染症のリスクには関連があるものの、入院患者に対して輸血を制限してもしなくても、感染症の全体的なリスクにはメタアナリシスで有意な差が示されていない(制限輸血は重症感染のリスクは減らす)[53]。
まれに血液製剤が細菌に汚染されることがある。これは、輸血による細菌感染症(transfusion-transmitted bacterial infection)として知られる、生命を脅かす感染症を引き起こす可能性がある。重症細菌感染のリスクは、血小板輸血では約5万回に1回、赤血球輸血では約50万回に1回と推定されている(2002年)[54]。血小板輸血が他の血液製剤よりも汚染されやすい理由は、室温で保存され、これが細菌の増殖にも好適であるからである[54]。汚染源としては以下が挙げられる[55]。
汚染源微生物は多様で、皮膚細菌叢、腸内細菌叢、環境中の微生物などが含まれる[54]。アルコール綿棒単独使用か、アルコール綿棒に続いて消毒薬を使用するか、どちらが供血者からの献血汚染を減らせるかは不明である[56]。献血センターや検査室では、汚染のリスクを減らすために多くの戦略が実施されている。輸血性細菌感染症の確定診断は、レシピエントにおける培養陽性の同定、およびドナー血液における同一菌の同定によってなされ、代替診断法はない[54]。
HIVに感染した血液を輸血されると90%がHIVに感染する[57]。しかし、先進国では、ドナーの選択とHIVスクリーニングが改善されており、輸血によってHIVに感染するリスクは極めて低い。日本では8400万輸血に一件[58]程度とされ、2013年の1件を最後に2022年まで感染確認はない[59]。
輸血を介したC型肝炎の感染も日本では、2013年以降2022年まで感染確認はない[59]。B型肝炎は毎年1例前後発生している[59]。
その他のまれな感染には、梅毒[54]、シャーガス病、サイトメガロウイルス感染症(免疫不全患者に起こる)、HTLV、バベシアなどがある。
比較表
| + =時折現れる症状 ++ =頻発症状 | ||||
| 発熱性非溶血性輸血反応 | TRALI | 急性溶血性輸血反応 | 血液製剤の細菌汚染 | |
|---|---|---|---|---|
| 輸血中または輸血後の症状の出現時間 | 通常、自然に解熱する。
5-10%は2時間後まで続く。 |
早期 (10–15 ml投与後) | 早期 (50–100 ml投与後) | 輸血後最大8時間 |
| 発熱 | + | ++ | ++ | ++ |
| 寒気 | ++ | ++ | ++ | +++ |
| 冷感 | ++ | - | + | - |
| 不快感 | ++ | - | - | - |
| 硬直 | + | - | - | - |
| 頭痛 | + | - | + | - |
| 嘔気嘔吐 | + | - | ++ | - |
| 呼吸困難 | + | ++ | ++ | - |
| チアノーゼ | - | ++ | ++ | - |
| 低血圧 / ショック | - | ++ | ++ | ++ |
| 播種性血管内凝固 | - | - | ++ | ++ |
| ヘモグロビン尿 | - | - | ++ | + |
| 腎不全 | - | - | ++ | ++ |
| 背部痛 | - | - | ++ | - |
輸血不応
輸血不応(Transfusion inefficacy)または血液製剤の有効性不足は、それ自体は「合併症」ではないが、輸血がその臨床目的を完全にまたは部分的に達成できないことに加えて、間接的に合併症を引き起こす可能性がある。このことは、集中治療室や新生児などの特定の患者群にとって特に重大な意味を持つ。
赤血球(RBC)は、輸血されることが圧倒的に多い血液製剤であるが、保存中に起こる様々な生化学的・生体力学的変化、いわゆる保存障害(storage lesion)によって損傷した赤血球が輸血効果を低下させることがある。赤血球の場合、これは生存率と組織酸素化能力を低下させる可能性がある[61]。生化学的変化の一部は輸血後に可逆的[62]であるが、生体力学的変化はそうではなく[63]、赤血球の若返り効果を持つとする製剤はまだこの現象を十分に逆転させることができない[64]。血液製剤の保存期間が輸血有効性の要因であるかどうか、特に「古い」血液が直接または間接的に合併症のリスクを増加させるかどうかについては、論争が続いている[65][66]。この疑問に対する研究結果は一貫しておらず、古い血液は確かに有効性が低いことを示すものもあれば、そのような差がないことを示すものもある[67]。
最大保存期間(現在42日間)、最大自己溶血閾値(現在米国で1%、欧州で0.8%)、輸血後生体内赤血球生存率の最低レベル(現在24時間後で75%)など、赤血球の保存障害を最小限に抑えるための一定の規制措置が設けられている[68]。しかし、これらの基準はすべて普遍的な方法で適用されており、製品の単位ごとの違いは考慮されていない[69]。例えば、生体内での輸血後赤血球生存率の試験は、健康なボランティアのサンプルで行われ、その後、普遍的な処理基準(GMP)に基づいて、すべての赤血球単位について適合が推定される(赤血球生存率自体は有効性を保証するものではないが、細胞機能にとって必要な前提条件であるため、規制上の代用として機能する)。生体内(in vivo)の患者における輸血の有効性を判断する「最良の」方法については、さまざまな意見がある[70]。一般に、輸血前の特定の赤血球製剤単位について、品質を評価したり有効性を予測したりするためのin vitro検査はまだ存在しないが、赤血球変形能[71]や赤血球脆弱性[72]などの赤血球膜特性に基づく潜在的に関連性のある検査は検討されている。
医師は、輸血にかかる直接的および間接的なコストが非常に高いことに加え、保存障害を取り巻く不確実性が指摘されていることもあり、輸血を最小限に抑える、いわゆる「制限プロトコール」を採用している[73][74][75]。しかし、組織の酸素化を速やかに回復させるために最善の努力を必要とするような、特に重症の患者には、制限的なプロトコールは選択できない。
血小板の輸血は(赤血球に比べて)はるかに少ないが、血小板の保存障害とそれに伴う有効性の低下が懸念事項である[76]。
その他
- 大腸がんでは、術中輸血とがんの再発が関連していることが知られている[77]。肺がんでは、術中輸血は、がんの早期再発、生存率の悪化、肺切除後の転帰の悪化と関連している[78][79] 。輸血による免疫系の障害は、輸血と自然免疫系および適応免疫系と完全に関連している10種類以上のがんを引き起こす主な要因の1つに分類される[80]。輸血は、腫瘍減量手術(cytoreductive surgery: CRS)や腹腔内温熱化学療法(Hyperthermic intraperitoneal chemotherapy: HIPEC)後の転帰を悪化させる[81] 一方、同種輸血は、T細胞、骨髄由来抑制細胞(MDSC)、腫瘍関連マクロファージ(TAM)、ナチュラルキラー細胞(NKC)、樹状細胞(DC)を含む5つの主要なメカニズムを通じて、レシピエントの防御機構を助けることができるともされる[80]。列挙した各項目の役割には、抗腫瘍CD8+細胞傷害性T細胞(CD8+/CTL)の活性化、制御性T細胞(Treg)の一時的不活性化、シグナル伝達兼転写活性化因子3(STAT3)によるシグナル伝達の不活性化、抗腫瘍免疫応答を増強するための細菌の使用、細胞性免疫療法などが含まれる[80]。
- 大量の赤血球輸血は、重篤な出血および/または輸血不応(上記参照)のいずれであれ、出血傾向の原因となる[83]。その機序は、レシピエントの血小板や凝固因子の希釈とともに、播種性血管内凝固によるものと考えられている[83]。厳重なモニタリングを行い、必要に応じて濃厚血小板や新鮮凍結血漿の輸血を行う[83]。
- 大量輸血では、血液製剤中に含まれているクエン酸塩が重炭酸塩に分解されるため、代謝性アルカローシスが起こることがある。
- 血液ドーピングは、アスリート[85]や軍人[86]が、肉体的スタミナを増強するため、あるいは単に任務時間中に活動的で警戒心を維持するためなどの理由で、それぞれ行われることがある。過度の血液ドーピングは血液の粘性が過剰に高まって組織への酸素供給が逆に減少する過粘稠度症候群を生じることがある[87]。
輸血の使用数
世界全体では、1年間に約8500万単位の赤血球製剤が輸血されている[12]。
米国では、2011年の入院中に約300万回の輸血が行われ、ありふれた処置となっている。輸血を伴う入院の割合は1997年からほぼ倍増し、人口1万人当たり40回の入院から95回の入院となった。輸血は、2011年に45歳以上の患者に行われた最も一般的な処置であり、1~44歳の患者では最も一般的な処置の上位5位に入っていた[88]。
ニューヨーク・タイムズ紙によれば、「医学の進歩により、何百万回もの輸血の必要性がなくなっており、かつて大量の血液を必要とした冠動脈バイパスなどの処置を受ける患者にとっては朗報である」。一方、「血液バンクの収入は減少しており、その減少は2008年の最高額50億ドルから今年(2014年)は年間15億ドルに達するかもしれない"。赤十字社によれば、今後3年から5年の間に、雇用損失は業界全体のおよそ4分の1にあたる12,000人に達するだろう」[89]。
歴史
ウィリアム・ハーヴェイの血液循環に関する実験に始まり、輸血に関する記録された研究は17世紀に始まり、動物間での輸血実験に成功した。しかし、動物の血液をヒトに輸血する医師による相次ぐ試みは、結果にばらつきがあり、しばしば致命的な結果をもたらした[90]。
教皇インノケンティウス8世 は、主治医のジャコモ・ディ・サン・ジェネシオから「世界初の輸血」を受けたと言われることがある。彼は教皇に10歳の少年3人の血を飲ませた。少年たちはその後死亡し、教皇自身も死亡した。しかし、この話の証拠は信用できず、反ユダヤ的な血の中傷の可能性があると考えられている[91]。
初期の試み
インカ帝国
最初に成功したと報告された輸血は、1500年代にはインカ帝国において行われていた[92]。16世紀に到着したスペインの征服者たちは、輸血を目撃している[93]。アンデス地域の先住民の間では、O型の血液型が多かったことから、このような処置は、ヨーロッパにおける初期の試みの失敗の一因となった、血液型が適合しない集団間での輸血の試みよりもリスクが少なかったと考えられている[93][注釈 2]。
動物同士の輸血

1660年代、王立協会に勤務していた医師リチャード・ロウアーは、血液量の変化が循環機能に及ぼす影響を調べ始め、動物における交差循環研究の方法を開発した。彼が考案した新しい器具のおかげで、王立協会の著名な同僚たちの前で、確実に記録された最初の輸血を成功させることができたとされる[95]。
ロウアーの記述によれば、「...1665年2月の終わり頃、(私は)中型の犬を一匹選び、その頸静脈を開いて、犬の力がほとんど抜けるまで血を抜いた。それから、この犬の大損失を2頭目の血液で補うために、1頭目と並んで固定されていたかなり大きなマスチフの頸動脈から血液を導入した。彼が「頸静脈を縫合」した後、その動物は「不快感や不満を示すことなく」回復した[95]。
その後、彼は「高名な(ロバート・)ボイルから......王立協会に実験全体の手順を知らせるよう要請され」、1665年12月に王立協会のフィロソフィカル・トランザクションズ(Philosophical Transactions)誌に掲載した[95]。
動物からヒトへの輸血
動物から人への最初の輸血は、1667年6月15日、フランス国王ルイ14世の高名な侍医であったジャン=バティスト・デニによって行われた[96]。彼は羊の血を15歳の青年に輸血し、彼は生き延びた[96][97]。デニは、9オンスの羊の血を、精神疾患の青年に輸血した[95]。当初、患者はこの輸血によく耐えたが、その後の輸血で、記録されている最初の有害事象が発生した[95]。デニは、今日の血液学者なら誰でも輸血反応として認めるであろうことを、驚くべき正確さで描写している。『血液が彼の静脈に入り始めるとすぐに、彼は腕に沿って、そして脇の下のあたりが熱くなるのを感じた。脈拍はすぐに上昇し、すぐに顔全体に大量の汗をかいた。この瞬間、脈拍は極端に変化し、腎臓に激痛が走り、胃の調子が悪くなり、自由にさせないと窒息しそうだと訴えた...。目を覚ますと......コップ一杯の大小便をし、その色はまるで煙突の煤が混じったような黒色だった』[95]。患者の妻はドニを故意に毒殺しようとした罪で訴えたたが、デニの容疑は晴れ、一転して妻自身が夫の毒殺の罪で訴えられた[95]。デニはまた、もう一人、ある労働者に輸血を行い、彼も生き延びた。どちらの例も、実際にこれらの人々に輸血された血液の量が少なかったために、輸血による反応に耐えられたためと考えられている。
デニによって輸血を受けた3人目の患者は、スウェーデンのグスタフ・ボンデ(Gustaf Bonde)男爵だった。彼は2回の輸血を受けたが、2回目の輸血の後、ボンデは死亡した[98]。1667年の冬、デニは他の患者には、子牛の血液による輸血も数回行った。3回目の輸血でその患者は死亡した[99]。
デニの実験の6ヵ月後、ロウアーはロンドンで、英国初の動物血液の輸血を行った。「王立協会の会合で、(患者の)腕に羊の血液を何オンスか、いろいろな時間に注入するのを監督した。その患者はアーサー・コガという、"無害な精神異常の患者 "であった。羊の血が使われたのは、種間の血液交換の価値についての憶測があったからである。穏やかな子羊の血は、興奮した人の気性の荒い精神を静めるかもしれないし、内気な人はもっと社交的な生き物の血によって外向的になるかもしれないと示唆されていた。コガは実験に参加するために20シリング(2021年の183ポンドに相当)を受け取った[100]。
ロウアーはその後、血流の正確なコントロールと輸血のための新しい器具を開発し、その設計は現代の注射器やカテーテルと実質的に同じであった[95]。まもなくロウアーはロンドンに移り、そこで診療を行うようになり、ほどなくして研究をやめてしまった[101]。
これらの動物血液を使った初期の実験は、イギリスとフランスで激しい論争を引き起こした[98]。 ついに1668年、王立協会とフランス政府はこの実験を禁止した。バチカンも1670年にこれらの実験を非難した。その後150年間、輸血は不確実な治療手段に留まり続けた。
ヒトからの輸血

19世紀初頭、イギリスの産科医ジェームズ・ブランデルは、注射器を用いたヒト血液の輸血による出血治療に取り組んだ。1818年、動物を使った実験の後、彼は分娩後出血の治療に初めてヒトの血液を輸血することに成功した。ブランデルは患者の夫をドナーとして使い、彼の腕から4オンスの血液を採取して妻に輸血した。1825年から1830年にかけて、ブランデルは10回の輸血を行い、そのうち5回は有益であり、その結果を出版した。彼はまた、輸血のための多くの器具を発明した[102]。彼はこの努力によって、およそ200万ドル(現代の5,000万ドル相当)という相当な金額を稼いだ。[103]
1840年、ロンドン大学セント・ジョージズ医学部で、サミュエル・アームストロング・レーンが、ブランデルの助力を得て、血友病治療のための全血輸血を初めて成功させた[104]。
しかし、初期の輸血は危険を伴い、その多くが患者の死につながった。19世紀後半になると、輸血は危険で怪しげな処置とみなされ、医学界からはほとんど敬遠されるようになった。
ジェームス・ブランデルを模倣する研究はエジンバラでも続けられた。1845年、Edinburgh Journal誌は、重度の子宮出血の女性への輸血が成功したことを紹介した。その後の輸血は、ジェームス・シンプソン教授の患者にも成功し、この教授にちなんでエディンバラのSimpson Memorial Maternity Pavilionシンプソン記念マタニティ・パビリオンが命名された[105]。
19世紀末には、輸血に成功したというさまざまな単独の報告が現れた[106]。 初期の輸血成功の最大の一連の報告は、1885年から1892年にかけてEdinburgh Royal Infirmaryエディンバラ王立診療所で行われた。エジンバラは後に、最初の献血と輸血サービスの拠点となった[105]。

ウィリアム・スチュワート・ハルステッド(1852-1922)はアメリカの外科医で、1881年にアメリカでおそらく初の輸血を行った[107]。ハルステッドは、出産した妹を診察し、妹が産後出血で衰弱しているのを発見し、大胆にも自分の血液を抜いて妹に輸血し、妹を手術して命を救った[108]。
20世紀
オーストリアのカール・ラントシュタイナーは、1901年、赤血球がヒトによって異なる表面抗原を持ち、これに他のヒトの血液の抗体が結合することによって免疫反応が起こり、赤血球が凝集して破壊されることを発見した[109]。赤血球が破壊されると遊離ヘモグロビンが血液中に放出され、致命的な結果をもたらす。更に彼は、1909年にヒトの血液をA、B、AB、Oの4種に分類した[109]。ラントシュタイナーの研究によって血液型の判定が可能になり、輸血がより安全に行われるようになった。この発見により、彼は1930年にノーベル生理学・医学賞を受賞した[109]。
ジョージ・W・クライルは、ケース・ウェスタン・リザーブ大学の外科教授であった1906年、クリーブランドのセント・アレクシス病院で、直接輸血による最初の手術を行ったことで知られている[110]。すなわち、血液の凝固を防ぐために、患者の静脈にドナーの動脈を外科的に接続する方法で患者を救った[111]。
ヤン・ヤンスキー (Jan Janský)もヒトの血液型を発見しており、1907年に血液型をI、II、III、IVの4つのグループに分類した[112]。1901年にABO血液型を発見したラントシュタイナーは、この時点では血液型はA、B、Oの3種であると考えており、現在知られている血液型4種を先に発見したのはヤンスキーであると見なされている[113]。
ウィリアム・ロレンゾ・モス(William Lorenzo Moss's)博士(1876-1957)の1910年のモス血液型検査法は、第二次世界大戦まで広く使用されていた[114][115]。
血液バンク


最初の輸血は、凝固する前に供血者から受血者へ直接行わなければならなかったが、抗凝固剤を添加し、血液を冷蔵保存することで数日間保存できることが発見され、血液バンクの発展への道が開かれた。ジョン・ブラクストン・ヒックスは、19世紀後半にロンドンのセント・メアリー病院で、血液の凝固を防ぐ化学的方法を初めて実験した。しかし、リン酸ナトリウム塩を用いた彼の試みは失敗に終わった。
1914年3月27日、ベルギーの医師アルベール・ユスタンは、初めて非直接的な輸血を行ったが、これは希釈した血液であった。同年11月には、アルゼンチンの医師ルイス・アゴーテが、もっと希釈度の低い輸血液を使用した。どちらも抗凝固剤としてクエン酸一ナトリウムを使用した[116]。
第一次世界大戦(1914-1918)は、血液バンクと輸血技術を急速に発展させるきっかけとなった。ロックフェラー大学(当時はロックフェラー医学研究所)の ペイトン・ラウス とジョセフ・R・ターナーは、血液の凝集(凝固)を避けるためには血液型検査が必要であり、血液サンプルは化学処理によって保存できるという最初の重要な発見をした[117][118]。 1915年3月の彼らの最初の報告では、ゼラチン、寒天、血清抽出物、デンプン、牛アルブミンが役に立たない保存剤であることが証明された[119]。
しかし、同じ実験を基に、彼らはクエン酸ナトリウムとグルコース(ブドウ糖)の混合溶液が完璧な保存剤であることを発見した。保存された血液は新鮮血とほぼ同じであり、「体内に再導入されたときに優れた機能を発揮する」と『Journal of Experimental Medicine誌』2月号で報告された[120]。血液は4週間まで保存可能となった。クエン酸-スクロース混合物を用いた追加実験も成功し、血球を2週間維持することができた[121]。このクエン酸塩と糖類の混合物は、ラウス・ターナー 溶液としても知られ、血液バンクの発展と輸血法の改善の基礎となった[122][123]。
ラウスとターナーによる、以下のもう一つの発見(交差適合試験)は、輸血の安全性において最も重要なステップであった。ラウスは、ラントシュタイナーの血液型の概念がまだ実用的な価値を見いだせないことをよく知っていた:「ラントシュタイナーの努力の運命は、ヒトの血液における群間差の実用的な意義に注意を喚起するものであったが、これは知識が技術に時を刻むという絶妙な例を示している。輸血は、(少なくとも1915年までは)血液凝固の危険性が大きすぎたため、まだ行われていなかった」[124]。1915年6月、彼らはJournal of the American Medical Association誌に、ドナーとレシピエントの血液サンプルを事前に検査すれば凝集を避けられるという重要な報告を行った。クエン酸ナトリウムを血液サンプルの希釈に用い、レシピエントとドナーの血液を9:1と1:1の割合で混ぜた後、15分後には、血液が凝集するか、状態が変わらないままのどちらかであった。この方法を彼らは血液型適合性判定のための迅速簡易検査と呼んだ。彼らのアドバイスによると、固まらない血液を「可能であれば常に選択すべきである」[125]。
カナダ人医師、ローレンス・ロバートソン中尉は、現場救護所で輸血を採用するよう王立陸軍医療軍団 (Royal Army Medical Corps: RAMC)を説得するのに尽力した。1915年10月、ロバートソンは榴散弾による多発外傷の患者に、戦時中初の輸血を注射器で行った。彼はこの後、数ヶ月の間に4回の輸血を行い、その成功はイギリス医学研究審議会の議長であったウォルター・フレッチャーに報告された[126]。

ロバートソンは1916年にその研究成果をBritish Medical Journal誌に発表し、志を同じくする少数の人々(高名な医師エドワード・ウィリアム・アーチボルドを含む)の協力を得て、英国当局に輸血のメリットを説得することができた。ロバートソンは1917年の春、西部戦線の傷病兵救護所に最初の輸血装置を設置した[126][127]。しかし、ロバートソンは交差適合試験を行わなかったため、1916年の輸血では1人が溶血で死亡し、1917年には3人が死亡した[128]。
医学研究者で米陸軍将校だったオズワルド・ホープ・ロバートソンは、1917年にRAMCに所属し、予想される第3次イーペルの戦いに備えて最初の血液バンクの設立に尽力した[129]。彼は抗凝固剤としてクエン酸一ナトリウムを使用し、血液は静脈の穿刺により採取され、戦線に沿って配置された英米の負傷者救護所で瓶に保管された。ロバートソンはまた、分離した赤血球を氷で冷やした瓶に保存する実験も行った[127]。イギリスの外科医Geoffrey Keynesジェフリー・ケインズは、輸血をより簡単に行えるようにするため、血液を保存できる携帯型の機械を開発した。
発展

英国赤十字の事務局長であったパーシー・レーン・オリバー(Percy Lane Oliver)は、1921年に世界初の献血サービスを設立した。その年、オリバーは、献血者を緊急に必要としていたキングス・カレッジ病院から連絡を受けた[130]。 献血者を提供した後、オリバーは、ジェフリー・ケインズ卿を医学顧問に任命し、ロンドン周辺の診療所で自発的に献血者を登録するシステムの組織化に着手した。ボランティアは、血液型を確定するために一連の検査を受けた。オリバーの命名によるロンドン輸血サービスは無料であり、最初の数年間で急速に拡大した[131]。1925年までにほぼ400人の会員を擁し、1926年には英国赤十字の組織に組み込まれた[131]。このサービスの活動は国際的な注目を集めるようになっり、多くの国に対してオリバーは助言を行った[131]。
アレクサンドル・ボグダーノフは1925年、モスクワに輸血学専門の学術機関を設立した。ボグダーノフの動機の少なくとも一端は、永遠の若さを求めてのことであり、11回の全血輸血を受けた後、1928年に死亡した[132]。 おそらく、複数回の輸血によって抗体が形成され、免疫反応による溶血が起こったのであろうと考えられている[133]。ボグダーノフは、政府に輸血の重要性を認識させ、彼の死後数年で、ソ連は輸血に使用する血液を病院で採取・保管する施設のネットワークを最初に確立した国となった[133]。先駆者ボグダーノフに続いて、ソ連のウラジミール・シャモフ(Vladimir Shamov)とセルゲイ・ユージン(Sergei Yudin)は、死亡したばかりのドナーからの輸血、すなわち死体血輸血を開拓した[134]。 ユージンは1930年3月23日、初めてこのような輸血を成功させ、9月にハリコフで開催された第4回ウクライナ外科学会で、死体血による最初の7回の臨床輸血を報告した[134]。1932年までに、ユージンは死体から3週間保管された血液による輸血を100回報告し、1937年には死体血液の使用を1,000回以上報告した[134][注釈 3]。

フレデリック・デュラン・ジョルダ(Frederic Durán-Jordà)は、1936年のスペイン内戦中に、初期の血液バンクのひとつを設立した。デュランは戦争開始と同時にバルセロナのサン・パウ病院の輸血部に従事したが、病院はすぐに血液の需要とドナーの不足に圧倒された。スペイン共和国軍(Spanish Republican Army)の衛生局の支援を受けて、デュランは負傷兵と民間人のための血液バンクを設立した。採取された300~400mLの血液は、改良型デュランエルレンマイヤーフラスコで10%クエン酸溶液と混合された。血液は2℃で滅菌ガラス容器に陽圧封入されて保存された。バルセロナの輸血サービスは、30ヶ月の作業の間に、ほぼ30,000人のドナーを登録し、9,000リットルの血液を処理した[135]。
1937年、シカゴのクック郡病院の治療部長であったバーナード・ファンタスは、米国初の病院血液バンクを設立した。ドナーの血液を保存し、冷蔵し、保管する病院の検査室を設立したことで、ファンタスは「血液バンク」"blood bank". という言葉を生み出した。数年のうちに、病院や地域の血液バンクが全米に設立された[136]。
ジョルダは1938年にイギリスに逃れ、ハマースミス病院の王立大学院医学部のジャネット・ヴォーン医師と協力して、ロンドンに全国規模の血液バンクのシステムを構築した[137]。 1938年に第二次世界大戦の勃発が間近に迫ると、戦争省はブリストルに陸軍血液補給廠(Army Blood Supply Depot: ABSD)を創設し、ライオネル・ウィットビーが責任者となり、国内4か所の大規模な血液廠を管理した。戦争を通じて英国の方針は、アメリカやドイツが前線の部隊が必要な血液を供給したのとは対照的に、中央の貯血所から軍人に血液を供給することであった。英国の方法は、すべての必要量を十分に満たすことに成功し、戦争期間中に70万人以上のドナーが献血した。このシステムは、1946年に設立された全国輸血サービス組織(National Blood Transfusion Service)へと発展した[138]。
第二次世界大戦中、東欧でナチスが捕虜の子どもたちに繰り返し血液を無理やり提供させたという話がある[139] 。
医療の進歩

1940年、米国で採血計画が開始され、エドウィン・コーンが血液分画(blood fractionation)の先駆者となった。彼は血漿中の血清アルブミンを分離する技術を開発した[140]。血清アルブミンは血管内の膠質浸透圧を維持し、血管の虚脱を防ぐのに不可欠である。
ゴードン・R・ウォードはBritish Medical Journal誌の通信欄に寄稿し、早くも1918年には、全血の代用として、また輸血の目的で血漿を使用することを提案していた。第二次世界大戦が始まると、英国では液体血漿が使用されるようになった。アメリカでは、「英国に血を」"Blood for Britain"と呼ばれる大規模なプロジェクトが1940年8月に開始され、血漿を英国に輸出するためにニューヨークの病院で採血が行われた。凍結乾燥された血漿のパッケージが、陸海軍の外科総監によって、全米アカデミーズと協力して開発され[141]、破損が減少し、輸送、包装、保管がはるかに簡単になった[142]。

出来上がった乾燥血漿のパッケージは、400mLのボトルが入った2つのブリキ缶に入っていた。一方のボトルには、もう一方のボトルに入っている乾燥血漿を溶かして復元するのに十分な蒸留水が入っていた。 。約3分で、血漿は使用可能になり、約4時間新鮮に保つことができた[143]。 チャールズ・ドリュー医師が監督者に任命され、試験管法を大量生産のための最初の成功技術に変えることができた。
1937年から40年にかけて、カール・ラントシュタイナー(1868-1943)、アレックス・ウィーナー(Alex Wiener)、フィリップ・レヴィン(Philip Levine)、R.E.ステットソン(R.E. Stetson)が、それまでの輸血反応の大半の原因であったRH因子を発見したことも、重要なブレークスルーとなった。その3年後、ジョン・ルーティト(John Loutit)Jとパトリック・モリソン(Patrick L. Mollison)によって、抗凝固剤の量を減らすクエン酸-ブドウ糖(acid–citrate–dextrose: ACD液)が導入され、より大量の輸血が可能になり、より長期間の保存が可能になった[144][145]。
カール・ウォルターとW.P.マーフィー・ジュニアは、1950年に採血用プラスチックバッグを発表した。割れやすいガラス瓶をPVC製の丈夫なプラスチックバッグに置き換えることで、1単位の全血から複数の血液成分を安全かつ容易に調製できる採血システムが進化した。
がん手術の分野では、大量出血への体液補充が大きな問題となった。心停止率は高かった。1963年、C・ポール・ボヤンとウィリアム・S・ハウランドは、血液の温度と注入速度が生存率に大きく影響することを発見し、手術に血液加温を導入した[146][147]。
保存血液の保存期間を42日までさらに延長したのは、1979年に導入された抗凝固保存剤CPDA-1であり、これにより血液供給量が増加し、血液バンク間の資源共有が容易になった[148][149] 。
2006年の時点で、米国では年間約1,500万単位の血液製剤が輸血されていた[150]]。2013年までに、その数は約1,100万単位まで減少した[89]。その理由は、腹腔鏡手術やその他の外科手術の進歩と、多くの輸血が不必要であることを示す研究結果によるものである[89]。例えば、人工股関節置換術では、では出血量が750mLから200mLに減少した[89]。
日本の輸血史
日本における輸血の実施は九州大学の後藤七郎と東京大学の塩田広重が、1919年にそれぞれ行って成功したのが最初とされる[151]。塩田は1930年に右翼の青年に狙撃された浜口雄幸首相を輸血を行い手術して救った[152]。この当時の輸血は、注射器で採取した血液を感染症検査などを行わず、そのまま輸血する「枕元輸血」と呼ばれる方法であった[153]。日本では血液バンクが整備されるきっかけとなったのは1948年に東京大学分院で輸血を受けた女性が梅毒に感染したことが契機である[154][155]。しかし、これらの血液バンクは商業目的であり、生活困窮者が金銭目的に供血を繰り返したことから血液製剤は低質で、輸血を介した肝炎ウイルス感染も多かった[156]。1964年、ライシャワー駐日米国大使が暴漢に刺され、輸血を受けた際に輸血後肝炎に感染した。これを契機に輸血用血液を献血で賄う機運が高まり、献血体制の確立が閣議決定された[153]。その後、献血の体制が急速に構築され、1968年には売血は影を潜めた[157]。しかしながら、当初の献血は、
あなたやあなたのご家族が輸血を必要とされるとき、この手帳で輸血が受けられます—献血手帳
つまり献血というより預血であった[157]。必要預血量を達成したとする団体が献血を辞退しはじめて献血量が伸び悩む一方、輸血の需要は増加の一途を辿った[157]。1982年、献血手帳のこの文言が削除され、献血がボランティアであることが明確化された[157]。しかし、血液製剤のうち、血漿分画製剤は国内の献血のみでは需要をまかなえず、海外からの輸入に現在まで依存している[157]。
特殊な状況
新生児
小児患者への輸血の安全性を確保するため、感染を避けるためのさらなる予防措置が講じられており、サイトメガロウイルス(CMV)陰性が保証された特別に検査された小児用血液製剤の使用が好まれている。ほとんどのガイドラインでは、免疫系が十分に発達していない新生児や低出生体重児には、単に白血球を除去した血液成分ではなく、CMV陰性の血液成分を提供することを推奨している[158]。このような特定の要件により、新生児用に献血できる献血者にはさらなる制限が設けられている。
新生児輸血は通常2つのカテゴリーに分類される。
- 血液検査による損失や貧血の補正を補うために輸血が行われることがある[159]。
- ビリルビンの除去、抗体の除去、赤血球の補充(サラセミアやその他のヘモグロビン異常症に続発する貧血など)のために輸血が行われる(交換輸血という)[160]。
大量出血
大量輸血プロトコール( massive transfusion protocol: MTP)は、10単位以上の血液が必要な重症外傷など、著しい出血がある場合に使用される。一般的には、濃厚赤血球、新鮮凍結血漿、濃厚血小板が投与される[161]。通常、新鮮凍結血漿と濃厚血小板が濃厚赤血球に比して比率が高い[161]。一部の地域では、大量失血による予防可能な死亡を減らすために、病院搬送前に輸血が行われる。例えば、妊娠中の母親に大量出血が起こったとき、救急車は血液バンクにあるような、FDA(米国食品医薬品局)規格のポータブル血液冷蔵庫に保存された血液を携えて出動可能である[162]。米国では、病院前輸血が広く行われていれば助かったはずの患者が、年間31,000人も失血死している[163]。
血液型が不明の場合
血液型O(-)は誰とでも適合するため、しばしば過剰に使用され、供給不足に陥っている[164]。血液と生物学的治療推進のための協会(Association for the Advancement of Blood and Biotherapies: AABO)によれば、この血液型のヒト自身は、他の血液型が適合しないため、O(-)の輸血はO(-)の血液型の人、および妊娠している可能性があり、緊急治療を行う前に血液型検査を行うことが不可能な女性に制限されるべきである[164]。可能な限り、AABBは、より希少性の低い代替を特定するための血液型検査を使用することにより、O(-)の血液を温存することを推奨している[164]。
宗教的輸血拒否
エホバの証人は、血液は神聖なものであるという信念から、輸血を拒否することがある[165]。
輸血の代替
赤血球輸血が臨床的に唯一の適切な選択肢である臨床状況もあるが、臨床医は代替案が実行可能かどうかを検討する。これには、患者の安全性、経済的負担、血液の不足などいくつかの理由がある。ガイドラインでは、貧血の程度にもよるが、輸血は貧血・出血のために心血管系が不安定、または緊急性の高い患者のために温存されるべきであると勧告している[166][167]。 慢性期の鉄欠乏性貧血患者には、鉄剤の投与が推奨される[166]。
人工的な代替血液は研究段階に留まっており、少なくとも2022年時点では実用化されていない[168][169][170]
薬物乱用目的の特殊な輸血
南アフリカでは、ニャオペ(麻薬の一種)中毒者の一部が、麻薬が引き起こす高揚感を経済的に共有するために、口語的にBluetoothingとして知られる、同名の無線技術にちなんで命名された少量の輸血を行っている[171]。
獣医学領域の輸血
動物間でも獣医師により輸血は行われる。適合することを確実にするための必要な検査は動物種により異なる。例えば、猫の既知の血液型は3種類[172]、牛は11種類[172]、犬は少なくとも13種類[173]、豚は16種類[174]、馬は30種類以上[172]である。しかし、多くの動物種(特に馬と犬)では、非自己細胞表面抗原に対する抗体は最初からは発現していないため、つまり、輸血された血液に対する免疫反応を起こす前に動物が感作される必要があるため、最初の輸血の前に必ずしも交差適合試験を行う必要はない[175]。
供血側の動物は、供血動物という[176]。1992年の資料では、人間のような血液バンクや犬血液型判定キットなどは不足しているとされる[177]。そのため、日本では供血犬・供血猫などを動物病院で飼育、もしくはボランティアで提供してくれる飼い主を募集していたりする[178][179]。
馬
- 馬の血液型は、A式、C式、D式、K式、P式、Q式、U式の7種類ある。多くの馬へ血液が提供できる馬はユニバーサルドナーと呼ばれ、「Aa抗原およびQa抗原のいずれも持たない馬」および「Aa抗原およびQa抗原に対する抗体を保有していない馬」であることが条件である[180]。この条件を満たしやすい種として、ポニーの一種であるハフリンガー種は約8割が条件を満たす[180][181]。
犬
- 犬の血液型は13種類あり、犬赤血球抗原(Dog Erythrocyte Antigens)は8種類ある[176]。その中で、DEA1.1が陰性であるものがユニバーサルドナーであり、供血犬となる[176]。
猫
- 猫の血液型は、A型、B型、AB型の3種である。A型、B型は互いに相性が悪く、B型血液の猫にA型を輸血するとA型の猫にB型の血液を輸血する場合より重篤な症状を引き起こすため、それぞれの型にあった血液を輸血する必要がある[182]。
脚注
注釈
出典
- ^ “Blood Transfusion | National Heart, Lung, and Blood Institute (NHLBI)”. www.nhlbi.nih.gov. 2019年6月16日閲覧。
- ^ “MAPとFFP、アルブミン、グロブリンとの比率について”. 独立行政法人福祉医療機構. 2024年4月3日閲覧。
- ^ 薬師寺 泰匡(薬師寺慈恵病院院長). “悩み多き輸血の判断”. 日経メディカル. 2024年4月3日閲覧。
- ^ a b c “血液型について|兵庫県赤十字血液センター|日本赤十字社”. 兵庫県赤十字血液センター. 2024年4月28日閲覧。
- ^ 松田 利夫、清水 勝 (2011). “明治時代の「輸血学」”. 人工血液 19: 89-98.
- ^ 輸血について 日本輸血・細胞治療学会
- ^ 血液製剤 MSDマニュアル プロフェッショナル版
- ^ “輸血について | 一般社団法人 日本輸血・細胞治療学会”. yuketsu.jstmct.or.jp. 2024年4月29日閲覧。
- ^ “2014年8月1日より「赤血球液-LR(RBC-LR)[日赤]」に商品名変更(旧称「赤血球濃厚液-LR(RCC-LR)[日赤]」)” (PDF). 日本赤十字社 (2014年7月). 2018年6月15日閲覧。
- ^ “生物学的製剤基準の改正に基づく添付文書等の改訂及び赤血球製剤の販売名変更について” (PDF). 日本赤十字社 (2013年12月). 2018年6月15日閲覧。
- ^ “Anesthesia in cases of poor surgical risk. Some suggestions for decreasing risk”. Surg Gynecol Obstet 74: 1011–1019. (1942).
- ^ a b c . Clinical Transfusion Medicine Committee of the, AABB“Red blood cell transfusion: a clinical practice guideline from the AABB*”. Annals of Internal Medicine 157 (1): 49–58. (July 2012). doi:10.7326/0003-4819-157-1-201206190-00429. PMID 22751760.
- ^ a b c “Five Things Physicians and Patients Should Question”, Choosing Wisely: an initiative of the ABIM Foundation (American Association of Blood Banks), (24 April 2014) 25 July 2014閲覧。
- ^ “Transfusion thresholds for guiding red blood cell transfusion”. The Cochrane Database of Systematic Reviews 12 (12): CD002042. (December 2021). doi:10.1002/14651858.CD002042.pub5. PMC 8691808. PMID 34932836.
- ^ “Transfusion strategies for acute upper gastrointestinal bleeding”. The New England Journal of Medicine 368 (1): 11–21. (January 2013). doi:10.1056/NEJMoa1211801. PMID 23281973.
- ^ “Transfusion guidelines: when to transfuse”. American Society of Hematology. 2024年4月28日閲覧。
- ^ Edwards, Patrick W.; Zeichner, Amos (January 1985). “Blood donor development: Effects of personality, motivational and situational variables”. Personality and Individual Differences 6 (6): 743–751. doi:10.1016/0191-8869(85)90085-6. ISSN 0191-8869.
- ^ a b Muthivhi, Tshilidzi; Olmsted, M.; Park, H.; Sha, Mandy (August 2015). “Motivators and deterrents to blood donation among Black South Africans: a qualitative analysis of focus group data” (英語). Transfusion Medicine 25 (4): 249–258. doi:10.1111/tme.12218. ISSN 0958-7578. PMC 4583344. PMID 26104809.
- ^ a b c d e “Blood safety and availability” (英語). www.who.int. 2024年4月28日閲覧。
- ^ a b “ドナーアフェレシスとは?”. 日本アフェレシス学会. 2024年4月7日閲覧。
- ^ Screening donated blood for transfusion-transmissible infections: recommendations. World Health Organization. (2009). ISBN 978-92-4-154788-8. オリジナルの2022-10-09時点におけるアーカイブ。
- ^ a b c “Blood safety and availability Fact sheet 279”. World Health Organization. 21 January 2016閲覧。
- ^ 水野樹、「術中回収式自己血輸血:産科手術」 『日本臨床麻酔学会誌』 2010年 30巻 7号 p.925-930, doi:10.2199/jjsca.30.925, P.925
- ^ “Testing of donated blood”. World Health Organization. March 18, 2011時点のオリジナルよりアーカイブ。21 January 2016閲覧。
- ^ “The international experience of bacterial screen testing of platelet components with an automated microbial detection system: a need for consensus testing and reporting guidelines”. Transfusion Medicine Reviews 28 (2): 61–71. (April 2014). doi:10.1016/j.tmrv.2014.01.001. PMID 24636779.
- ^ “Bacterial Detection Testing by Blood and Blood Collection Establishments and Transfusion Services to Enhance the Safety and Availability of Platelets for Transfusion”. FDA U.S. Food and Drug Administration. 21 January 2016閲覧。
- ^ “Prevention of Transfusion-Transmitted Cytomegalovirus Infections: Which is the Optimal Strategy?”. Transfusion Medicine and Hemotherapy 41 (1): 40–44. (February 2014). doi:10.1159/000357102. PMC 3949610. PMID 24659946.
- ^ a b c “Why implement universal leukoreduction?”. Hematology/Oncology and Stem Cell Therapy 1 (2): 106–123. (2008). doi:10.1016/s1658-3876(08)50042-2. PMID 20063539.
- ^ “保存前白血球除去|安全対策|輸血用血液製剤|医薬品情報|日本赤十字社”. www.jrc.or.jp. 2024年4月7日閲覧。
- ^ a b “製剤への放射線照射|安全対策|輸血用血液製剤|医薬品情報|日本赤十字社”. www.jrc.or.jp. 2024年4月7日閲覧。
- ^ “Mirasol PRT treatment of donor white blood cells prevents the development of xenogeneic graft-versus-host disease in Rag2-/-gamma c-/- double knockout mice”. Transfusion 46 (9): 1553–1560. (September 2006). doi:10.1111/j.1537-2995.2006.00939.x. PMID 16965583.
- ^ “Inactivation of human white blood cells in platelet products after pathogen reduction technology treatment in comparison to gamma irradiation”. Transfusion 51 (7): 1397–1404. (July 2011). doi:10.1111/j.1537-2995.2010.02984.x. PMID 21155832.
- ^ “Toxicity testing of a novel riboflavin-based technology for pathogen reduction and white blood cell inactivation”. Transfusion Medicine Reviews 22 (2): 133–153. (April 2008). doi:10.1016/j.tmrv.2007.12.003. PMID 18353253.
- ^ “Separation, identification and quantification of riboflavin and its photoproducts in blood products using high-performance liquid chromatography with fluorescence detection: a method to support pathogen reduction technology”. Photochemistry and Photobiology 80 (3): 609–615. (2004). doi:10.1562/0031-8655(2004)080<0609:TNSIAQ>2.0.CO;2. PMID 15382964.
- ^ “A randomized controlled clinical trial evaluating the performance and safety of platelets treated with MIRASOL pathogen reduction technology”. Transfusion 50 (11): 2362–2375. (November 2010). doi:10.1111/j.1537-2995.2010.02694.x. PMID 20492615.
- ^ “The Mirasol PRT system for pathogen reduction of platelets and plasma: an overview of current status and future trends”. Transfusion and Apheresis Science 35 (1): 5–17. (August 2006). doi:10.1016/j.transci.2006.01.007. PMID 16935562.
- ^ Basavarajegowda, Abhishekh; Shastry, Shamee (2024), Pretransfusion Testing, StatPearls Publishing, PMID 36251808 2024年4月28日閲覧。
- ^ a b 北海道赤十字血液センター. “Type & Screenについて|北海道赤十字血液センター|日本赤十字社”. 北海道赤十字血液センター. 2024年4月29日閲覧。
- ^ a b Blood Processing. University of Utah. Available at: http://library.med.utah.edu/WebPath/TUTORIAL/BLDBANK/BBPROC.html. Accessed on: December 15, 2006.
- ^ “不規則抗体の臨床的意義と抗原陰性血の選択について”. 日本赤十字社. 2024年4月29日閲覧。
- ^ Modern Blood Banking and Transfusion Practices (4th ed.). Philadelphia: F. A. Davis. (1999). ISBN 978-0-8036-0419-3
- ^ “Which blood types are compatible with each other: Blood type compatibility” (英語). www.blood.ca. 2024年4月29日閲覧。
- ^ “WHO | Haemovigilance”. Who.int (2013年6月25日). March 18, 2011時点のオリジナルよりアーカイブ。2013年12月11日閲覧。
- ^ “SHOT Terms of Reference”. Shotuk.org. 30 September 2020時点のオリジナルよりアーカイブ。22 August 2014閲覧。
- ^ Wang, SS. "What's the Shelf Life of Blood? Focus on Whether Older Donations Impair Recovery of Transfusion Recipients". The Wall Street Journal. 2009 Dec. 1.
- ^ The 2014 Annual SHOT Report (2015). SHOT. (2015). ISBN 978-0-9558648-7-2. オリジナルの2016-01-27時点におけるアーカイブ。 2016年1月21日閲覧。
- ^ a b c d e f g h i Blood Groups and Red Cell Antigens. Bethesda, United States: National Center for Biotechnology Information. (2005) 4 October 2017閲覧。
- ^ “The 2011 National Blood Collection and Utilization Survey Report”. Department of Health and Human Services. 19 March 2016時点のオリジナルよりアーカイブ。21 January 2016閲覧。
- ^ “Post-transfusion purpura”. Practical Transfusion Medicine (4th ed.). Wiley-Blackwell. (2013). pp. 127–130
- ^ a b “NHSN | CDC” (英語). www.cdc.gov (2017年12月29日). 2018年9月18日閲覧。
- ^ “Transfusion-related acute lung injury; clinical perspectives”. Korean Journal of Anesthesiology 68 (2): 101–105. (April 2015). doi:10.4097/kjae.2015.68.2.101. PMC 4384395. PMID 25844126.
- ^ “A systematic review of transfusion-associated graft-versus-host disease”. Blood 126 (3): 406–414. (July 2015). doi:10.1182/blood-2015-01-620872. PMID 25931584.
- ^ “Health care-associated infection after red blood cell transfusion: a systematic review and meta-analysis”. JAMA 311 (13): 1317–1326. (April 2014). doi:10.1001/jama.2014.2726. PMC 4289152. PMID 24691607.
- ^ a b c d e “Incidence and significance of the bacterial contamination of blood components”. Developments in Biologicals 108 (2): 59–67. (2002). PMID 12220143.
- ^ “Transfusion-transmitted bacterial infection | Lifeblood” (英語). www.lifeblood.com.au. 2024年4月28日閲覧。
- ^ “Skin preparation with alcohol versus alcohol followed by any antiseptic for preventing bacteraemia or contamination of blood for transfusion”. The Cochrane Database of Systematic Reviews 2015 (2): CD007948. (February 2015). doi:10.1002/14651858.CD007948.pub3. PMC 7185566. PMID 25674776.
- ^ Donegan, Elizabeth (1990-11-15). “Infection with Human Immunodeficiency Virus Type 1 (HIV-1) among Recipients of Antibody-Positive Blood Donations” (英語). Annals of Internal Medicine 113 (10): 733. doi:10.7326/0003-4819-113-10-733. ISSN 0003-4819.
- ^ “よくあるご質問 輸血によりウイルス肝炎などに罹ることもあると聞きました。輸血による感染症のリスクを教えてください? | 愛知医科大学病院”. www.aichi-med-u.ac.jp. 2024年4月28日閲覧。
- ^ a b c “ウイルス|感染症|輸血の副作用|医薬品情報|日本赤十字社”. www.jrc.or.jp. 2024年4月28日閲覧。
- ^ Unless otherwise specified in boxes, reference is: Transfusion reactions / M.A. Popovsky. Basel: Karger. (1996). ISBN 978-3-8055-6509-7. OCLC 40288753
- ^ “Clinical impact of blood storage lesions”. American Journal of Hematology 85 (2): 117–122. (February 2010). doi:10.1002/ajh.21599. PMID 20052749.
- ^ “In vivo regeneration of red cell 2,3-diphosphoglycerate following transfusion of DPG-depleted AS-1, AS-3 and CPDA-1 red cells”. British Journal of Haematology 71 (1): 131–136. (January 1989). doi:10.1111/j.1365-2141.1989.tb06286.x. PMID 2492818.
- ^ “Decreased erythrocyte deformability after transfusion and the effects of erythrocyte storage duration”. Anesthesia and Analgesia 116 (5): 975–981. (May 2013). doi:10.1213/ANE.0b013e31828843e6. PMC 3744176. PMID 23449853.
- ^ “Storage-induced damage to red blood cell mechanical properties can be only partially reversed by rejuvenation”. Transfusion Medicine and Hemotherapy 41 (3): 197–204. (June 2014). doi:10.1159/000357986. PMC 4086768. PMID 25053933.
- ^ “The Shelf Life of Donor Blood”. The New York Times. (2013年3月11日)
- ^ “What's the Shelf Life of Blood?”. The Wall Street Journal. (2009年12月1日)
- ^ “Age of red blood cells and transfusion in critically ill patients”. Annals of Intensive Care 3 (1): 2. (January 2013). doi:10.1186/2110-5820-3-2. PMC 3575378. PMID 23316800.
- ^ “Transfusion of red blood cells after prolonged storage produces harmful effects that are mediated by iron and inflammation”. Blood 115 (21): 4284–4292. (May 2010). doi:10.1182/blood-2009-10-245001. PMC 2879099. PMID 20299509.
- ^ “Scientific problems in the regulation of red blood cell products”. Transfusion 52 (8): 1827–1835. (August 2012). doi:10.1111/j.1537-2995.2011.03511.x. PMID 22229278.
- ^ “Clinical evidence of blood transfusion effectiveness”. Blood Transfusion = Trasfusione del Sangue 7 (4): 250–258. (October 2009). doi:10.2450/2008.0072-08. PMC 2782802. PMID 20011636.
- ^ “Artificial microvascular network: a new tool for measuring rheologic properties of stored red blood cells”. Transfusion 52 (5): 1010–1023. (May 2012). doi:10.1111/j.1537-2995.2011.03418.x. PMID 22043858.
- ^ “The use of the mechanical fragility test in evaluating sublethal RBC injury during storage”. Vox Sanguinis 99 (4): 325–331. (November 2010). doi:10.1111/j.1423-0410.2010.01365.x. PMID 20673245.
- ^ “Estimating the cost of blood: past, present, and future directions”. Best Practice & Research. Clinical Anaesthesiology 21 (2): 271–289. (June 2007). doi:10.1016/j.bpa.2007.01.002. PMID 17650777.
- ^ “Transfusion Overuse: Exposing an International Problem and Patient Safety Issue”. Patient Safety Movement Foundation (2013年). 1 April 2022時点のオリジナルよりアーカイブ。15 March 2022閲覧。
- ^ “Easy does it – showing caution with RBC transfusions”. College of American Pathologists (April 2009). 22 August 2014閲覧。
- ^ “The platelet storage lesion”. Clinics in Laboratory Medicine 30 (2): 475–487. (June 2010). doi:10.1016/j.cll.2010.02.002. PMID 20513565.
- ^ “Inflammatory response, immunosuppression, and cancer recurrence after perioperative blood transfusions”. British Journal of Anaesthesia 110 (5): 690–701. (May 2013). doi:10.1093/bja/aet068. PMC 3630286. PMID 23599512.
- ^ “Perioperative blood transfusion is associated with worse clinical outcomes in resected lung cancer”. The Annals of Thoracic Surgery 97 (5): 1827–1837. (May 2014). doi:10.1016/j.athoracsur.2013.12.044. PMID 24674755.
- ^ “Does blood transfusion increase the chance of recurrence in patients undergoing surgery for lung cancer?”. Interactive Cardiovascular and Thoracic Surgery 14 (1): 85–90. (January 2012). doi:10.1093/icvts/ivr025. PMC 3420304. PMID 22108935.
- ^ a b c “Taming the immune system through transfusion in oncology patients”. Transfusion and Apheresis Science 56 (3): 310–316. (June 2017). doi:10.1016/j.transci.2017.05.017. PMID 28651910.
- ^ “Hepatic resection and blood transfusion increase morbidity after cytoreductive surgery and HIPEC for colorectal carcinomatosis”. Clinical & Translational Oncology 22 (11): 2032–2039. (November 2020). doi:10.1007/s12094-020-02346-2. PMID 32277348.
- ^ a b “その他|非溶血性副作用|輸血の副作用|医薬品情報|日本赤十字社”. www.jrc.or.jp. 2024年4月21日閲覧。
- ^ a b c Vagholkar, Ketan; Iyengar, Madhavan; Vagholkar, Suvarna; Maurya, Inder (2015-10-31). “Complications of Massive Blood Transfusion”. Journal of Medical Science And clinical Research. doi:10.18535/jmscr/v3i10.58. ISSN 2347-176X.
- ^ “Damage Control Resuscitation and Management in Severe Hemorrage/Shock in the Prehospital Setting”. internationaltraumalifesupport.remote-learner.net. ITLA (May 2019). 2022年10月9日時点のオリジナルよりアーカイブ。2022年10月9日閲覧。
- ^ “Kashechkin tests positive for blood doping”. Cyclingnews.com. August 9, 2007閲覧。
- ^ Pugliese, David (2002). Canada's Secret Commandos. Ottawa: Esprit de Corps Books. ISBN 978-1-895896-18-3
- ^ Smith, DA; Perry, PJ (1992). “The efficacy of ergogenic agents in athletic competition. Part II: Other performance-enhancing agents”. Ann Pharmacother 26 (5): 653–659. doi:10.1177/106002809202600510. PMID 1591427.
- ^ “Most Frequent Procedures Performed in U.S. Hospitals, 2011”. Healthcare Cost and Utilization Project (HCUP) Statistical Briefs [Internet].. Rockville (MD): Agency for Healthcare Research and Quality. (October 2013). PMID 24354027. Statistical Brief #165
- ^ a b c d “Blood Industry Shrinks as Transfusions Decline”. The New York Times Newspaper. New York Times (Web Edition). (2014年8月24日) 2014年8月24日閲覧。
- ^ (英語) Scientific American. Munn & Company. (1869-02-20). pp. 122
- ^ Jacalyn Duffin, History of Medicine: A scandalously short introduction, University of Toronto Press, 1999, p. 171.[要ISBN]
- ^ The New Book of Knowledge. Scholastic Library Publishing. (2002). pp. 260
- ^ a b The Eureka! Moment: 100 Key Scientific Discoveries of the 20th Century. Routledge. (2016). ISBN 9781136714764[要ページ番号]
- ^ “輸血の概要 - 13. 血液の病気”. MSDマニュアル家庭版. 2024年4月7日閲覧。
- ^ a b c d e f g h “The history of peripheral intravenous catheters: how little plastic tubes revolutionized medicine”. Acta Anaesthesiologica Belgica 56 (3): 271–282. (2005). PMID 16265830. オリジナルの2014-07-15時点におけるアーカイブ。.
- ^ a b “The First Blood Transfusion?”. Heart-valve-surgery.com (2009年1月3日). 2010年2月9日閲覧。
- ^ “This Month in Anesthesia History (archived)”. July 20, 2011時点のオリジナルよりアーカイブ。2016年3月5日閲覧。
- ^ a b “Red Gold . Innovators & Pioneers . Jean-Baptiste Denis”. PBS. 2010年2月9日閲覧。
- ^ Mollison's Blood Transfusion in Clinical Medicine. (2005). p. 406. doi:10.1002/9780470986868. ISBN 978-0-470-98686-8[リンク切れ]
- ^ “First Blood Transfusion: A History”. JSTOR (2015年4月22日). 22 April 2015閲覧。
- ^ “Richard Lower: anatomist and physiologist”. Annals of Internal Medicine 132 (5): 420–423. (March 2000). doi:10.7326/0003-4819-132-5-200003070-00023. PMID 10691601.
- ^ “James Blundell, pioneer of blood transfusion.”. British Journal of Hospital Medicine 68 (8): 447. (August 2005). doi:10.12968/hmed.2007.68.8.24500. PMID 17847699.
- ^ Bridge Across the Abyss: Medical Myths and Misconceptions. Universal-Publishers. (2008). p. 22. ISBN 978-1-58112-987-8
- ^ “History of Blood Transfusion Medicine - BloodBook, Blood Information for Life”. www.bloodbook.com. 2024年4月28日閲覧。
- ^ a b The History of the Blood Transfusion Service In Edinburgh. Edinburgh. (1993)
- ^ (英語) Scientific American, "A Successful Case of Transfusion of Blood". Munn & Company. (1880). pp. 281
- ^ “William Stewart Halsted” (英語). prabook.com. 2024年4月21日閲覧。
- ^ Osborne, Michael P (2007-03). “William Stewart Halsted: his life and contributions to surgery”. The Lancet Oncology 8 (3): 256–265. doi:10.1016/s1470-2045(07)70076-1. ISSN 1470-2045.
- ^ a b c “Karl Landsteiner Biography: Discoverer of Blood Groups | BroadBiography” (英語) (2023年8月7日). 2024年4月28日閲覧。
- ^ “The first direct human blood transfusion: the forgotten legacy of George W. Crile”. Neurosurgery 64 (3 Suppl): ons20–26; discussion ons26–27. (March 2009). doi:10.1227/01.NEU.0000334416.32584.97. PMID 19240569. "[...] the first successful blood transfusion performed between 2 brothers on August 6, 1906, at St. Alexis Hospital, Cleveland, OH."
- ^ Blood transfusion (Inventions)
- ^ "Hematologická studie u psychotiků"
- ^ Mole, Sara; Williams, Ruth; Goebel, Hans (2011-03-10) (英語). The Neuronal Ceroid Lipofuscinoses (Batten Disease). OUP Oxford. ISBN 978-0-19-101558-8
- ^ ["Studies on isoagglutinins and isohemolysins". Bulletin Johns Hopkins Hospital 21: 63–70.]
- ^ “Dr. William Lorenzo Moss”. 2014年2月28日時点のオリジナルよりアーカイブ。2014年2月22日閲覧。
- ^ “Effect of External Temperature on Sedimentation Rate of Red Blood Corpuscles”. Journal of the American Medical Association 114 (16). (1940). doi:10.1001/jama.1940.02810160078030.
- ^ “The Rockefeller University Hospital Centennial – The First Blood Bank”. centennial.rucares.org. The Rockefeller University (2010年). 2022年3月18日閲覧。
- ^ “Dr. Peyton Rous, Nobel Laureate, Dies” (英語). The New York Times: pp. 43. (1970年2月17日). ISSN 0362-4331 2022年3月18日閲覧。
- ^ “On the preservation in vitro of living erythrocytes” (英語). Experimental Biology and Medicine 12 (6): 122–124. (March 1915). doi:10.3181/00379727-12-74. ISSN 1535-3702.
- ^ “The Preservation of Living Red Blood Cells in Vitro”. The Journal of Experimental Medicine 23 (2): 219–237. (February 1916). doi:10.1084/jem.23.2.219. PMC 2125399. PMID 19867981.
- ^ “The Preservation of Living Red Blood Cells in Vitro”. The Journal of Experimental Medicine 23 (2): 239–248. (February 1916). doi:10.1084/jem.23.2.239. PMC 2125395. PMID 19867982.
- ^ “An update on solutions for red cell storage”. Vox Sanguinis 91 (1): 13–19. (July 2006). doi:10.1111/j.1423-0410.2006.00778.x. PMID 16756596.
- ^ “Cold blood and clinical research during World War I”. Military Medicine 161 (7): 392–400. (July 1996). doi:10.1093/milmed/161.7.392. PMID 8754712.
- ^ “Karl Landsteiner. 1868-1943”. Obituary Notices of Fellows of the Royal Society 5 (15): 294–324. (1947). doi:10.1098/rsbm.1947.0002.
- ^ “A rapid and simple method of testing donors for transfusion”. Journal of the American Medical Association LXIV (24): 1980–1982. (1915). doi:10.1001/jama.1915.02570500028011.
- ^ a b "A Canadian kept blood flowing in WWI. An American got credit". Toronto Star. July 9, 2016. Katie Daubs
- ^ a b “Taking credit: the Canadian Army Medical Corps and the British conversion to blood transfusion in WWI”. Journal of the History of Medicine and Allied Sciences 56 (3): 238–277. (July 2001). doi:10.1093/jhmas/56.3.238. PMID 11552401.
- ^ “Blood transfusion in World War I: the roles of Lawrence Bruce Robertson and Oswald Hope Robertson in the "most important medical advance of the war"”. Transfusion Medicine Reviews 23 (3): 232–236. (July 2009). doi:10.1016/j.tmrv.2009.03.007. PMID 19539877.
- ^ “Red Gold: the Epic Story of Blood”. PBS (2002年6月23日). 2023年12月3日時点のオリジナルよりアーカイブ。2024年4月28日閲覧。
- ^ The Great Ormond Street Hospital Manual of Children's Nursing Practices. John Wiley & Sons. (2012). p. 75. ISBN 978-1-118-27422-4
- ^ a b c “Percy Oliver”. Red Gold: The Eipc Story of Blood. 2002年10月18日時点のオリジナルよりアーカイブ。2024年4月28日閲覧。
- ^ Bernice Glatzer Rosenthal. New Myth, New World: From Nietzsche to Stalinism, Pennsylvania State University, 2002, ISBN 0-271-02533-6, pp. 161–162.
- ^ a b Huestis, Douglas W. (2007-10-01). “Alexander Bogdanov: The Forgotten Pioneer of Blood Transfusion”. Transfusion Medicine Reviews 21 (4): 337–340. doi:10.1016/j.tmrv.2007.05.008. ISSN 0887-7963.
- ^ a b c Thompson, Patrick; Strandenes, Geir (2020), Spinella, Philip C., ed. (英語), The History of Fluid Resuscitation for Bleeding, Springer International Publishing, pp. 3–29, doi:10.1007/978-3-030-20820-2_1, ISBN 978-3-030-20820-2, PMC PMC7123228 2024年4月28日閲覧。
- ^ Blood Banking and Transfusion Medicine: Basic Principles & Practice. Elsevier Health Sciences. (2007). ISBN 978-0-443-06981-9
- ^ The blood bank and the technique and therapeutics of transfusion. St. Louis: The C.V.Mosby Company. (1942). pp. 196–197
- ^ Blood: An Epic History of Medicine and Commerce. Little, Brown and Company. (1998). pp. 84–87. ISBN 0-316-91146-1
- ^ “The history of blood transfusion”. British Journal of Haematology 110 (4): 758–767. (September 2000). doi:10.1046/j.1365-2141.2000.02139.x. PMID 11054057.
- ^ For example: “Free World”. 8. Free World, Incorporated. (1944年). p. 442 16 August 2019閲覧. "[...] Nazis chose the healthiest Polish children and transported them to German field hospitals where they used them for constant blood transfusions [...]."
- ^ Cohn, E. J.; Strong, L. E.; Hughes, W. L.; Mulford, D. J.; Ashworth, J. N.; Melin, M.; Taylor, H. L. (1946-03). “Preparation and Properties of Serum and Plasma Proteins. IV. A System for the Separation into Fractions of the Protein and Lipoprotein Components of Biological Tissues and Fluids 1a,b,c,d” (英語). Journal of the American Chemical Society 68 (3): 459–475. doi:10.1021/ja01207a034. ISSN 0002-7863.
- ^ (英語) United States Naval Medical Bulletin. U.S. Government Printing Office. (1942)
- ^ “Transfusion Before World War I”. Blood program in world war II.. Office of the Surgeon General, Department of the Army. (1964). オリジナルの11 January 2006時点におけるアーカイブ。
- ^ “Plasma Equipment and Packaging, and Transfusion Equipment”. Blood program in world war II.. Office of the Surgeon General, Department of the Army. (1964). オリジナルの8 February 2006時点におけるアーカイブ。
- ^ Loutit, J. F.; Mollison, P. L.; Young, I. Maureen; Lucas, E. J. (16 December 1943). “Citric Acid-Sodium Citrate-Glucose Mixtures for Blood Storage”. Quarterly Journal of Experimental Physiology and Cognate Medical Sciences 32 (3): 183–202. doi:10.1113/expphysiol.1943.sp000882.
- ^ Loutit, J. F.; Mollison, P. L. (1943-12-11). “Disodium-Citrate-Glucose Mixture as a Blood Preservative”. British Medical Journal 2 (4327): 744–745. doi:10.1136/bmj.2.4327.744. ISSN 0007-1447. PMC 2285557. PMID 20785169.
- ^ “Cardiac arrest and temperature of bank blood”. JAMA 183: 58–60. (January 1963). doi:10.1001/jama.1963.63700010027020. PMID 14014662.
- ^ Anaesthesia: essays on its history. Springer-Verlag. (1985). pp. 99–101. ISBN 978-3-540-13255-4
- ^ “The Mechanism of Action of Adenine in Red Cell Preservation”. The Journal of Clinical Investigation 44 (4): 629–642. (April 1965). doi:10.1172/JCI105176. PMC 292538. PMID 14278179.
- ^ “Adenine in red cell preservation”. The Journal of Clinical Investigation 41 (2): 351–359. (February 1962). doi:10.1172/JCI104489. PMC 289233. PMID 14039291.
- ^ “New rules may shrink ranks of blood donors”. Wall Street Journal. (2007年1月10日). オリジナルの2009年8月4日時点におけるアーカイブ。 2008年4月5日閲覧。
- ^ 安部勝美 (2000). “輸血医学と検査の変遷”. 医学検査 49: 1267-1276.
- ^ 医学探偵の歴史事件簿 小長谷正明(著) 岩波新書 (2014年)ISBN 978-4004314745
- ^ a b “血液事業のあゆみ|関連情報|医薬品情報|日本赤十字社”. www.jrc.or.jp. 2024年4月28日閲覧。
- ^ 日本輸血学会25周年記念講演 『日本輸血学会雑誌』 1980年 26巻 1-3号 p.1-15, doi:10.3925/jjtc1958.26.1
- ^ 根本晋一「高度歯科医療に関する医療過誤訴訟の研究- -インプラント植立手術を素材として」(PDF)『日本大学歯学部紀要』第35号、日本大学歯学部、2007年、101-112頁、CRID 1520290882410127232、ISSN 1348818X。
- ^ “「黄色い血」から献血へ、運動支えた学生団体が60周年で解散へ…「今の若者に思い託す」”. 読売新聞オンライン (2023年8月18日). 2024年4月28日閲覧。
- ^ a b c d e “血液事業の歴史|大阪府赤十字血液センター|日本赤十字社”. 大阪府赤十字血液センター. 2024年4月28日閲覧。
- ^ “Red blood cell transfusions in newborn infants: Revised guidelines”. Canadian Paediatric Society (CPS). 2007年2月3日時点のオリジナルよりアーカイブ。2007年2月2日閲覧。
- ^ “Red Blood Cell Transfusion in the Neonate Clinical Pathway”. Johns Hopkins all children's hospital. 2024年4月27日閲覧。
- ^ “Component therapy”. Indian Journal of Pediatrics 70 (8): 661–666. (August 2003). doi:10.1007/BF02724257. PMID 14510088.
- ^ a b “Traumatic hemorrhagic shock: advances in fluid management”. Emergency Medicine Practice 13 (11): 1–19; quiz 19–20. (November 2011). PMID 22164397. オリジナルの2012-01-18時点におけるアーカイブ。.
- ^ Villalpando, Nicole. “Whole blood program saves Cedar Park mom's life”
- ^ Caruba, Lauren. “Bleeding Out: A new series exploring America's urgent health crisis”
- ^ a b c American Association of Blood Banks (24 April 2014), “Five Things Physicians and Patients Should Question”, Choosing Wisely: an initiative of the ABIM Foundation (American Association of Blood Banks), オリジナルの24 September 2014時点におけるアーカイブ。 25 July 2014閲覧。, which cites
- “The appropriate use of group O RhD negative red cells”. National Health Service (c. 2008). 2022年10月9日時点のオリジナルよりアーカイブ。25 July 2014閲覧。
- ^ (英語) Transfusion Medicine and Hemostasis: Clinical and Laboratory Aspects. Elsevier. (2009). p. 279. ISBN 9780080922300
- ^ a b “Guidelines for the management of iron deficiency anaemia”. Gut 60 (10): 1309–1316. (October 2011). doi:10.1136/gut.2010.228874. PMID 21561874.
- ^ . International Consensus Conference on Transfusion Outcomes Group“Appropriateness of allogeneic red blood cell transfusion: the international consensus conference on transfusion outcomes”. Transfusion Medicine Reviews 25 (3): 232–246.e53. (July 2011). doi:10.1016/j.tmrv.2011.02.001. PMID 21498040.
- ^ “人工血液について Q10 | 日本人工臓器学会”. 2023年11月23日閲覧。
- ^ “Q7. 血液は人工的に造れないの?|東海北陸ブロック血液センター|日本赤十字社”. 東海北陸ブロック血液センター. 2023年11月23日閲覧。
- ^ “次世代医療の切り札となる「人工血液」 中央大学・小松晃之研究室|SDGs@大学|朝日新聞EduA”. www.asahi.com. 2023年11月23日閲覧。
- ^ “'Bluetooth' drug craze sweeps townships | IOL”. (1 February 2017) 2017年2月2日閲覧。
- ^ a b c “Blood types”. Cornell University College of Veterinary Medicine eClinpath. 2023年10月21日閲覧。
- ^ Cotter, Susan M. (October 2022). “Blood Groups and Blood Transfusions in Dogs - Dog Owners”. MSD Veterinary Manual. 2023年10月21日閲覧。
- ^ Smith, Douglas M.; Newhouse, Michael; Naziruddin, Bashoo; Kresie, Lesley (May 2006). “Blood groups and transfusions in pigs”. Xenotransplantation 13 (3): 186–194. doi:10.1111/j.1399-3089.2006.00299.x. ISSN 0908-665X. PMID 16756561.
- ^ “Crossmatch Testing”. Cornell University College of Veterinary Medicine (2019年2月26日). 2023年10月21日閲覧。
- ^ a b c 国立国会図書館. “犬に血液型はあるか。”. レファレンス協同データベース. 2023年5月24日閲覧。
- ^ Hohenhaus, A. E. (1992年12月). “Canine blood transfusions”. Problems in Veterinary Medicine. pp. 612–624. 2023年5月24日閲覧。
- ^ Company, The Asahi Shimbun (2021年4月28日). “健康な猫から、病気の仲間への贈り物 「供血猫」登録は助け合いの輪を広げること”. sippo. 2023年5月24日閲覧。
- ^ “ペットを救うために働く「供血犬」に穏やかな暮らしを 八王子の英会話講師が引退後の飼い主を探す活動:東京新聞 TOKYO Web”. 東京新聞 TOKYO Web. 2023年5月24日閲覧。
- ^ a b “馬の輸血とユニバーサルドナー”. 馬の資料室(日高育成牧場). 2023年5月24日閲覧。
- ^ 重種馬の新たな価値~ユニバーサルドナー~ NLBC 家畜衛生通信 第23号 令和4年11月 著:十勝牧場 衛生課
- ^ “愛猫の血液型知っていますか? - 日本動物医療センター”. 日本動物医療センター - 24時間夜間救急も可 (2017年2月9日). 2023年5月24日閲覧。
- ^ “Wagging tails for Taiwan's first veterinary blood bank” (英語). Reuters (2016年7月8日). 2023年5月24日閲覧。
関連文献
- Blood Work: A Tale of Medicine and Murder in the Scientific Revolution. W. W. Norton & Company. (2012). ISBN 978-0393342239
- "Milk as a Substitute for Blood Transfusion", historical account, Scientific American, 13 July 1878, p. 19
- 輸血学 第3版 遠山博ほか(中外出版社)
- 最新版 献血と輸血のすべて 霜山龍志(丸善札幌SC)2012年
関連項目
- アルノー・ツァンク(Arnault Tzanck) - フランスにおける輸血の組織化に貢献した。
- 打鶏血 - 1960年代から文化革命初期まで存在した中国の健康法。1年未満のニワトリの血を輸血する。
- 無輸血治療
- 胎児輸血- 子宮内での胎児への輸血
- 亜型検査
- 認定輸血検査技師
- 国際輸血学会(ISBT)
- 医療識別票 - 意識不明になった場合、蘇生拒否などの希望や、稀血・血液型などの輸血に必要な情報、注意すべき持病などを医療関係者に伝える装身具
- 若者からの輸血 - 若者の血を輸血すると若返るとした疑似科学健康法。
- ウィンドウ期間 - 最初の感染から検査がその感染を確実に検出できるようになるまでの期間。この間には献血を行うべきでは無い。
- シャーガス病 - 輸血により感染するため、一定期間伝染病がある地域にいた人は献血を行えない。
外部リンク
- Transfusion Evidence Library - 輸血に関するエビデンス検索(英語)
- 『輸血』 - コトバンク
輸血関連学会
- British Blood Transfusion Society (BBTS) - 英国輸血学会
- 日本輸血・細胞治療学会
書籍
- Blood Groups and Red Cell Antigens Free online book at NCBI Bookshelf ID: NBK2261
- Handbook of Transfusion Medicine Archived 2023-03-14 at the Wayback Machine. - 英国で出版された輸血学のハンドブック第5版
ガイドライン
- Australian National Blood Authority Patient Blood Management Guidelines -オーストラリアの輸血管理ガイドライン(英語)
- National Institute for Health and Care Excellence Blood Transfusion Guidance - 英国の輸血ガイドライン
患者向け
- Blood Transfusion Leaflets - 英国(英語)
- Blood Transfusion Leaflets - ウェールズ(英語)
- Blood Transfusion Information - スコットランド(英語)
- Blood Transfusion Information - アメリカ癌学会(英語)
