日本における後発医薬品
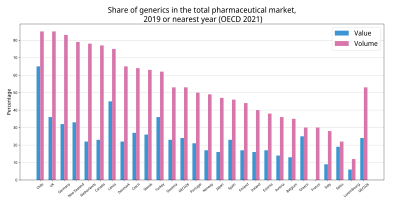
青は金額比、赤は数量比[1]。
日本における後発医薬品(にほんにおけるこうはついやくひん)は、日本国政府によって利用推進政策が取られており、経済財政運営と改革の基本方針2017(骨太の方針)では普及率80%を目指している[2]。日本ジェネリック製薬協会によれば、2020年には後発医薬品の数量シェア80%が達成されている[2]。
歴史[編集]
かつて後発医薬品の普及率は、アメリカ合衆国・イギリス・ドイツ・デンマークなどの国家では、数量ベースで7割近くを占めるのに対し[1]、日本では2006年(平成18年)で1割程度に留まっていた。
これは、ブランド嗜好が強い国民性が浸透していた医療現場において、医師が医薬情報担当者による情報提供が少なく、信頼性に不安を感じる後発医薬品よりも、長年の育薬に基づく豊富な情報が提供され、後発品に比べて薬効・供給量の安定している先発医薬品を処方したためと考えられる[3]。2009年には経済協力開発機構 (OECD) は、大多数の患者は後発薬処方を希望するが医師の9%しか同意せず、医師の収入への影響と薬剤品質への懸念が、導入を妨げている理由であると報告している[3]。
2007年6月、「経済財政改革の基本方針2007」が閣議決定され、2012年度に数量ベースで30%の数値目標を掲げた[4]。後発品の数値割合の定義(旧指標)は、以下の通り[4]。
(後発品の数値割合)=(後発医薬品の数量)/{(全医薬品の数量)-(「経腸成分栄養剤」「特殊ミルク製剤」「生薬」「漢方」の数量)}
2009年のOECD対日審査においては医療制度改革に一節が割かれ、後発医薬品の推進についても言及されている[3]。日本は少子高齢化社会を迎え、医療費上昇に伴って公的健康保険財政は困難に直面しており、その一環として薬価の低い後発医薬品が着目されている[5][3]。財務省財政制度等審議会 財政構造改革部会資料によれば、後発医薬品に変えることで1兆3千億円程度の医療費を削減できるとの試算がある。OECDは米国並みに後発薬を普及させることで、総医療費を7%(GDPの0.5%)削減することができるとし、2010年までにシェアを最低でも30%とするよう勧告した[3]。
2013年4月、厚生労働省は「後発医薬品のさらなる使用促進のためのロードマップ」を策定し取り組みを進め、2018年3月までに数量シェア60%以上を目標に掲げた[6]。後発品の数値割合の定義(新指標)は以下の通り[7]。
(後発品の数値割合)=(後発医薬品の数量)/{(後発医薬品のある先発医薬品の数量)+(後発医薬品の数量)}
2014年に日本国政府は、後発薬市場を2017年までに34%まで引き上げ、それにより保健支出を0.4兆円削減する目標を立てた[8]。OECDは、もし後発医薬品市場をアメリカ合衆国並み(84%)に引き上げ、かつ価格が10%低下すれば、薬剤支出を半減することができるとしている[8]。
2015年6月30日には、日本国政府の財政赤字脱却を目指す「財政健全化計画」が経済財政運営の指針「骨太の方針2015」に盛り込まれ、歳出抑制の具体策の目玉として後発医薬品の普及が謳われた。5月19日には、内閣総理大臣安倍晋三が議長を務める経済財政諮問会議にて、民間議員が示した改革案に業界首脳らはこぞって反対した。その内容は、ジェネリックの数量シェアを80 - 90%へ引き上げ、さらに2018年度からは長期収載医薬品に対する公的医療保険の給付額を後発医薬品の薬価までとし、先発医薬品との差額分は患者の自費負担とする「参照価格制度」の導入などであった[9]。同年6月の閣議決定において、2017年央に数量シェア70%以上とするとともに、2018年度から2020年度末までの間のなるべく早い時期に80%以上とする目標が定められた[6]。
2017年6月の閣議決定において「2020年(令和2年)9月までに、後発医薬品の使用割合を80%とし、できる限り早期に達成できるよう、更なる使用促進策を検討する」と定められた[6]。薬価調査結果による後発医薬品の数値割合(数量シェア)は、2017年 65.8%[7]、2018年9月 72.6%[10]。
後発医薬品の製造販売を中心とする企業は、研究開発への投資(費用・時間)が少なくて済む分、競合他社も製造に乗り出すため、先発メーカーのように、ひとつの新薬で莫大な利益を得ることができない。
後発医薬品が発売される時期には、先発医薬品の発売から10年以上が経過しているため、十分な副作用情報が蓄積されている。万一、後発薬特有の副作用が出現した場合にも、先発医薬品と同様に、製造販売後における安全管理基準等を遵守し、副作用情報等の迅速かつ適正な収集・評価・提供を行っており、医薬品副作用被害救済制度の対象となる[11]。
後発医薬品の名称[編集]
2005年(平成17年)9月22日、厚生労働省の「医療用後発医薬品の承認申請にあたっての販売名の命名に関する留意事項について」にて通知されている[12]。
- 一般的名称(成分名、一般名)に剤型、含量、会社名(屋号等)を付す
- 日本薬局方に収載されているものは、収載されている名称を一般的名称とする
- 「塩」「エステル」「水和物」等の文言は、一般名から省略できる(ただし、他の製剤との混同を招かない場合に限る)
- 剤型は日本薬局方製剤総則に収載された剤型を記載する
- 液剤は、「外用」「内用」「うがい用」等を付記する
- 経口投与されない錠剤等は、「外用」「膣用」「吸入用」等を付記し、用法を明確化する
- 錠剤、カプセル剤等は、有効成分の含量を記載する
- 軟膏剤、液剤、顆粒剤、散剤、シロップ剤、点眼剤などで、1回の投与で製剤の一部のみを使用する場合は、濃度を記載する
- 注射剤は、濃度ではなく含量表示を原則とし、基本的には容器あたりの総量表示とする
- 会社名(屋号等)は原則4文字以内で記載する
後発医薬品の商品名変更[編集]
上記通知の発出前に承認されたものは「それまでのブランド名のままでよい」とされてきたが、先発薬との名称類似による誤調剤が頻発し、錯誤を回避するため、2011年(平成23年)12月27日、日本ジェネリック製薬協会は会員各社に対し、2012年(平成24年)1月から、少なくとも毎年10%に相当する品目数を、3年間で一般名に切り替えるよう変更を要請した[13][14]。具体的な変更例としては、
- 長生堂製薬の「セデコパン錠」→エチゾラム0.25/0.5/1.0mg「JG」[* 1]
- 長生堂製薬の「アサシオン錠」→トリアゾラム0.125/0.25mg「CH」[* 2]
- 辰巳化学の「ネスゲン錠」→トリアゾラム0.XX mg「TCK」
- ニプロファーマの「デトメファン15mg」(元は旧ニプロジェネファの製品)→デキストロメトルファン臭化水素酸塩15mg「NP」
- 沢井製薬の「サワテン500mg」→カルボシステイン錠500mg「サワイ」
- テバ製薬の「ムコトロン錠250mg」→カルボシステイン錠250mg「テバ」
などがある[15]。
2015年(平成27年)9月4日、厚生労働省は「医薬品産業強化総合戦略」を発表し、一般名に名称変更しない後発医薬品の独自ブランド品を薬価基準から削除する(調剤報酬に載せないことにより市場から撤退させる)ことを決定し[16]、実施された。
後発医薬品(配合剤)の統一名称[編集]
複数の有効成分を配合した医薬品、すなわち配合剤の場合、一般名と配合量で商品名を表示しようとすると煩雑になる。そのため、日本ジェネリック医薬品・バイオシミラー学会は統一ブランド名称を商標登録し、学会保有商標の使用を有償で許諾している[17]。商標の利用は薬価収載時点から起算して5年間有効とし、期間満了時には更新できる[18]。これは商品名乱立を避けるため学会が各メーカーからの要望を受けて決定しているものだが、メーカーに対する拘束力はない[19]。
2021年9月までに発表された品目は以下の通りで、【 】で特記以外はすべて降圧薬である。販売名は、各統一ブランド名称の後ろに剤型と「会社名(屋号)」がつく。
- 例:シムビコートタービュヘイラー30吸入の日本ジェネリックによるGE販売名は、ブデホル吸入粉末剤30吸入「JG」。
- アイミクス配合錠(イルベサルタン・アムロジピンベシル酸塩)→「イルアミクス(ILUAMIX)」
- アゾルガ配合懸濁性点眼液(ブリンゾラミド・チモロールマレイン酸塩液)→「ブンチモ(BunTimo)」【緑内障・高眼圧症治療剤】
- アトーゼット配合錠(エゼチミブ・アトルバスタチンカルシウム水和物)→「エゼアト (EzeAto)」【小腸コレステロールトランスポーター阻害剤・HMG-CoA還元酵素阻害剤配合剤】
- エックスフォージ配合錠(バルサルタン・アムロジピンベシル酸塩)→「アムバロ(AMVALO)」
- エムラクリーム(リドカイン・プロピトカイン)→「リドプロ(LIDOPRO)」【外用局所麻酔剤】
- カデュエット配合錠(アムロジピンベシル酸塩・アトルバスタチンカルシウム水和物)→「アマルエット(AMALUET)」【高血圧症・高コレステロール血症治療薬】
- エカード配合錠(カンデサルタン シレキセチル・ヒドロクロロチアジド)→「カデチア(CADETHIA)」
- エプジコム配合錠(ラミブジン・アバカビル硫酸塩錠)→「ラバミコム(Labamicom)」【抗ウイルス化学療法剤(HIV)】
- コディオ配合錠(バルサルタン・ヒドロクロロチアジド)→「バルヒディオ(VALHYDIO)」
- コソプト配合点眼液(ドルゾラミド塩酸塩・チモロールマレイン酸塩液)→「ドルモロール(Dormolol)」【緑内障・高眼圧症治療剤】
- コンプラビン配合錠(クロピドグレル硫酸塩・アスピリン錠)→「ロレアス(LoreAce)」【経費的冠動脈形成術(PCI)が適用される虚血性心疾患】
- ザクラス配合錠(アジルサルタン・アムロジピンベシル酸塩配合剤)→「ジルムロ (ZilMlo)」
- ザラカム配合点眼液(ラタノプロスト・チモロールマレイン酸塩液)→「ラタチモ(Latachimo)」【緑内障・高眼圧症治療剤】
- シムビコートタービュヘイラー(ブデソニド・ホルモテロールフマル酸塩水和物吸入剤)→「ブデホル(BudeForu) 」【ドライパウダー吸入式喘息・COPD治療配合剤】
- スタレボ配合錠(レボドパ・カルビドパ水和物・エンタカポン)→「エカレボ(ECaLevo)」【抗パーキンソン剤】
- ゾシン静注用(タゾバクタムナトリウム・ピペラシリンナトリウム)→「タゾピペ(TAZOPIPE)」【β-ラクタマーゼ阻害薬配合抗菌薬】
- タプコム配合点眼液(タフルプロスト・チモロールマレイン酸塩液)→「タフチモ(TafTimo)」【緑内障・高眼圧症治療剤】
- ツルバダ配合錠(エムトリシタビン・テノホビル ジソプロキシルフマル酸塩)→「エムテノ(EmTeno)」【抗ウイルス化学療法剤(HIV-1)】
- ディレグラ配合錠(フェキソフェナジン塩酸塩・塩酸プソイドエフェドリン)→「プソフェキ(PusoFeki)」【アレルギー性鼻炎】
- デュオトラバ配合点眼液 (トラボプロスト・チモロールマレイン酸塩液)→「トラチモ(TraTimo)」【緑内障・高眼圧症治療剤】
- トラムセット配合錠(トラマドール塩酸塩・アセトアミノフェン)→「トアラセット(TOARASET)」【慢性疼痛/抜歯後疼痛治療剤】
- プレミネント配合錠(ロサルタンカリウム・ヒドロクロロチアジド)→「ロサルヒド(LOSARHYD)」
- ミカムロ配合錠(テルミサルタン・アムロジピンベシル酸塩)→「テラムロ(TERAMURO)」
- ミコンビ配合錠(テルミサルタン・ヒドロクロロチアジド)→「テルチア(TELTHIA)」
- ヤーズ配合錠(ドロスピレノン・エチニルエストラジオール ベータデクス)→「ドロエチ(DroEthi)」【月経困難症治療剤】
- ユニシア配合錠(カンデサルタン シレキセチル・アムロジピン)→「カムシア(CAMSHIA)」
- ルナベル配合錠(ノルエチステロン・エチニルエストラジオール錠)→「フリウェル(FREWELL)」【月経困難症治療剤】
- レザルタス配合錠(オルメサルタン メドキソミル・アゼルニジピン)→「オルアゼ(OLAZE)」
統一ブランド名準備中先発医薬品名一覧も公開されている[20]。
処方箋様式[編集]

2006年4月より処方箋の様式が変更となり、医師が処方箋中の「後発医薬品への変更可」欄に署名(または記名押印)すれば、先発医薬品の商品名が書かれていても後発医薬品に変更して調剤することが可能となった。しかし当該欄の利用頻度が伸びなかったため、2008年4月より、後発医薬品に変更可とし、認められない場合に「後発医薬品への変更不可」欄に署名(または記名押印)する形式に再変更された[21]。
2008年(平成20年)に行われた小規模な調査(医師600人、薬剤師400人)では、半数の医師が処方箋で「後発品への変更不可」とした経験があると答えた[22]。
- 医師が「変更不可」とした薬剤で最も多かったのは抗癌剤、次いで降圧薬、3番目に抗不整脈薬・狭心症薬、4番目に免疫抑制剤であった[23]。
- 「変更可」の処方箋であっても、薬剤師が先発医薬品を選ぶものとして最も多かったのは、抗精神病薬・向精神薬・抗うつ薬、次いで抗癌剤、3番目に催眠鎮静剤・抗不安薬、4番目に免疫抑制剤となった[23]。
その一方で、「後発医薬品への変更不可」の指示は「オーダリングシステムによって誘導されている」との指摘もあり[24]、日本ジェネリック医薬品学会では、これを是正するための仕様書を公表した[25]。
その後、2010年の診療報酬改定により、後発薬処方割合の高い調剤薬局はその割合に応じて後発医薬品調剤体制加算(5〜19点)が算定可能となった[21][26]。さらに2012年の診療報酬改定により、処方箋に医師が一般名で薬剤処方を行うと一般名処方加算(2点)が算定できるようになり[27]、これを受けて2012年には、院外処方診療所のうち61%が一般名処方加算を行うまでに広がった[28]。
現在では、処方箋を調剤薬局へ提出した際、変更不可でない場合で薬局に後発医薬品の在庫があれば、薬局の薬剤師が患者に対して後発医薬品に変更するかを尋ねるようになっている。しかし後発品メーカーのうち、どのメーカーの製剤を選択するかを患者が指定できることは保証されていない(複数のメーカーの在庫がある場合に、当該薬局の責任において患者に選択させることは不可能ではないが、一般的には行われていない)。
一般名処方マスタ[編集]
2012年(平成24年)4月1日以降、後発医薬品が存在する医薬品について、一定のルールに従った「一般名処方」の処方箋を医師が交付した場合に、医療機関は一般名処方加算(後の「一般名処方加算2」)を診療報酬で算定できる様になった。さらに、2016年(平成28年)4月1日以降は、後発医薬品のある全ての医薬品が一般名処方されている場合に「一般名処方加算1」を診療報酬で算定できる様となった。
このルールが、厚生労働省によって定義される「処方箋に記載する一般名処方の標準的な記載(一般名処方マスタ)」で、半月から3か月に一度の頻度で更新されている[29]。
- 内用薬と外用薬
- 【般】+「一般的名称」+「剤形」+「含量」
- 一般的名称(成分名)が同一でも、剤形 and/or 含量が異なると、別の一般名コードが割り振られる。例えば、下記はすべて成分名が「耐性乳酸菌」の別のコードの医薬品で、先発医薬品はエンテロノン-R散のみで他はすべてGE。
- 一般名処方マスタ - 医薬品名 - 一般名の順で、すべて一般名処方加算1の対象(2018年12月14日適用)。
日本におけるAG医薬品[編集]
オーソライズドジェネリック(AG)とは、後発医薬品のうち、先発医薬品メーカーが認定して成分なだけでなく原薬・添加物・製造方法なども同一のもの、あるいは先発医薬品メーカーから特許実施許諾を得て販売されるものをいう[30]。
以下は、2021年2月までに承認を受けたAG(既収載品、未発売、発売時期未定を含む)[31][32][33][34][35][36][37]
- 生物学的同等性(BE)試験が課せられていないパターン1のAGには「★」、課せられているパターン2または3は「☆」、無印は掲載無[38]
- AG/先発品 の順で記載
- 日医工サノフィ/サノフィ
- ★フェキソフェナジン塩酸塩錠「SANIK」- アレグラ錠(第二世代抗ヒスタミン薬)
- ★クロピドグレル錠「SANIK」 - プラビックス錠(抗血小板薬(ADP受容体拮抗薬))
- ロレアス配合錠「SANIK」 - コンプラビン配合錠(経皮的冠動脈形成術(PCI)が適用される虚血性心疾患(クロピドグレル硫酸塩+アスピリンの配合剤))
- 日医工/アステラス製薬
- ソリフェナシンコハク酸塩錠/OD錠2.5mg「日医工」 - ベシケア錠/OD錠(過活動膀胱治療剤)実施権許諾を受けたAG[39]
- 第一三共エスファ/第一三共
- ★レボフロキサシン錠/細粒「DSEP」- クラビット錠(経口抗菌薬)
- オルメサルタンOD錠「DSEP」 - オルメテックOD錠(血圧降下薬(ARB))
- オルアゼ配合錠LD/HD「DSEP」 - レザルタス配合錠(血圧降下薬(オルメサルタン+アゼルニジピンの配合剤))
- シタフロキサシン錠/細粒「DSEP」 - グレースビット錠(経口抗菌薬)
- メマンチン塩酸塩錠/OD錠「DSEP」 - メマリー錠/OD錠(NMDA受容体拮抗 アルツハイマー型認知症治療剤)
- メマンチン塩酸塩ドライシロップ「DSEP」 - メマリードライシロップ(同上)
- 第一三共エスファ/日本ベーリンガーインゲルハイム・アステラス
- テルミサルタン錠「DSEP」 - ミカルディス錠(血圧降下薬(ARB))
- テラムロ配合錠BP/AP「DSEP」 -ミカムロ配合錠(血圧降下薬(テルミサルタン+アムロジピンの配合剤))
- テルチア配合錠BP/AP「DSEP」 -ミコンピ配合錠(血圧降下薬(テルミサルタン+ヒドロクロロチアジドの配合剤))
- 第一三共エスファ/アストラゼネカ・塩野義
- ロスバスタチン錠/OD錠「DSEP」 -クレストール錠(HMG-CoA還元酵素阻害薬)
- 第一三共エスファ/アストラゼネカ
- ゲフィチニブ錠「DESP」 - イレッサ錠(EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺がん)
- ビカルタミド錠/OD錠「DESP」 - カソデックス錠/OD錠(前立腺がん治療薬)
- タモキシフェン錠「DESP」 - ノルバデックス錠(乳がん治療薬)
- アナストロゾール錠「DESP」 - アリミデックス錠(閉経後乳癌治療薬)
- 第一三共エスファ/キッセイ薬品・第一三共
- シロドシン錠/OD錠「DSEP」 - ユリーフ錠/OD錠(前立腺肥大症に伴う排尿障害改善薬)
- 第一三共エスファ/MDS
- エゼチミブ錠「DSEP」- ゼチーア錠(高脂血症治療薬)
- あすか製薬/武田薬品
- カンデサルタン錠「あすか」 - ブロプレス(血圧降下薬(ARB))
- ☆カムシア配合錠LD/HD「あすか」 - ユニシア配合錠(血圧降下薬(カンデサルタン+アムロジピンの配合剤))
- ☆カデチア配合錠LD/HD「あすか」- エカード配合錠(血圧降下薬(カンデサルタン+ヒドロクロロチアジドの配合剤))
- あすか/ノーベルファーマ
- サンド/ノバルティス
- ★バルサルタン錠「サンド」 - ディオバン(血圧降下薬(ARB))
- ゾレドロン酸点滴静注「サンド」 - ゾメタ(骨吸収抑制剤)
- オクトレオチド酢酸塩皮下注「サンド」 - サンドスタチン(ソマトスタチンアナログ製剤)
- アムバロ配合錠LD/HD「サンド」 - エックスフォージ配合錠(血圧降下薬(バルサルタン+アムロジピンの配合剤))
- ★バルヒディオ配合錠MD・EX「サンド」 - コディオ配合錠(血圧降下薬(バルサルタン+ヒドロクロロチアジドの配合剤))
- キョーリンリメディオ/杏林・MSD
- モンテルカスト錠「KM」 - キプレス/シングレア(ロイコトリエン受容体拮抗剤)
- キョーリンリメディオ/杏林
- モメタゾン点鼻液「杏林」[41] - ナゾネックス(定量噴霧式アレルギー性鼻炎治療剤)
- DSファーマプロモ[* 6]/大日本住友製薬
- イルベサルタン錠「DSPB」 - アバプロ錠(血圧降下薬(ARB))
- ブロナンセリン錠/散「DSPB」 - ロナセン錠/散(非定型抗精神病薬)[42]
- ☆メトホルミン塩酸塩錠MT「DSPB」 - メトグルコ(ビアグナイド系経口血糖降下剤)
- サンドファーマ/GSK
- ★バラシクロビル錠/顆粒「SPKK」 - バルトレックス(抗ウイルス化学療法剤)
- ★パロキセチン「SPKK」 - パキシル(SSRI)
- ★スマトリプタン「SPKK」 - イミグラン(片頭痛治療剤)
- ニプロESファーマ/田辺三菱
- ベポタスチンベシル酸塩錠「タナベ」 - タリオン(H1受容体拮抗剤)
- 岡山大鵬薬品/大鵬薬品工業
- ホリナート錠「タイホウ」 - ユーゼル(還元型葉酸製剤)
- エスワンタイホウ配合OD錠T - ティーエスワン(代謝拮抗剤)
- パロノセトロン静注/点滴静注バッグ「タイホウ」」 - アロキシ静注/点滴静注バッグ(5-HT3受容体拮抗型制吐剤)創製元のスイスのヘルシングループから許諾を得たAG[43]
- 大塚製薬工場/大塚製薬
- ★レバミピド錠「オーツカ」 - ムコスタ(胃炎・胃潰瘍治療剤)
- 持田製薬販売/持田製薬
- ジエノゲスト錠「モチダ」 - ディナゲスト(子宮内膜症治療剤)
- 大蔵製薬/MeijiSeikaファルマ
- ★セフジトレンピボキシル錠「OK」 - メイアクト(経口セフェム系抗菌薬)
- 協和キリンフロンティア/協和発酵キリン
- ダルベポエチンアルファ注シリンジ「KKF」 - ネスプ注射液(腎性貧血)
- バイオシミラー(バイオ後続品、BS)ではなくAGとして。バイオ医薬品のAGは国内初で、バイオセイム[44]または、オーソライズド・バイオシミラー(ABS)[45][46]と呼ばれる。
- 適応は「腎性貧血」のみで、「骨髄異形成症候群(MDS)に伴う貧血」は再審査期間(2024年12月まで)などが終了したら追加取得を目指す[47]。
- 旭化成シンメッド/旭化成ファーマ
- 武田テバファーマ/武田テバ薬品
- ☆ランソプラゾールOD錠「武田テバ」 - タケプロンOD錠(プロトンポンプ阻害薬(PPI))
- ボグリボース錠/OD錠「武田テバ」 - ベイス錠/OD錠(食後. 過血糖改善剤)
- ピオグリタゾン錠「武田テバ」- アクトス錠(インスリン抵抗性改善剤-2型糖尿病治療剤-)
- 武田テバファーマ/GSK
- レボセチリジン塩酸塩錠「武田テバ」- ザイザル錠(持続性選択H1受容体拮抗・アレルギー性疾患治療剤)
- デュタステリドカプセルAV「武田テバ」- アボルブカプセル(5α還元酵素阻害薬 前立腺肥大症治療薬)
- 武田テバファーマ/武田薬品工業
- ジルムロ配合錠LD「武田テバ」- ザクラス配合錠LD/HD(持続性AT1レセプターブロッカー/持続性Ca拮抗薬配合剤)
- 参天アイケア/参天製薬
- ドルモロール配合点眼液「SEC」[49] - コソプト配合点眼液(緑内障・高眼圧症治療薬(ドルゾラミド塩酸塩+チモロールマレイン酸塩の配合剤))
- ファイザー/アステラス
- ★セレコキシブ「ファイザー」[50] - セレコックス(非ステロイド性消炎・鎮痛剤(COX-2選択的阻害剤))
- ファイザーUPJ/ヴィアトリス製薬[51]
- ★プレガバリンOD錠「ファイザー」- リリカOD錠(疼痛治療剤/神経障害性疼痛・繊維筋痛症)
- ★アムロジピン錠/OD錠「ファイザー」- ノルバスク錠/OD錠(高血圧症・狭心症治療薬/持続性Ca拮抗薬)
- ★ドキサゾシン錠「ファイザー」- カルデナリン錠(血圧降下剤)
- ★エレトリプタン錠「ファイザー」-レルパックス錠(5-HT1B/1D受容体作動型片頭痛治療剤)
AGかどうか開示されていないGE
- サンド/ノバルティス
承認取得されているAG
- アスペンジャパン/GSK[53]
先発医薬品との違い[編集]
後発医薬品と先発医薬品では、有効成分の含有量は同一である[54]。このことは生物学的同等性試験によって保証されているが、一方で、後発医薬品の副成分(添加物や基材)、剤形、製法は先発医薬品とは異なる[55][56]。これは、物質特許の期限は切れていても、製法特許や製造特許、用途特許が切れていない、またはそれらの期限が切れていても、製造工程の細部まで公開されないといった事情があるため、先発薬企業が持っている特許を迂回して製造するのである。
同じ成分の先発医薬品と後発医薬品で効能・効果(適応症)が異なることがある[57]。これは、先発医薬品が有する用途特許が残っており、それが原因で同じ成分の後発医薬品がその効能・効果を謳えないことに起因する。
さらに、実際に使用した患者や医師からは、効果に違いがあるとの意見がある[58][59]。また、薬の添加物や剤形が変わることにより、例えば薬の溶出速度が変化したり、有効成分が分解されやすくなったり、溶解速度が若干遅くなっていたり[60]、先発品には無い副作用やアレルギー反応が出ることがある[61][62]。
内服薬の飲みやすさ、外用剤のはがれやすさ、塗布薬や点眼薬の効き目にも、先発医薬品とは違いが生じるため[59][63][64]、後発医薬品は「先発医薬品と同等製品」と謳っていても、決して「先発医薬品と同一製品」ではない[56]。特に外用薬については、薬局薬剤師を対象にした厚生労働省「診療報酬改定結果検証部会」のアンケートでも、「後発品に変更しづらい剤形」として上位に挙がっている[64]。
この点について日本ジェネリック医薬品・バイオシミラー学会は「添加物や剤形の変更は先発医薬品でも行われていることから、ジェネリック医薬品に限らず先発医薬品でも同様に起こりうる」と反論しているが、その具体例は挙げられていない。
なお同一成分ながら、患者の疾病に対する効能・効果を有していない後発医薬品を処方または調剤した場合、レセプト審査の際に「不適切な薬剤を投与した」として、医療機関の診療報酬や調剤報酬が減点される。
後発医薬品の使用にあたっての問題点・課題[編集]
本節では主に厚生労働省が2008年に取りまとめたアンケート調査結果を基に記述する[65]。
後発医薬品の供給体制[編集]
- 薬局において、先発品を好む傾向から後発医薬品を用意していたとしてもデッドストックとなる確率が高くなる。
- 下記の品質確保に伴う生産中止や、新型コロナ対応による急激な需要増大に伴う出荷調整などの事態が発生している。
- 原材料の値上げなどによって製造コストが上がっているにも関わらず販売価格が上がらないため、増産のため新たに設備投資をしても回収することができない[66]。
- 2005年4月に施行された改正薬事法により、他社が開発した薬剤データを基に共同開発が可能となったことで参入障壁が下がり新規参入が増えたことによる価格競争の激化と早期撤退[67]。
後発医薬品の品質問題(後述)[編集]
- 小林化工の抗真菌薬「イトラコナゾール」に睡眠導入薬「リルマザホン」の誤混入により、死亡を含む健康被害事例など、社内承認規格の不適合、承認書にない工程の実施、試験の実態と手順との齟齬、書類不備などの事例が発生している。
- 後発医薬品メーカーの中には、自社の成長スピードに品質管理体制が対応できない事例を認める(日医工の例)など、臨床効果の評価判定が不十分な例がある。
- その結果、効果・安全性が必ずしも推奨できない状況となっている。
後発医薬品メーカーによる情報提供不足[編集]
- 後発医薬品のデータの情報量が少ないので、薬剤師側が安心して勧めることができない。また後発医薬品の臨床データがないという現状がある。
- 後発医薬品メーカーは、先発品からの切り替えに際して起きた有害事象などのデータの蓄積、情報提供ができる体制を整えてほしい。
- 後発医薬品メーカーの MR の数が少ない。
先発品と後発医薬品との価格差[編集]
- 後発医薬品のある処方内容が全体の一部でしかないので、思っているほど負担額が下がらず、わずかな差なら先発品を、という患者も多い。
後発医薬品の品質問題[編集]
前述のとおり、後発医薬品はかつては「ゾロ薬」と呼ばれ、「安かろう悪かろう」とされていた時代もあった[68]。しかし院内調剤が主流であった1990年代までは、薬価差益[69]が大きく病院や診療所にとって、経営利益を増すため採用されていた。
その後は医薬分業が進んだこと、後発医薬品の品質が向上かつ安定してきたこと、また先に述べた公的健康保険制度の医療費削減という大きな課題から、日本国政府主導の『骨太の方針』により、後発医薬品を大々的に推進するようになった。
後発医薬品は有効成分や効能については基本的に先発医薬品(新薬)と同等としているが、製造法や品質管理は製造会社により、様々に異なる。このため日本の製薬会社により製造された後発医薬品においても、2020年(令和2年)に小林化工による死亡を含む大規模な健康被害の発生例がある[68]。
また、後発医薬品企業で日本最大手の日医工においても、製品の自主回収が相次いで発出され、2020年(4月1日から12月11日現在)では35医薬品(クラスII該当、承認規格または社内規格不適合、承認書にない工程を実施、試験の実態と手順に齟齬、書類不備など)に上った[68]。日医工は、品質試験で基準に満たずに廃棄すべき錠剤を再利用していた件について、多くの品目を製造してスケジュールが厳しくなっていたことも理由の一つとして挙げている[70]。
これらの事案に対し、日本ジェネリック医薬品・バイオシミラー学会は、2020年(令和2年)12月18日に「ジェネリック医薬品関連で発生している各種回収事案についての緊急声明文」を発表[68]。その中で「ジェネリック医薬品の信頼を損ねる事案が相次いで発生したことに、大きな失望を禁じ得ない」「少数の企業の不祥事により、後発医薬品の努力と信頼が崩れることは、決して容認できない」と激しく非難するとともに[68]、小林化工・日医工の2社に対し事案内容の詳細な公表、第三者委員会による調査受け入れ、再発防止策の立案とその公表を、同学会として強く要望するに至った[68]。また一連の事態について、日本経済新聞は2021年(令和3年)3月6日に「相次ぐ不祥事は、薬価引き下げや薄利多売[71]の構造的課題を抱えながら、拡大路線に走ってきた業界のひずみを浮き彫りにしている」と分析・報道している[72]。
2020年12月に判明した小林化工による健康被害問題をきっかけに、他社の医薬品の事故や品質問題も次々明るみにとなり、さらに回収や出荷停止が相次ぐ展開となった。日刊ゲンダイの取材において、ある大手薬局チェーンの担当者は「毎日回収の情報があり、卸も薬局も対応に追われ大混乱で、経験した事がないレベルの事態です。そのうえ、オリンピック開催によって、観客や選手の新型コロナ感染だけではなく熱中症などでも医薬品の需要が増えたら、とてもじゃありませんが耐え切れそうにない。命に抱わる深刻な健康被害も起きかねない」と応じ、ある医薬品卸の関係者も「安定確保医薬品と言って、その医薬品が無いと命の危険に直結し、かつ簡単に代替の効かないような薬を(2021年)6月1日に厚生労働省がリストアップしたところです。全部で506成分あって、特に優先度が高いものだけで21成分。この中で新型コロナ治療やワクチン副反応対応で対処療法として使う可能性があるものが13成分ほどあります。また現在流通に問題があったり製薬会社の出荷に不安があったりして、特に心配なものが18成分はある。オリンピック・パラリンピックで多くの人が集まって新型コロナがまた流行したり何か大きな事故があったりしたら、既に現段階で逼迫しているのですから、あっという間に命に直接関わる医薬品の供給がストップするかもしれません。その時にはもはや地域や、薬の内容は関係なく、日本中大混乱になりかねません。絶対起こしてはならない恐ろしい事態です。医薬品業界としては、昨年より今年の方が危ない状態なんですよ。なのに命がけで綱渡りをする必要があるでのでしょうか」と答えている[73]。
ジェネリック医薬品の品質に懐疑的な考えの病院では、必要以上にジェネリックを導入しない方針を取るケースがある[74]。
後発医薬品と生活保護[編集]
生活保護世帯は、医療扶助により自己負担なしの全額公費負担医療となっている[75]。そのため、厚生労働省は2008年、被保護者に対し後発医薬品を事実上強制する通知を地方公共団体に発出した[76][77]。この通知は、受給者が正当な理由なく後発医薬品への変更指示に従わない場合は、生活保護の停止や廃止をするというもので[76][77]、批判を受けて後に撤回することとなった[76][77]。
その後、2014年10月、財務省は医療扶助費を削減するため、生活保護受給者に後発医薬品を使用するよう求める方針を固め、厚生労働省との折衝を開始すると報道された[78]。
2018年(平成30年)の生活保護法改正により、「医師が医学的知見に基づき後発医薬品を使用することができると認めたものについては、原則として、後発医薬品によりその給付を行うものとする(生活保護法第34条3項)[79][80]」として、生活保護における後発医薬品の調剤が原則化された[80][81][82]。医師の判断により後発医薬品を使用可能(一般名処方を含む)とした処方箋を持参した受給者に対し、薬剤師は後発医薬品について説明した上で、原則として後発医薬品を調剤する[80]。また受給者が先発医薬品を希望する場合はいったん調剤するが、福祉事務所は受給者に対し後発医薬品の使用を促すこととする[80]。同年10月1日から施行された[82][83]。
日本の主要後発医薬品メーカー[編集]
日本において、後発医薬品を販売している企業は196社(2017年4月6日現在)であるが、国内売上高の1000億円以上は、沢井製薬・日医工の2社のみである(2017年度)。500億円以上では、東和薬品・ニプロ・明治HD・三和化学研究所を加えて6社のみで、沢井製薬・日医工・東和薬品の3社は「ジェネリック御三家」と呼ばれる。なお196社の中には、先発企業が後発医薬品も販売している事例も含む。
「」は、成分名の後に付けられる各メーカーの略称。
- 旭化成シンメッド(旭化成ファーマの100%子会社)- 「旭化成」
- あすか製薬(武田薬品工業が筆頭株主)- 「あすか」
- あすかActavis製薬(あすかアクタヴィス) - 「AA」
- アルフレッサ ファーマ(アルフレッサホールディングス子会社) - 一部他社から販売受託している薬品がある。自社製造分の略称は「AFP」
- 大塚製薬工場(大塚製薬子会社) - 「オーツカ」
- 大原薬品工業 - 「オーハラ」
- 岡山大鵬薬品(大鵬薬品工業子会社) - 「タイホウ」
- 科研製薬 - 「NS」「科研」
- 共創未来ファーマ(東邦ホールディングスの子会社) - 「共創未来」、富士フイルムファーマからの承継は「FFP」
- キョーリンリメディオ(キョーリン製薬ホールディングス傘下、杏林リメディオ) - 「杏林」、「KM」(AG)
- 共和薬品工業[* 8] - 「アメル」
- ケミックス - 「CHM」
- 健栄製薬 - 「ケンエー」
- 小林化工 - 「KN」「MEEK」[* 9]
- 沢井製薬 - 「サワイ」「SW」
- サンド(ノバルティスホールディングジャパン子会社) - 「サンド」[* 10]
- シオノケミカル - 「SN」または「シオノ」
- 全星薬品工業 - 「ZE」
- 第一三共エスファ(第一三共の子会社) - 一部他社から販売受託している薬品がある。自社製造分の略称は「DSEP」
- 大興製薬 - 自社製品の後発医薬品のほか、他メーカーのOEM生産も行っている。「DK」
- ダイト - 自社製品の後発医薬品のほか、他メーカーへの原薬供給も行っている。「ダイト」
- DSファーマバイオメディカル(大日本住友製薬の子会社、旧住友製薬バイオメディカル) - 「DSPB」
- 辰巳化学 - 「TCK」[* 13]
- 鶴原製薬 - 「ツルハラ」
- テバ・ファーマシューティカル・インダストリーズ
- 東亜薬品 - 「TOA」
- 東和薬品 - 「トーワ」
- 日医工 - 「日医工」
- 日新製薬 - 点眼薬のジェネリック医薬品などを手がける。「日新」
- ニプロ
- 日本ケミファ - 「ケミファ」
- 日本化薬 - 「NK」
- 日本調剤グループ
- 日本点眼薬研究所 - 「日点」
- 日本薬品工業 - 「NPI」
- ファイザー - 「ファイザー」
- 富士製薬工業 - 「F」
- 富士フイルムファーマ - 富士フイルムホールディングス系列(子会社の富士フイルムが8割を出資)。他社へ製造委託ないしは他社からの販売受託している薬品もあった。自社製造分の略称は「FFP」。2019年3月31日をもって解散し、ジェネリック医薬品については共創未来ファーマに製造販売承認の承継あるいは販売移管[84]。
- マイラン製薬、マイランEPD - 「マイラン」「MYL」
- Meiji Seika ファルマ - 「明治」
- 持田製薬販売(持田製薬子会社) - 「モチダ」
- 祐徳薬品工業 - 「ユートク」
- 陽進堂 - 「YD」
- 全星薬品工業 -「ZE」
先発企業も後発医薬品を「主要事業のひとつ」として位置付けており、たとえば第一三共はインドの製薬会社・ランバクシーを買収[85]して後発医薬品事業に新規参入し、2010年4月には日本国内での後発医薬品の子会社となる第一三共エスファを設立し、同年10月より営業を開始した。
2016年4月には、武田薬品工業が長期収載品事業を会社分割により大正薬品工業(現在の武田テバ薬品)へ継承する代わりに、大正薬品工業の親会社であるテバ製薬の株式交付を、武田薬品工業が受けたことでテバ製薬が合弁会社となり、同年10月に武田テバファーマに社名変更した。
2014年1月1日には、ファイザー製薬が「エスタブリッシュ医薬品事業部門」を含む4部門編成となり、特許が切れた医薬品をエスタブリッシュ医薬品と呼んでいる[86][出典無効]。ファイザーは2019年7月29日、特許切れ医薬品事業を分離し、後発医薬品大手の米マイランと統合することで合意したと発表した[87]。
脚注[編集]
- ^ 長生堂製造商品の販売が日本ジェネリック担当であり、日本ジェネリックの製造品にエチゾラムがなかったことから、CHではなく、JGがつけられている。
- ^ 長生堂製造商品の販売が日本ジェネリック担当だが、日本ジェネリックが他社に製造委託した商品にすでにトリアゾラム「JG」があったため、JGではなく、CHがつけられている。
- ^ 旧・エントモール散
- ^ 旧・コレポリーR 散 10%
- ^ ノーベルファーマ初のAG。
- ^ 大日本住友製薬の連結子会社のDSファーマバイオメディカルを、DSファーマバイオメディカルが吸収合併し2019年4月に社名変更。
- ^ テリボンのAG販売目的で設立した100%子会社。2019年6月発売
- ^ インドのジェネリック医薬品メーカー・ルピン社の傘下だった
- ^ 「MEEK」はMeiji Endorsable and Essential generics made by Kobayashiの意で、Meiji Seikaファルマと共同販売している物もある。
- ^ かつては「SND」を使用。
- ^ 2021年9月1日、サンドと統合し社名変更
- ^ かつては「アスペン」を使用。
- ^ かつては「タツミ」を使用。
- ^ かつては「TYK」を使用(ただし、興和テバから継承した製品分)。
- ^ 武田テバ薬品、武田テバファーマからの製造販売承認承継品を含む。
- ^ かつて、長生堂製薬に製造委託し、旧田辺製薬販売が販売していた薬品につけられた「タナベ」は、資本関係解消などに伴い、順次「CH」ないし「JG」に変更された。自社製造分は従来通り「タナベ」で、現在のニプロESファーマへの商号変更後も「タナベ」のままとなる。
- ^ 販売事業は、2013年4月以降は日本ジェネリックが担当している関係上、一部の商品は「JG」となっているものもある。
出典[編集]
- ^ a b c Health at a Glance 2013 (Report). OECD. 21 November 2013. pp. 104–105. doi:10.1787/health_glance-2013-en. ISBN 978-92-64-205024。
- ^ a b “【Factに迫る!】ジェネリック医薬品の数量シェアについて ~国の公表値とGE薬協の公表値~”. 日本ジェネリック製薬協会. 2021年8月閲覧。
- ^ a b c d e OECD Economic Surveys: Japan 2009 (Report). OECD. 13 August 2009. pp. 115–116. doi:10.1787/eco_surveys-jpn-2009-en. ISBN 9789264054561。
- ^ a b 80%時代に向けての活動と今後の課題~ジェネリック製薬企業・業界団体~ 日本ジェネリック製薬協会(2017年7月18日) (PDF)
- ^ 厚生労働省 2012, pp. 21–22.
- ^ a b c 後発医薬品(ジェネリック医薬品)の使用促進について厚生労働省
- ^ a b 薬価基準改定の概要 (PDF) 厚生労働省
- ^ a b OECD Economic Surveys: Japan 2015, OECD, (2015-04), pp. 129-130, doi:10.1787/eco_surveys-jpn-2015-en, ISBN 9789264232389
- ^ 『週刊ダイヤモンド』2015年6月13日号
- ^ 医薬品価格調査(薬価本調査)の速報値について (PDF) 中医協(2018年12月5日)
- ^ 厚生労働省 2012, pp. 22–23.
- ^ “医療用後発医薬品の承認申請にあたっての販売名の命名に関する留意事項について(薬食審査発第 0922001号)” (PDF). 厚生労働省医薬食品局審査管理課長(千葉県薬務課のアーカイブ) (2015年9月22日). 2015年12月25日閲覧。
- ^ “ジェネリック医薬品販売名称の一般的名称への変更について(GE薬協会発第 100号)” (PDF). 日本ジェネリック製薬協会会長(厚生労働省のアーカイブ) (2011年12月27日). 2015年12月25日閲覧。
- ^ “ジェネリック医薬品販売名称の一般的名称への変更 日本ジェネリック製薬協会が会員へ通知” (2011年12月29日). 2014年10月20日閲覧。
- ^ 後発医薬品ではないが、沢井製薬の「ノーマルン」が、2014年12月から翌年9月末にかけて、名称を『アミトリプチリン塩酸塩錠10mg(25mg)「サワイ」』に変更されたケースがある。
- ^ “医薬品産業強化総合戦略〜グローバル展開を見据えた創薬〜” (PDF). 厚生労働省 (2015年9月4日). 2015年9月7日閲覧。
- ^ “配合剤ジェネリック医薬品の統一ブランド名称について”. 日本ジェネリック医薬品学会 (2013年8月1日). 2015年12月25日閲覧。
- ^ “商標利用規約兼同意書” (PDF). 日本ジェネリック医薬品学会. 2015年12月25日閲覧。
- ^ “日本ジェネリック医薬品学会、配合剤の統一ブランド名称案発表”. 日経ドラッグインフォメーション (2014年7月14日). 2019年7月30日閲覧。
- ^ “統一ブランド名準備中先発医薬品名一覧” (PDF). 日本ジェネリック医薬品・バイオシミラー学会 (2019年3月20日). 2020年12月28日閲覧。[リンク切れ]
- ^ a b “ジェネリック医薬品(後発医薬品)の使用促進について”. 厚生労働省. 2014年1月13日閲覧。
- ^ 江本 哲朗 (2008年9月11日). “「後発品変更不可」とした薬、「あり」が約半数”. 日経メディカル (日経BP) 2019年11月29日閲覧。
- ^ a b 江本 哲朗 (2008年9月12日). “「変更不可」にするのは、どんな薬?”. 日経メディカル (日経BP) 2019年11月29日閲覧。
- ^ 「後発医薬品への変更調剤を推進するための処方オーダリングシステムの仕様に関する研究」, 瀬戸僚馬 他, 『ジェネリック研究』 第3巻, P.36-42, 2009年
- ^ ジェネリック医薬品の処方を推進するための処方オーダリングシステム追加仕様書 (PDF)
- ^ 「後発品調剤、7割が「積極的に取り組んでいる」」『日経ドラッグインフォメーション』2011年9月8日。
- ^ 厚生労働省 2012, pp. 24–25.
- ^ 「院外処方の診療所の約6割が一般名処方加算を算定」『日経ヘルスケア』2012年9月14日。
- ^ 医療保険が適用される医薬品について 厚生労働省
- ^ お薬のしおり No.193 東京医科大学病院薬剤部、2022年7月21日閲覧。
- ^ “? 新薬メーカー オーソライズド・ジェネリックで後発品市場の主役に―第一三共 競合品も取り込み一気呵成”. Answers (2018年3月1日). 2018年3月7日閲覧。
- ^ “? バイオ版オーソライズド・ジェネリックが承認―注目の薬価は?バイオシミラー市場へのインパクトは?”. Answers (2018年8月23日). 2018年11月26日閲覧。
- ^ 後発品承認簿 2019/2/15 日刊薬業(じほう)(2019-02-18) (PDF)
- ^ “? 新薬メーカー オーソライズド・ジェネリックで後発品市場の主役に―第一三共 競合品も取り込み一気呵成”. Answers (2018年3月1日). 2018年3月7日閲覧。
- ^ “薬価基準収載品目リスト及び後発医薬品に関する情報について(令和2年6月19日適用)”. Answers (2020年6月19日). 2020年6月30日閲覧。
- ^ “プレガバリンやリバスチグミンの後発品が薬価収載”. 日経DI. (2020年12月11日) 2020年12月14日閲覧。
- ^ “厚労省・後発品承認 初後発は12成分 サインバルタ後発品に17社40品目”. ミクスonline (2021年2月16日). 2021年4月16日閲覧。
- ^ 医療用医薬品最新品質情報集(ブルーブック)データシート 一覧 ジェネリック医薬品品質情報検討会
- ^ オーソライズドジェネリック『ソリフェナシンコハク酸塩錠/OD 錠「日医工」』製造販売承認取得および実施権許諾に関するお知らせ 日医工(2021年2月15日) (PDF)
- ^ ルナベル配合錠LD及び同ULDのオーソライズド・ジェネリックについて ノーベルファーマ(2018-08-15) (PDF)
- ^ “キョーリンリメディオ、モメタゾン点鼻液50μg「杏林」56噴霧用・112噴霧用を発売”. 日経新聞. (2019年6月14日) 2019年7月30日閲覧。
- ^ “抗精神病薬「ロナセン」のジェネリック版「ブロナンセリン」が承認”. PULSE(Media Innovation) (2019年2月17日). 2019年2月18日閲覧。
- ^ 5-HT3(セロトニン)受容体拮抗型制吐剤『パロノセトロン静注』、『パロノセトロン点滴静注バッグ』製造販売承認取得のお知らせ 岡山大鵬薬品株式会社、ヘルシングループ(2021年2月15日) (PDF)
- ^ “バイオ版オーソライズド・ジェネリックが承認―注目の薬価は?バイオシミラー市場へのインパクトは?”. AnswerNews (2018年8月23日). 2019年3月27日閲覧。
- ^ “ネスプ(ダルベポエチン)の作用機序とバイオセイム・ABS【CKD・腎性貧血】”. 新薬情報オンライン (2019年3月18日). 2019年3月27日閲覧。
- ^ “ABSって?(オーソライズドバイオシミラー)”. 日医工 (2018年7月31日). 2019年3月27日閲覧。
- ^ “ネスプのバイオセイム、来月5日発売へ 協和キリン子会社、「できるだけ多くで切り替えを」”. 日刊薬業. (2019年7月29日) 2019年7月30日閲覧。
- ^ “旭化成ファーマ、テリボンAGで新会社設立 承認取得も収載・発売時期は検討中”. 日刊薬業(じほう) (2019年2月18日). 2019年2月18日閲覧。
- ^ “参天グループ 緑内障・高眼圧症治療薬コソプトのAGの承認取得 発売は検討中”. ミクス Online (2017年8月25日). 2019年12月27日閲覧。
- ^ “ファイザー、セレコキシブ錠でAG市場に参入 先発医薬品と同一の品質を有する医薬品で治療する選択肢を提供し、増大するNCDの負担軽減に貢献”. ファイザー株式会社 (2020年3月16日). 2020年6月30日閲覧。
- ^ “ヴィアトリス製薬 リリカなど14製品の製造販売承認承継 AG含む18製品の販売権移管”. ミクスonline (2021年9月2日). 2021年9月7日閲覧。
- ^ a b “厚労省 後発品147品目を承認 シムビコートGEに3社、テリボンにAG ”. ミクス Online. (2019年2月18日) 2019年7月30日閲覧。
- ^ “GSK 日本市場にAG投入へ GEメーカー・アスペンジャパンから販売”. ミクスonline. (2014年10月10日) 2021年3月17日閲覧。
- ^ 厚生労働省 2012, pp. 4–5.
- ^ 厚生労働省 2012, p. 4.
- ^ a b 多田智裕 (2012年5月22日). “Vol.494 ジェネリックは「先発品と同じ薬」ではありません。短絡的すぎる「薬剤費の抑制=ジェネリックの使用促進」という図式” (HTML). 医療ガバナンス学会. 2019年8月18日閲覧。
- ^ 稲葉直人 青柳誠 棚瀬健仁 前田益孝 椎具達夫 戸村成男 神田英一郎「慢性腎臓病(CKD)患者の保存期における球形吸着炭の評価 : 先発医薬品クレメジンと後発品メルクメジンの比較」The Japanese journal of nephrology 51(1), 51-55, 2009-01-25
- ^ 「後発医薬品の適正使用と医薬品添加物に関する研究」『YAKUGAKU ZASSHI』第127巻第12号、日本薬学会、2007年12月、2035-2044頁、2015年1月27日閲覧。
- ^ a b “ジェネリックは効果に乏しい? 医師の6割弱が「そういうこともある」 メドピア調査”. ミクスonline. (2012年8月6日) 2019年11月17日閲覧。
- ^ 「後発医薬品から先発医薬品へ戻った事例 : ロキソプロフェンナトリウム錠」(PDF)第30巻、第一薬科大学研究年報、2014年3月31日、2019年8月18日閲覧。
- ^ 「ジェネリック医薬品の副成分にアレルギー反応を呈したと考えられた2歳男児例」『小児科』第50巻第8号、2010年7月1日、1091-1093頁、2015年1月27日閲覧。
- ^ “後発医薬品への変更で肝機能障害が発現した一症例”. 第33回日本病院薬剤師会近畿学術大会要旨集. (2012-01).
- ^ 安部正敏「皮膚疾患の外用療法」『週刊医学界新聞』、医学書院、2016年4月18日、2016年8月23日閲覧。
- ^ a b 大谷道輝 (2020年1月20日). “外用薬の後発品選び、薬剤師は正しい情報を”. 日経ドラッグインフォメーション (日経BP) 2020年6月26日閲覧。
- ^ “後発医薬品の使用にあたっての問題点・課題等” (PDF). 厚生労働省. 2022年8月10日閲覧。
- ^ “https://answers.ten-navi.com/pharmanews/24979/”. AnswersNews. (2023年2月9日)
- ^ 坂巻弘之 (2023年7月3日). “ジェネリック医薬品の品不足 原材料の他国依存に限界”. エコノミスト Online
- ^ a b c d e f ジェネリック医薬品関連で発生している各種回収事案についての緊急声明文 日本ジェネリック医薬品・バイオシミラー学会、2020年12月18日、2020年12月27日閲覧
- ^ 薬価差益 - コトバンク、2021年2月4日閲覧
- ^ 日医工 廃棄すべき錠剤再加工 業務停止命令『読売新聞』2021年(令和3年)3月4日朝刊、13版、31面
- ^ 薄利多売 - コトバンク、2021年3月6日閲覧
- ^ 大崩貴之 (2021年3月6日). “後発薬、拡大路線のひずみ 日医工、不正管理で業務停止命令 品目多数で欠品回避か(会員登録制)”. 日本經濟新聞 (日本経済新聞社) 2021年5月6日閲覧。
- ^ “医薬品消える緊急事態 薬剤師悲鳴「東京五輪なんて無理」”. 日刊ゲンダイ (2021年6月13日). 2021年6月13日閲覧。
- ^ ジェネリック処方に慎重な大学病院院長「患者中心の医療を考えた結果です」|NEWSポストセブン
- ^ “生活保護法による医療扶助・介護扶助”. 東京都福祉保健局. 2020年12月27日閲覧。
- ^ a b c “ジェネリック使わないと生活保護ダメ 厚労省通知”. asahi.com. 朝日新聞社 (2008年4月29日). 2008年5月1日時点のオリジナルよりアーカイブ。2020年12月28日閲覧。
- ^ a b c “生活保護受給者への後発医薬品の使用通知、厚労省が撤回”. asahi.com. 朝日新聞社 (2008年4月30日). 2008年5月1日時点のオリジナルよりアーカイブ。2008年5月1日閲覧。
- ^ “生活保護者に後発薬…「医療扶助費」圧縮へ”. 読売新聞 ヨミドクター. 読売新聞社 (2014年10月24日). 2014年10月24日閲覧。[リンク切れ]
- ^ “生活保護法(昭和二十五年法律第百四十四号)”. e-Gov法令検索. 総務省行政管理局. 2020年12月27日閲覧。
- ^ a b c d 改正生活保護法について (PDF) 社会・援護局保護課(厚生労働省)
- ^ “・生活保護の医療扶助における後発医薬品の使用促進について(◆平成30年09月28日社援保発第928006号)”. www.mhlw.go.jp. 厚生労働省. 2020年7月2日閲覧。
- ^ a b “生活保護法改正による後発医薬品の使用原則化について(生活保護法指定医療機関・指定薬局の皆様へ)”. 東京都福祉保健局. 2020年12月27日閲覧。
- ^ “生活保護の後発品原則化に思う「悪意なき悪意」”. 日経DI online (2018年10月17日). 2020年7月3日閲覧。
- ^ “会社解散および製品の製造販売承認の承継・販売移管に関するお知らせ”. 富士フイルムファーマ株式会社 (2018年7月27日). 2019年5月7日閲覧。
- ^ “第一三共に巨額特損、インド製薬会社の買収で大誤算”. 東洋経済 (2009年1月16日). 2015年10月26日閲覧。
- ^ エスタブリッシュ医薬品事業 ファイザー製薬
- ^ “米ファイザー、特許切れ医薬品事業をマイランと統合で合意”. 朝日新聞デジタル. (2019年7月30日) 2019年12月26日閲覧。
関連項目[編集]
外部リンク[編集]
- 日本ジェネリック医薬品・バイオシミラー学会
- かんじゃさんの薬箱 - 患者様用ジェネリック医薬品情報システム
- 日本ジェネリック製薬協会 - 旧・医薬工業協議会
- 安心してご利用ください ジェネリック医薬品 - 政府広報オンライン
- 厚生労働省
