後発医薬品
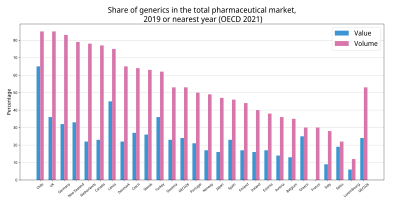
青は金額比、赤は数量比[1]。
後発医薬品(こうはついやくひん)、ジェネリック医薬品(英: generic drug, generic medicine[2])とは、先発医薬品(新薬)の独占的販売期間の終了後に発売される、先発医薬品と同じ有効成分で効能・効果、用法・用量が同一とされており、先発医薬品に比べて低価格な医薬品である。医薬品の有効成分は一般名 (generic name) で表せることから「ジェネリック医薬品」と呼ばれる。後発薬、GE薬といった略称で呼ばれることもある。
新薬の創薬には多大な開発経費がかかるため、その知的財産権は特許として保護されている[3]。後発医薬品は、先発医薬品の特許期間(日本では20年から25年[3][4])終了後に発売される[3][4]。さらに、先発医薬品の製造販売承認後の再審査期間(日本では6年から10年[3])終了後でなければ、特許が切れていても後発医薬品の承認申請はできない[3]。

かつての日本では、医師の間で「ゾロ」「ゾロ品」「ゾロ薬」などと称され[5]、先発医薬品の特許権が消滅したとき、後発医薬品がゾロゾロと出てくることから、そう呼ばれていた[* 1]。
かつて、日本の後発医薬品の普及率は欧米に比べ遅れていたが[2]、厚生労働省主導で普及へ向けての政策や診療報酬の見直しが進められた結果、日本における後発医薬品の普及率は、78.3%(2020年12月。数量ベース)[6]となり、欧米と同等の普及率となっている。なお、アメリカ82%、イギリス81%、ドイツ79%、カナダ70%、オランダ69%、デンマーク54%、オーストラリア50%となっている(2013年・数量ベース)[1]。しかし小林化工や日医工でみられたように、後発品メーカーは利益を追求して品質を軽視する傾向があり[7]、厚生労働省職員の講演では「使用促進は拙速だった」と発言されている[8]。
日本における後発医薬品の薬価は、最初の発売時は原則として先発医薬品の7割、その後は薬価改定を受けて先発医薬品の2割程度となる[要出典]。期限切れになった先発医薬品の特許内容を参考として製造されるため、有効成分が同じであっても、後発医薬品は複数の企業から発売されている。
承認申請[編集]
先発医薬品の承認申請には、発見の経緯や外国での使用状況、物理的化学的性質や規格・試験方法、安全性、毒性・催奇性、薬理作用、吸収・分布・代謝・排泄、臨床試験など数多くの試験を行い、26の資料を提出する必要がある。
これに対して、後発医薬品では「規格及び試験方法」「安定性試験」「生物学的同等性試験」の3つの資料と、添付文書記載事項(添付文書案)の提出によって、独立行政法人医薬品医療機器総合機構(PMDA)により審査され、製造承認が下りる。
先発医薬品と比較して、後発医薬品の承認申請資料が少ないのは、有効成分に関する有効性・安全性は、既に先発医薬品において確認されている(毒性試験、薬理試験、臨床試験等)ため、同一の有効成分を使用する後発医薬品では、それらの試験の必要がないとする為である。
この考え方は、アメリカ食品医薬品局 (FDA) 、欧州医薬品庁 (EMA) をはじめ、諸外国でも同様に認められており[9]、後発医薬品の実施試験が少ないからといって、先発医薬品と比べて有効性・安全性・品質が劣ることはないとされている。
生物学的同等性試験[編集]
後発医薬品が、先発医薬品と同等の薬効・作用を持つことを証明するために、後発医薬品の承認申請には、生物学的同等性試験(biological equivalence study, BE試験)のデータが必要になる。
生物学的同等性試験では原則として、ヒト(健常人)に先発医薬品・後発品を投与し、両者の血中濃度推移に統計学的な差がないことを確認する[10]。より具体的には、先発医薬品・後発品を各10〜20名程度の健常人に投与し、一定時間ごとに採血を行い、薬物血中濃度の推移を比較し、両群の間に統計学的な差がないことを示す手法がとられる。ただし、倫理的な面や、製剤特性等の理由から、ヒト以外の動物での試験が認められることもある。
日本では、厚生労働省より通達されている「後発医薬品の生物学的同等性試験ガイドライン」に従って、生物学的同等性試験が行われている。
品質再評価[編集]
1997年4月以降、新薬の承認時には溶出試験規格の認定が義務付けられ、当該医薬品の後発品についても溶出試験規格が求められていたが、それ以前の経口薬には溶出試験規格がない製品もあった。そこで、溶出試験規格がない医薬品のうち、後発医薬品があり、かつ先発医薬品との同等性を設定する必要がある約550成分(約7000品目)を対象として、1997年2月から厚生省が品質の再評価を始めた。
手順としては、対象成分が選定されると先に標準製剤(通常は先発医薬品)に溶出試験の条件を設定し、次いで標準製剤と後発医薬品の溶出試験結果を比較、類似していることが確認されれば、後発医薬品にも溶出試験が設定される。先発医薬品と後発医薬品の溶出挙動が類似しているのであれば、バイオアベイラビリティーに著しい差が生じる可能性はなくなる、という考え方に基づいたものである。
その結果、先発医薬品との溶出同等性が保証されていると考えられている。しかし、薬物濃度の測定にはクロマトグラフィーが多く用いられるが、製造工程が異なり不純物が異なるにも拘らず同一の条件で測定されており、有効成分と不純物が分離されず不純物濃度を有効成分濃度の一部と見做している可能性は否定されない。
オレンジブック[編集]
オレンジブック (Approved Drug Products with Therapeutic Equivalence Evaluations) とは、後発医薬品の使用促進のため米国で発刊されているもので、アメリカ食品医薬品局(FDA)が先発医薬品と後発医薬品の生物学的同等性の判定を行い(生物学的同等性試験)、その治療上の同等性についての評価を掲載したものである。この本の表紙がオレンジ色であることから「オレンジブック」といわれている。
日本版オレンジブックとは「医療用医薬品品質情報集」のことで、上記の品質再評価の経過や結果を掲載したものである[11]。日本版オレンジブックは通知のごとに発行されるため一覧性がなく、通知に含まれない重要な品質再評価情報が掲載されないことがあるため、日本ジェネリック製薬協会がこれらを補い、さらに広範囲の情報を掲載したものを「オレンジブック総合版」として、ウェブサイトで公開している。
オーソライズド・ジェネリック(AG)[編集]
オーソライズド・ジェネリック(英: Authorized generics, AG)とは、先発医薬品の製薬会社が特許権をオーソライズ(公認)したジェネリック医薬品で、先発医薬品とは別の会社が販売するものである。ジェネリック医薬品は先発医薬品と有効成分が同等であるが、AGの場合は、さらに先発製剤と原薬・添加物・製法・形状・色・味が同一で、製造工場・効能・効果も、一部の例外を除き先発医薬品と同一である[12]。
そのため他の後発医薬品と違い、生物学的同等性などの試験を省くことができる。また、先発医薬品からの切替に対する医療従事者・患者の抵抗が少ない。AGは先発医薬品の特許が切れる前に発売することができ、さらにアメリカ合衆国では「180日ルール」(ジェネリック市場での180日間の独占販売権)が適用されるため、後から発売される後発医薬品に先駆けて、市場を独占できる可能性がある。
製造プロセスでいくつかに分けられ、生物学的同等性試験の結果、ジェネリック医薬品としては承認の範囲内でも、先発医薬品とは明らかにAUCやCmaxが異なる場合もあり、AGといっても均一ではない[13]。
- パターン1 - すべて先発医薬品メーカーと同じ原薬、製法、技術者、製造ラインを用いて子会社が製造(承認申請に際し生物学的同等性試験は不要)
- パターン2 - 先発医薬品と同じ原薬、製法を用いて受託会社が製造(製造工場と製造技術が異なる。生物学的同等性試験が必要)
- パターン3 - 異なる原薬を用い同じ製法で受託会社が製造(原薬と製造工場と製造技術が異なる。生物学的同等性試験が必要)
日本初のAGは、フェキソフェナジン塩酸塩錠「SANIK」(先発医薬品はアレグラ)で、30mg錠、60mg錠ともに2013年6月に薬価収載された[14]。ただし、先発薬『アレグラ』の後発医薬品は既発であったため、先行販売ではなかった。
AGとそうではないGEは、いずれも一般名+「メーカー名」であるため、見分けがつかない。
- 例:フェキソフェナジン塩酸塩錠「SANIK」はAG。フェキソフェナジン塩酸塩錠「トーワ」、フェキソフェナジン塩酸塩錠「YD」などはGE。
後追いAG[編集]
後発医薬品が参入して一定期間が経過した後に市場に投入されるAG[15]を、特に区別して呼ぶことがあり、文脈中では「いわゆる“後追いAG”」などと表記される[16]。
オートAG[編集]
先発品メーカーから特許権の許諾を受けて発売されるAGと区別して、先発品と原薬、添加物、製造方法が同一のAGを呼ぶ時の、日医工による呼称[17]。
各国の状況[編集]
アメリカ合衆国[編集]
アメリカ合衆国では、民間の医療保険会社が後発医薬品の使用を奨励している。さらに、医師が処方した薬を薬剤師の判断で後発医薬品に替えることができる「代替調剤」がほとんどの州で認められており、後発医薬品の市場占有率は97%と非常に高くなっている。ただし日本とは違い、後発医薬品は「先発医薬品とは別の薬」という認識が医療関係者に共有されている[18]。
イギリス[編集]
イギリスでは総合診療医(General Practitioner, GP)の処方箋の大部分が医薬品について一般名で処方されており、2009年には82.8%の処方が一般名で記載されている[19]。
先発医薬品も後発医薬品も自由価格であるが、後発医薬品の場合はPPRS(医薬品価格規制制度)の適用を受けず、イギリス政府と英国ジェネリック医薬品工業協会の協定によるスキームをもとに価格設定の取り決めが行われている[19]。
イギリスでは、薬剤の処方は最終的に医師の判断によって行われ、薬局薬剤師による後発医薬品への代替調剤は認められていない[19]。そのため先発医薬品が銘柄で処方されているときは、その医薬品が調剤される[19]。一方、一般名で処方されているときは、薬剤師の判断で調剤できるが、先発医薬品による調剤は、薬局が赤字となるため行われない[19]。
イギリスの後発医薬品の市場占有率は、ドイツに次いで高くなっている[20]。
ドイツ[編集]
ドイツでは連邦疾病金庫中央連合会が「参照価格」を設定する場合には、償還の対象となる薬価は参照価格を上限とする参照価格ルールがある[19]。また疾病金庫やその連合会が製薬企業との間で医薬品の割引契約を締結する制度が社会法典に定められている[19]。
州疾病金庫連合会及び保険医協会は、患者グループ及び医師グループに応じて1症例当たりの標準値を設定しており、医師の処方総額が標準値に症例数を乗じた標準値総額を上回る場合には経済性審査を受けなければならない[19]。
薬局は一定の要件で医師によって処方された医薬品に代替して同一の有効成分を含有する安価な医薬品を調剤する代替調剤ルールがある[19]。
また、患者は参照価格を上回る額については超過負担を支払わなければならず、反対に参照価格を30%以上下回る医薬品や製薬企業との割引契約の対象となっている医薬品を利用した場合は患者負担が減免される[19]。
フランス[編集]
フランスでは、2002年の社会保障財政法以降に、後発医薬品の利用が進んだ[19]。
1999年以降、薬剤師は医師が処方箋に代替不可の署名をしていなければ、処方されたブランド医薬品の類似薬効の後発医薬品に変更することが義務付けられた[19]。
また、2002年の社会保障財政法により、医師は医薬品の処方を商品名ではなく、一般名で行うことが義務付けられた[19]。
日本[編集]
注釈[編集]
出典[編集]
- ^ a b Health at a Glance 2013 (Report). OECD. 21 November 2013. pp. 104–105. doi:10.1787/health_glance-2013-en. ISBN 978-92-64-205024。
- ^ a b OECD Economic Surveys: Japan 2009 (Report). OECD. 13 August 2009. pp. 115–116. doi:10.1787/eco_surveys-jpn-2009-en. ISBN 9789264054561。
- ^ a b c d e “ジェネリック医薬品をもっと良く知っていただくために | ジェネリック医薬品って何?”. 日本ジェネリック株式会社. 2020年12月27日閲覧。
- ^ a b “後発医薬品(ジェネリック医薬品)をご存知ですか?”. 東京都福祉保健局. 2020年12月27日閲覧。
- ^ ジェネリック医薬品関連で発生している各種回収事案についての緊急声明文 日本ジェネリック医薬品・バイオシミラー学会、2020年12月18日、2020年12月27日閲覧
- ^ “2018年8月の後発品割合は76.5%”. 2018年12月20日閲覧。
- ^ “後発医薬品 品質不正が示す「薄利多売ビジネス」の限界 | AnswersNews”. 製薬業界の転職サイト Answers(アンサーズ) (2021年10月18日). 2023年5月24日閲覧。
- ^ “第17回日本ジェネリック医薬品・バイオシミラー学会より 厚労省「後発品の使用促進は拙速だった」”. 日経メディカルDI. 2023年5月24日閲覧。
- ^ “生物学的同等性”. ジェネリック医薬品. 長崎県保険医協会. 2011年1月6日閲覧。
- ^ 厚生労働省 2012, p. 6.
- ^ 日本公定書協会『医療用医薬品品質情報集 : Orange book』薬事日報社、1999年6月。ISBN 9784840811385。
- ^ わたしたちのお薦め オーソライズド・ジェネリック - 第一三共エスファ株式会社
- ^ ジェネリック医薬品の臨床効果は先発医薬品と同等と言えるのか? - 日本ジェネリック製薬協会
- ^ “【日医工】日本初オーソライズドジェネリック 『SANIK』に照準”. 薬事日報 (2013年7月23日). 2015年10月26日閲覧。
- ^ “【TREND】後追いAG続々、成熟市場で巻き返し。ティーエスワン、後発品内シェア8割超に”. MRジャーナル(株式会社アクセライズ) (2018年9月3日). 2019年2月18日閲覧。
- ^ “「シムビコート」は3社、「ロナセン」は12社 6月後発品追補へ承認”. 日刊薬業(じほう) (2019年2月15日). 2019年2月18日閲覧。
- ^ 後発品メーカー国内初の売上1000億円世界のトップ10入りの計画も活発化 NIKKEI Drug Information(2014.12) (PDF)
- ^ 多田智裕 (2012年5月22日). “Vol.494 ジェネリックは「先発品と同じ薬」ではありません。短絡的すぎる「薬剤費の抑制=ジェネリックの使用促進」という図式” (HTML). 医療ガバナンス学会. 2019年8月18日閲覧。
- ^ a b c d e f g h i j k l m 健保連海外医療保障 No.89 2011年3月 健康保険組合連合会、2020年12月31日閲覧。
- ^ “世界のジェネリック医薬品事情”. 女性を応援する乳がん情報サイト 乳がんINFOナビ. 日本化薬 (2014年7月31日). 2018年2月11日閲覧。[リンク切れ]
参考文献[編集]
- 『ジェネリック医薬品への疑問に答えます 〜ジェネリック医薬品 Q&A〜』(プレスリリース)厚生労働省、2012年7月。
関連項目[編集]
- 一般名 (generic name)
- 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)
- 医薬品の製造および品質管理に関する規準
- 医薬品 - 医薬部外品
- 処方箋 - 処方箋医薬品 - 一般用医薬品
- バイオ医薬品 - バイオシミラー
- 薬剤師 - 調剤
- 製薬会社
- 薬価
- 試験データ保護
- 偽造品の取引の防止に関する協定 (ACTA)
- ジェネリック家電 - 「ジェネリック医薬品」になぞらえた派生語
外部リンク[編集]
- 日本ジェネリック医薬品・バイオシミラー学会
- かんじゃさんの薬箱 - 患者様用ジェネリック医薬品情報システム
- 日本ジェネリック製薬協会 - 旧・医薬工業協議会
- 政府広報 - 安心してご利用ください ジェネリック医薬品
- 厚生労働省
- オレンジブック総合版 - 日本版オレンジブック研究会
- Generic pharmaceuticals and competition(英語) - OECD
