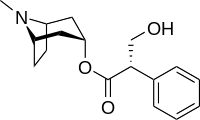
ヒヨスチアミン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Anaspaz, Levbid, Levsin |
| Drugs.com | monograph |
| MedlinePlus | a684010 |
| 胎児危険度分類 |
|
| 法的規制 | |
| 投与経路 | 経口、注射 |
| 薬物動態データ | |
| 生物学的利用能 | 50%タンパク質結合 |
| 代謝 | 肝臓 |
| 半減期 | 3–5時間 |
| 排泄 | 尿素 |
| 識別 | |
| CAS番号 |
101-31-5 |
| ATCコード | A03BA03 (WHO) |
| PubChem | CID: 154417 |
| DrugBank |
DB00424 |
| ChemSpider |
10246417 |
| UNII |
PX44XO846X |
| KEGG | D00147 |
| ChEBI |
CHEBI:17486 |
| ChEMBL |
CHEMBL1697729 |
| 化学的データ | |
| 化学式 | C17H23NO3 |
| 分子量 | 289.375 g/mol |
| |
ヒヨスチアミン(Hyoscyamine)は、トロパンアルカロイドである。ヒヨス、マンドレイク、シロバナヨウシュチョウセンアサガオ、トマト、ベラドンナ等のナス科の特定の植物に二次代謝産物として含まれる。アトロピンの左旋性異性体であり、そのためlevo-アトロピンと呼ばれることもある。同じようにナス科に含まれる抗コリン性物質で前駆体であるスコポラミンの旧別名ヒヨスチンと紛らわしいが、別ものである。ヒヨスチアミンの商標としては、Symax、HyoMax、Anaspaz、Egazil、Buwecon、Cystospaz、Levsin、Levbid、Levsinex、Donnamar、NuLev、Spacol T/SやNeoquess等がある。
薬理学[編集]
ヒヨスチアミンは、ムスカリン性アセチルコリン受容体のアンタゴニスト(ムスカリン拮抗剤)である。汗腺、唾液腺、胃分泌部、心筋、洞房結節、消化管の平滑筋、中枢神経系の副交感神経系でアセチルコリンの作用を阻害する。拍出量と心拍数を増加させ、血圧を低下させ、分泌を減少させる[1]。セロトニンと拮抗していると考えられている[2]。同程度の投与量では、ヒヨスチアミンはアトロピンの98%の抗コリン活性を持つ。一方、ベラドンナに由来する他成分であるスコポラミンは、アトロピンの92%の抗コリン活性を持つ[2]。
利用[編集]
消化性潰瘍、過敏性腸症候群、大腸憩室症、膵炎、疝痛、尿路感染症等を含む、下腹部や膀胱の様々な疾患による痙攣症状を緩和するために用いられる。また、心臓疾患の緩和、パーキンソン病の症状の制御、肺疾患患者で見られる異常な呼吸器症状や粘液の過剰分泌の制御にも用いられる。
また、神経因性疼痛や慢性疼痛の疼痛管理、治療抵抗性、治療不能、治癒不能な疾患による難治性疼痛の緩和ケアにも有用である。またオピオイドと併用することで、得られる鎮痛効果が増大する。この効果には、いくつかのメカニズムが提案されている。類似薬のアトロピンやスコポラミン、またシクロベンザプリン、トリヘキシフェニジル、オルフェナドリン等の抗コリン薬もこの目的のために利用される。オピオイドやその他の蠕動抑制剤と一緒に用いる場合、麻痺性イレウスの危険性を考慮すると、便秘を予防する手段が特に重要となる。
副作用[編集]
副作用としては、口や喉の渇き、目の痛み、視覚障害、不安感、めまい、不整脈、潮紅、気分の悪さなどがある。過剰摂取は、頭痛、吐き気、嘔吐、及び見当識障害、幻覚、陶酔感、性的興奮、短期記憶喪失、また極端な場合には昏睡を含む中枢神経系の症状を引き起こす。陶酔効果や性的効果はアトロピンの効果よりも強いが、スコポラミンやジシクロベリン、オルフェナドリン、シクロベンザプリン、トリヘキシフェニジル、フェニルトロキサミン等のエタノールアミン系抗ヒスタミン剤よりも弱い。また、利尿剤としても作用する。
植物中での生合成[編集]
ヒヨスチアミンは、シロバナヨウシュチョウセンアサガオ等のナス科の植物から抽出できる。ヒヨスチアミンは、植物中でのスコポラミン生合成の直接の前駆体であるため、同じ代謝経路で生成される[3]。
スコポラミンの生合成は、L-オルニチンがオルニチン脱炭酸酵素により脱炭酸され、プトレシンが生成するところから始まる。プトレシンはプトレシン-N-メチルトランスフェラーゼによりメチル化され、N-メチルプトレシンとなる[3]。
メチルプトレシンを特異的に認識するプトレシンオキシダーゼによる脱アミノ化によって4-メチルアミノブタナールが生成され、さらに自発的環化によりN-メチルピロリウムカチオンとなる。次の段階でピロリウムカチオンはアセト酢酸とともに縮合し、ヒグリンを生成する。この反応を触媒する酵素はまだ知られていない。ヒグリンは転位し、トロピノンになる[3]。
その後、トロピノンレダクターゼIによりトロピンに変換され、フェニルアラニン由来のフェニル酢酸と縮合し、リットリンとなる。Cyp80F1に分類されるシトクロムP450[4]がリットリンを酸化、転位し、ヒヨスチアミンアルデヒドとなる。
出典[編集]
- ^ “DailyMed - ED-SPAZ- hyoscyamine sulfate tablet, orally disintegrating”. dailymed.nlm.nih.gov. 2020年4月3日閲覧。
- ^ a b Kapoor, A. K. (Professor of pharmacology). Illustrated medical pharmacology. Raju, S. M., (First edition ed.). New Delhi. p. 131. ISBN 978-93-5090-655-2. OCLC 870530462
- ^ a b c Ziegler, Jörg; Facchini, Peter J. (2008). “Alkaloid biosynthesis: metabolism and trafficking”. Annual Review of Plant Biology 59: 735–769. doi:10.1146/annurev.arplant.59.032607.092730. ISSN 1543-5008. PMID 18251710.
- ^ Li, Rong; Reed, Darwin W.; Liu, Enwu; Nowak, Jacek; Pelcher, Lawrence E.; Page, Jonathan E.; Covello, Patrick S. (2006-05). “Functional genomic analysis of alkaloid biosynthesis in Hyoscyamus niger reveals a cytochrome P450 involved in littorine rearrangement”. Chemistry & Biology 13 (5): 513–520. doi:10.1016/j.chembiol.2006.03.005. ISSN 1074-5521. PMID 16720272.
