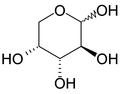
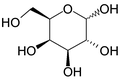
ピラノース
ピラノース(Pyranose)は、5つの炭素と1つの酸素を頂点として六員環を構成している炭水化物の総称である。
鎖状の状態から、C-5のヒドロキシ基とC-1のアルデヒド基が分子内ヘミアセタール反応を起こすことによって六角形が形成される。六員環のエーテル化合物であるピランに形が似ていることから名前がつけられた。C-1位のアノマーOH基がOR基に変換されているピラノースはピラノシドと呼ばれる。
水溶液中では五員環のフラノースと平衡状態になるが、アラビノースなど一部を除いて、糖には主にピラノース構造を取るものが多い。
形成
ピラノース環は糖のC-5位のヒドロキシル基とC-1位のアルデヒド基の反応によって形成される。これによって分子内ヘミアセタールが形成される。C-4位のヒドロキシル基とアルデヒド基が反応した場合は、代わりにフラノースが形成される[1]。ピラノース型はフラノース型よりも熱力学的に安定であり、このことはこれら2つの環構造の溶液中での分布によって見ることができる[2]。

歴史

ヘルマン・エミール・フィッシャーは、D-アルドヘキソース類の構造を決定した功績により、1902年のノーベル化学賞を受賞した[1]。しかし、フィッシャーが提案した鎖状の遊離アルデヒド構造は、溶液中でヘキソースがとる異性体構造の非常に小さい割合でしか存在しない。ヘキソースが6員環のプラノース環を優先的に形成することを最終的に決定したのは、ウォルター・ハースの研究グループのエドマンド・ハーストとクリフォード・パーヴスである。ハースは平らな六角形の環平面の上部と下部に官能基を配置するハース投影式によって環を描いた[3] 。
926年にSponslerとDoreが6員環に対するSachseの数学的取扱いがセルロースのX線構造に適応できることに気が付いた時にピラノース環の配座についてさらに改良された[3]。ピラノース環は、環の全ての炭素原子が理想的な四面体型に近くなるような配座を取っていることが決定された。
配座
ピラノースの基本的な配座は38種類が存在する(2種類のいす型、6種類のねじれ舟形、12種類の半いす型、12種類のエンベロープ型)[4]。


これらの配座は互いに相互変換できる。しかし、それぞれの配座は大きく異なる相対エネルギーを有していることから、相互変換には著しい障壁が存在する。これらの配座のエネルギーは量子力学によって計算することができる[5]。
ピラノース環の配座はシクロヘキサン環の配座と一見類似している。しかし、ピラノース特異的命名法には環内の酸素原子への言及が含まれ、ヒドロキシル基の存在が配座の優先傾向に独特な影響を与えている。また、ピラノース環に特異的な配座ならびに立体化学的効果も存在する。
命名法

ピラノースの配座を命名するために、まず配座を決定する。一般的な配座はシクロヘキサンで見られるものと似ており、これらの配座が名称の基礎となっている。一般的な配座は、いす (Chair, C)、ふね (Boat, B)、ねじれ (Skew, S)、半いす (Half-Chair, H)、エンベロープ (Envelope, E) である。その次に、環の原子に番号を付ける。アノマー炭素は常に1である。構造内の酸素原子は一般的に非環状型の時に結合している炭素原子の番号で呼ばれる。
次に、
- 真上から見た場合に原子の番号が時計回りになるように環を配置する。4位(エンベロープの場合は5位)の原子は平面内に位置する。
- 平面の上部にある原子を配座ラベルの前に上付きで書く。
- 平面の下部にある原子を配座ラベルの後ろに下付きで書く[6]。
NMR分光法
上記の概略図中の相対構造エネルギーで示されているように、いす型が最も安定な配座である。この相対的に決定された安定配座は、ピラノース環の水素原子が互いに一定の角度に留まっていることを意味する。炭化水素のNMRでは、これらの2面角を環の周りのそれぞれのヒドロキシル基の配置を決定するために利用する。
主なピラノース
脚注
- ^ a b Robyt, J.F. (1998). Essentials of Carbohydrate Chemistry. Springer. ISBN 0-387-94951-8
- ^ Ma, B.Y.; Schaefer, H.F.; Allinger, N.L. (1998). “Theoretical studies of the potential energy surfaces and compositions of the D-aldo and D-ketohexoses”. Journal of the American Chemical Society 120 (14): 3411–3422. doi:10.1021/ja9713439.
- ^ a b Rao, V.S.R.; Qasba, P.K.; Chandrasekaran, R.; Balaji, P.V. (1998). Conformation of Carbohydrates. CRC Press. ISBN 90-5702-315-6
- ^ Ionescu, A.R.; Berces, A.; Zgierski, M.Z.; Whitfield, D.M.; Nukada, T. (2005). “Conformational Pathways of Saturated Six-Membered Rings. A Static and Dynamical Density Functional Study”. The Journal of Physical Chemistry A 109 (36): 8096–8105. doi:10.1021/jp052197t. PMID 16834195.
- ^ Biarns, X.; Ardvol, A.; Planas, A.; Rovira, C.; Laio, A.; Parrinello, M. (2007). “The Conformational Free Energy Landscape of b-D-Glucopyranose. Implications for Substrate Preactivation in b-Glucoside Hydrolases”. Journal of the American Chemical Society 129 (35): 10686–10693. doi:10.1021/ja068411o. PMID 17696342.
- ^ Furhop, J.H.; Endisch, C. (2000). Molecular and Supramolecular Chemistry of Natural Products and Their Model Compounds. CRC Press. ISBN 0-8247-8201-1