タンパク質生合成

タンパク質生合成(たんぱくしつせいごうせい、英: protein biosynthesis)は、タンパク質合成(英: protein synthesis)とも呼ばれ、細胞内で行われる中心的な生物学的プロセスであり、新しいタンパク質の生成を通じて細胞内タンパク質の消失(分解や輸送)とのバランスを維持する。タンパク質は、酵素、構造タンパク質、またはホルモンとして、多くの重要な機能を果たしている。原核生物と真核生物の両方で、タンパク質生合成は非常によく似たプロセスであるが、いくつかの明確な違いがある[1]。
タンパク質生合成は、転写と翻訳の2つの段階に大きく分けられる。転写の際、タンパク質をコード(符号化)するDNA(遺伝子として知られる)の一部が、メッセンジャーRNA(mRNA)と呼ばれる鋳型分子に変換される。この変換は、細胞の核内でRNAポリメラーゼと呼ばれる酵素によって行われる[2]。真核生物では、このmRNAは最初は未成熟な形(pre-mRNA)で作られ、転写後修飾を受けて成熟mRNAが生成される。成熟mRNAは、細胞核から核膜孔を通って細胞質へと運ばれ、翻訳が行われる。翻訳の際、mRNAはリボソームによって読み取られ、リボソームはmRNAのヌクレオチド配列を使用してアミノ酸の配列を決定する。リボソームは、コード化されたアミノ酸間の共有ペプチド結合の形成を触媒して、ポリペプチド鎖を形成する。
翻訳されたポリペプチド鎖は、機能性タンパク質を形成するために、適切に折りたたまれなければならない。たとえば酵素として機能する場合、ポリペプチド鎖が正しく折りたたまれて機能的な活性部位を形成する必要がある。そのポリペプチド鎖が機能的な三次元(3D)形状をとるためには、まず二次構造と呼ばれる一連の小さな基礎構造を形成しなければならない。次に、これらの二次構造のポリペプチド鎖が折り重なって、全体の三次元的な三次構造が形成される。正しく折りたたまれると、タンパク質はさまざまな翻訳後修飾を受けてさらに成熟する。翻訳後修飾は、タンパク質の機能、細胞内での位置(細胞質や核など)、他のタンパク質と相互作用する能力を変化させる[3]。
タンパク質生合成は、疾患において重要な役割を果たしており、DNAの変異やタンパク質のミスフォールディング(誤った折りたたみ)など、このプロセスの変化や誤りが疾患の根本的な原因となることが多い。DNA変異は、後続するmRNA配列を変化させ、それからmRNAにコード化されたアミノ酸の配列を変化させる。変異によって翻訳を早期終了させるストップシークエンスが生成することで、ポリペプチド鎖が短くなることがある。あるいはまた、mRNA配列が変異することにより、ポリペプチド鎖のその位置にコードされている特定のアミノ酸が変化する。このアミノ酸の変化は、タンパク質が機能を果たしたり正しく折りたたまれる能力に影響を及ぼすことがある[4]。誤って折りたたまれたタンパク質は、互いにくっついて高密度のタンパク質凝集塊を形成する傾向があるため、しばしば疾患に関与している。このような凝集塊は、アルツハイマー病やパーキンソン病など、多くの場合は神経学的な、さまざまな疾患に関連している[5]。
転写
[編集]転写とは、DNAを鋳型としてmRNAを生成することで、細胞の核内で行われる。真核生物では、このmRNA分子はpre-mRNAと呼ばれ、核内で転写後修飾を受けて成熟mRNA分子となる。ただし、原核生物では転写後修飾は必要ではなく、転写によって直接に成熟mRNA分子が生成される[1]。
最初にヘリカーゼと呼ばれる酵素がDNA分子に作用する。DNAは、2本の相補的なポリヌクレオチド鎖から構成される逆平行の二重らせん構造を持っており、塩基対間の水素結合によって結びついている。ヘリカーゼがこの水素結合を切断すると、遺伝子に相当するDNAの領域がほどけて2本のDNA鎖が分離し、一連の塩基が露出する。DNAは二本鎖分子であるにもかかわらず、片方の鎖のみがpre-mRNA合成の鋳型として機能する - この鎖は鋳型鎖(テンプレート鎖)と呼ばれる。もう一方のDNA鎖(鋳型鎖と相補的である)はコード鎖と呼ばれる[6]。
DNAとRNAはどちらも固有の方向性を持っている。つまり、分子の両端は別個である。この方向性の特性は、基礎となるヌクレオチドサブユニットの非対称性によるもので、五炭糖の片側にリン酸基が、もう片側に塩基が存在する。五炭糖の5つの炭素には、1'('はプライムを意味する)から5'までの番号が付けられている。したがって、ヌクレオチドをつなぐホスホジエステル結合は、あるヌクレオチドの3'炭素上のヒドロキシ基と別のヌクレオチドの5'炭素上のリン酸基が結合することで形成される。ゆえに、コードDNA鎖は5'から3'の方向に走り、相補的な鋳型DNA鎖は3'から5'の逆方向に走ることになる[1]。
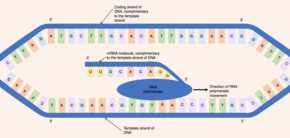
RNAポリメラーゼ酵素は、露出した鋳型鎖に結合し、3'から5'の方向に遺伝子を読み取る。同時に、RNAポリメラーゼは、鋳型鎖と相補的な塩基対を形成することができる活性化ヌクレオチド(核内に遊離している)間でホスホジエステル結合の形成を触媒することにより、5'から3'の方向にpre-mRNAの一本鎖を合成する。移動するRNAポリメラーゼの背後では、DNAの2本の鎖が再結合するので、一度に露出するDNAの塩基対は12個のみである[6]。RNAポリメラーゼは、毎秒20ヌクレオチドの速度でpre-mRNA分子を構築するので、同じ遺伝子から1時間あたり数千のpre-mRNA分子を作り出すことができる。このように合成速度が速いにもかかわらず、RNAポリメラーゼ酵素には独自の校正機構が備わっている。RNAポリメラーゼの校正機構は切除反応によるもので、成長中のpre-mRNA分子から誤ったヌクレオチド(鋳型DNA鎖と相補的でないもの)を除去することができる[1]。RNAポリメラーゼが転写を終了する特定のDNA配列に到達すると、RNAポリメラーゼが切り離され、pre-mRNAの合成が完了する[6]。
合成されたpre-mRNA分子は、鋳型DNA鎖と相補的であり、コードDNA鎖と同じヌクレオチド配列を持っている。ただし、DNA分子とmRNA分子のヌクレオチド組成には1つの決定的な違いがある。DNAは、グアニン、シトシン、アデニン、チミンの4種類の塩基(G、C、A、T)で構成されている。RNAもグアニン、シトシン、アデニン、ウラシルの4種類の塩基で構成されている。RNA分子では、DNA塩基のチミンの代わりに、アデニンと塩基対を形成することができるウラシル(U)が用いられている。したがって、pre-mRNA分子では、コードDNA鎖のチミンとなる相補的塩基がすべてウラシルに置き換えられる[7]。
転写後修飾
[編集]
転写が完了すると、pre-mRNA分子は転写後修飾を受け、成熟mRNA分子になる。
転写後修飾には、次の3つの重要なステップがある。
- pre-mRNA分子の5'末端に5'キャップを付加
- pre-mRNA分子の3'末端に3'ポリ(A)テールを付加
- RNAスプライシングによるイントロンの除去
5'キャップは、pre-mRNA分子の5'末端に付加され、メチル化によって修飾されたグアニンヌクレオチドで構成されている。5'キャップの目的は、翻訳前の成熟mRNA分子の分解を防ぐことである。また、キャップは、リボソームがmRNAに結合して翻訳を開始するのを助け[8]、mRNAを細胞内の他のRNAと区別できるようにする[1]。一方、3'ポリ(A)テールは、mRNA分子の3'末端に付加され、100-200個のアデニン塩基で構成されている[8]。このような異なるmRNA修飾によって、5'キャップと3'テールの両方が存在する場合、細胞は完全なmRNAメッセージが無傷であることを検出できる[1]。
次に、この修飾されたpre-mRNA分子は、RNAスプライシングのプロセスを経る。遺伝子は一連のイントロンとエクソンから構成され、イントロンはタンパク質をコードしないヌクレオチド配列であり、エクソンはタンパク質を直接コードするヌクレオチド配列である。イントロンとエクソンは、基礎となるDNA配列とpre-mRNA分子の両方に存在するため、タンパク質をコードする成熟mRNA分子を生成するためにはスプライシングが必要となる[6]。スプライシングの際には、スプライセオソームと呼ばれる多タンパク質複合体(150以上のタンパク質とRNAで構成される)によって、介在性のイントロンがpre-mRNA分子から除去される[9]。その後、この成熟mRNA分子は、細胞核の外側にある核膜孔を通って細胞質へと輸送される。
翻訳
[編集]

翻訳の際、リボソームはmRNA鋳型分子からポリペプチド鎖を合成する。真核生物では、翻訳は細胞の細胞質内で起こり、そこではリボソームが自在に遊離しているか小胞体に付着している。核細胞を持たない原核生物では、転写と翻訳の両プロセスが細胞質内で行われる[10]。
リボソームは、タンパク質とリボソームRNAの複合体からなる複雑な分子機械で、mRNA分子を取り囲むように2つのサブユニット(大サブユニットと小サブユニット)に分かれて配置されている。リボソームは、mRNA分子を5'-3'方向に読み進め、それを鋳型として用いて、ポリペプチド鎖のアミノ酸の種類と順番を決定する[11]。mRNA分子を翻訳するために、リボソームはトランスファーRNA(tRNA、転移RNA)と呼ばれる小分子を用いて、正しいアミノ酸をリボソームに送達する。各tRNAは、70-80個のヌクレオチドで構成され、分子内のヌクレオチド間で水素結合が形成されるため、特徴的なクローバー葉構造をとる。tRNAは約60種類あり、それぞれのtRNAはmRNA分子内の3つのヌクレオチドからなる特定の配列(コドンと呼ばれる)に結合し、特定のアミノ酸を送達する[12]。
リボソームは、最初にmRNAの開始コドン(AUG)に結合し、分子の翻訳を開始する。mRNAヌクレオチド配列はトリプレット(三連符)で読まれる。mRNA分子内にある3つの隣接するヌクレオチドが1つのコドンに対応する。各tRNAには、アンチコドンと呼ばれる3つのヌクレオチド配列が露出しており、これはmRNA内に存在する特定のコドンと相補的になっている。たとえば、最初に出会うコドンは、ヌクレオチドAUGから構成される開始コドンである。アンチコドン(相補的な3ヌクレオチドの配列UAC)を持つ正しいtRNAが、リボソームを使用してmRNAに結合する。このtRNAは、mRNAコドンに対応する正しいアミノ酸を送達する。開始コドンの場合、これはアミノ酸メチオニンである。次のコドン(開始コドンに隣接)は、相補的なアンチコドンを持つ正しいtRNAと結合して、次のアミノ酸をリボソームに送達する。さらにリボソームは、そのペプチジルトランスフェラーゼ酵素活性を利用して、隣接する2つのアミノ酸の間に共有ペプチド結合の形成を触媒する[6]。
次に、リボソームはmRNA分子に沿って3番目のコドンに移動する。リボソームはその後、最初のtRNA分子を放出する。これは、1つのリボソームが一度にまとめるられるtRNA分子は2つに限られるためである。3番目のコドンに相補的な正しいアンチコドンを持った次のtRNAが選択され、次のアミノ酸がリボソームに送達され、成長するポリペプチド鎖に共有結合される。このプロセスは、リボソームがmRNA分子に沿って移動しながら続き、毎秒最大15個のアミノ酸をポリペプチド鎖に付加する。最初のリボソームの背後には、最大50個のリボソームがmRNA分子に結合してポリソームを形成し、これにより複数の同一ポリペプチド鎖を同時に合成することが可能になる[6]。リボソームがmRNA分子内の終止コドン(UAA、UAG、またはUGA)に遭遇すると、成長中のポリペプチド鎖が終結する。このとき、tRNAは終結を認識することができず、終結因子によって完全なポリペプチド鎖がリボソームから放出される[12]。インド出身の科学者、ハー・ゴビンド・コラナ博士は、約20アミノ酸のRNA配列を解読した[要出典]。1968年、彼はその業績により、他の2人の科学者とともにノーベル賞を受賞した。
タンパク質フォールディング
[編集]
ポリペプチド鎖の合成が完了すると、ポリペプチド鎖は折りたたまれて、タンパク質が機能を発揮できるような特定の構造をとる。タンパク質の構造の基本的な形は一次構造と呼ばれ、これは単にポリペプチド鎖、つまり共有結合したアミノ酸の配列である。タンパク質の一次構造は、遺伝子によってコード化されている。したがって、遺伝子の配列を変更すると、タンパク質の一次構造とそれに続くすべてのレベルのタンパク質の構造が変化し、最終的には全体の構造と機能が変化する可能性がある。
次に、タンパク質の一次構造(ポリペプチド鎖)は折りたたまれたり巻きついたりして、タンパク質の二次構造を形成することができる。最も一般的な種類の二次構造は、αヘリックスやβシートと呼ばれるもので、これらはポリペプチド鎖の中で形成される水素結合による小さな構造である。次に、この二次構造が折り重なって、タンパク質の三次構造を形成する。三次構造は、タンパク質の全体的な立体構造で、さまざまな二次構造が折り重なってできている。三次構造では、タンパク質の重要な特徴、たとえば活性部位が折りたたまれて形成され、タンパク質の機能が発揮されるようになる。タンパク質によっては、最終的に、より複雑な四次構造をとる場合もある。ほとんどのタンパク質は単一のポリペプチド鎖からできているが、一部のタンパク質は複数のポリペプチド鎖(サブユニットと呼ばれる)から構成され、これらのポリペプチド鎖が折りたたまれて相互作用して四次構造を形成する。したがって、そのタンパク質全体は、複数の折りたたまれたポリペプチド鎖のサブユニットからなるマルチサブユニット複合体である(例: ヘモグロビン)[13]。
翻訳後修飾
[編集]タンパク質が成熟して機能的な3次元状態をもった折りたたみが完了しても、必ずしもそれはタンパク質の成熟経路の終わりではない。折りたたまれたタンパク質は、翻訳後修飾を受けてさらにプロセシングされる可能性がある。200種類以上の翻訳後修飾が知られており、これらの修飾によってタンパク質の活性や、他のタンパク質と相互作用する能力、そしてタンパク質が細胞内のどこに存在するか(例:細胞核または細胞質)が変化する[14]。翻訳後修飾によって、ゲノムにコードされているタンパク質の多様性は2-3桁拡大する[15]。
翻訳後修飾には、4つの主要な種類がある[3]。
- 切断
- 化学基の付加
- 複合分子の付加
- 分子内結合の形成
切断
[編集]
タンパク質の切断とは、プロテアーゼと呼ばれる酵素によって行われる不可逆的な翻訳後修飾である。これらのプロテアーゼは非常に特異的なことが多く、標的タンパク質内の限られた数のペプチド結合を加水分解する。その結果、短縮されたタンパク質は、ポリペプチド鎖の始点と終点に異なるアミノ酸を持つ変更されたポリペプチド鎖となる。このような翻訳後修飾は、しばしばタンパク質の機能を変化させ、タンパク質は切断によって不活性化または活性化され、新たな生物学的活性を示すことがある[16]。
化学基の付加
[編集]
翻訳された後、成熟したタンパク質構造内のアミノ酸に小さな化学基を付加することができる[17]。標的タンパク質に化学基を付加するプロセスの例には、メチル化、アセチル化、およびリン酸化 (en:英語版) がある。
メチル化とは、メチル基をアミノ酸に可逆的に付加することで、メチルトランスフェラーゼ(メチル基転移酵素)によって触媒される。メチル化は、20種類の一般的なアミノ酸のうち少なくとも9種類で起こり、主にリシンとアルギニンで起こる。一般的にメチル化されるタンパク質の一例としてヒストンがある。ヒストンは細胞核に存在するタンパク質である。DNAはヒストンの周囲にしっかりと巻きついて、他のタンパク質や、DNAのマイナス電荷とヒストンのプラス電荷の相互作用によって所定の位置に固定される。ヒストンタンパク質上のアミノ酸メチル化の高度に特異的なパターンは、DNAのどの領域がきつく巻かれて転写されないか、どの領域がゆるく巻かれて転写されるかを決定するために使用される[18]。
ヒストンによるDNA転写の制御は、アセチル化によっても変化する。アセチル化とは、ヒストンアセチルトランスフェラーゼ酵素によって、リシン系アミノ酸にアセチル基が可逆的に共有結合で付加されることである。アセチル基は、アセチル補酵素A(アセチルCoA)と呼ばれる供与体分子から除去され、標的タンパク質に転移する[19]。ヒストンは、ヒストンアセチルトランスフェラーゼと呼ばれる酵素によって、リシン残基がアセチル化される。アセチル化の効果は、ヒストンとDNAの間の電荷相互作用を弱めることで、それによってDNA中のより多くの遺伝子が転写できるようになる[20]。
一般的な翻訳後の化学基修飾の最後はリン酸化である。リン酸化とは、タンパク質内の特定のアミノ酸(セリン、スレオニン、チロシン)に、リン酸基を可逆的に共有結合で付加することである。リン酸基は、プロテインキナーゼによって供与体分子のアデノシン三リン酸(ATP)から除去され、標的アミノ酸のヒドロキシ基に転移し、副産物としてアデノシン二リン酸が生成される。このプロセスを逆にして、プロテインホスファターゼ酵素によってリン酸基を除去することができる。リン酸化は、リン酸化タンパク質上に結合部位を作成し、他のタンパク質と相互作用して、巨大な多タンパク質複合体の生成を可能にする。あるいは、リン酸化によってタンパク質の基質結合能力が変化し、タンパク質の活性レベルを変えることができる[1]。
複合分子の追加
[編集]
翻訳後修飾では、より複雑で大きな分子を折りたたまれたタンパク質構造に組み込むことができる。その代表的な一例は、多糖分子を付加するグリコシル化である。これは、翻訳後修飾の中でも最も一般的なものと広く考えられている[15]。
グリコシル化とは、多糖分子(糖鎖またはグリカンとして知られる)がグリコシルトランスフェラーゼ(糖転移酵素)によって標的タンパク質に共有結合的に付加されることを言い、小胞体内やゴルジ装置内のグリコシダーゼによって修飾される。グリコシル化は、標的タンパク質の最終的な折りたたまれた立体構造を決定する上で重要な役割を果たすことがある。場合によっては、正しいフォールディング(折りたたみ)のためにグリコシル化が必要なこともある。N-結合型グリコシル化は、溶解度を高めることでタンパク質のフォールディングを促進し、タンパク質シャペロンとの結合を仲介する。シャペロンとは、他のタンパク質の折りたたみや構造維持を担うタンパク質である[1]。
グリコシル化には大きく分けて、N-結合型グリコシル化とO-結合型グリコシル化の2種類がある。N-結合型グリコシル化は、小胞体内で前駆体糖鎖が付加されることで始まる。前駆体糖鎖はゴルジ装置で修飾され、アスパラギンアミノ酸の窒素に共有結合した複雑な糖鎖結合を生成する。他方、O-結合型グリコシル化は、成熟したタンパク質構造内のアミノ酸であるセリンとスレオニン上の酸素に対して、いくつかの単糖が共有結合で付加する[1]。
共有結合の形成
[編集]
細胞内で産生されたタンパク質の多くは細胞外に分泌され、細胞外タンパク質として機能する。細胞外タンパク質は、さまざまな条件にさらされる。タンパク質の立体構造を安定化させるために、タンパク質内で共有結合が形成されたり、あるいは四次構造内の異なるポリペプチド鎖間で共有結合が形成される。最も一般的な種類は、ジスルフィド結合(ジスルフィド架橋と呼ばれる)である。ジスルフィド結合は、硫黄原子を含む側鎖の化学基を用いて2つのシステインアミノ酸の間に形成される。これらの化学基はチオール官能基として知られている。ジスルフィド結合は、タンパク質の既存の構造を安定させる働きがある。ジスルフィド結合は、2つのチオール基の間の酸化反応で形成されるため、反応するには酸化性環境が必要である。そのため、ジスルフィド結合は通常、小胞体内の酸化性環境下において、プロテインジスルフィドイソメラーゼと呼ばれる酵素の触媒作用によって形成される。細胞質内は還元性環境であるためジスルフィド結合はほとんど形成されない[1]。
疾患におけるタンパク質生合成の作用
[編集]多くの疾患は遺伝子の変異によって引き起こされる。これはDNAヌクレオチド配列とコード化タンパク質のアミノ酸配列とが直接関係しているためである。タンパク質の一次構造に変化が生じると、タンパク質が誤って折りたたまれたり、機能不全を引き起こす可能性がある。鎌状赤血球症を含む複数の疾患の原因として、単一遺伝子内の変異が特定されており、単一遺伝子疾患と呼ばれている。
鎌状赤血球症
[編集]
鎌状赤血球症は、赤血球の中で酸素を輸送する役割を担うタンパク質であるヘモグロビンのサブユニットに変異が生じることで発症する疾患群である。鎌状赤血球症の中でも最も危険なものは鎌状赤血球貧血として知られている。鎌状赤血球貧血は、最も一般的なホモ接合型劣性単一遺伝子疾患であり、この病気に苦しむ患者は、罹患した遺伝子の両方のコピー(両親から受け継いだもの)に変異がなければならない。ヘモグロビンは複雑な四次構造を持ち、αサブユニット2個とβサブユニット2個の、計4個のポリペプチドサブユニットから構成されている[21]。鎌状赤血球貧血の患者は、ヘモグロビンβサブユニットのポリペプチド鎖をコードする遺伝子にミスセンス変異または置換変異がある。ミスセンス変異とは、ヌクレオチド変異により、全体的なコドントリプレットが変化し、異なるアミノ酸が新しいコドンと対になることを意味する。鎌状赤血球貧血の場合、最も一般的なミスセンス変異は、ヘモグロビンβサブユニット遺伝子のチミンからアデニンへの一塩基変異である[22]。これにより、コドン6がアミノ酸のグルタミン酸のコードから、バリンのコードへと変化する[21]。
このようなヘモグロビンβサブユニットのポリペプチド鎖内の一次構造の変化は、低酸素状態におけるヘモグロビンマルチサブユニット複合体の機能を変化させる。赤血球が体内の組織に酸素を放出すると、変異したヘモグロビンタンパク質は赤血球内でくっつき初め、半固体構造を形成する。これにより、赤血球の形状が歪み、特徴的な「鎌状」の形になり、細胞の柔軟性が低下する。この硬くて歪んだ赤血球は、血管内に蓄積して閉塞を引き起こすことがある。その閉塞は組織への血流を妨げ、組織が死滅して患者に大きな苦痛をもたらすことがある[23]。
癌
[編集]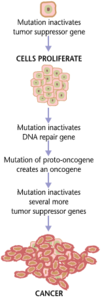
癌(がん)は、遺伝子の変異とタンパク質の不適当な翻訳の結果として形成される。癌細胞は異常に増殖するだけでなく、抗アポトーシス性あるいはアポトーシス促進性の遺伝子またはタンパク質の発現を抑制する。ほとんどの癌細胞では、細胞内でオン/オフのシグナル伝達物質として機能するシグナル伝達タンパク質Rasに変異が見られる。癌細胞の中では、Rasタンパク質は持続的に活性化し、何の調節もないために細胞の増殖が促進される[24]。さらに、ほとんどの癌細胞は、損傷した遺伝子のゲートキーパー(守護者)として働き悪性細胞のアポトーシスを開始する調節遺伝子p53の変異コピーを2つ持っている。正常なp53が存在しない場合、その細胞はアポトーシスを誘導することも、他の細胞に破壊を促すシグナルを送ることもできない[25]。
腫瘍細胞が増殖すると、1つの部位に留まって良性と呼ばれるか、または悪性細胞となって体の他の部位に移動する。多くの場合、この悪性細胞は、組織の細胞外マトリックスを分解するプロテアーゼを分泌する。これにより、癌は「転移」と呼ばれる末期段階に入り、細胞が血流やリンパ系に入って体内の新たな部位に移動する[24]。
参照項目
[編集]- セントラルドグマ - 遺伝情報がDNAからmRNAを経てタンパク質に伝達されるという分子生物学の概念
- コドン - DNA上の塩基配列とタンパク質のアミノ酸配列とを対応付ける3個1組の塩基配列
- 遺伝子発現 - 遺伝子の情報をもとにタンパク質やRNAが合成される過程
- アミノ酸合成 - 生物学的経路(代謝経路)におけるアミノ酸合成過程
脚注
[編集]- ^ a b c d e f g h i j Alberts B (2015). Molecular biology of the cell (Sixth ed.). Abingdon, UK: Garland Science, Taylor and Francis Group. ISBN 978-0815344643
- ^ O'Connor C (2010). Essentials of Cell Biology. NPG Education: Cambridge, MA 3 March 2020閲覧。
- ^ a b Wang YC, Peterson SE, Loring JF (February 2014). “Protein post-translational modifications and regulation of pluripotency in human stem cells”. Cell Research 24 (2): 143–160. doi:10.1038/cr.2013.151. PMC 3915910. PMID 24217768.
- ^ Scheper GC, van der Knaap MS, Proud CG (September 2007). “Translation matters: protein synthesis defects in inherited disease”. Nature Reviews. Genetics 8 (9): 711–723. doi:10.1038/nrg2142. PMID 17680008.
- ^ Berg JM, Tymoczko JL, Gatto Jr GJ, Stryer L (2015). Biochemistry (Eighth ed.). US: W. H. Freeman and Company. ISBN 9781464126109
- ^ a b c d e f Toole G, Toole S (2015). AQA biology A level. Student book (Second ed.). Great Clarendon Street, Oxford, OX2 6DP, UK: Oxford University Press. ISBN 9780198351771
- ^ Berk A, Lodish H, Darnell JE (2000). Molecular cell biology (4th ed.). New York: W.H. Freeman. ISBN 9780716737063
- ^ a b “Eukaryotic pre-mRNA processing”. Khan Academy. 9 March 2020閲覧。
- ^ Jo BS, Choi SS (December 2015). “Introns: The Functional Benefits of Introns in Genomes”. Genomics & Informatics 13 (4): 112–118. doi:10.5808/GI.2015.13.4.112. PMC 4742320. PMID 26865841.
- ^ “Stages of translation (article)” (英語). Khan Academy. 10 March 2020閲覧。
- ^ “Nucleus and ribosomes (article)” (英語). Khan Academy. 10 March 2020閲覧。
- ^ a b Cooper GM (2000). The cell : a molecular approach (2nd ed.). Sunderland (MA): Sinauer Associates. ISBN 9780878931064
- ^ “Protein structure: Primary, secondary, tertiary & quatrenary (article)” (英語). Khan Academy. 11 March 2020閲覧。
- ^ Duan G, Walther D (February 2015). “The roles of post-translational modifications in the context of protein interaction networks”. PLoS Computational Biology 11 (2): e1004049. Bibcode: 2015PLSCB..11E4049D. doi:10.1371/journal.pcbi.1004049. PMC 4333291. PMID 25692714.
- ^ a b Schubert M, Walczak MJ, Aebi M, Wider G (June 2015). “Posttranslational modifications of intact proteins detected by NMR spectroscopy: application to glycosylation”. Angewandte Chemie 54 (24): 7096–7100. doi:10.1002/anie.201502093. PMID 25924827.
- ^ Ciechanover A (January 2005). “Proteolysis: from the lysosome to ubiquitin and the proteasome”. Nature Reviews. Molecular Cell Biology 6 (1): 79–87. doi:10.1038/nrm1552. PMID 15688069.
- ^ Brenner S, Miller JH (2001). Encyclopedia of genetics. Elsevier Science Inc. pp. 2800. ISBN 978-0-12-227080-2
- ^ Murn J, Shi Y (August 2017). “The winding path of protein methylation research: milestones and new frontiers”. Nature Reviews. Molecular Cell Biology 18 (8): 517–527. doi:10.1038/nrm.2017.35. PMID 28512349.
- ^ Drazic A, Myklebust LM, Ree R, Arnesen T (October 2016). “The world of protein acetylation”. Biochimica et Biophysica Acta 1864 (10): 1372–1401. doi:10.1016/j.bbapap.2016.06.007. PMID 27296530.
- ^ Bannister AJ, Kouzarides T (March 2011). “Regulation of chromatin by histone modifications”. Cell Research 21 (3): 381–395. doi:10.1038/cr.2011.22. PMC 3193420. PMID 21321607.
- ^ a b Habara A, Steinberg MH (April 2016). “Minireview: Genetic basis of heterogeneity and severity in sickle cell disease”. Experimental Biology and Medicine 241 (7): 689–696. doi:10.1177/1535370216636726. PMC 4950383. PMID 26936084.
- ^ Sickle Cell Anemia. StatPearls Publishing. (2020). PMID 29489205 12 March 2020閲覧。.
- ^ Ilesanmi OO (January 2010). “Pathological basis of symptoms and crises in sickle cell disorder: implications for counseling and psychotherapy”. Hematology Reports 2 (1): e2. doi:10.4081/hr.2010.e2. PMC 3222266. PMID 22184515.
- ^ a b “Cell Division, Cancer | Learn Science at Scitable” (英語). www.nature.com. 2021年11月30日閲覧。
- ^ “p53, Cancer | Learn Science at Scitable” (英語). www.nature.com. 2021年11月30日閲覧。
推薦図書
[編集]- 『細胞の分子生物学 第6版』Bruce Alberts, Alexander D. Johnson, Julian Lewis, David Owen Morgan, Martin C. Raff, K. Roberts、ニュートンプレス、2017年。ISBN 978-4-315-52062-0。OCLC 1022211448。
外部リンク
[編集]- A useful video visualising the process of converting DNA to protein via transcription and translation
- Video visualising the process of protein folding from the non-functional primary structure to a mature, folded 3D protein structure with reference to the role of mutations and protein mis-folding in disease
- A more advanced video detailing the different types of post-translational modifications and their chemical structures


