β-グルカン

β-グルカン(β-glucan、べーた-)とは、グルコースがグリコシド結合で連なった多糖であるグルカンの内、β-グリコシド結合で繋がった重合体の総称である。植物や菌類、細菌など自然界に広く分布し、いくつかのキノコ類などに由来するβ-グルカンは免疫賦活作用、制癌作用を持つとされる。単にβ-グルカンと言った場合は、通常β-1,3-グルカンのことを指す。β-グルカンは結合様式により様々な名称を持つ。
歴史
[編集]1940年代には酵母から抽出した混合物の免疫特性が研究されており、1941年、ルイス・ピレマー(Louis Pillemer)は酵母細胞壁抽出物にザイモサン(Zymosan)と名付けた[1]。ザイモサンは1943年に事典にも登録されている[2]。
1958年にDi CarloとFioreによってザイモサンの50 - 60%がグルカンである事が確認された[3]。1961年にはRiggiとDiLuzioによってザイモサンの活性成分がβ-1,3-グルカンである事が確認された[3][4]。
穀物および菌類製品は、何世紀にもわたって医薬品や化粧品用途として使用されてきた。しかしながらβ-グルカンの特異的な機能性について20世紀になるまで調査されていなかった。β-グルカンは、最初地衣類から発見され、その後すぐに大麦からも発見された。1981年にコレステロール低下作用が報告されたオート麦β-グルカンは特に注目された[5]。
1997年、FDAは1日当たり3.0gのオート麦β-グルカン摂取はコレステロールと冠状動脈性心疾患のリスクを低下させるという効能表示文言を承認した。承認された文言は後に修正され、次の由来に含まれるβ-グルカンが追加されている。ロールドオーツ(オートミール)、オート麦ふすま、オート麦全粒粉、Oatrim(非デンプン多糖から作った脂肪代替物の商品名)、大麦全粒粉、大麦ベータ繊維。
許容される表示の例:「飽和脂肪酸とコレステロールが少ない食事の一種であるオートミール由来の可溶性食物繊維は、心疾患のリスクを減少させます。この効果を得るのに必要な一日あたりの量である3.0gのうち、0.75gのβ-グルカン水溶性繊維を一杯のオートミールは供給します。」この健康強調表示の表現は、連邦官報21号連邦規則集101.81「特定の食品に由来する可溶性繊維および冠状動脈心疾患(CHD)のリスク」に記載されている[6]。
構造
[編集]グルカンはD-グルコース六員環が直線的に結合しているが、由来に依り様々な結合様式が見られる。最も典型的なβ-グルカンは1,3-グリコシド結合を骨格とする。厳密には、β-グルカンは、β型グリコシド結合によって繋がったD-グルコース鎖の多糖類であるが、慣例的には全てのβ-D-グルコース多糖類がβ-グルカンとして分類されるわけではない[7]。セルロースはβ-1,4-D-グルカンの直鎖状高分子であるが、不溶性であり他の穀物や酵母β-グルカンとは物理化学的性質が異なるため、一般的にはβ-グルカンとは見なされない[8]。
幾つかのβ-グルカン分子は、主鎖であるβ-グルカン骨格の結合部位とは別の位に分岐グルコース側鎖を持つ。更にこれらの側鎖はPolysaccharide-Kのようにタンパク質のような他のタイプの分子が結合していることもある。
最も一般的なβ-グルカンの形態は、D-グルコースがβ-1,3結合したものである。酵母および菌類のβ-グルカンには1,6結合の分岐があり、穀物β-グルカンにはβ-1,3とβ-1,4結合の骨格が見られる。側鎖の導入率、位置、長さは免疫調節機能に影響があると推測される。分子量、形状、構造の違いは生理活性に影響する[9][10]。
| 由来 | 名称 | 骨格 | 分岐 | 水溶性 |
|---|---|---|---|---|
| 穀物 |  |
なし | 可溶[9] | |
| 細菌 | カードラン | 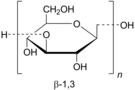 |
なし | 不溶[11] |
| キノコ | レンチナン
グリフォラン |
 |
グルコース残基がβ-1,6結合している | 不溶[12] |
| 酵母 | ザイモサン |  |
β-1,3-グルカンの側鎖がβ-1,6結合している | 不溶[10] |
| 海藻 | ラミナラン |  |
β-1,3-グルカンの側鎖がβ-1,6結合している | 可溶[13] |
β-グルカンの種類
[編集]
β-グルカンは、細菌、真菌、酵母、オート麦、大麦といった穀物の細胞壁を構成する天然成分である。
各タイプのβ-グルカンは分子骨格、分岐レベル、分子量の違いをもち、溶解性や生理的性質へ影響する。
最も一般的なβ-1,3-グルカンの供給元はパン酵母(Saccharomyces cerevisiae)の細胞壁である。酵母由来のβ-1,3-グルカンしばしば不溶性である。しかし、β-(1,3)(1,4)-グルカンは、オート麦や大麦、または頻度はずっと低いがライ麦や小麦といった幾つかの穀物のふすまより抽出される。他の供給源として幾つかの海藻(コンブ属)や[14]、霊芝、コフキサルノコシカケ(Ganoderma applanatum)[15]、椎茸、チャーガ、舞茸といった特別なキノコ類が知られている[16]。

穀物のβ-グルカン
[編集]オート麦、大麦、小麦、ライ麦由来の穀物β-グルカンは健康に良い影響を与える様々な生理的性質を持つ。オート麦および大麦由来β-グルカンは、高コレステロール血症患者を対象に血糖値調整効果について研究されている[17]。
穀物β-グルカンの骨格にはβ-1,3結合とβ-1,4結合が混在しており、分岐は見られない[13]。オート麦と大麦では三量体と四量体の1,4結合の比に違いが見られる。大麦の1,4結合による重合度は4よりも大きい。しかし、大麦の大部分は三量体か四量体である。オート麦では、β-グルカンは穀粒の胚乳で主に見られ、特に胚乳の外層に見られる[9]。
キノコのβ-グルカン
[編集]種々のキノコ類でβ-グルカンが確認されている。たもぎ茸、シイタケ、マイタケ、スエヒロタケ等に含まれるβ-グルカンは、直鎖β-1,3-グルカン骨格にβ-1,6結合でグルコース残基が一つ結合している。シイタケのβ-グルカンであるレンチナンは5:2の割合でグルコース残基の分岐を持つ。マイタケのβ-グルカンはグリフォランと呼ばれ、スエヒロタケのβ-グルカンはシゾフィランと呼ばれる[13][18]。
酵母のβ-グルカン
[編集]酵母の細胞壁に見られるβ-グルカンは直鎖β-1,3結合の骨格から30残基の側鎖がβ-1,6結合し分岐している[13]。1990年代に行われたヒト臨床試験でPGG-グルカンの高リスク手術患者での感染への影響が評価された。これらの研究においてPGG-グルカンは有意な減少を示した[19][20][21][22]。
経口投与された酵母グルカンはアレルギー性鼻炎の原因となるサイトカインIL-4およびIL-5を減少させ、IL-12レベルを上昇させたと報告されている[23]。
海藻のβ-グルカン
[編集]海藻、特にコンブ属(Laminaria)に多く含まれるβ-グルカンであるラミナラン(Laminaran)は直鎖β-1,3-グルカン骨格に、β-1,6-グリコシド結合で僅かに側鎖が結合していると報告されている。ラミナランは他のβ-グルカンと比較すると分子量が小さく、末端残基にマンニトールの様なグルコース以外の単糖が結合している[13][18]。
その他のβ-グルカン
[編集]地衣類には構造多糖としてリケニンが含まれる。リケニンはβ-1,4結合とβ-1,3結合が約5:2の割合で組み合わさった直鎖上のβ-グルカンである[18]。
土壌細菌(Agrobacterium biobar)から抽出されたβ-グルカンであるカードランは、分岐がない直鎖状のβ-1,3-グルカンである[13]。
ユーグレナ(Euglena gracilis)が含有するβ-グルカンであるパラミロンも分岐がない直鎖状のβ-1,3-グルカンである[13]。
β-グルカンの吸収性
[編集]腸細胞はβ-1,3-グルカンおよび類似の化合物の細胞壁を越えてのリンパへの輸送を促進し、リンパにおいてマクロファージと相互作用し免疫機能を活性化する[24]。
放射能標識による検証で、β-グルカンの小さい断片および大きい断片が血清中に見出され、これらが腸管より吸収されたことが示唆されている[25]。
パイエル板上に存在するM細胞は不溶性のグルカン粒子全体を腸管関連リンパ組織(GALT)へ物理的に輸送する[26]。
デクチン1
[編集]デクチン-1(Dectin-1)とはβ-1,3-グルカンおよびβ-1,6-グルカンの受容体であり、C型レクチンに属する。ヒトのデクチン1は9つのアイソフォームが存在する。β-グルカンの構造により結合性が異なり、分子量が数十万以上の(1-3)-β-D-グルカンへの結合性が高い。またオリゴ領域では10糖以上のものを認識し結合する[27]。
マクロファージや樹状細胞はデクチン1でβ-グルカンを認識する。デクチン1はT細胞との相互作用を促進すると推測される。真菌細胞壁成分の50%以上を占める β-グルカンを特異的に認識するデクチン1は、TLRsと並んで真菌感染に対する防御応答において重要な役割を果たしていると考えられる[27]。
マウスのミクログリア表面にデクチン-1が発現しており、デクチン-1を介してβ-グルカン粒子の貪食と活性酸素種の産生が起きている。しかしマクロファージや樹状細胞とは異なり、β-グルカンによるミクログリアの活性化ではサイトカイン類の有意な産生はみられなかった。従って、ミクログリアはβ-グルカンに特異な反応を示し、中枢神経系における抗真菌免疫で重要な役割を果たしている可能性が示唆されている[28]。
しかしながらデクチン1による真菌の認識は、β-グルカンが露出する限られた形態の時にしか起こらない。例えばCandida albicansは酵母型と菌糸型の2つの形態を取るが、デクチン1は酵母型とは結合するが菌糸型とはほとんど結合しない。
デクチン1ノックアウトマウス由来の樹状細胞では、本来誘導されるはずのTNF産生が認められず、β-グルカンによる免疫賦活活性にデクチン1が必須である事が明らかとなっている。マウスへのデクチン1中和抗体投与により、β-グルカンによる抗腫瘍活性発現が有意に低下し、腫瘍が増殖した。これよりデクチン1はβ-グルカンの抗腫瘍活性発現においても重要な役割を果たしていることが示唆されている[27]。
酵母β-グルカンの生理機能
[編集]酵母中の細胞壁にあるβ-グルカンには1,3-グルカンに加え、1,6-グルカンも含まれる[29]。
1990年代からの人体への臨床試験によってPGG-グルカンがリスクの高い外科手術に起因する病気に感染した患者に与える影響が評価されている。これらの研究においては、PGG-グルカンが合併症を大きく減少させたことが明らかになっている[30][31][32][33]。
β1,3Dグルカンが生体内に入ると免疫細胞に働きかけて悪性新生物(ガン細胞)を攻撃させたり、抗酸化酵素(スーパーオキシドディスムターゼ、SODに代表される)に働きかけてラジカル消去効果を高めたりするという前医療統計学的実験論文も公表されている[34]。一方、2007年に発表された酵母細胞壁画分の実験では、抗酸化作用はβ-グルカンそのものよりも酵母細胞壁タンパク質によるものが大きいと結論づけている[35]。酵母ベータ1,3Dグルカンの持つ抗酸化作用・機序については前述の通り2008年6月末現在では未解明な部分が多い。
酵母β-グルカンの抗酸化作用
[編集]1980年代後半から2000年代にかけて一部研究者の手によって酵母(Saccharomyces cerevisiae)から抽出したベータ1,3Dグルカンの持つ抗酸化作用の有無に関する実験検証が行われていることは上述されている。酵母β-グルカンが放射線被爆したマウスで造血機能を回復すると報告されており、著者はこの中で副次的実験結果としてβ-グルカンの持つラジカル捕捉能について記している[36]。酵母β-グルカンを含む高分子多糖成分が抗酸化作用にかかわっているのかということについては、より精細かつ具体的な検証が期待される(2008年11月1日現在)。
β-グルカンと放射線被曝
[編集]放射線(コバルト60)を被曝させたマウスにβ-1,3-グルカンを投与したところ、9.0Gy照射で生存率が0%から53%以上に向上した。これは造血の回復促進による特異的な効果と考えられた。12.0Gy以上の線量では生存率の向上は見られなかった[37]。
副作用
[編集]βグルカンによってアレルギーの増悪がおきることが報告された[38]。元々アレルゲンの多くに真菌が存在しその多くが細胞壁にβグルカンを有していることから、免疫細胞がこれを検知することでアレルギーが増悪するのではないかと考えられる[38]。
またインドメタシンやアスピリンとβグルカンが同時に投与された時、ラットに致死的な毒性が現れた。この際サイトカインの異常高値が確認された[38]。
研究略年表
[編集]- 1941年 ルイス・ピレマー(Louis Pillemer)は酵母細胞壁抽出物にザイモサン(Zymosan)と名付けた[1]。
- 1958年 Di CarloとFioreによってザイモサンの50 - 60%がグルカンである事が確認された[3]。
- 1961年 テュレーン大学のRiggiとニコラス・ディルジオ(Nicholas R. DiLuzio)によってザイモサンの活性成分がβ-1,3-グルカンである事が確認された[3][4]。
- 1963年 βグルカンが、がん細胞の縮小に効果を持つことが初めて発表された。
- 1984年 米マサチューセッツ工科大学(MIT)とAlpha Beta Technology社(ABT)の産学共同研究で酵母βグルカンの微粒子精製に成功。
- 1985年 日本で、シイタケ由来のレンチナンが天然由来の抗がん剤として認可を受けた。2007年現在ではこの他に、カワラタケ由来のクレスチン、スエヒロタケ由来のソニフィランも認可を受けている。
- 1986年 致死量の放射線(コバルト60)被曝後のマウスへβ-1,3-グルカンを投与したところ、造血が回復し生存率が向上したと報告[37]。
- 1990年 MITとABTが共同で酵母βグルカン粒子から医療向け水溶性βグルカン(注射液)の開発に成功。
- 1990年 水溶性βグルカン(実験用注射液と思われるリン酸グルカン)の開発特許認可(米パテント番号4,975,421)
- 1994年 米ルイビル大学で酵母βグルカンが癌に及ぼす影響の研究を開始。
- 1996年 W.K. Washbum、R. Gttschalk、I. Otsu等の研究陣が臓器移植ラットを使って実施した水溶性ベータグルカンの実験では、臓器移植後のGVHDや移植拒絶反応を有意に増加させなかったという結果が発表された[39]。
- 1999年 米ルイビル大学微生物学研究室と同大学ジェームズ・グラハム・ブラウン癌センターが共同で酵母βグルカンと最新分子標的抗癌剤(モノクロナール抗体抗癌剤)の併用効果について前医療実験開始。
- 2001年 正常ヒト皮膚線維芽細胞(NHDF)と水溶性グルカンの結合を調べたところ、NHDFには少なくとも2つのグルカン結合部位が存在すると示された。またグルカンはNHDFからのインターロイキン-6遺伝子発現を刺激した。これは皮膚線維芽細胞がグルカンを認識する最初の報告であり、グルカンに反応するのが免疫系細胞に限定されないと示唆された[40]。
- 2002年 酵母由来のβ1,3-グルカンをマウスに経口投与し炭疽症予防効果を検討したところ、未処理群のマウスは10匹中5匹の生存だったが、β-グルカン投与群では生存率は100%であった。また抗腫瘍効果が見られたとする実験報告がされている[41]。
- 2004年 米免疫医療誌[The Journal of Immunology]2004 173で経口投与による酵母β1,3Dグルカンと分子標的抗癌剤(リツキシマブ、トラスツズマブ、セツキシマブ等)併用による抗腫瘍相乗効果の前医療動物実験結果が発表された。
- 2005年 米外科医療誌[Neurosurgical Review]2005年28(4)号では、H.カヤリ、M.F.オズダグ等の研究陣が酸化ストレス状況に置かれたラットを使って実施したベータグルカンの抗酸化作用の実証実験が発表された。
- 2007年 米食品化学誌[Journal of Agricultural Food Chemistry]55(12):4710-6でS.C.Jaehrig、S.Rohn等によって酵母細胞壁抽出複合体は、(1-->3)(1-->6)ベータDグルカン画分の抗酸化作用よりも細胞壁蛋白画分の抗酸化作用が大きいという実験結果が発表された。
- 2009年12月 北海道大人獣共通感染症リサーチセンター宮崎忠昭らの研究チームの実験結果から、インフルエンザウイルスに感染したマウスへβグルカンとEF乳酸菌の組み合わせを投与すると、インフルエンザウイルスに対する免疫力が高まり重症化を防ぐ効果があるという結果が発表された。
脚注
[編集]- ^ a b Shih-Houng Young, Vincent Castranova (2005-03-18). Toxicology of 1 - 3-Beta-Glucans: Glucans as a Marker for Fungal Exposure. CRC Press. p. 70. ISBN 9780415700375
- ^ “zymosan”. Webster's Dictionary. メリアム・ウェブスター社. 2017年2月22日閲覧。
- ^ a b c d “平成24年度「食品の機能性評価事業」結果報告” (PDF). 日本健康・栄養食品協会. p. 30. 2017年2月22日閲覧。
- ^ a b M. Novak & V. Vetvicka (2008-10-09). “β-Glucans, History, and the Present: Immunomodulatory Aspects and Mechanisms of Action”. Journal of Immunotoxicology 5 (1): 47-57. doi:10.1080/15476910802019045.
- ^ R W Kirby, J W Anderson, B Sieling, E D Rees, W J Chen, R E Miller, and R M Kay (1981). “Oat-bran intake selectively lowers serum low-density lipoprotein cholesterol concentrations of hypercholesterolemic men.”. The American Journal of Clinical Nutrition 34 (5): 824-829. PMID 6263072.
- ^ “101.81 Health claims: Soluble fiber from certain foods and risk of coronary heart disease (CHD).”. 合衆国政府印刷局. 2017年9月28日閲覧。
- ^ Djordje B. Zeković, Stefan Kwiatkowski, Miroslav M. Vrvić, Dragica Jakovljević & Colm A. Moran (2005). “Natural and Modified (1→3)-β-D-Glucans in Health Promotion and Disease Alleviation”. Critical Reviews in Biotechnology 25 (4): 205-230. doi:10.1080/07388550500376166.
- ^ Per Sikora, Susan M. Tosh, Yolanda Brummer, Olof Olsson (2012). “Identification of high β-glucan oat lines and localization and chemical characterization of their seed kernel β-glucans.”. Food Chemistry 137: 83-91. doi:10.1016/j.foodchem.2012.10.007. PMID 23199994.
- ^ a b c YiFang Chu (2013). Oats Nutrition and Technology. Wiley Blackwell. ISBN 978-1-118-35411-7
- ^ a b Julia J. Volman, Julian D. Ramakers, Jogchum Plat (2008). “Dietary modulation of immune function by β-glucans”. Physiology & Behavior 94 (2): 276-284. doi:10.1016/j.physbeh.2007.11.045.
- ^ Mcintosh, M (19 October 2004). “Curdlan and other bacterial (1→3)-β-D-glucans”. Applied Microbiology and Biotechnology 68 (2): 163-173. doi:10.1007/s00253-005-1959-5.
- ^ Han, Man Deuk (March 2008). “Solubilization of water-insoluble β-glucan isolated from Ganoderma lucidum”. Journal of Environmental Biology.
- ^ a b c d e f g NAKASHIMA, Ayaka; YAMADA, Koji; IWATA, Osamu; SUGIMOTO, Ryota; ATSUJI, Kohei; OGAWA, Taro; ISHIBASHI-OHGO, Naoko; SUZUKI, Kengo (2018). “β-Glucan in Foods and Its Physiological Functions” (英語). Journal of Nutritional Science and Vitaminology 64 (1): 8-17. doi:10.3177/jnsv.64.8. ISSN 0301-4800.
- ^ Jane Teas (1983). “The dietary intake of Laminaria, a brown seaweed, and breast cancer prevention”. Nutrition and Cancer 4 (3): 217-222. doi:10.1080/01635588209513760. PMID 6302638.
- ^ Taichi Usui, Yoshio Iwasaki, Takashi Mizuno, Motohiro Tanaka, Kenkichi Shinkai, Masao Arakawa (1983). “Isolation and characterization of antitumor active β-d-glucans from the fruit bodies of Ganoderma applanatum”. Carbohydrate Research 115: 273-280. doi:10.1016/0008-6215(83)88159-2.
- ^ Solomon P. Wasser, Alexander L. Weis (1999). “Therapeutic Effects of Substances Occurring in Higher Basidiomycetes Mushrooms: A Modern Perspective”. Critical Reviews in Immunology 19 (1): 65-96. doi:10.1615/CritRevImmunol.v19.i1.30. PMID 9987601.
- ^ Geraldine F Keogh, Garth JS Cooper, Tom B Mulvey, Brian H McArdle, Graeme D Coles, John A Monro, and Sally D Poppitt (2003). “Randomized controlled crossover study of the effect of a highly beta-glucan-enriched barley on cardiovascular disease risk factors in mildly hypercholesterolemic men”. The American Journal of Clinical Nutrition 78 (4): 711-718. PMID 14522728.

- ^ a b c “β-グルカンについて” (PDF). 日本食品分析センター (2004年). 2018年4月20日閲覧。
- ^ T J Babineau, P Marcello, W Swails, A Kenler, B Bistrian, and R A Forse (1994). “Randomized phase I/II trial of a macrophage-specific immunomodulator (PGG-glucan) in high-risk surgical patients”. Annals of Surgery 220 (5): 601-609. doi:10.1097/00000658-199411000-00002. PMC 1234447. PMID 7979607.

- ^ Babineau TJ, Hackford A, Kenler A, Bistrian B, Forse RA, Fairchild PG, Heard S, Keroack M, Caushaj P, Benotti P. (1994). “A phase II multicenter, double-blind, randomized, placebo-controlled study of three dosages of an immunomodulator (PGG-glucan) in high-risk surgical patients”. Arch Surg 129 (11): 1204-1210. doi:10.1001/archsurg.1994.01420350102014. PMID 7979954.
- ^ E. Patchen Dellinger, MD; Timothy J. Babineau, MD; Paul Bleicher, MD, PhD; et al (1999). “Effect of PGG-glucan on the Rate of Serious Postoperative Infection or Death Observed After High-Risk Gastrointestinal Operations”. Arch Surg 134 (9): 977-983. doi:10.1001/archsurg.134.9.977. PMID 10487593.

- ^ W Browder, D Williams, H Pretus, G Olivero, F Enrichens, P Mao, and A Franchello (1990). “Beneficial effect of enhanced macrophage function in the trauma patient”. Annals of Surgery 211 (5): 605-613. PMC 1358234. PMID 2111126.

- ^ Kirmaz C, Bayrak P, Yilmaz O, Yuksel H. (2005). “Effects of glucan treatment on the Th1/Th2 balance in patients with allergic rhinitis: a double-blind placebo-controlled study”. European Cytokine Network 16 (2): 128-134. PMID 15941684.
- ^ A Frey, K T Giannasca, R Weltzin, P J Giannasca, H Reggio, W I Lencer, M R Neutra (1996). “Role of the glycocalyx in regulating access of microparticles to apical plasma membranes of intestinal epithelial cells: implications for microbial attachment and oral vaccine targeting”. Journal of Experimental Medicine 184 (3): 1045-1059. doi:10.1084/jem.184.3.1045. PMC 2192803. PMID 9064322.

- ^ S. Tsukagoshi, Y. Hashimoto, G. Fujii, H. Kobayashi, K. Nomoto, K. Orita (1984). “Krestin (PSK)”. Cancer Treatment Reviews 11 (2): 131-155. doi:10.1016/0305-7372(84)90005-7. PMID 6238674.
- ^ Feng Hong, Jun Yan, Jarek T. Baran, Daniel J. Allendorf, Richard D. Hansen, Gary R. Ostroff, Pei Xiang Xing, Nai-Kong V. Cheung and Gordon D. Ross (2004). “Mechanism by Which Orally Administered β-1,3-Glucans Enhance the Tumoricidal Activity of Antitumor Monoclonal Antibodies in Murine Tumor Models”. J Immunology 173 (2): 797-806. doi:10.4049/jimmunol.173.2.797. PMID 15240666.

- ^ a b c Yoshiyuki Adachi「(1→3)-β-D-グルカン受容体Dectin-1の自然免疫及び抗腫瘍免疫活性作用と真菌感染防御における役割」『Trends in Glycoscience and Glycotechnology』第19巻、2007年、195-207頁、doi:10.4052/tigg.19.195。

- ^ Shah, Vaibhav B.; Huang, Yongcheng; Keshwara, Rohan; Ozment-Skelton, Tammy; Williams, David L.; Keshvara, Lakhu (2008-03-01). “β-Glucan Activates Microglia without Inducing Cytokine Production in Dectin-1-Dependent Manner”. The Journal of Immunology 180 (5): 2777–2785. doi:10.4049/jimmunol.180.5.2777. ISSN 0022-1767.
- ^ Manners, David J. (1973年2月2日). “The Structure of a β-(1->3)-D-Glucan from Yeast Cell Walls”. Biochemistry.
- ^ Babineau, TJ; Marcello P; Swails W; Kenler A; Bistrian B; Forse RA (November 1994). “Randomized phase I/II trial of a macrophage-specific immunomodulator (PGG-glucan) in high-risk surgical patients”. Annals of Surgery (アメリカ合衆国: リッピンコット・ウィリアムズ・アンド・ウィルキンス) 220 (5): 601-609. doi:10.1097/00000658-199411000-00002. PMC 1234447. PMID 7979607.
- ^ Babineau, TJ; Hackford A; Kenler A; Bistrian B; Forse RA; Fairchild PG; Heard S; Keroack M et al. (November 1994). “A phase II multicenter, double-blind, randomized, placebo-controlled study of three dosages of an immunomodulator (PGG-glucan) in high-risk surgical patients”. Archives of surgery (Chicago, Ill. : 1960) (アメリカ) 129 (11): 1204-1210. doi:10.1001/archsurg.1994.01420350102014. ISSN 0004-0010. PMID 7979954.
- ^ Dellinger, EP; Babineau TJ, Bleicher P, Kaiser AB, Seibert GB, Postier RG, Vogel SB, Norman J, Kaufman D, Galandiuk S, Condon RE (September 1999). “Effect of PGG-glucan on the rate of serious postoperative infection or death observed after high-risk gastrointestinal operations. Betafectin Gastrointestinal Study Group”. Archives of surgery (シカゴ, Ill. : 1960) (アメリカ: アメリカ医学会) 134 (9): 977-983. doi:10.1001/archsurg.134.9.977. PMID 10487593.
- ^ Browder, W; Williams D; Pretus H; Olivero G; Enrichens F; Mao P; Franchello A (May 1990). “Beneficial effect of enhanced macrophage function in the trauma patient”. Annals of Surgery (アメリカ合衆国: リッピンコット・ウィリアムズ・アンド・ウィルキンス) 211 (5): 605-612; discussion 612-613. ISSN 0003-4932. PMC 1358234. PMID 2111126.
- ^ A.Pietrzycka, M.ST.Pniewski, A.M.Waszkielewicz, et al. (2006). “EFFECT OF VITA GLUCAN ON SOME ANTIOXIDANT PARAMETERS OF THE HUMAN BLOOD. IN VITRO STUDY”. Acta Poloniae Pharmaceutica - Drug Research, 63 (6): 547-551. ISSN 0001-6837.
- ^ S.C. Jaehrig, S. Rohn, L.W. Kroh, L-G. Fleischer, and T. Kurz (2007). “In Vitro Potential Antioxidant Activity of (1→3),(1→6)-β-d-Glucan and Protein Fractions from Saccharomyces cerevisiae Cell Walls”. J. Agric. Food Chem. 55 (12): 4710-4716. doi:10.1021/jf063209q.
- ^ Patchen, M.L.; D'Alesandro, M.M.; Brook, I.; Blakely, W.F.; MacVittie, T.J. (1987). “Glucan: Mechanisms Involved in Its “Radioprotective” Effect” (英語). Journal of Leukocyte Biology 42 (2): 95–105. doi:10.1002/jlb.42.2.95.
- ^ a b Patchen, M. L.; MacVittie, T. J. (1986-02). “Comparative effects of soluble and particulate glucans on survival in irradiated mice”. Journal of Biological Response Modifiers 5 (1): 45–60. ISSN 0732-6580. PMID 3958754.
- ^ a b c 大野尚仁「βグルカンの生体防御系修飾作用」『日本細菌学雑誌』第55巻第3号、日本細菌学会、2000年8月、527-537頁、doi:10.3412/jsb.55.527、ISSN 00214930、NAID 10005225385。
- ^ W.Kenneth Washburn and Ichiro Otsu and Rita Gottschalk and Anthony P. Monaco (1996). “PGG-Glucan, a Leukocyte-Specific Immunostimulant, Does Not Potentiate GVHD or Allograft Rejection”. Journal of Surgical Research 62 (2): 179-183. doi:10.1006/jsre.1996.0192. ISSN 0022-4804.
- ^ Kougias, Panagiotis; Wei, Duo; Rice, Peter J.; Ensley, Harry E.; Kalbfleisch, John; Williams, David L.; Browder, I. William (2001-06). Kozel, T. R.. ed. “Normal Human Fibroblasts Express Pattern Recognition Receptors for Fungal (1→3)-β- d -Glucans” (英語). Infection and Immunity 69 (6): 3933–3938. doi:10.1128/IAI.69.6.3933-3938.2001. ISSN 0019-9567. PMC 98428. PMID 11349061.
- ^ V. Vetvicka, K. Terayama, R. Mandeville, P. Brousseau, B. Kournikakis, G. Ostroff, Québec Canada, Alberta Canada (2002). “Pilot Study : Orally-administered yeast β1,3-glucan prophylactically protects against anthrax infection and cancer in mice”. Journal of the American Nutraceutical Association 5: 16-20. ISSN 1521-4524.
