ビタミンB12全合成

生体物質であるビタミンB12の全合成はハーバード大学のロバート・ウッドワードとチューリッヒ工科大学のアルバート・エッシェンモーザー[1][2][3][4]らの研究グループによって1972年に達成され[5][6]、1973年に論文が発表された[7][8][9][10]。ビタミンB12の全合成は現在でも2例目の報告が上がっておらず[7]、この業績は天然物合成の金字塔と考えられている[11][12][13][14]。全合成の研究は1960年にETH(チューリッヒ工科大学)、1961年にハーバード大学で始まった[5]。1965年からは二者の協力事業となり、少なくとも91人の博士研究員(ほとんどはハーバード大学)と12人の博士課程の学生(ETH)が関わった。関係者の出身国は19か国にわたる。全合成の論文には、研究に深く携わったチューリッヒの7人、ケンブリッジの17人の名前が載せてある。
ビタミンB12は構造が複雑であるため、合成は不可能ではないかと考えられてきた[7]。
ビタミンB12の合成には2つの異なる方法があり、この全合成に伴って1972年に達成された。この2つは複雑に組み合わさっており、ビタミンの大員環配位子であるコリンの作り方で、全体的に見れば根本的に異なっている。環Aと環Bを合成する方法("A/B法")がハーバード大学で、環Aと環Dを光反応で合成する方法("A/D法")がETHで研究された[15]。ウッドワードはA/B法を1968年(ロンドン講演)[8]、1971年[9]、1973年[10]の講演で公表しており、1972年7月にニューデリーで開かれた国際純正・応用化学連合での講演「Total Synthesis of Vitamin B12」(ビタミンB12の全合成)で完成が報告された[10]。エッシェンモーザーも1970年に行われたETHの100年記念講演でA/B法を公表している[1]ほか、環A/Dを光反応で合成するビタミンB12の合成法を1971年にボストンで行われた第23回 IUPAC会議[2]で公表している。光反応を用いる方法の完成形はサイエンスで1977年に公表された[4]。これはチューリッヒ化学協会においてエッシェンモーザーが行った講演を基に1974年に公表されたネイチャーウィッセンシャフテンの記事を英訳、加筆したものである[3]。
以下では、AB法について述べる。AD法は、初期の段階では非立体化学的だったが、1971年7月にボストンで行われた第23回IUPAC国際会議のエッシェンモーザーによる特別講演では収率が70%以上であり、天然型と非天然型の生成比率が2:1であることが公表された[2]。また、1972年8月のバンクーバーでの国際有機合成討論会では、同じくエッシェンモーザーによりカドミウム誘導体を用いることで90%以上の選択性で天然型に閉環することが発表された[16]。
この合成では、環ADの合成をウッドワードが、環BCの合成をエッシェンモーザーが行なった[6]。総工程数は90段階以上にのぼる[7]。
2つのビタミンB12を合成する方法はR.V.スティーブンス[17]やニコラウ、ソーレンセン[11]などによって評価され、そのほかの40以上の出版物上で議論された[18][19]。これはウッドワードが行った3つのB12に関する講演に基づいているので[8][9][10]、ハーバード-ETHのA/B法のみを扱っている。
ビタミンB12のX線回折による結晶解析はオックスフォード大学のドロシー・ホジキンがカリフォルニア大学ロサンゼルス校(UCLA)のケネス・ナイトレイ・トゥルーブラッドやプリンストン大学のジョン・G・ホワイトらと協力して1956年に行った[20][6]。ウッドワードによれば[21]、ハーバードのA-D合成法が有機反応がかかわる軌道対称性をコントロールするウッドワード・ホフマン則(1965年)を思いつくのに重要な役割を果たしたということである[7]。
分子[編集]
ビタミンB12(コバラミン)の分子の中心となるのはコバルトイオンを中心とするコリン構造(図中の赤い部分)である。異なるコバルト配位子が結合したビタミンがいくつかあるが、ビタミンB12の全合成で対象となるのはシアノイオンを配位子とするシアノコバラミンである。コリンの環のふちにはメチル基(8)とアミド基(6)がC1とC2の間をあけるようにつながっている。7個目のアミド基はイソプロパノール基、リン酸基、リボース基とジメチルベンズイミダゾール基によってN-アルキル化している。イミダゾール上の窒素原子の一つは、コバルトの5番目の配位子となる。全部で不斉中心となる炭素原子が9個あり、合成がより困難になっている。
 |
| ビタミンB12の概観 |
|---|
逆合成[編集]
逆合成解析では第1段階は簡単であった。1960年にビタミンB12においてアルキル基やリン酸基が結合している7番目のアミド結合がアミド加水分解によってコバル酸(cobyric acid)に変換され、それを元に戻すこともできることがフリードリッヒ、グロス、バーンハウアー(Bernhauer)、ツェラー(Zeller)によって示された[22][23][24][25]。ウッドワードやエッシェンモーザーの研究はコバル酸を合成することを目的とした形式全合成であり[26]、アルキル基などの付加は含まれていなかった[23]。
 |
| ビタミンB12の逆合成 |
|---|
C5とC15のメチル基はコリン骨格を作ってからでないと加えることができない。この部分は環ADを西側、環BCを東側と呼ぶ。これらを直接結合させて環を閉じるのは立体障害のためできないと考えられていたが、硫黄縮合を用いる方法により結合させることが可能になった。
課題[編集]
1968年の時点で、全合成には以下のような課題があった[27]。このうち1970年夏の時点で残っていた課題は、3、4、5である[28]。
- コバルト原子の導入
- 大員環の閉環
- エステルの区別(合成の途中段階では7つのカルボキシ基が全てメチルエステルになっていたがコバル酸は6つがアミドになっており、1つだけカルボキシ基が残っている)ビスノルコバリン酸ヘプタメチルエステルと、環Cのプロピオン酸メチルが結合する炭素に関してだけ立体化学が反転しているビスノルネオコバリン酸ヘプタメチルエステルの分離[29])
- 架橋部(5番目と15番目の炭素)へのメチル基の導入
- 立体化学を正常にすること。環BのC8、環CのC13などは立体化学が反転しやすかった[28]。
合成方法[編集]
環Aの合成[編集]
環Aの出発物質はm-アニシジン 1とアセトイン 2である。両者を混合してシッフ塩基とし、濃縮してメトキシジメチルインドール 3を合成する。これをグリニャール試薬であるヨウ化プロパルギル 4と反応させてプロパルギルインドーレニン(propargyl indolenine)5を合成する。これをメタノール中で三フッ化ホウ素および酸化水銀(II)と反応させることで環が閉じ、7が生成する。このとき求電子付加反応が起こり、反応中間体として 6が生成する。7において2つのメチル基はシスの位置関係にある。
 |
| ビタミンB12の環Aの合成 |
|---|
この化合物は2種類のエナンチオマーの混合物(ラセミ体)であり、(−)-α-フェニルエチルイソシアネートを用いて(+)-体のみを単離する光学分割が行われる。
 |
| ビタミンB12の合成過程における光学分割 |
|---|
環Dの合成[編集]
環Dの合成の出発物質は(S)-樟脳 8である。これをヒドロキシルアミンで酸化してオキシム 9に変換し、加水分解してアミド 10にする。それをカルボキシ基とアミドの間で脱水縮合させてラクタム11、ニトロソアミン化合物12、ジアゾ化合物13、そしてシクロペンテン14を合成する。(この反応にはカルベンが関わる。また13→14の反応ではメチル基の転位反応が起こっている)LiAlH4でこれを還元するとアルコール15が生成し、これをクロム酸で酸化するとアルデヒド16が得られる。ここでウィッティヒ反応を用い、カルボメトキシメチレントリフェニルホスホランと反応させてトランスのアルケン17を得る。これを加水分解するとカルボン酸18が生成する。
 |
| ビタミンB12の環Dの合成 |
|---|
環Aと環Dのカップリング[編集]
アミン7とカルボン酸18は、カルボン酸を塩化物にすることで縮合しアミド19になる。tert-ブチルアルコール中でカリウム tert-ブトキシドを作用させるとマイケル付加により六員環化合物20が生成する。このとき水素原子はトランスの位置関係になる。ここで、後で芳香環を部分還元することを見越し、化合物に保護基を導入する。それはケタール21のカルボニル基とイミニウム塩22(トリエチルオキソニウム四フッ化ホウ素塩)およびオルトアミド23(ナトリウムメトキシドのメタノール溶液を反応させる)のエノールエーテルである。エノールエーテル24は化合物をトルエン中で加熱し、エタノールを取り除くことで得られる。これをバーチ還元してテトラエン25を合成し、さらに酸処理することでジケトン26 を得る。これはペンタシクロノン(pentacyclenone)と命名されている。
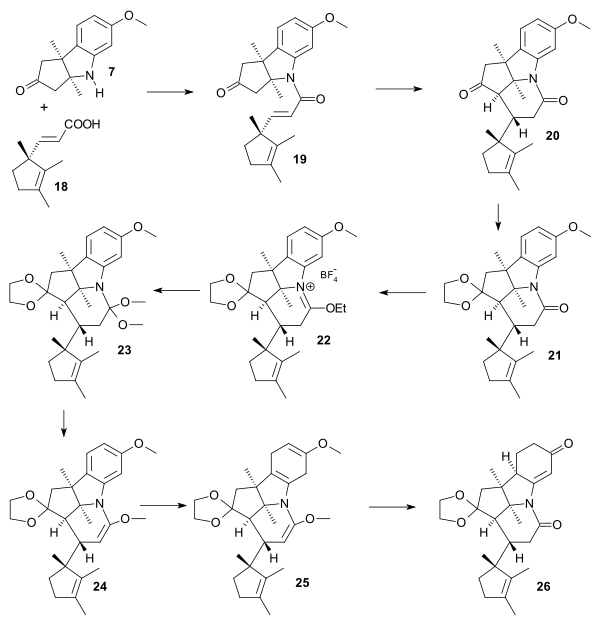 |
| ビタミンB12の環ADのカップリング |
|---|
アセタール化合物26の保護基は酸加水分解でケトン27に再生される。ジオキシム27のうち最もじゃまなケトン基を亜硝酸および酢酸で選択的加水分解することでモノオキシム28が生成する。ここで新たに加わる窒素原子が環ADの完成に必要な2番目の窒素原子となる。次にシクロペンテン環とシクロヘキセノン環がどちらもオゾンによるオゾン分解で酸化され、トリケトン29ができる。アルドール縮合(英語版)によって1位と5位のカルボニル基(ピロリジンアセテートと呼ばれる部分)が縮合しシクロヘキセン30が生成する。これと同時にオキシム基がトシル化するほか、過ヨウ素酸によってシクロヘキセン環が酸化開裂し、ジアゾメタンが酸化開裂によって生成したカルボキシ基をエステル化して、化合物31が生成する。これをポリスチレンスルホン酸ナトリウム(イオン交換樹脂)のメタノール溶液中で 2時間、170°Cで加熱するとベックマン転位が起こり、ラクタム32が生成する(ただしこれは単離されない)。これがさらに反応して4つの環をもつ化合物33(α-コルノルステロン)が生成する。ここではアミンカルボニル縮合とアルドール縮合が連続して起こる。この化合物ではラクタムの開環は起こらない側鎖であるプロピオン酸エステルの立体化学が適切ではないためα-コルノルステロンはエピマーのβ-コルノルステロン34に変換される[30]。β体はまず過剰の塩基で両者を平衡状態にし、酸性に戻してジアゾメタンで処理することで得られる。34にメタノールとチオフェノールを同時に反応させることで35が得られる。このときメタノールはカルボニル基、チオールは炭素-窒素結合をそれぞれ攻撃する[31]。これでイミダゾール末端が何に変化するかはっきりわかるようになる。これをオゾン分解してアルデヒド36とアンモニアが得られる。このときチオエステルはアミド基に変換される。このアミド基が水素化ホウ素ナトリウムによりアルデヒド還元され[32]メチロール基に、さらにメタンスルホン酸無水物でメシル化、臭化リチウムでブロモ化(英語版)されて臭化物37が生成する。このアミド基がニトリル基に変換されれば環ADの反応は終了となる[33]。
 |
| ビタミンB12の環ADのカップリング後の反応 |
|---|
環Cの合成[編集]
環Cの合成の出発物質は、キラルな(+)-カンファキノン(camphorquinone)38である[注 1]。これを無水酢酸中で三フッ化ホウ素を付加させ、アセトキシ(英語版)トリメチルシクロヘキセンカルボン酸のエステル39に変換する。この反応はマナッセとサミュエルによって1902年に開発された[35]。エステルを加水分解し、カルボン酸40を得る。これをアミド化し、化合物41にしたあとオゾン分解でペルオキシド42に変換する。これを亜鉛とメタノールで還元してスクシンイミド43を得る。これを塩酸とメタノールの混合溶液で処理するとラクタム44が生成し、このラクタム44を熱分解することで環式化合物C(化合物45)が完成する。
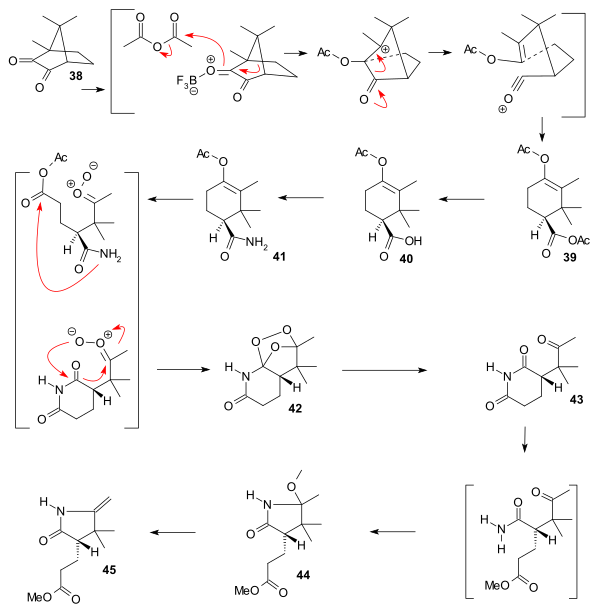 |
| ビタミンB12の環Cの合成 |
|---|
環Bの合成[編集]
環Bの出発物質は3-メチル-4-オキソ-2-ペンテン酸46である。これをブタジエンと混合するとディールス・アルダー反応(触媒:塩化スズ(IV))が起こり、ラセミ体のシクロヘキセン47が生成する。この反応は立体選択的反応であり、メチル基とカルボキシ基がシスの関係にある。2つの光学異性体の分離には1-フェニルエチルアミンを用いる。これを使って(+)-47を単離する。クロム酸でC-C二重結合を酸化し、反応中間体として3つのカルボキシ基を持つ化合物48が生成するが、分子内の2か所でエステル化反応が起き、ジラクトン49になる。アーント・アイシュタート合成によりカルボキシ基の炭素鎖が引き伸ばされ50となり、アンモニアとの反応でラクタム51ができる。これと五硫化二リンが反応してチオラクタム52が生成する。
 |
| ビタミンB12の環Bの合成 |
|---|
環Bと環Cのカップリング[編集]
環式化合物B(52)と環式化合物C(45)は過酸化ベンゾイルの塩酸溶液中で、硫黄原子を橋渡しにして結合させることができる(化合物53が生成する)。硫黄原子は亜リン酸トリエチルと反応させると硫黄縮合が起こって引き抜かれ[24]、まずエナミン-イミン54になり、次にラクタム基が硫化水素雰囲気下、トリメチルオキソニウムフッ化ホウ素塩の存在下でチオラクタム基に変化してチオデキストロリン55となる[33]。ただしこのチオデキストロリンはいくつかの不斉中心において立体配置が逆転している分子の混合物(ラセミ体)である[36]。
 |
| ビタミンB12の環Bと環Cのカップリング |
|---|
環ADと環BCのカップリング[編集]
西側の環AD(臭素とシアンの化合物37)と東側の環BC(プロピオン酸エステルが結合する不斉炭素原子に関してラセミ体になっているチオデキストロリン55)はカリウム tert-ブトキシドと反応させることで硫黄イオン中間体を経てスルフィド(チオエーテル)56となり、両者は結合する[24]。
このチオエーテルには環BC内の二重結合の位置の違いによって3つの互変異性体があり[37]、56(I型)がそのまま反応して次の過程に進むことはない。I型は容易に安定なII型に変化し、それ以上反応が進まなくなる。そしてI型と平衡状態にあるIII型もIII型のみを反応させた場合収率90%と非常に効率よくできるのだが[38]、こちらもI型ほどではないもののII型に変性しやすいので、37と55からコリゲノリドを合成する際の収率でみると40%程度にしかならなかった。結果的に、エッシェンモーザーがI型をメチル水銀誘導体に変換しておくことで三フッ化ホウ素/トリフェニルリン/ベンゼン法でコリゲノリドに直接変換できることを発見した。
次に4.5当量のシアノエチルホスフィン(トリβ-シアノエチルリン)、5.3当量のトリフルオロ酢酸およびスルホランないしはニトロメタンの存在下[36]、60°Cで20時間加熱すると硫黄縮合が起こりシアノコリゲノリド57ができる[37]。1968年夏の段階でここまで到達していた[24]。このとき環Cのプロピオン酸エステル部分が結合する不斉炭素もラセミ体となっている。反応物の立体障害のため、合成はこの方法でしか進行しない[24]。
ウッドワードはコリゲノリドを3Nメタノール性塩化水素中に16時間放置し、インコリゲン酸メチルエステルを合成した[39]。しかしコバルトを導入するとそれが触媒となってエステルが分解されるので、この化合物に直接コバルトを導入して合成を進めるのは不可能だった。しかし、トリエチルオキソニウム四フッ化ホウ素塩を作用させて得られるO-メチルコリゲノリドはラクトン環が開環したエキソ環状体と平衡をなしていることがわかった(ただし平衡は大きくラクトンよりに偏っている)ので[40]、大過剰の塩基を加えカルボン酸イオンが安定に存在できるようにした上で、大過剰のジアゾメタンを加えてO-メチルコリゲン酸メチルエステルに変換した。これはテトラヒドロフラン中で塩化コバルトないしはヨウ化コバルトを用いて容易にコバルト錯体に変換できる[41]。つまり、O-メチルコリゲノリドをテトラヒドロフラン中でコバルト塩で処理し、ついで空気およびシアンイオンで処理し、さらにジアゾメタンで処理すると、O-メチルコリゲン酸メチルエステルが合成できる[41]。しかしここからコバル酸を合成することはできなかった[42]。
一方エッシェンモーザーは化合物57に五硫化二リンおよび4-メチルピリジン(γ-ピコリン)を反応させ、ラクタムおよびラクトンの酸素原子を硫黄に置換してジチオシアノコリゲノリド58が生成することを発見した(同様のものが別にケンブリッジ大学でも合成されていた)[42][43]。これにメチルイソプロポキシ水銀およびトリメチルオキソニウム・フッ化ホウ素との反応でS-メチルジチオコリゲノリド59ができる。これにジメチルアミンが付加して[44]メチル基から硫黄陰イオンが取り除かれ、チオラクトン環を含み、環外に二重結合を持つアルケン60となる。このとき塩化コバルトまたはヨウ化コバルトによってコバルトが容易に導入される[45]。この化合物はテンプレート合成(英語版)時にコバルトへの付加物から単離された。
また、エッシェンモーザーの手法では、化合物58をメタノール溶液中、カリウム tert-ブトキシドの存在下で脱離的開裂させ、生成したアニオンをジアゾメタンでエステル化する。このエステル(チオコリゲン酸メチルエステル)から亜鉛誘導体を合成する。ここで過酸化ベンゾイルを反応させると環Aの硫黄原子と環Bの炭素原子の間に結合が生じ、スルフィドを含む大員環が完成する。その後硫黄が脱離し、炭素同士が結合する。実際、亜鉛のない化合物からでもジメチルホルミアミド中で、トリフルオロ酢酸とトリフェニルホスフィンで処理すると同様の反応が起き、亜鉛を導入してから塩化亜鉛錯体として単離することができる[46]。また、ジチオコリゲノリド58にジメチルアミンのメタノール溶液を作用させると、チオコリゲン酸アミドオクタメチルエステルになる。これに亜鉛を導入して錯体とした後にヨウ素のメタノール溶液で酸化し、トリフルオロ酢酸とトリフェニルホスフィンで処理した後再び亜鉛を導入すると、亜鉛錯体が生成する。この手法のここまでの収率は50%を超えている。この亜鉛錯体から酸処理によって亜鉛を除き[47]、塩化コバルトのテトロヒドロフラン溶液によってコバルトを導入すると60ができる[46][15]。その後、60に塩基触媒環化法を適用し、ビスノルコバリン酸アミドオクタメチルエステル(化合物61)が70%以上の収率で生成することが確認された[46][15]。1970年の時点で、(S)-ビスノルコバリン酸ヘプタメチルエステル(61)まで合成が進んでいた[28]。
 |
| ビタミンB12の環ADと環BCの合成 |
|---|
化合物60から化合物61への環化反応は中心のコバルトイオンが触媒となって進む(ジアザビシクロノネンおよびジメチルアセトアミドの存在下で近接する炭素原子間が結合し、塩基条件下で進行する別のタイプの硫黄引き抜き反応が進行して61が生成する)。化合物61はビスノルコバリン酸abdegペンタメチルエステルcジメチルアミドfニトリルと命名されている[48]。この反応でも環Cのプロピオン酸エステルが結合する不斉炭素に関して、ラセミ体となって生成する。これはヨウ素の酢酸溶液により酸化されてラクトン62で環Bの炭素に結合するプロピオン酸エステルが正しい立体配置に戻る[49]。
最後の難関は5番目と15番目の炭素にメチル基を結合させることである。このとき、10番目の炭素は大きな置換基で十分に遮蔽されており、攻撃されることはない。クロロメチルベンジルエーテルが反応し、ジ(クロロメチル)付加体ができる。これがチオフェノールによってさらにジチオフェニル化合物63に変換される。この化合物を単離するためには薄層クロマトグラフィーを行うことが必要である。ラネー合金により硫黄が脱離し、ラクトン環が還元反応に開環することでカルボン酸が生成し、これがジアゾメタンと反応してエステル64に変換される。これは当初低収率の反応だったが、ケンブリッジ大学で[49]。この段階で混ざっている化合物64の異性体の数がHPLCによって減り、環Cの13番目の炭素での立体配置が反転している2種類のみとなる(この段階ではラセミ体である)。これが化合物65である。化合物65に含まれる異性体は、プロピオン酸エステル基が紙面の奥側に出ているコバル酸abdegヘキサメチルエステルfニトリルと、手前に出ているネオコバル酸abdegヘキサメチルエステルfニトリルである[50]。ただし両者はこの先の反応を進め、シアノ基をアミドに置換した後でも両者の間で平衡状態になることから[51]、この段階での分離には意味がない[50]。
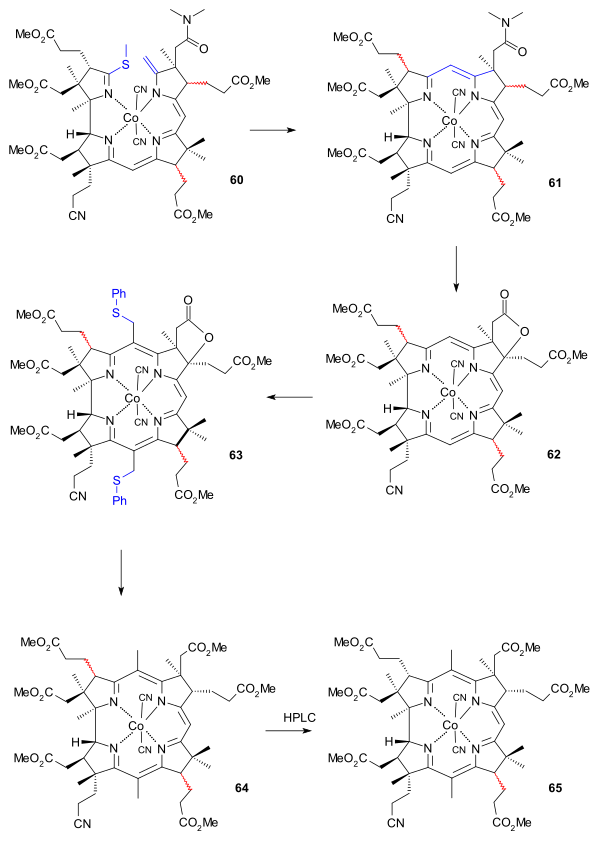 |
| ビタミンB12の環ADと環BCを合成した後の反応 |
|---|
化合物65は硫酸によりシアノ基がアミド基に変換され、化合物66になる。これにより13番目の炭素について立体配置が反転している光学異性体の量の比のバランスが72:28に崩れ、光学分割が可能になる。求める異性体67は生成量の少ない方である。これはHPLCで分離できる。
しかしここから通常のように亜硝酸や亜硝酸アミドを用いて反応させようとすると10位の炭素だけが急速にニトロソ化され、合成を進めることができなくなる[51]。エッシェンモーザーはクロロアセトアルデヒドとテトラフルオロホウ酸銀(I) から得られるシクロヘキシルニトロンによりアミド基がカルボキシ基に変換され、化合物68が得られることを発見した[52]。またケンブリッジ大学のエルマー・コンツは酢酸ナトリウムの存在下、0°Cで1時間四塩化炭素中で四酸化二窒素を用い、収率70-80%でこのアミドを酸に変換できることを示した[53]。
最後に、液体アンモニアとエチレングリコールを75°Cで30時間反応させてコバル酸の合成を完成させようとしたが、実際にできたのはプソイドコバル酸(デヒドロコバル酸)であった(アミドの一つが近くの炭素と結合して環になっている)。これが生成したのは中のコバルト原子が3価から1価に還元され、それに伴って水素が引き抜かれたためと考えられている[53]。プソイドコバル酸をコバル酸に変換することはできなかったが、もともとのコバル酸エステルにアンモニアおよび塩化アンモニウムを加えることで6つのエステルが全てアミド基に変換され、コバル酸69を合成することができた[25]。
 |
| コバル酸の完成 |
|---|
コバル酸からの合成方法[編集]
ヌクレオチドの合成[編集]
D-リボースと無水酢酸、ピリジンを1,4-ジオキサン中で95°Cで反応させると、リボフラノースができる。これをジエチルエーテルを溶媒にして塩酸と0°Cで反応させると塩素置換体ができる。これに5,6-ジメチルベンズイミダゾール、ついで塩酸を反応させると、α-リバゾールとβ-リバゾールの2種類の異性体ができる。これらを分離してα-リバゾールのみを取り出す[6]。
α-リバゾールと塩化トリフェニルメチルを反応させ、さらに亜リン酸エチルシアノエステル(NCCH2CH2OPO3H2)、酢酸、水酸化リチウム、Amberlyte(イオン交換樹脂の一つ)、続いて2当量の水酸化アンモニウム、N,N'-ジシクロヘキシルカルボジイミド、HCNH2、tert-ブチルアルコールを作用させると、収率71%で目的物質が生成する[6]。これをAとする。
また、トレオニンの双性イオンに酸素処理したテトラリンを加えると、1-アミノ-2-プロパノールが生成する。これを金属を触媒にAと反応させると、リン酸基の結合位置によって2つの異性体ができる。このうち多いほう(34%)が目的とするヌクレオチドである[6]。これをヌクレオチドBとする。
ビタミンB12の合成[編集]
この合成は1976年3月17日に発表された。コバル酸にトリエチルアミンおよびジメチルホルムアミドを溶媒としてエチルクロロカルボン酸を反応させると、エステルができる。これに合成したヌクレオチドBを反応させると収率73%でビタミンB12が生成する[6]。
脚注[編集]
注釈[編集]
出典[編集]
- ^ a b Eschenmoser, A. (1970). “Roads to Corrins”. Quart. Rev. 24: 366–415. doi:10.1039/qr9702400366.
- ^ a b c Eschenmoser, A. (1971). Studies on Organic Synthesis, in: XXIIIrd International Congress of Pure and Applied Chemistry: special lectures presented at Boston, USA, 26-30 July 1971, Vol. 2. ロンドン: Butterworths. pp. 69–106. doi:10.3929/ethz-a-010165162. ISBN 0-408-70316-4
- ^ a b Eschenmoser, A. (1974). “Organische Naturstoffsynthese heute: Vitamin B12 als Beispiel”. Naturwissenschaften 61: 513–525. Bibcode: 1974NW.....61..513E. doi:10.1007/BF00606511.
- ^ a b Eschenmoser, A.; Wintner, C. E. (1977). “Natural Product Synthesis and Vitamin B12”. Science 196 (4297): 1410–1420. doi:10.1126/science.867037. PMID 867037.
- ^ a b 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.26
- ^ a b c d e f g Vitamin B12 : An Epic Adventure in Total Synthesis
- ^ a b c d e 『有機化学美術館』p.135
- ^ a b c Woodward, R. B. (1968). “Recent advances in the chemistry of natural products”. Pure Appl. Chem. 17: 519–547. doi:10.1351/pac196817030519.
- ^ a b c Woodward, R. B. (1971). “Recent advances in the chemistry of natural products”. Pure Appl. Chem. 25: 283–304. doi:10.1351/pac197125010283.
- ^ a b c d Woodward, R. B. (1973). “The total synthesis of vitamin B12”. Pure Appl. Chem. 33 (1): 145–178. doi:10.1351/pac197333010145. PMID 4684454.
- ^ a b Nicolaou, K. C.; Sorensen, E. J. (1996). Classics in Total Synthesis: Targets, Strategies, Methods. ヴァインハイム: VCH Verlag Chemie. ISBN 978-3-527-29231-8
- ^ Nicolaou, K. C.; Sorensen, E. J.; Winssinger, N. (1998). “The Art and Science of Organic and Natural Products Synthesis”. Journal of Chemical Education 75: 1226–1258. doi:10.1021/ed075p1225.
- ^ Nicolaou, K. C.; Vourloumis, D.; Winssinger, N.; フィル・バラン (2000). “The Art and Science of Total Synthesis at the Dawn of the Twenty-First Century”. Angew. Chem. Int. Ed. 39 (1): 44–122. doi:10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L. PMID 10649349.
- ^ Eschenmoser, A. (1987). “Vitamin B12: Experiments Concerning the Origin of Its Molecular Structure”. Angew. Chem. Int. Ed. 英語版 27: 5–39. doi:10.1002/anie.198800051.
- ^ a b c 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.17
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.18
- ^ Stevens, R. V. (1982). The Total Synthesis of Vitamin B12, in: Vitamin B12, Vol. 1 (D. Dolphin, ed.). ニューヨーク: ジョン・ワイリー・アンド・サンズ. pp. 169–200. ISBN 978-0-471-03655-5
- ^ Jackson, A. H.; Smith, K. M. (1973). “The Total Synthesis of Pyrrole Pigments”. Total Synth. Nat. Prod. 1: 143–278. doi:10.1002/9780470129647.ch3. ISBN 9780471032519.
- ^ Mulzer, J.; Riether, D. (2003). “Total Synthesis of Cobyric Acid: Historical Development and Recent Synthetic Innovations”. Eur. J. Org. Chem.: 30–45. doi:10.1002/1099-0690(200301)2003:1<30::AID-EJOC30>3.0.CO;2-I.
- ^ Hodgkin, D. Crowfoot; Kamper, J.; Mackay, M.; Pickworth, J.; Trueblood, K.N.; White, J. G. (1956). “Structure of Vitamin B12”. Nature 178 (4524): 64–66. doi:10.1038/178064a0. PMID 13348621.
- ^ Woodward, R. B. (1967). Aromaticity (Chemical Society Special Publication No. 21). ロンドン: 王立化学会. pp. 217–249
- ^ Synthesen auf dem Vitamin-B12-Gebiet. 4. Mitteilung Partialsynthese von Vitamin B12 (p 704-712) W. Friedrich, G. Gross, K. Bernhauer, P. Zeller Helvetica Chimica Acta 1960 Volume 43 Issue 3, Pages 704 - 712 doi:10.1002/hlca.19600430314
- ^ a b 「天然物化学最近の進歩(1)」『化学の領域』第27巻7号、p.19
- ^ a b c d e 「天然物化学最近の進歩(1)」『化学の領域』第27巻7号、p.21
- ^ a b 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.25
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.2
- ^ 「天然物化学最近の進歩(1)」『化学の領域』第27巻7号、p.20
- ^ a b c 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.6
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.5
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.7
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.9
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.10
- ^ a b 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.11
- ^ オーガニック・シンセシズ Coll. Vol. 10, p.204 (2004); Vol. 79, p.125 (2002). PDF版
- ^ Manasse, O.; Samuel, E.. “Mittheilungen Reactionen des Campherchinons”. Berichte der deutschen chemischen Gesellschaft 35 (3): 3829–3843. doi:10.1002/cber.190203503216.
- ^ a b 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.12
- ^ a b 「天然物化学最近の進歩(1)」『化学の領域』第27巻7号、p.24
- ^ 「天然物化学最近の進歩(1)」『化学の領域』第27巻7号、p.22
- ^ 「天然物化学最近の進歩(2)」『化学の領域』第27巻8号、p.47
- ^ 「天然物化学最近の進歩(2)」『化学の領域』第27巻8号、p.48
- ^ a b 「天然物化学最近の進歩(2)」『化学の領域』第27巻8号、p.49
- ^ a b 「天然物化学最近の進歩(2)」『化学の領域』第27巻8号、p.50
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.13
- ^ 「天然物化学最近の進歩(2)」『化学の領域』第27巻8号、p.52
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.14
- ^ a b c 「天然物化学最近の進歩(2)」『化学の領域』第27巻8号、p.51
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.16
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.15
- ^ a b 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.19
- ^ a b 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.20
- ^ a b 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.21
- ^ 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.22
- ^ a b 「ビタミンB12の全合成」『化学の領域』第27巻9号、p.23
参考文献[編集]
- 佐藤健太郎『有機化学美術館へようこそ』技術評論社、2007年6月25日。ISBN 978-4-7741-3114-6。
- The Total Synthesis of Vitamin B12 (PDF) - IUPACによる論文の原文
- 『化学の領域』第二十七巻 No.7-12 昭和四十八年、南江堂、いずれの記事も稲山誠一訳
- R.B.Woodward「天然物化学最近の進歩(I)」第27巻第7号、1973年7月。
- R.B.Woodward「天然物化学最近の進歩(II)」第27巻第8号、1973年8月。
- R.B.Woodward「ビタミンB12の全合成」第27巻第9号、1973年9月。
外部リンク[編集]
- Synthesis of Cyanocobalamin
- Vitamin B12 : An Epic Adventure in Total Synthesis-カリフォルニア工科大学 Stoltzグループホームページ
- ウッドワード・エッシェンモーザーのビタミンB12合成@SynArchive.com
- ウッドワードによる全合成の講義の映像
