セレコキシブ
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Celebrex |
| Drugs.com | monograph |
| MedlinePlus | a699022 |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 | |
| 法的規制 |
|
| 投与経路 | Oral |
| 薬物動態データ | |
| 生物学的利用能 | 40% |
| 血漿タンパク結合 | 97% (mainly to serum albumin) |
| 代謝 | Hepatic (mainly CYP2C9) |
| 半減期 | ~11 h |
| 排泄 | Renal 27%, faecal 57% |
| 識別 | |
| CAS番号 |
169590-42-5 |
| ATCコード | L01XX33 (WHO) M01AH01 (WHO) |
| PubChem | CID: 2662 |
| DrugBank |
DB00482 |
| ChemSpider |
2562 |
| UNII |
JCX84Q7J1L |
| KEGG |
D00567 |
| ChEBI |
CHEBI:41423 |
| ChEMBL |
CHEMBL118 |
| 化学的データ | |
| 化学式 | C17H14F3N3O2S |
| 分子量 | 381.373 g/mol |
| |


セレコキシブ(Celecoxib, 日本における製品名:セレコックス)は、非ステロイド性消炎・鎮痛薬(英語: Non-steroidal anti-inflammatory Drugs:NSAIDs)であり、100mgと200mgの錠剤がある。セレコキシブは、COX-2を選択的に阻害することを目的にドラッグデザインされ、日本でCOX-2選択的阻害剤としてカテゴライズされている唯一の薬剤である。
商品名のセレコックスは、日本ではアステラス製薬が製造販売、ファイザーが販売提携を行っている。2020年6月に後発医薬品の発売が開始された[1]。
安全性に関する最新のトピックス[編集]
- 内視鏡による胃・十二指腸潰瘍発現率に関する日本データ
COX-2選択的阻害薬は、消化管に対する高い安全性がよく知られたことではあるが、日本で調査したデータで、明確なエビデンスが得られた。
- 対象
- 投与前の内視鏡検査で胃・十二指腸粘膜が正常であった健康成人189例(40〜74歳:平均57.5歳)。
- 方法
- スクリーニング時のH. pylori感染有無により患者を層別化し、セレコキシブ(1回100mg 1日2回)群、ロキソプロフェン(1回60mg 1日3回)群、プラセボ群に2:1:1で割り付けし、2週間投与した。
- 結果
- 内視鏡による胃・十二指腸潰瘍発現率(主要評価項目)は、
- セレコキシブ群 1.4%(1/74例)
- ロキソプロフェン群 27.6%(21/76例)
- プラセボ群 2.7%(1/37例)
であった。
セレコキシブ群はロキソプロフェン群よりも、胃・十二指腸潰瘍の発現率が有意に低く(p<0.0001、Cochran-Mantel-Haenszel検定)、プラセボ群と同程度(p=0.7979、CMH検定)であった。
Sakamotoらは、これらのことから、セレコキシブは、ロキソプロフェンよりも胃・十二指腸潰瘍の発現率で有意に優れており、しかも忍容性に優れ、安全性に対して大きな懸念もなかった、と結論づけた[2]。
効能[編集]
日本においてセレコキシブは、2007年に関節リウマチ、変形性関節症、2009年に腰痛症、肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎の適応を取得した。また、2011年には急性疼痛として、手術後、外傷後、抜歯後の消炎・鎮痛の適応が承認された[3]。日本以外の国では、強直性脊椎炎や月経困難症などの適応ももっている。セレコキシブは鎮痛効果を発揮しつつ、従来のNSAIDsで見られるような消化管への副作用を最小限に抑えることを目的としてドラッグデザインされたCOX-2選択的阻害薬である。
セレコキシブの日本国内における関節リウマチ、変形性関節症、腰痛症の第III相試験結果、および肩関節周囲炎、頸肩腕症候群、腱・腱鞘炎の国内一般臨床試験において、消炎・鎮痛効果で改善効果が認められた[4][5][6][7][8][9][10]。
副作用[編集]
日本における副作用発現率は以下のとおりである。
- 関節リウマチ及び変形性関節症
- 国内臨床試験では、関節リウマチ及び変形性関節症患者の安全性評価症例1,734例中、臨床検査値異常を含む副作用発現症例は426例(24.6%)であった。(承認時:2007年1月)
- 腰痛症、肩関節周囲炎、頸肩腕症候群及び腱・腱鞘炎
- 国内臨床試験では、腰痛症、肩関節周囲炎、頸肩腕症候群及び腱・腱鞘炎患者の安全性評価症例1,304例中、臨床検査値異常を含む副作用発現症例は451例(34.6%)であった。(効能・効果追加時:2009年6月)
- 手術後、外傷後並びに抜歯後の消炎・鎮痛
- 国内臨床試験では、手術後患者、外傷後患者及び抜歯後患者の安全性評価症例861例中、臨床検査値異常を含む副作用発現症例は113例(13.1%)であった。(効能・効果追加時:2011年12月)
投与注意事項[編集]
消化性潰瘍のある患者は投与禁忌となっている。NSAIDsを服用中の患者においては、警告症状の有無にかかわらず中等度から重度の肝障害や消化管の副作用が発現する可能性がある。
アレルギー[編集]
セレコキシブは、本剤の成分に過敏症の既往のある患者には投与禁忌であることに加え、スルホンアミド部分を含むことから、スルホンアミドに対し過敏症の既往のある患者にも禁忌である。
薬物相互作用[編集]
セレコキシブは、主としてシトクロムP450(CYP)2C9を介して代謝される。CYP2D6の基質ではないが、CYP2D6の阻害作用を有するため、パロキセチンなど、CYP2D6で代謝される薬剤との併用により、併用薬の血漿中濃度が上昇し、併用薬の作用が増強する可能性があるため注意が必要である。また、他のNSAIDsと同様、セレコキシブは、一部のアンジオテンシンII受容体拮抗薬やヒドロクロロチアジドなどの利尿剤と併用することで腎に対するリスクの上昇が考えられる[11]。一方、多くの他のNSAIDsにあるニューキノロン系抗菌薬との相互作用は添付文書上記載はない。
妊婦への投与[編集]
妊娠末期には投与禁忌である。 妊娠中の投与に関する安全性は確立していないため、妊婦(妊娠末期以外)または妊娠している可能性のある場合には、治療上の有益性が危険性を上回ると判断される場合にのみ投与する。授乳中の場合には、授乳を避けさせる。
消化管への安全性[編集]
- 高リスク:
- 出血や穿孔などの合併症を伴う潰瘍の既往(特に最近)
- 中等度リスクが3つ以上ある場合
- 中等度リスク(リスクファクター1~2つ):
- 高齢(>65歳)
- 高用量NSAIDsによる治療
- 合併症を伴わない潰瘍の既往
- 低用量を含むアスピリンとステロイドまたは抗凝固薬の併用
- 低リスク:リスクファクターなし
- 上部消化管への安全性
- 2000年に発表されたCLASS試験は、COX-2選択性による消化管への安全性についての裏づけに引用された主要なエビデンスである。アスピリン非服用患者において、セレコキシブ群ではイブプロフェン群またはジクロフェナク群と比較して症候性潰瘍および症候性潰瘍と潰瘍の合併の発現率が有意に減少したことが示された[14]。
- 日本国内の試験としては、健康成人190人をセレコキシブ100mg×2回/日群、ロキソプロフェン60mg×3回/日群、およびプラセボ群に無作為割り付けし2週間投与し内視鏡検査したところ、胃・十二指腸潰瘍の発現率は、セレコキシブ群で1.4%(1/74例)、プラセボ群で2.7%(1/37例)に対し、ロキソプロフェン群では27.6%(21/76例)であった。この試験結果は、2011年、シカゴで行われたDDW(Digestive Disease Week)で発表された[15]。
- 下部消化管への安全性
- 小腸をはじめとする下部消化管は、長らく「未知の領域」であったが、カプセル内視鏡の登場により、その実態が明らかになりつつある。
- Goldsteinらは、カプセル内視鏡で小腸粘膜傷害のない健康成人(n=356)を無作為割り付けし、セレコキシブ(1回200mg 1日2回)とナプロキセン(1回500mg 1日2回)+プロトンポンプ阻害薬(PPI)(オメプラゾール1回20mg 1日1回)、およびプラセボを2週間投与した。その結果、小腸粘膜傷害の発現数はナプロキセン+PPI群の2.99に対し、セレコキシブ群では0.32であり(p<0.001)、セレコキシブが下部消化管においても安全性が高いことが示された[16]。Goldsteinらは同様にセレコキシブ(1回200mg 1日2回)とイブプロフェン(1回800mg 1日3回)+PPI(オメプラゾール 1回20mg 1日1回)、およびプラセボとの比較も行っており(n=408)、その結果、小腸粘膜傷害発症率はイブプロフェン+PPI群で25.9%に対し、セレコキシブ群では6.4%であった(p<0.001)[17]。
- CONDOR試験
- Chanらは、関節リウマチ、変形性関節症患者で、心血管リスクが低く、H.pylori陰性の高齢者など消化管障害高リスクの対象を無作為割り付けし、セレコキシブ1回200mg 1日2回とジクロフェナクSR(1回75mg 1日2回)+PPI(1回20mg 1日1回)の2群にわけ、6ヵ月間観察した試験を行った。その結果、CSULGIE(全消化管における臨床的に重大な複合消化管イベント)の累積発現率は、セレコキシブ群はジクロフェナクSR+PPI群と比べ有意に低いことが認められた(p<0.0001)[18]。
- 以上のことから、従来のNSAIDsでは、たとえPPIを併用していたとしても消化管の粘膜傷害の発症を完全に抑制することはできず、セレコキシブのようなCOX-2選択的阻害薬で消化管への安全性の高さが証明された。
心血管系リスク[編集]
2004年にCOX-2阻害剤のロフェコキシブ(Vioxx)が市場から回収され、特にセレコキシブ等のCOX-2選択的NSAIDsをはじめとするNSAIDsの使用が心臓発作や脳卒中のリスクを増大させる懸念が高まった。時として致命的になる血栓塞栓性疾患のリスクを増大させ、投与期間とともにそのリスクが増大すると報告されている[19]。アメリカでは、発売されている全てのNSAIDsで心血管系および消化管のリスクについてFDAは「黒枠警告」を義務付けている。 セレコキシブの心血管系リスクについては意見が分かれており、各臨床試験でさまざまな結果が出されている。
- APC試験:大腸ポリープ再発予防を目的としたセレコキシブの2つの臨床試験のうちの1つ。長期にわたり高用量のセレコキシブを服用した場合(1日400mgと800mgを33ヵ月間)プラセボとの比較で心血管系リスクが上昇する、とされた[20]。
- PreSAP試験:大腸ポリープ再発予防を目的としたもう1つの試験であり、本試験ではセレコキシブの心血管系リスクの上昇は示されなかった[21]。
- ADAPT試験:アルツハイマーの予防を大規模に検討した本試験では、セレコキシブにおけるリスクの増大は示されなかった。一方、対照薬であったナプロキセンで、リスクの上昇が示される結果となった[22]。
上記、APC、PreSAP、ADAPT試験は、いずれも中止された。
2005年に米国内科学会が発行しているAnnals of Internal Medicineで、COX-2阻害剤の循環器への影響は各剤で異なることが報告された[23]。ロフェコキシブ等の他のCOX-2選択的阻害剤は、セレコキシブと比較して心筋梗塞の発症率が有意に高かった[24]。2005年4月、FDAはデータを詳細に審査し、「どのNSAIDsでも心血管系リスクは共通して増大するであろう。」と結論づけた[25]。無作為化試験に関する2006年に実施されたメタ解析では、COX-2阻害剤に関連する脳血管イベントについて検証が行われたが、非選択的NSAIDsやプラセボとの比較においてはリスクの有意性は示されなかった[26]。
2006年には、セレコキシブと他のNSAIDsの心血管系リスクに関する2つのメタ解析研究が報告されている。1つは、過去に実施されたCOX-2阻害剤の全無作為化比較試験と他のNSAIDsの臨床試験における心血管系イベントの発生率を検討したもので、British Medical Journalに公表された。著者等は、セレコキシブを含む選択的NSAIDsおよび非選択的NSAIDsではリスクの大きな増大はないと結論づけた。セレコキシブでの心血管系リスクの増大は1日1回400 mgかそれ以上の用量に限り報告されている[27]。もう1つのメタ解析はJAMAに公表され、無作為化試験ではなく観察研究が対象であったが(ほとんどが低用量)、セレコキシブとプラセボの比較では心血管系リスクの増大は認められなかった[28]。
Vioxx Gastrointestinal Outcomes Research (VIGOR)試験では、ロフェコキシブはナプロキセンとの比較でアテローム血栓性心血管系イベントが5倍増大すると発表された[29]。Celecoxib Long-Term Arthritis Safety Study(CLASS)試験ではそのようなイベント発生率の増大は発表されなかったが、専門家の多くは、ロフェコキシブの長期服用に関連するリスクは薬理学的に3つの異なる機序においてセレコキシブにも当てはまると考えている[23]。相対的に拮抗していない血小板由来のトロンボキサン(TXA2)の生成によるプロスタサイクリン(PGI2)阻害は、血栓リスクにつながることが示唆されている。COX-2が触媒となって血管内皮細胞からPGI2が産生され、血小板凝集抑制、血管平滑筋の増殖抑制、および血管拡張が生じる。これと相反し、血小板から生成されたTXA2は、不可逆的な血小板凝集、血管収縮、および平滑筋増殖作用により血管の恒常性を維持する。PGI2のバランスの失調によりTXA2の働きが強まり血栓症が助長される[29]。さらに、COX-2選択的阻害剤では、血管収縮作用のあるTXA2は通常値であっても血管拡張作用を有するPGI2が著しく減少して血圧が上昇することがある[30][31]。さらに、アテローム血栓性イベントを助長する第3の前提条件として、COX-2の発現増大は虚血プレコンディショニングの最終段階における循環器保護に重要な役割を果たす点があげられる。さまざまな意見があるため、処方医はセレコキシブを処方する際には注意を要することが求められており、現在、明確な治療の指標が示されるよう、合理的な治療計画がなされている。
ファイザーは、セレコキシブの実際の心血管系リスクをより明らかにするために、この目的で特別にデザインされたある大規模無作為化試験に資金援助することを同意した。クリーブランドクリニックを中心に実施されるこの試験には、ハイリスク患者20,000例の組み入れが予定されている。セレコキシブと非選択的NSAIDsであるナプロキセンおよびイブプロフェンの比較検討が行われる[32]。患者は全員関節炎に罹患しているため、プラセボ群を置くことは倫理的に困難である。本試験は現在進行形であり、試験の完了は2014年5月以降と計画されている。最終的には、この臨床試験がセレコックスの心血管系リスクがナプロキセンやイブプロフェンよりも高いかどうかの答えを得る一助となるであろう。
- セレコキシブの心血管系リスクに関して、Trelleらは31件の無作為化大規模試験のメタアナリシスで、従来のNSAIDsと比較した。これによると、心筋梗塞、脳卒中、心血管死、死亡、APTCエンドポイントといった心血管イベント発現をセレコキシブと従来のNSAIDsと比較したところ、セレコキシブは、イブプロフェンおよびジクロフェナクに対して、相対リスクで同程度か、わずかながら優勢な成績を示した[33]。
- 日本国内においては、Sakamotoらが重篤な心血管イベントの発現率をセレコキシブの国内臨床試験12試験の複合解析でみたところ、重篤な心血管イベントの発現率はセレコキシブ群で0.1%、ロキソプロフェン群で0.3%であり、有意差はなかった。その他の心血管イベントとしては、セレコキシブ群では脳血管障害で1件、血栓症が1件認められた一方、ロキソプロフェン群では心不全、狭心症、心筋虚血、心筋梗塞、脳出血で各1件ずつ認められ、わずかながら有意差(p<0.0442)をもってセレコキシブ群に心血管イベントの発現率が低かったことが示された[34]。
腎への影響[編集]
腎において、プロスタグランジンは腎血流量や腎糸球体濾過率(GFR)の調節に関わっており、NSAIDs服用によるCOX阻害によるプロスタグランジンの産生抑制によって、腎血流量やGFRの低下、浮腫を招くことが知られている。腎保護作用のあるCOX-1を阻害しないCOX-2選択的阻害薬は従来のNSAIDsに比べ、腎への影響は小さいといわれてきた。しかし、近年、腎においてはCOX-2も構成型であることが明らかになってきたため、COX-2選択的阻害剤も従来のNSAIDsと有意差はない、という意見が定着しつつある。 37件の無作為化二重盲検比較試験のメタアナリシスにおいて、セレコキシブは、コントロールと比較して、腎関連イベント、高血圧、腎機能低下発現の相対リスクでやや優勢な結果が出されている。しかし、末梢の浮腫に関しては、同程度であることが示されている[35]。
薬理[編集]
セレコキシブはCOX-2選択的阻害薬であり、主としてシクロオキシゲナーゼのこのアイソザイムを阻害し、プロスタグランジンの産生を阻害する。一方、非選択的NSAIDsは、COX-1とCOX-2の両方を阻害する。COX-1は従来、構成型の「ハウスキーピング」酵素と定義され、血小板で発現する唯一のアイソザイムであり、胃粘膜保護、腎臓のホメオダイナミクス、血小板血栓形成の役割に関わっている[10]。一方、COX-2は、炎症に関与する細胞として広範囲に発現し、細菌リポ多糖、サイトカイン、成長因子、腫瘍促進因子などの刺激により増大する[36]。セレコキシブはCOX-1と比較してCOX-2阻害の選択性がおよそ10~20倍も高く[36]、スルホンアミド基がCOX-2の親水性のサイドポケットに結合する[37]。以上のことから、理論的には、セレコキシブなどのCOX-2阻害剤は、この選択性によって炎症や疼痛を軽減させるのみならず、非選択的NSAIDsに共通してみられる消化管の有害事象(消化性潰瘍等)が最小限に抑えられる。
セレコキシブはCOX-1に影響することなくCOX-2を阻害する。COX-1は、プロスタグランジンの合成や血栓形成に関与しているが、COX-2はプロスタグランジンの合成のみに関与する。そのため、COX-2を阻害したとしてもトロンボキサン(TXA2)には影響がなくプロスタグランジンの合成のみが阻害され、非選択的NSAIDsのように心保護作用は発揮されない。
医薬品化学[編集]
合成[編集]
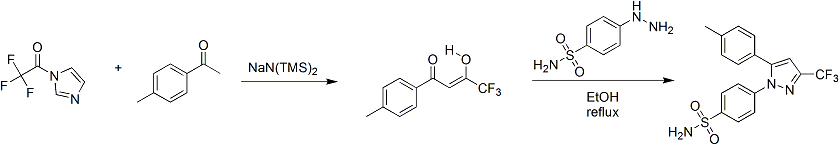
セレコキシブの合成は、1997年にサールリサーチ・アンド・ディベロップメント社の研究チームにより初めて報告された。セレコキシブの合成法は、以下のとおりである。まず、強塩基のナトリウムビス(トリメチルシリル)アミドを触媒としたアセトフェノンとN-(トリフルオロアセチル)イミダゾールのクライゼン縮合反応により1,3-ジカルボニル付加体を生成する[34]。続いて、得られた付加体と(4-スルファモイルアフェニル)ヒドラジンの縮合により、1,5-ジアリルピラゾール部位が合成される。
構造活性相関[編集]
サール社の研究グループは、COX-2を十分に阻害するには適切に置換された2つの芳香環が中心環付近に位置していなければならないことを発見した。セレコキシブの構造活性相関を推定するにあたり1,5-ジアリルピラゾール部分にさまざまな修飾を施すことが可能である[38]。ピラゾール1位にあるパラ-スルファモイルフェニル基は、パラ-メトキシフェニル基よりもCOX-2を選択的に阻害することが分かった(Compound[化合物]1-3を参照)。さらに、COX-2を阻害するには4-(メチルスルフォニル)フェニル基か4-スルファモイルフェニル基が必要なことも知られている(Compound 2-4を参照)。例えば、これらのいずれかを–SO2NHCH3置換基に置きかえると、非常に高い50%阻害濃度が認められ、COX-2の阻害活性は減少する(Compound 5を参照)。また、トリフルオロメチル基やジフルオロメチル基が、ピラゾール3位に導入された場合、フルオロメチル基やメチル基よりも優れた選択性と阻害力を発揮する(Compound 6、7、8、9を参照)[38]。
ピラゾールの4位は立体障害により大きく影響を受ける。すなわち、置換基のかさ高さが増大するほど阻害能は減少する。例えば、R1基の大きさをメチル基からプロピル基にまで徐々に拡大した場合、エチル基以上の大きさの置換基を有するとCOX-2阻害力が減少した(Compound 12、13、14を参照)。さらに、この位置にハロゲン原子を組み込むことでCOX-2阻害力が非常に大きくなる(Compound 15、16を参照)。ピラゾールの5位には芳香環が必要であることが知られているが、その柔軟性により、どういった修飾の組み合わせにより最大の阻害能と選択性が得られるかは不明であるため、この置換基の最適化は困難である。メタ部位(3-置換)と比較してパラ部位(4-置換)やオーソ部位(2-置換)での置換は力価が高くなることがわかっている(Compound 17、18、19を参照)。
これらの位置に-CN等の電子吸引基を有する場合は、COX-1およびCOX-2の阻害力が弱い。また、メトキシル等の電子供与基はCOX-1およびCOX-2のいずれも強力に阻害してしまうため、COX-2選択的阻害剤としては不十分である(Compound 20、21を参照)。パラ-メトキシ基の強力なCOX-1阻害力はα位でハロゲン原子を置換することにより軽減することができる。例えば、3-フルオロ基や3-クロロ基の導入によりCOX-1阻害作用がそれぞれ43倍および33倍減少する(Compound 22、23を参照)。5位の芳香環のパラ置換基により創出される立体障害を考慮することが必要である。パラ位のメチル化および4-エチル化によるCOX-2阻害力を考えた場合、メチル化した場合は50%阻害濃度が0.040μMでCOX-2を阻害することができるが、一方エチル化した場合では0.86μMであり、これはパラメチル置換基の阻害力が少なくとも20倍高いことを意味している(Compound 10、11を参照)。
Compound 10がセレコキシブである。COX-2の阻害にはピラゾール環の1位に4-スルファモイルフェニル基が必要であり、また、ピラゾール環5位の4-メチルフェニル基は阻害力を最大にするうえでの立体障害が低い一方、3位のトリフルオロメチルグループはより優れた選択性と阻害力を有する[38]。セレコキシブの選択性を説明するには、薬物分子とCOX-1およびCOX-2酵素の結合差の自由エネルギーを解析しなければならない。構造の最適化は、シクロオキシゲナーゼの523番目のサイドポケット部位(COX-1ではイソロイシン、COX-2ではバリン)への結合が重要であることを見出した[39]。この(523番目のアミノ酸の)変異は、セレコキシブ‐COX-1複合体を不安定化するようなスルホンアミド基の酸素とイソロイシンのメチル基の間の立体障害を作り出すことにより、COX-2選択性に寄与することが明らかとなった[39]。従って、COX-2選択的阻害剤は非選択的NSAIDsよりも立体構造がかさ高いと考えるのが妥当である。
歴史[編集]
セレコキシブは、G.D.サール社が開発し、セレブレックスの製品名でモンサント社(サール社の親会社)とファイザーが共同販売した。モンサント社はファルマシア社と合併し、ファイザーがファルマシア社から医療研究部門を買収したことで、権利はファイザーに移行した。
セレコキシブは、2004年にサール社(後にファイザー)の勝訴で解決した大きな特許紛争の争点であった。ロチェスター大学とG.D.サール社(358 F.3d 916、Fed. Cir. 2004)の裁判で、ロチェスター大学は米国特許 No.6,048,850 (どの化合物かを開示していないヒトにおいてCOX-2を阻害するための方法特許)によりセレコキシブのような薬剤は保護されていると主張した。裁判所は、ロチェスター大学が主張しているのはCOX-2を阻害できる化合物を要する方法のことでありどの化合物かは記載されていないため特許は無効、サール社側に勝訴の判決が下った。
研究事例[編集]
癌予防[編集]
ある種の癌において、セレコキシブがその発生率を抑制する可能性については、多くの研究が行われてきた。しかし、心血管系のリスクを考慮し、癌の発生を軽減する目的でセレコキシブを使用することへの医学的推奨は今のところ行われていない。
アスピリンやセレコキシブ等のNSAIDsを服用している患者の場合、大腸癌リスクは明らかに減少する。さらにセレコキシブを含む特定のCOX-2阻害剤は、従来のNSAIDsと比較して癌抑制作用があり、毒性も低いことがいくつかの疫学研究や前臨床試験で指摘されている。12件の癌原性試験で、セレコキシブにラットやマウスの腸に対して癌発生の抑制作用があることが裏づけられた(Chemoprevention Databaseでデータの入手が可能)。非常にハイリスクな患者(家族性大腸腺腫症の家族歴あり)を対象とした小規模な臨床試験でも、セレコキシブがポリープの成長を抑制することが示されている。このため大規模無作為臨床試験が実施され、臨床成績が2006年8月にNew England Journal of Medicineで報告された[20]。試験では、セレコキシブを400~800mg/日投与した患者において、ポリープの再発が33~45%減少したことが示された。この試験におけるセレコキシブの心血管系イベントの頻度はプラセボと比べ高いことが認められた。しかし、その差に有意差はなかったことが示されている[21]。
癌治療[編集]
癌の予防とは異なり、癌治療は患者の体内で既に形成され確立されている腫瘍を治療することが焦点となる。このような癌症状にセレコキシブが有用か否かを明らかにするために、現在多くの試験が実施されている[40]。しかし、研究室で行われる分子研究では、セレコキシブはその最も大きな標的であるCOX-2だけでなく他の細胞内構造物にも相互作用する可能性があることが明らかとなった。これらの追加的な標的の発見は多くの議論を巻き起こし、セレコキシブは主にCOX-2を阻害することで腫瘍の成長を抑制するという当初の仮説は議論が分かれることとなった[41]。
確かに、COX-2の阻害はセレコキシブの抗炎症および鎮痛効果において最重要である。 だが、セレコキシブによるCOX-2の阻害が抗癌作用に大きな役割を果たしているかどうかは明らかでない。例えば、最近の悪性腫瘍細胞を用いたある研究では、セレコキシブはin vivoではこれらの細胞成長を抑制したがその際にCOX-2は何ら役割を果たさなかったことが示されている。さらに驚くことに、COX-2が存在しない癌細胞種においてさえもセレコキシブの抗癌作用は得られたのである[42]。
セレコキシブに化学修飾を行ったいくつかの研究から、同剤の抗癌作用にはCOX-2以外の標的が重要であるとする見解をさらに裏づけられるような結果が得られた。化学構造をわずかに変えたセレコキシブの数十の類似体が生成された[43]。これらの中にはCOX-2阻害活性を維持しているものもあったが多くはそうではなかった。しかし、腫瘍細胞に対するこれら全ての化合物の効果を細胞培養により検討した結果、腫瘍抑制作用は化合物によるCOX-2の阻害とは関係がなく、抗癌作用にCOX-2の阻害は必要ないとの見解が示された[43][44]。たとえば、これらの化合物の一つである2,5-ジメチル-セレコキシブは、COX-2阻害力が完全に欠けていたにもかかわらず、実際はセレコキシブそのもの以上に強力な腫瘍抑制作用を発揮したのである[45]。
癒着予防[編集]
セレコキシブは腹部内の癒着を予防する可能性がある。癒着は、特に腹部の手術等において多く見られる合併症であり、腸閉塞や不妊の主な原因となる。2005年には、ボストンの研究者たちがセレコキシブを投与したマウスでは手術後の癒着が「劇的に」減少したと報告したことが公表された[46]。
参考文献[編集]
- セレコックス添付文書
- ^ 20年6月後発品収載 消炎鎮痛薬セレコックス後発品、薬価は先発の28%に(ミクスonline)
- ^ Sakamoto, C. et al.: Aliment Pharmacol Ther 37(3): 346-54, 2013
- ^ “セレコキシブ:急性疼痛への使用も可能に”. 日経メディカル. 日本経済新聞社 (2012年1月20日). 2021年1月8日閲覧。
- ^ 安倍 達, et al.: Prog Med 26(suppl.3): 2820, 2006
- ^ 菅原 幸子, C. et al.: Prog Med 26(suppl.3): 2911, 2006
- ^ 菊地 臣一ほか:Prog Med 29(suppl.2): 2853, 2009
- ^ 高岸 憲二: Prog Med 29(suppl.2): 2893, 2009
- ^ 高岸 憲二: Prog Med 29(suppl.2): 2918, 2009
- ^ 荻野 利彦: Prog Med 29(suppl.2): 2941, 2009
- ^ a b Katzung, et al.: BASIC AND CLINICAL PHARMACOLOGY. 10TH EDIDITION. McGraw Hill. p579
- ^ Lexi-Comp,Inc. (Lexi-Drugs). Hudson, Ohio: Lexi-Comp,Inc.,2010. Electronic
- ^ Lanza, F.K. et al.: Am J Gastroenterol 104: 728, 2009
- ^ 消化性潰瘍診療ガイドライン 92, 南江堂 2009
- ^ Silverstein, F.E. et al.: JAMA 284: 1247, 2000
- ^ C. Sakamoto et al.: Gastroenterology 140(5,Suppl 1): S-587, 2011
- ^ Goldstein, J.L. et al.: Clin Gastroenterol Hepatol 3: 133, 2005
- ^ Goldstein, J.L. et al.: Aliment Pharmacol Ther 25: 1211, 2007
- ^ Chan, F.K.L. et al: Lancet 376: 173, 2010
- ^ “全日本民医連 - 副作用モニター情報〈333〉セレコックス(セレコキシブ=非ステロイド性消炎・鎮痛剤)の副作用と注意点 2010年6月21日”. 2019年12月9日閲覧。
- ^ a b Bertagnolli M, et al.: NEJM 355(9): 873, 2006
- ^ a b Arber N, et al.: NEJM 355 (9): 885, 2006
- ^ ADAPT Research, Group: PLos Clin Trials 1(7): e33, 2006
- ^ a b Kimmel SE, et al.: Ann Intern Med. 142(3): 157, 2005
- ^ Mukherjee D, et al.: JAMA ;286(8):954, 2001
- ^ Jenkins JK, et al.:. FDA Center for Drug Evaluation and Research. (2005-04-06)
http://www.fda.gov/downloads/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm106201.pdf#search='Analysis and recommendation for agency action regarding nonsteroidal anti inflammatory drugs and cardiovascular risk' - ^ Chen LC, et al.: J Clin Pharm Ther 31(6), 565, 2006
- ^ Kearney PM, et al.: BMJ 332 (7553): 1302, 2006
- ^ McGettigan P, et al.:JAMA 296 (13): 1633, 2006
- ^ a b Pitt B, et al.: Circulation : 106(2): 167, 2002
- ^ Lee YH, et al.: Rheumatol Int 27(5): 477, 2007
- ^ Collins R, et al.: Lancet. 335 (8693): 827, 1990
- ^ PRECISION: ClinicalTrials.gov. National Library of Medicine. 2006-12-07. http://clinicaltrials.gov/ct/show/NCT00346216?order=13
- ^ Trelle, S. et al.: BMJ 342: c7086, 2011
- ^ Sakamoto, C. et al.: Digestion, 83: 108, 2011
- ^ Zhang, J. et al.: JAMA 296(13): 1619, 2006
- ^ a b Shi S, et al.: Eur J Clin Pharmacol 64(3): 233, 2008
- ^ DiPiro, J. T., et al.: Pharmacotherapy: A Pathophysiologic Approach. New York: McGraw-Hill Medical, 2008.
- ^ a b c Penning TD, et al.: J Med Chem 40 (9): 1347, 1997
- ^ a b Price MLP, et al.: Bioorg Med Chem Lett 11: 1541, 2001
- ^ Dannenberg AJ, et al.: Cancer Cell 4 (6): 431, 2003
- ^ Schönthal AH: Br. J. Cancer 97 (11): 1465, 2007
- ^ Chuang, H-C; et al.: Mol Cancer 7 (1): 38, 2008
- ^ a b Zhu J, et al.: J Natl Cancer Inst 94 (23): 1745, 2002
- ^ Schönthal AH, et al.: Expert Opin Investig Drugs 17(2): 197, 2008
- ^ Schönthal AH: Neurosurg Focus 20(4): E21, 2006
- ^ Greene AK, et al.: Ann Surg. 242(1): 140, 2005