「ギラン・バレー症候群」の版間の差分
m 人名に由来するため Category:医学のエポニムを追加 (HotCat使用) |
→原因: など加筆修正 タグ: サイズの大幅な増減 |
||
| 17行目: | 17行目: | ||
}} |
}} |
||
'''ギラン・バレー症候群'''(ギラン・バレーしょうこうぐん、{{lang-en-short|{{lang|fr|Guillain-Barré}} syndrome}}、以下GBSと記する)は、[[急性]]・多発性の[[根神経炎]]の一つ。主に[[筋肉]]を動かす[[運動神経]]が障害され、四肢に力が入らなくなる病気のこと。重症の場合、{{要出典|date=2017年5月|範囲=中枢神経障害性}}の[[呼吸不全]]を来し、この場合には一時的に[[気管]]切開や[[人工呼吸器]]を要するが、{{要出典範囲|[[予後]]はそれほど悪くない|date=2022年8月}}。[[日本]]では厚生労働省の治療研究(難治性疾患克服研究事業)の対象となっているが、医療給付(難病医療費助成制度)の対象ではない。 |
'''ギラン・バレー症候群'''(ギラン・バレーしょうこうぐん、{{lang-en-short|{{lang|fr|Guillain-Barré}} syndrome}}、以下GBSと記する)は、[[急性]]・多発性の[[根神経炎]]の一つ。主に[[筋肉]]を動かす[[運動神経]]が障害され、四肢に力が入らなくなる病気のこと。重症の場合、{{要出典|date=2017年5月|範囲=中枢神経障害性}}の[[呼吸不全]]を来し、この場合には一時的に[[気管]]切開や[[人工呼吸器]]を要するが、{{要出典範囲|[[予後]]はそれほど悪くない|date=2022年8月}}。[[日本]]では厚生労働省の治療研究(難治性疾患克服研究事業)の対象となっているが、医療給付(難病医療費助成制度)の対象ではない。 |
||
毎年10万人あたり1 - 2人の割合で発症する稀な病気であり、男女を問わず、また世界のどの地域でも同程度の罹患率である<ref name=NIH2016/><ref name=Sejvar2011>{{cite journal | vauthors = Sejvar JJ, Baughman AL, Wise M, Morgan OW | title = Population incidence of Guillain-Barré syndrome: a systematic review and meta-analysis | journal = Neuroepidemiology | volume = 36 | issue = 2 | pages = 123–33 | date = 2011 | pmid = 21422765 | pmc = 5703046 | doi = 10.1159/000324710 }}</ref><ref name=Fer2016/>。 |
|||
| ⚫ | |||
[[File:Guillain Barre Patterns.png|thumb|right|400 px|ギラン・バレー症候群の様々な症状]] |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
原因は不明だが、根本的なメカニズムとして、身体の免疫系が誤って[[末梢神経]]を攻撃し、[[ミエリン]]の絶縁体を損傷する[[自己免疫疾患]]が関与していると考えられている<ref name=NIH2016>{{cite web|title=Guillain–Barré Syndrome Fact Sheet|url=https://www.ninds.nih.gov/Disorders/Patient-Caregiver-Education/Fact-Sheets/Guillain-Barré-Syndrome-Fact-Sheet|website=NIAMS|access-date=29 August 2022|date=June 1, 2016|url-status=live|archive-url=https://web.archive.org/web/20160805044252/http://www.ninds.nih.gov/disorders/gbs/detail_gbs.htm|archive-date=5 August 2016}}</ref>。この免疫機能障害は、感染によって引き起こされることもあれば、あまり一般的ではないが手術によって引き起こされることもあり、ごくまれにワクチン接種によって引き起こされることもある<ref name=NIH2016/><ref name=Fer2016>{{cite book |last1=Ferri |first1=Fred F. | name-list-style = vanc |title=Ferri's Clinical Advisor 2017: 5 Books in 1|date=2016|publisher=Elsevier Health Sciences|isbn=9780323448383|page=529|url=https://books.google.com/books?id=rRhCDAAAQBAJ&pg=PA529|language=en|url-status=live|archive-url=https://web.archive.org/web/20160821222609/https://books.google.ca/books?id=rRhCDAAAQBAJ&pg=PA529|archive-date=2016-08-21}}</ref>。診断は通常、[[:en:Diagnosis_of_exclusion|別の原因を除外]]した上で[[徴候と症状]]に基づいて行われ、[[神経伝導速度検査|神経伝導検査]]や[[脳脊髄液]]の検査などによって裏付けられる<ref name=NIH2016/>。 |
|||
=== 感染症 === |
|||
[[File:ARS Campylobacter jejuni.jpg|right|thumb|ギラン・バレー症候群の約30%を引き起こす[[:en:Campylobacter_jejuni|カンピロバクター・ジェジュニ]]の[[走査型電子顕微鏡]]画像]] |
|||
ギラン・バレー症候群の3分の2は、発症前に[[感染症]]を経験している<ref name=NatRevNeurol2014>{{cite journal | vauthors = van den Berg B, Walgaard C, Drenthen J, Fokke C, Jacobs BC, van Doorn PA | title = Guillain-Barré syndrome: pathogenesis, diagnosis, treatment and prognosis | journal = Nature Reviews. Neurology | volume = 10 | issue = 8 | pages = 469–82 | date = August 2014 | pmid = 25023340 | doi = 10.1038/nrneurol.2014.121 | s2cid = 25154778 }}</ref>。最も一般的なのは、[[胃腸炎]]または[[呼吸器感染症]]であり、約30%の症例は、下痢を引き起こす[[:en:Campylobacter_jejuni|カンピロバクター・ジェジュニ]]細菌によって誘発される<ref name="NEJM2012" />。さらに10%は[[サイトメガロウイルス]](CMV、HHV-5)に起因するものである<ref name="NEJM2012" />。それにもかかわらず、[[カンピロバクター]]やCMVに感染してもギラン・バレー症候群を発症する人はごくわずかであり、それぞれ1000回につき0.25 - 0.65例、1000回につき0.6 - 2.2例と言われている<ref name="NEJM2012" />。細菌はその表面に異なる[[リポ多糖]]を持ち、感染した株によってギラン・バレー症候群を発症するリスクが異なる可能性がある<ref name=NatRevNeurol2014 />。日本では、2018年にカンピロバクターを原因とする[[食中毒]]患者で、ギラン・バレー症候群と診断された例がある<ref>{{Cite news |title=レバ刺し食べた2人が食中毒、1人は重体 茨城の飲食店 |newspaper=朝日新聞デジタル |date=2018-12-07 |author= |url=https://www.asahi.com/articles/ASLD667BSLD6UJHB00X.html |accessdate=2018-12-07}}</ref>。十分に加熱されていない肉類を食するとカンピロバクター性のギラン・バレー症候群を発症する場合がある<ref>{{Cite web |url=https://www.fukushihoken.metro.tokyo.lg.jp/sibaura/sonota/namasyoku.html |title=肉の生食に注意! |publisher =東京都福祉保健局 |accessdate=2022-10-09}}</ref>。 |
|||
他の感染症との関連はあまり定かではないが、2つの[[ヘルペスウイルス]]([[エプスタイン・バール・ウイルス]](HHV-4)および[[水痘・帯状疱疹ウイルス]](HHV-3))と、細菌の[[マイコプラズマ]]が関連していると言われている<ref name="NEJM2012" />。 |
|||
ギラン・バレー症候群は[[インフルエンザ]]後に発症することが知られており、[[インフルエンザワクチン]]の接種がリスク低減につながることが実証されている<ref>{{cite journal |last1=Vellozzi |first1=C. |last2=Iqbal |first2=S. |last3=Broder |first3=K. |title=Guillain-Barre Syndrome, Influenza, and Influenza Vaccination: The Epidemiologic Evidence |journal=Clinical Infectious Diseases |date=15 April 2014 |volume=58 |issue=8 |pages=1149–1155 |doi=10.1093/cid/ciu005 |pmid=24415636|doi-access=free }}</ref>。 |
|||
熱帯性[[フラビウイルス科|フラビウイルス]]感染症である[[デング熱]]および[[ジカウイルス]]もギラン・バレー症候群の発症と関連している<ref>Parra B, et al. Guillain–Barré Syndrome Associated with Zika Virus Infection in Colombia. N Engl J Med 2016; 375:1513-1523. {{DOI|10.1056/NEJMoa1605564}}</ref><ref name="Carod2013">{{cite journal | vauthors = Carod-Artal FJ, Wichmann O, Farrar J, Gascón J | title = Neurological complications of dengue virus infection | journal = The Lancet. Neurology | volume = 12 | issue = 9 | pages = 906–919 | date = September 2013 | pmid = 23948177 | doi = 10.1016/S1474-4422(13)70150-9 | s2cid = 13948773 }}</ref><ref>{{cite journal | vauthors = Gatherer D, Kohl A | title = Zika virus: a previously slow pandemic spreads rapidly through the Americas | journal = The Journal of General Virology | volume = 97 | issue = 2 | pages = 269–273 | date = February 2016 | pmid = 26684466 | doi = 10.1099/jgv.0.000381 | url = http://eprints.gla.ac.uk/113711/1/113711.pdf | doi-access = free }}</ref>。 |
|||
[[E型肝炎ウイルス]]に感染したことのある人は、ギラン・バレー症候群を発症することが多いことが分かっている<ref name=NatRevNeurol2014/><ref name=Eldar2014>{{cite journal | vauthors = Eldar AH, Chapman J | title = Guillain Barré syndrome and other immune mediated neuropathies: diagnosis and classification | journal = Autoimmunity Reviews | volume = 13 | issue = 4–5 | pages = 525–30 | date = April 2014 | pmid = 24434363 | doi = 10.1016/j.autrev.2014.01.033 }}</ref>。 |
|||
| ⚫ | |||
季節性インフルエンザワクチンは「ギランバレー症候群」を誘発する可能性が指摘されているが、これは100万回に1例(1000回あたり0.001人)程度の非常に稀なものである<ref>{{cite journal |vauthors=Martín Arias LH, Sanz R, Sáinz M, Treceño C, Carvajal A |title=Guillain-Barré syndrome and influenza vaccines: A meta-analysis |journal=Vaccine |volume=33 |issue=31 |pages=3773–8 |date=July 2015 |pmid=25999283 |doi=10.1016/j.vaccine.2015.05.013 |url=}}</ref><ref>{{Cite web |url=https://www.cdc.gov/vaccinesafety/concerns/guillain-barre-syndrome.html |title=Guillain-Barré Syndrome and Vaccines |publisher =CDC |accessdate=2022-08-24}}</ref>。インフルエンザの自然感染は、インフルエンザワクチン接種よりもギラン・バレー症候群の強い[[リスクファクター|危険因子]]であり、ワクチン接種でインフルエンザに罹患するリスクを減らすことで、ギラン・バレー症候群のリスクを低下させることができる<ref>{{cite journal |vauthors=Kwong JC, Vasa PP, Campitelli MA, Hawken S, Wilson K, Rosella LC, Stukel TA, Crowcroft NS, McGeer AJ, Zinman L, Deeks SL |title=Risk of Guillain-Barré syndrome after seasonal influenza vaccination and influenza health-care encounters: a self-controlled study |journal=Lancet Infect Dis |volume=13 |issue=9 |pages=769–76 |date=September 2013 |pmid=23810252 |doi=10.1016/S1473-3099(13)70104-X |url=}}</ref><ref name=Rinaldi2013>{{cite journal | vauthors = Rinaldi S | title = Update on Guillain-Barré syndrome | journal = Journal of the Peripheral Nervous System | volume = 18 | issue = 2 | pages = 99–112 | date = June 2013 | pmid = 23781958 | doi = 10.1111/jns5.12020 | s2cid = 23577086 }}</ref><ref name="DeStefano2019">{{cite journal | vauthors = DeStefano F, Bodenstab HM, Offit PA | title = Principal controversies in vaccine safety in the United States | journal = Clinical Infectious Diseases | volume = 69 | issue = 4 | pages = 726–731 | date = August 2019 | pmid = 30753348 | doi = 10.1093/cid/ciz135 | doi-access = free }}</ref><ref name="fizz-_imasara">{{Cite web |url=https://www.fizz-di.jp/archives/1073916148.html |title=今さら聞けないインフルエンザの予防接種の話~ワクチンの効果と、よくある誤解 |publisher =お薬Q&A〜Fizz Drug Information〜 |date=2021-07-19 |accessdate=2022-08-24}}</ref>。 |
|||
[[1976年]]の[[H1N1亜型|H1N1]]豚インフルエンザの発生後に行われた[[インフルエンザワクチン]]接種では、ギラン・バレー症候群の発生率が増加し、100万回あたり8.8例(1000回あたり0.0088人)が合併症として発症した<ref name="Lehmann2010">{{cite journal | vauthors = Lehmann HC, Hartung HP, Kieseier BC, Hughes RA | title = Guillain-Barré syndrome after exposure to influenza virus | journal = The Lancet. Infectious Diseases | volume = 10 | issue = 9 | pages = 643–51 | date = September 2010 | pmid = 20797646 | doi = 10.1016/S1473-3099(10)70140-7 }}</ref><ref name="nelson12">{{cite journal |doi=10.1093/aje/kws194|title=Invited Commentary: Influenza Vaccine and Guillain-Barre Syndrome--Is There a Risk?|year=2012|last1=Nelson|first1=K. E.|journal=American Journal of Epidemiology|volume=175|issue=11|pages=1129–1132|pmid=22582208|doi-access=free}}</ref>。1976年のインフルエンザワクチン接種による発症リスクは異常値であり、その後のワクチン接種ではこのような著しい増加は起きていない<ref name="Lehmann2010" /><ref name="NEJM2012">{{cite journal | vauthors = Yuki N, Hartung HP | title = Guillain-Barré syndrome | journal = The New England Journal of Medicine | volume = 366 | issue = 24 | pages = 2294–304 | date = June 2012 | pmid = 22694000 | doi = 10.1056/NEJMra1114525 }}</ref>。 |
|||
2021年3月24日、[[:en:Zoster_vaccine|帯状疱疹ワクチン]]「Shingrix」の接種後に、100万回当たり3例のギラン・バレー症候群の増加が推定されたため、FDAは製造元の[[グラクソ・スミスクライン]]社にギラン・バレー症候群のリスクに関する警告を記載するように求めた<ref name="U.S. Food and Drug Administration 2021">{{cite web | title=New safety communication regarding Shingrix vaccine | website=U.S. Food and Drug Administration | date=2021-03-25 | url=https://www.fda.gov/vaccines-blood-biologics/safety-availability-biologics/fda-requires-warning-about-guillain-barre-syndrome-gbs-be-included-prescribing-information-shingrix | access-date=2021-10-18}}</ref>。研究者らは、ワクチンにより帯状疱疹のリスクを減らせるメリットは大きいが、医師と患者は接種前にギラン・バレー症候群のリスクについて認識しておく必要があると述べている<ref name="U.S. Food and Drug Administration 2021" /><ref>{{Cite web |url=https://jamanetwork.com/journals/jamainternalmedicine/article-abstract/2785607 |title=Risk of Guillain-Barre' Syndrome Following Recombinant Zoster Vaccine in Medicare Beneficiaries |publisher =JAMA Internal Medicine |date=2021-11-01 |accessdate=2022-10-09}}</ref>。 |
|||
===COVID-19感染またはワクチン関連 === |
|||
ギラン・バレー症候群は新型コロナウイルス感染症(COVID-19)に関連して報告されており、COVID-19の神経学的合併症の可能性がある<ref>{{cite journal | vauthors = Ellul MA, Benjamin L, Singh B, Lant S, Michael BD, Easton A, Kneen R, Defres S, Sejvar J, Solomon T | display-authors = 6 | title = Neurological associations of COVID-19 | journal = The Lancet. Neurology | volume = 19 | issue = 9 | pages = 767–783 | date = September 2020 | pmid = 32622375 | doi = 10.1016/S1474-4422(20)30221-0 | pmc = 7332267 | doi-access = free }}</ref><ref>{{cite journal | vauthors = Toscano G, Palmerini F, Ravaglia S, Ruiz L, Invernizzi P, Cuzzoni MG, Franciotta D, Baldanti F, Daturi R, Postorino P, Cavallini A, Micieli G | display-authors = 6 | title = Guillain-Barré Syndrome Associated with SARS-CoV-2 | journal = The New England Journal of Medicine | volume = 382 | issue = 26 | pages = 2574–2576 | date = June 2020 | pmid = 32302082 | pmc = 7182017 | doi = 10.1056/NEJMc2009191 }}</ref><ref>{{cite journal | vauthors = Paterson RW, Brown RL, Benjamin L, Nortley R, Wiethoff S, Bharucha T, Jayaseelan DL, Kumar G, Raftopoulos RE, Zambreanu L, Vivekanandam V, Khoo A, Geraldes R, Chinthapalli K, Boyd E, Tuzlali H, Price G, Christofi G, Morrow J, McNamara P, McLoughlin B, Lim ST, Mehta PR, Levee V, Keddie S, Yong W, Trip SA, Foulkes AJ, Hotton G, Miller TD, Everitt AD, Carswell C, Davies NW, Yoong M, Attwell D, Sreedharan J, Silber E, Schott JM, Chandratheva A, Perry RJ, Simister R, Checkley A, Longley N, Farmer SF, Carletti F, Houlihan C, Thom M, Lunn MP, Spillane J, Howard R, Vincent A, Werring DJ, Hoskote C, Jäger HR, Manji H, Zandi MS | display-authors = 6 | title = The emerging spectrum of COVID-19 neurology: clinical, radiological and laboratory findings | journal = Brain | date = July 2020 | volume = 143 | issue = 10 | pages = 3104–3120 | pmid = 32637987 | doi = 10.1093/brain/awaa240 | pmc = 7454352 | doi-access = free }}</ref><ref>{{Cite journal|last1=Abu-Rumeileh|first1=Samir|last2=Abdelhak|first2=Ahmed|last3=Foschi|first3=Matteo|last4=Tumani|first4=Hayrettin|last5=Otto|first5=Markus|date=2021|title=Guillain-Barré syndrome spectrum associated with COVID-19: an up-to-date systematic review of 73 cases|journal=Journal of Neurology|volume=268|issue=4|pages=1133–1170|doi=10.1007/s00415-020-10124-x|issn=1432-1459|pmc=7445716|pmid=32840686}}</ref>。COVID-19は末梢神経障害を引き起こすと報告されており、最近ではギラン・バレー症候群を含む[[自己免疫疾患]]を悪化させるという証拠もある<ref>{{cite journal |last1=Finsterer |first1=Josef |last2=Scorza |first2=Fulvio Alexandre |last3=Scorza |first3=Carla Alessandra |last4=Fiorini |first4=Ana Claudia |title=Peripheral neuropathy in COVID-19 is due to immune-mechanisms, pre-existing risk factors, anti-viral drugs, or bedding in the Intensive Care Unit |journal=Arquivos de Neuro-Psiquiatria |date=19 July 2021 |volume=79 |issue=10 |pages=924–928 |doi=10.1590/0004-282X-ANP-2021-0030 |pmid=34287509 |s2cid=236157120 |doi-access=free }}</ref>。いくつかの研究では、[[パーキンソン病]]が感染者により一般的であることが分かってきている<ref>{{cite journal |last1=Smeyne |first1=Richard J. |last2=Noyce |first2=Alastair J. |last3=Byrne |first3=Matthew |last4=Savica |first4=Rodolfo |last5=Marras |first5=Connie |title=Infection and Risk of Parkinson's Disease |journal=Journal of Parkinson's Disease |year=2021 |volume=11 |issue=1 |pages=31–43 |doi=10.3233/JPD-202279 |pmid=33361610 |pmc=7990414 }}</ref>。 |
|||
[[2021年]][[9月8日]]、[[欧州医薬品庁]](EMA)は[[AZD1222|アストラゼネカ製ワクチン]]のごくまれな副反応にギラン・バレー症候群を追加したことを発表した<ref name="reuter20210908">{{cite web|url=https://jp.reuters.com/article/health-coronavirus-vaccines-ema-idJPKBN2G501G|title=欧州当局、アストラ製ワクチン副反応にギラン・バレー症候群追加|date=2021-9-8|accessdate=2021-09-09|pubrisher=[[ロイター]]}}</ref><ref name="EMAEU">{{cite web |title=COVID-19 Vaccine Janssen: Guillain-Barré syndrome listed as a very rare side effect |url=https://www.ema.europa.eu/en/news/covid-19-vaccine-janssen-guillain-barre-syndrome-listed-very-rare-side-effect |website=European Medicines Agency |access-date=13 September 2021}}</ref><ref>{{Cite journal |date=2022-06-21 |title=Autoimmune damage to the nerves following Covid vaccines: EMA issued warning to patients and healthcare professionals |url=https://www.bmj.com/content/374/bmj.n1786/rr-0 |language=en}}</ref>。同年7月31日までの全世界での接種数5億9200万回のうち、ギラン・バレー症候群の発症が833件(71万回に約1例)報告されていることから、因果関係に「少なくとも合理的な可能性」があると判断した<ref name="reuter20210908"/>。EMAはこの副反応を頻度が最も低い「非常にまれ」なカテゴリーに分類し、ワクチン接種の効果は副反応のリスクを上回ると強調した<ref name="reuter20210908"/>。[[アメリカ食品医薬品局|米国食品医薬品局]](FDA)も[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン|ジョンソン・エンド・ジョンソン製ワクチン]]についてギラン・バレー症候群の発症リスクが増加する可能性があると警告した<ref name="fda_20210713">{{Cite web |url=https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-july-13-2021 |title=Coronavirus (COVID-19) Update: July 13, 2021 |publisher =FDA |date=2021-07-13 |accessdate=2022-10-09}}</ref><ref name="reuter20210721">{{cite web|url=https://jp.reuters.com/article/health-coronavirus-johnson-johnson-idJPKBN2EI23N|title=J&Jのコロナワクチン、まれな自己免疫疾患発症 米当局が警告|date=2021-07-21|accessdate=2021-9-9|publisher=[[ロイター]]}}</ref>。FDAは接種後にギラン・バレー症候群を発症する可能性は「非常に低い」とし、ワクチンにより得られる利益はリスクを上回るとの見解を示している<ref>{{Cite web |url=https://consumer.healthday.com/fda-set-to-add-guillain-barre-warning-to-j-j-covid-19-vaccine-2653758528.html |title=FDA Adds Guillain-Barré Warning to J&J COVID-19 Vaccine |publisher =HealthDay |date=2022-05-24 |accessdate=2022-10-09}}</ref><ref>{{Cite web |url=https://www.yakuji.co.jp/entry88450.html |title=J&J社製のコロナワクチンでギラン・バレー症候群のリスク増、米FDA |publisher =薬事日報 |date=2021-07-27 |accessdate=2022-10-09}}</ref>。 |
|||
=== 薬物性 === |
|||
抗うつ薬の[[:en:Zimelidine|ジメリジン]]は、非常に良好な安全性プロファイルを持っていたが、ギラン・バレー症候群のまれな症例報告の結果、市場から撤退した<ref name=Fagius>{{cite journal | vauthors = Fagius J, Osterman PO, Sidén A, Wiholm BE | title = Guillain-Barré syndrome following zimeldine treatment | journal = Journal of Neurology, Neurosurgery, and Psychiatry | volume = 48 | issue = 1 | pages = 65–9 | date = January 1985 | pmid = 3156214 | pmc = 1028185 | doi = 10.1136/jnnp.48.1.65 }}</ref><ref>{{cite journal | vauthors = Carlsson A | title = A paradigm shift in brain research | journal = Science | volume = 294 | issue = 5544 | pages = 1021–4 | date = November 2001 | pmid = 11691978 | doi = 10.1126/science.1066969 | bibcode = 2001Sci...294.1021C | s2cid = 24365669 }}</ref><ref>{{cite web|url=https://www.thecarlatreport.com/blog/the-rise-and-sudden-fall-of-zimelidine-the-first-ssri/|title=The Rise and Sudden Fall of Zimelidine: The First SSRI|accessdate=2022-10-09}}</ref>。 |
|||
== 分類 == |
== 分類 == |
||
[[File:Georges Guillain.jpg|right|upright|thumb|[[:en:Georges Guillain|ジョルジュ・ギラン]]は、[[:en:Jean Alexandre Barré|バレー]]、[[:en:André_Strohl|ストロール]]とともに、脳脊髄液に特異な変化を伴う自己免疫性の急性麻痺2症例を報告した。1925年、彼は師である[[:en:Pierre Marie|ピエール・マリー]]の後任として、パリの[[:en:Pitié-Salpêtrière Hospital|サルペトリエール病院]]神経科の教授に就任した<ref>{{cite journal | vauthors = Goetz CG | title = Georges Guillain's neurologic exploration of America | journal = Neurology | volume = 50 | issue = 5 | pages = 1451–5 | date = May 1998 | pmid = 9596004 | doi = 10.1212/WNL.50.5.1451 | s2cid = 823333 }}</ref>。]] |
|||
1859年にフランス人医師の{{仮リンク|ジャン・ランドリー|en|Jean Landry (physician)}}({{lang-fr-short|Jean Baptiste Octave Landry}})によって、上行性麻痺の一例という報告がなされた。その後、この症例はランドリー上行性麻痺の一例と呼ばれている。 |
1859年にフランス人医師の{{仮リンク|ジャン・ランドリー|en|Jean Landry (physician)}}({{lang-fr-short|Jean Baptiste Octave Landry}})によって、上行性麻痺の一例という報告がなされた。その後、この症例はランドリー上行性麻痺の一例と呼ばれている。 |
||
| 36行目: | 83行目: | ||
他の病型には、感覚障害を伴うAMSAN(acute motor-sensory axonal neuropathy、急性運動感覚性軸索型ニューロパチー)、[[フィッシャー症候群]]などが知られている。特にイタリアではGBSの35%がフィッシャー症候群と地域差が認められ、このフィッシャー症候群は、ギラン・バレー症候群の亜型と考えられている。ギラン・バレー症候群が全身型の疾患であるのに対して、同様の[[自己免疫]]が原因で[[末梢神経]]の障害が起こる疾患にフィッシャー症候群や[[ビッカースタッフ型脳幹脳炎]]があり、[[眼筋麻痺|外眼筋麻痺]]、[[失調]]、[[深部感覚#深部反射|深部反射]]低下などが見られる。PCB(pharygeal-cervical-brashial weakness、咽頭頚部上腕型GBS)という亜型も知られており咽頭筋、呼吸筋、近位筋の筋力低が特徴とされている。 |
他の病型には、感覚障害を伴うAMSAN(acute motor-sensory axonal neuropathy、急性運動感覚性軸索型ニューロパチー)、[[フィッシャー症候群]]などが知られている。特にイタリアではGBSの35%がフィッシャー症候群と地域差が認められ、このフィッシャー症候群は、ギラン・バレー症候群の亜型と考えられている。ギラン・バレー症候群が全身型の疾患であるのに対して、同様の[[自己免疫]]が原因で[[末梢神経]]の障害が起こる疾患にフィッシャー症候群や[[ビッカースタッフ型脳幹脳炎]]があり、[[眼筋麻痺|外眼筋麻痺]]、[[失調]]、[[深部感覚#深部反射|深部反射]]低下などが見られる。PCB(pharygeal-cervical-brashial weakness、咽頭頚部上腕型GBS)という亜型も知られており咽頭筋、呼吸筋、近位筋の筋力低が特徴とされている。 |
||
==疫学== |
|||
稀な疾患であり、年間の発病率は10万人当たり1〜2人程度とされる。ただ、厳密には前述するように複数の名称が混在しており、その解釈により増減する。 |
|||
| ⚫ | |||
{|class=wikitable |
|||
! nowrap="nowrap" |分類!! nowrap="nowrap" |内容 |
|||
|- |
|||
|感染症||[[カンピロバクター]]、[[ジカウイルス]]<ref>Parra B, et al. Guillain–Barré Syndrome Associated with Zika Virus Infection in Colombia. N Engl J Med 2016; 375:1513-1523. {{DOI|10.1056/NEJMoa1605564}}</ref>、[[EBウイルス]]、[[サイトメガロウイルス]]、[[マイコプラズマ]]、[[ヒト免疫不全ウイルス|HIV]]、[[インフルエンザ桿菌]]、[[水痘]]、[[帯状疱疹]]、[[インフルエンザ]] ([[A型インフルエンザウイルス|A型]]、[[B型インフルエンザウイルス|B型]])、[[麻疹]]、[[風疹]]、[[流行性耳下腺炎]]、[[コクサッキーウイルス]] (A4, B5)、[[サルモネラ]]、[[エルシニア症]]、[[野兎病]]、[[リステリア症]]、[[ブルセラ症]]、[[赤痢]]、[[大腸菌]]、[[結核]] |
|||
|- |
|||
|[[ワクチン]]||[[インフルエンザワクチン|インフルエンザ]]、[[狂犬病ワクチン]]、[[BCG]]、[[破傷風ワクチン|破傷風]]、[[B型肝炎ワクチン|B型肝炎]]、[[麻疹ワクチン|麻疹]]、[[風疹ワクチン|風疹]]、[[流行性耳下腺炎ワクチン|流行性耳下腺炎]]、[[ポリオワクチン|ポリオ]]、[[COVID-19ワクチン|COVID-19]]<ref name="reuter20210908">{{cite web|url=https://jp.reuters.com/article/health-coronavirus-vaccines-ema-idJPKBN2G501G|title=欧州当局、アストラ製ワクチン副反応にギラン・バレー症候群追加|date=2021-9-8|accessdate=2021-09-09|pubrisher=[[ロイター]]}}</ref><ref name="reuter20210721"/> |
|||
|- |
|||
|全身性疾患||[[ホジキンリンパ腫]]、[[悪性腫瘍]]、[[全身性エリテマトーデス]] |
|||
|- |
|||
|薬剤||[[ガングリオシド]]、[[金]]製剤、[[D-ペニシラミン]]、[[ダナゾール]]、{{仮リンク|ジメリジン|en|Zimelidine}} |
|||
|- |
|||
|その他||[[外科手術]]、[[妊娠]] |
|||
|} |
|||
上記のような原因が報告されている。特に60%以上の例で何らかの先行感染が認められる。特に因果関係がはっきりしているのは[[サイトメガロウイルス]]、[[EBウイルス]]などの[[ウイルス]]や、[[マイコプラズマ]]、[[カンピロバクター]]の4つである。カンピロバクターはGBS発症の1週間前頃に下痢、サイトメガロウイルス、EBウイルス、マイコプラズマは2週間前程度に上気道炎を先行感染として起こすことが多い。ワクチンの接種後の発症例も認められている。ワクチンの場合は3週間以上前のことが多い。よってGBSを疑った場合は、1週間前に下痢をしなかったか、2週間前に咽頭痛や咳、鼻水といった風邪の症状はなかったのか、1か月以内にワクチンの接種をしなかったのかと調査していく必要がある。 |
|||
カンピロバクターは全体の20 - 30%を占める主要な先行感染であり、カンピロバクター後にGBSを発症する確率は0.1%である。カンピロバクターの菌体のLOS分子がガングリオシドと[[分子相同性]]をもっており、感染源に対する[[抗体]]が誤って自己の末梢神経も攻撃してしまうということによって発症するという分子相同性疾患という概念が作られたが、その他の先行感染などでは不明な点も多く、また先行感染が証明されない症例も多い。血清中の抗[[ガングリオシド]]抗体の上昇が50%〜60%で認められる。ガングリオシド抗体は[[エスアールエル|SRL]]や[[近畿大学]]にて測定される。 |
|||
日本では、2018年にカンピロバクターを原因とする[[食中毒]]患者で、ギラン・バレー症候群と診断された例がある<ref>{{Cite news |title=レバ刺し食べた2人が食中毒、1人は重体 茨城の飲食店 |newspaper=朝日新聞デジタル |date=2018-12-07 |author= |url=https://www.asahi.com/articles/ASLD667BSLD6UJHB00X.html |accessdate=2018-12-07}}</ref>。十分に加熱されていない肉類を食するとカンピロバクター性のギラン・バレー症候群を発症する場合がある。 |
|||
[[有髄神経]]の構造は、電気的な興奮を伝える[[軸索]]が中心にあり、軸索の周囲を[[絶縁体]]である[[髄鞘]]が覆っている。ギラン・バレー症候群は髄鞘が傷害される脱髄型と、軸索そのものが傷害される軸索傷害型、両者が傷害される混合型に分類できる。 |
[[有髄神経]]の構造は、電気的な興奮を伝える[[軸索]]が中心にあり、軸索の周囲を[[絶縁体]]である[[髄鞘]]が覆っている。ギラン・バレー症候群は髄鞘が傷害される脱髄型と、軸索そのものが傷害される軸索傷害型、両者が傷害される混合型に分類できる。 |
||
| 82行目: | 106行目: | ||
|標的分子||不明||ガングリオシドGM1、GD1a |
|標的分子||不明||ガングリオシドGM1、GD1a |
||
|} |
|} |
||
=== インフルエンザの予防接種 === |
|||
[[1976年]]に米国東部[[ニュージャージー州]]の陸軍基地で[[H1N1亜型|H1N1]]豚インフルエンザ(現在の[[新型インフルエンザ]]とは異なる)が発見された。[[スペイン風邪]]の原因が豚インフルエンザと考えられていたので、大流行を防止するために4300万人に予防接種を行った結果、約400人がギラン・バレー症候群となり、25人が死亡した(インフルエンザによる死亡は1人)。[[1957年]]にも同様な現象が見られた。しかし米国では予防接種の少ない時期でも毎週80-160例の新規患者が発生していると[[アメリカ疾病予防管理センター]]は述べている。 |
|||
| ⚫ | |||
[[2021年]][[9月8日]]に[[欧州医薬品庁]](EMA)が[[AZD1222|アストラゼネカ製ワクチン]]のまれな副反応としてギラン・バレー症候群を追加したことを発表した<ref name="reuter20210908"/>。同年7月31日までの全世界での接種数5億9200万回のうち、ギラン・バレー症候群の発症が833件報告されていることから、因果関係に「少なくとも合理的な可能性」があると判断したもので、[[アメリカ食品医薬品局|米国食品医薬品局]](FDA)も[[ジョンソン・エンド・ジョンソンCOVID-19ワクチン|ジョンソン・エンド・ジョンソン製ワクチン]]について接種後6週間にギラン・バレー症候群の発症リスクが高まるとして警告を発している<ref name="reuter20210721">{{cite web|url=https://jp.reuters.com/article/health-coronavirus-johnson-johnson-idJPKBN2EI23N|title=J&Jのコロナワクチン、まれな自己免疫疾患発症 米当局が警告|date=2021-07-21|accessdate=2021-9-9|publisher=[[ロイター]]}}</ref>。約1280万人への接種で100件の発症例の暫定報告があり、うち95件が入院を必要とする重篤例で、死亡例も1件あったという。 |
|||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
== 検査 == |
== 検査 == |
||
| 272行目: | 274行目: | ||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
=== 出典 === |
=== 出典 === |
||
{{Reflist|3}} |
|||
<references /> |
|||
== 参考文献 == |
== 参考文献 == |
||
2022年10月9日 (日) 09:32時点における版
| ギラン・バレー症候群 | |
|---|---|
| 概要 | |
| 診療科 | 神経学 |
| 分類および外部参照情報 | |
| ICD-10 | G61.0 |
| ICD-9-CM | 357.0 |
| OMIM | 139393 |
| DiseasesDB | 5465 |
| MedlinePlus | 000684 |
| eMedicine | emerg/222 neuro/7 pmr/48 neuro/598 |
| Patient UK | ギラン・バレー症候群 |
| MeSH | D020275 |
ギラン・バレー症候群(ギラン・バレーしょうこうぐん、英: Guillain-Barré syndrome、以下GBSと記する)は、急性・多発性の根神経炎の一つ。主に筋肉を動かす運動神経が障害され、四肢に力が入らなくなる病気のこと。重症の場合、中枢神経障害性[要出典]の呼吸不全を来し、この場合には一時的に気管切開や人工呼吸器を要するが、予後はそれほど悪くない[要出典]。日本では厚生労働省の治療研究(難治性疾患克服研究事業)の対象となっているが、医療給付(難病医療費助成制度)の対象ではない。
毎年10万人あたり1 - 2人の割合で発症する稀な病気であり、男女を問わず、また世界のどの地域でも同程度の罹患率である[1][2][3]。
徴候と症状

前駆症状として、咽頭発赤、扁桃炎、急性結膜炎、急性胃腸炎、感冒症状(咽頭痛や微熱など)が見られる。これらの症状は通常は神経症状出現の1〜3週間ほど前に認められる。全例の約3分の2で先行感染が認められる。
症状の程度は様々だが、運動神経の障害が主で初発症状は下肢の筋力低下から起こることが多い。その後、下肢から体幹部に向かい左右対称性に筋力低下や麻痺が上行する。四肢麻痺は、遠位筋に強く現れる。呼吸筋の麻痺が発症すると人工呼吸器により呼吸管理が必要となることがある。運動神経の障害が主であるが、軽度の感覚神経障害も発症する。特に異常感覚や神経因性疼痛が多く支持療法が必要となることも多い。
そのほか、両側性の顔面神経麻痺や外眼筋障害などといった脳神経症状や、構音障害や嚥下障害などの球麻痺症状、自律神経障害を伴うことがある。自律神経障害は突然死の原因となり、麻痺による長期臥床は肺梗塞の原因となりいずれも致死的であり注意が必要である。約7割の患者が半年以内に日常生活をおくれるようになるが、重篤な場合は回復まで数年を要することもあり、回復しても手足の痺れなどの後遺症が残る場合があるという。
- 運動神経の障害
- 脱力、麻痺である。多くは下肢から始まり、上に向かって進行する。急性・急速進行性・左右対称性・全身性・遠位筋優位の筋力低下である。末梢性神経障害のため、弛緩性麻痺となることが特徴である。
- 反射弓の障害
- 深部腱反射の低下や消失が特徴的とされている。神経根の障害からレンショウ抑制や側方抑制の障害が起こることによって腱反射が亢進することがある。この所見は軸索型GBSで認められやすい。腱反射は亢進するが痙性や病的反射は認められないことから上記の障害モデルは提唱されているが詳細は不明である。急性期から反射が亢進する場合、回復期から亢進する場合がある。
- 感覚の障害
- 感覚鈍麻、異常感覚、神経因性疼痛が高頻度に認められる。痛みは90%近い患者で認められ、神経根痛や筋痛、関節痛などを訴えることもある。ステロイド、カルバマゼピン、オピオイド、ガバペンチン、プレガバリンなどが支持療法として用いられる。
- 自律神経障害
- ギラン・バレー症候群で自律神経障害が認められる場合は圧受容器反射弓の求心路が障害される。そのため、中枢への抑制がきかず節後神経交感神経活動は亢進する。そのため、安静時の血圧や心拍数は上昇しており血中のノルアドレナリンも高値となる。しかし起立すると血圧は急激に低下し、失神を起こすこともある。SIADH(抗利尿ホルモン不適合分泌症候群)の合併のためADH(抗利尿ホルモン)も高値を示すことが多い。
原因
原因は不明だが、根本的なメカニズムとして、身体の免疫系が誤って末梢神経を攻撃し、ミエリンの絶縁体を損傷する自己免疫疾患が関与していると考えられている[1]。この免疫機能障害は、感染によって引き起こされることもあれば、あまり一般的ではないが手術によって引き起こされることもあり、ごくまれにワクチン接種によって引き起こされることもある[1][3]。診断は通常、別の原因を除外した上で徴候と症状に基づいて行われ、神経伝導検査や脳脊髄液の検査などによって裏付けられる[1]。
感染症
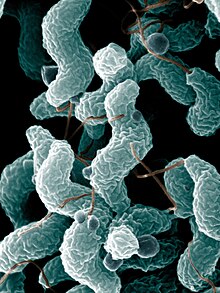
ギラン・バレー症候群の3分の2は、発症前に感染症を経験している[4]。最も一般的なのは、胃腸炎または呼吸器感染症であり、約30%の症例は、下痢を引き起こすカンピロバクター・ジェジュニ細菌によって誘発される[5]。さらに10%はサイトメガロウイルス(CMV、HHV-5)に起因するものである[5]。それにもかかわらず、カンピロバクターやCMVに感染してもギラン・バレー症候群を発症する人はごくわずかであり、それぞれ1000回につき0.25 - 0.65例、1000回につき0.6 - 2.2例と言われている[5]。細菌はその表面に異なるリポ多糖を持ち、感染した株によってギラン・バレー症候群を発症するリスクが異なる可能性がある[4]。日本では、2018年にカンピロバクターを原因とする食中毒患者で、ギラン・バレー症候群と診断された例がある[6]。十分に加熱されていない肉類を食するとカンピロバクター性のギラン・バレー症候群を発症する場合がある[7]。
他の感染症との関連はあまり定かではないが、2つのヘルペスウイルス(エプスタイン・バール・ウイルス(HHV-4)および水痘・帯状疱疹ウイルス(HHV-3))と、細菌のマイコプラズマが関連していると言われている[5]。 ギラン・バレー症候群はインフルエンザ後に発症することが知られており、インフルエンザワクチンの接種がリスク低減につながることが実証されている[8]。 熱帯性フラビウイルス感染症であるデング熱およびジカウイルスもギラン・バレー症候群の発症と関連している[9][10][11]。 E型肝炎ウイルスに感染したことのある人は、ギラン・バレー症候群を発症することが多いことが分かっている[4][12]。
ワクチン
季節性インフルエンザワクチンは「ギランバレー症候群」を誘発する可能性が指摘されているが、これは100万回に1例(1000回あたり0.001人)程度の非常に稀なものである[13][14]。インフルエンザの自然感染は、インフルエンザワクチン接種よりもギラン・バレー症候群の強い危険因子であり、ワクチン接種でインフルエンザに罹患するリスクを減らすことで、ギラン・バレー症候群のリスクを低下させることができる[15][16][17][18]。
1976年のH1N1豚インフルエンザの発生後に行われたインフルエンザワクチン接種では、ギラン・バレー症候群の発生率が増加し、100万回あたり8.8例(1000回あたり0.0088人)が合併症として発症した[19][20]。1976年のインフルエンザワクチン接種による発症リスクは異常値であり、その後のワクチン接種ではこのような著しい増加は起きていない[19][5]。
2021年3月24日、帯状疱疹ワクチン「Shingrix」の接種後に、100万回当たり3例のギラン・バレー症候群の増加が推定されたため、FDAは製造元のグラクソ・スミスクライン社にギラン・バレー症候群のリスクに関する警告を記載するように求めた[21]。研究者らは、ワクチンにより帯状疱疹のリスクを減らせるメリットは大きいが、医師と患者は接種前にギラン・バレー症候群のリスクについて認識しておく必要があると述べている[21][22]。
COVID-19感染またはワクチン関連
ギラン・バレー症候群は新型コロナウイルス感染症(COVID-19)に関連して報告されており、COVID-19の神経学的合併症の可能性がある[23][24][25][26]。COVID-19は末梢神経障害を引き起こすと報告されており、最近ではギラン・バレー症候群を含む自己免疫疾患を悪化させるという証拠もある[27]。いくつかの研究では、パーキンソン病が感染者により一般的であることが分かってきている[28]。
2021年9月8日、欧州医薬品庁(EMA)はアストラゼネカ製ワクチンのごくまれな副反応にギラン・バレー症候群を追加したことを発表した[29][30][31]。同年7月31日までの全世界での接種数5億9200万回のうち、ギラン・バレー症候群の発症が833件(71万回に約1例)報告されていることから、因果関係に「少なくとも合理的な可能性」があると判断した[29]。EMAはこの副反応を頻度が最も低い「非常にまれ」なカテゴリーに分類し、ワクチン接種の効果は副反応のリスクを上回ると強調した[29]。米国食品医薬品局(FDA)もジョンソン・エンド・ジョンソン製ワクチンについてギラン・バレー症候群の発症リスクが増加する可能性があると警告した[32][33]。FDAは接種後にギラン・バレー症候群を発症する可能性は「非常に低い」とし、ワクチンにより得られる利益はリスクを上回るとの見解を示している[34][35]。
薬物性
抗うつ薬のジメリジンは、非常に良好な安全性プロファイルを持っていたが、ギラン・バレー症候群のまれな症例報告の結果、市場から撤退した[36][37][38]。
分類

1859年にフランス人医師のジャン・ランドリー(仏: Jean Baptiste Octave Landry)によって、上行性麻痺の一例という報告がなされた。その後、この症例はランドリー上行性麻痺の一例と呼ばれている。
1916年にフランス人医師のジョルジュ・ギラン(仏: Georges Guillain)とジャン・アレクサンドル・バレーが、急性で単相性の運動麻痺を呈した2症例を髄液の蛋白細胞解離と脱髄を示唆する電気生理所見とともに報告したことによりギラン・バレー症候群 (GBS) という名称が定着した。その後、欧米諸国では、急性炎症性脱髄性多発ニューロパチーacute inflammatory demyelinating polyneuropathy (AIDP) と同義語として用いられてきた。現在、ランドリー上行性麻痺の原因はAIDPであったと推定されている。
1970年代より中国で初夏に流行する急性麻痺性疾患が認められた。当初 Chinese paralytic syndrome と命名されたこの疾患は、末梢神経に脱髄やリンパ球浸潤を伴わず軸索変性が認められ1993年にacute motor axonal neuropathy(AMAN、急性運動軸索型ニューロパチー)として認識された。AIDP、AMAN共に先行感染を伴い、単相性の経過をとり、発症後1〜3週間で最大を迎え、その後自然軽快していく、また血漿交換など免疫学的な治療が有効なことからGBSという概念で包括し、軸索型GBSをAMAN、脱髄型GBSをAIDPととらえるようになった。
このような歴史的経過から、GBSの名称には以下の様々が混在している。
- acute inflammatory demyelinating polyneuropathy (AIDP)
- acute idiopathic polyradiculoneuritis (AIP)
- acute idiopathic polyneuritis (AIP)
- French Polio(仏ポリオ)
- Landry's ascending paralysis(ランドリー上行性麻痺)
- Landry-Guillain-Barré syndrome(ランドリー・ギラン・バレー症候群)
欧米ではGBSの90%がAIDPであるが中国では65%がAMANであり、日本ではAMANが38%、AIDPが36%とされている。
他の病型には、感覚障害を伴うAMSAN(acute motor-sensory axonal neuropathy、急性運動感覚性軸索型ニューロパチー)、フィッシャー症候群などが知られている。特にイタリアではGBSの35%がフィッシャー症候群と地域差が認められ、このフィッシャー症候群は、ギラン・バレー症候群の亜型と考えられている。ギラン・バレー症候群が全身型の疾患であるのに対して、同様の自己免疫が原因で末梢神経の障害が起こる疾患にフィッシャー症候群やビッカースタッフ型脳幹脳炎があり、外眼筋麻痺、失調、深部反射低下などが見られる。PCB(pharygeal-cervical-brashial weakness、咽頭頚部上腕型GBS)という亜型も知られており咽頭筋、呼吸筋、近位筋の筋力低が特徴とされている。
有髄神経の構造は、電気的な興奮を伝える軸索が中心にあり、軸索の周囲を絶縁体である髄鞘が覆っている。ギラン・バレー症候群は髄鞘が傷害される脱髄型と、軸索そのものが傷害される軸索傷害型、両者が傷害される混合型に分類できる。
従来は脱髄型が多く生命予後、機能予後ともに良好とされていた。しかし大規模調査の結果、日本では軸索傷害型と混合型の割合が高く、長期的にも機能が完全には回復しない例も多いことが明らかとなってきた。軸索型、脱髄型の特徴を以下にまとめる。
| 特徴 | 脱髄型 | 軸索型 |
|---|---|---|
| 先行感染 | 上気道炎 | 胃腸炎(カンピロバクター) |
| 脳神経障害 | 30 - 40% | まれ (< 20%) |
| 感覚障害 | あり | なし |
| 自律神経障害 | 交感神経亢進 | まれ |
| 腱反射 | 消失 | ときに亢進 |
| 進行期間 | 平均18日 | 平均10日 |
| 回復 | 週単位で回復 | 2つのパターン(急速型と遷延型) |
| 標的分子 | 不明 | ガングリオシドGM1、GD1a |
検査
- 神経伝達速度検査
- GBSの急性期に認められやすい神経伝導速度検査の異常所見としては遠位刺激のCMAP振幅の低下、伝導ブロック、遠位CMAPでの時間的分散、H波やF波の消失、遅延、A波の出現、特に絞扼部での遅延や伝導ブロック、SCSで正中神経では異常が認められるが腓腹神経では正常を示すAMNS(abnormal median normal sural)パターンなどがよく知られている。AMNSはAIDPで特徴的とされている。Hoらの基準にあてはめるには発症2週間以内の検査で行う。しかし神経伝導検査の所見は経時的に変化するため2〜4週後に再度検査を行う方が予後予測の上では重要視されている。Hoらの基準とHaddenらの基準の違いとしてはHoらは伝導ブロックを脱髄所見としておらず時間的分散のみを脱髄所見としている。伝導ブロック、時間的分散ともに明確に定義はされてはいない。
- 電気生理学的な検討ではAIDP、AMANともに運動神経終末、生理的絞扼部、脊髄神経根で異常が認められる頻度が高い。この部位は血液神経関門が欠如あるいは脆弱であるため、血液中の免疫グロブリンの攻撃を受けやすいと考えられている。
- 筋電図検査
- 筋電図検査では脱神経電位が認められることがある。かつては予後不良の所見とされていた。
- 髄液検査
- 脳脊髄液中に蛋白が増加しているが、細胞の増加は認めない(蛋白細胞解離)。解離の程度は臨床症状の程度に平行して増強し、病初期ははっきりしないことが多く10〜20病日でピークとなる。髄液内に細胞浸潤は認められないものの、組織障害が起こり蛋白の上昇が起こっていると考えられている。
- 血液検査
- 急性期の血清中に抗ガングリオシド抗体を認めることがある。ガングリオシド抗体は急性期に50%〜60%の例で認められ、回復期には消失ないし低下する。ガングリオシドはセラミドにグルコース、ガラクトース、Nアセチルガラクトサミンなどの六炭糖が結合したもので、運動神経および感覚神経の神経軸索やミエリンに豊富に分布する。絶対的ではないが、GBSでは抗ガングリオシド抗体の種類と臨床病型に相関関係があり、以下のようにまとめられる。抗GM1抗体はAMANの発症に関わり、カンピロバクターが有するリポオリゴ糖 (LOS) とGM1との分子相同性で説明される。カンピロバクターのLOSによって算出された抗体が末梢神経軸索上のGM1を標的として作用することで軸索障害が生じると考えられている。カンピロバクターの遺伝子多型によって作られるLOSが規定されており、患者で算出される抗体の種類もそれに応じて決定される。LOSの糖鎖産出には転移酵素が関わる。Cst-IIと呼ばれるシアル酸転移酵素の51番目のアミノ酸がスレオニンの場合は抗GM1抗体や抗GD1a抗体が産生される。スレオニンではなくアスパラギンを有するCst-IIではGT1aやGD1cエピトープが産生され抗GQ1b抗体が産生される。また単一のガングリオシドに対する抗体以外にガングリオシド複合体に対する抗体 (GCA) も知られ重症のGBSを引き起こす傾向がある。またIgM型の抗GM1抗体は多巣性運動ニューロパチー (MMN) 症例でしばしば検出される。
抗原 先行感染 臨床像 抗原分布 特記事項 GM1 C.jejuni AMAN、純運動型GBS ランビエ絞輪 GM1b C.jejuni AMAN、純運動型GBS GM2 CMV 脳神経障害、感覚障害 IgMに病的意義がある。感覚神経への関与が明らかになっている。 GM3 GD1a C.jejuni AMAN 有髄神経軸索、ランビエ絞輪 GD1b 呼吸器感染症>消化器感染症 純感覚型GBS、失調 有髄神経傍絞輪部、後根神経節 GD3 GT1a 咽頭頚部上腕型GBS 嚥下機能に関与すると考えられている。 GT1b GQ1b 呼吸器感染症>消化器感染症 外眼筋麻痺 Ⅲ、Ⅳ、Ⅵ脳神経傍絞輪部、後根神経節 フィッシャー症候群、ビッカースタッフ型脳幹脳炎 GA1 Gal-C GalNAc-GD1a C.jejuni AMAN、純粋運動型GBS 脊髄前根
- 細菌学的検査・免疫学的検査
- 便中からカンピロバクターが分離されたり、血清中の抗サイトメガロウイルス・EBウイルス・マイコプラズマ抗体が上昇したりすることがある。先行感染の症状がはっきりしない場合に特に有用な検査である。
鑑別診断
パーキンソン病や脳血管障害では両側性に病変が出現することは少ない。
診断
診断基準にはいくつか知られている。
NINCDS、1978祖父江改変
必要条件
- 進行性の運動麻痺が四肢のうち二肢以上に存在し、程度は軽度から完全麻痺まで、体幹筋、球部筋、顔面筋、外眼筋が侵されることもある。
- 深部腱反射の消失。全身性が原則である
診断を支持する所見
- 臨床所見 重要度順に
- 進行性
- 比較的対称性
- 軽度な知覚症状
- 脳神経障害:顔面神経が約50%。舌・嚥下・外眼筋支配神経も障害される
- 改善は進行停止後2〜4週間以内に始まる
- 自律神経症候
- 神経症候発現のときは発熱しない
- 脳脊髄液
- 蛋白量:発病1週間後から上昇
- 細胞数:10/mm3以下、単核細胞
- 電気生理学的所見
- 80%以上の症例が神経伝達を障害され、神経伝導速度の遅延または伝導ブロックを示す。伝導速度は正常の60%以下となるが病変は散在性ですべての神経が侵されるわけではない
診断を疑わせる所見
- 高度かつ持続性の非対称性麻痺
- 持続性の直腸膀胱障害
- 発症時の直腸膀胱障害
- 50/mm3以上の髄液中の単核細胞数
- 髄液中の多核白血球
- 明瞭な感覚障害レベル
診断を除外する条件、鑑別診断
- n-ヘキサン、メチルn-ブチルケトンなどの揮発性有機溶剤、急性間欠性ポルフィリン症、ジフテリアの感染症、鉛ニューロパチーの臨床所見、ポリオ、ボツリヌス中毒、中毒性ニューロパチー(例:ニトロフラントイン、ダプソン、有機リン化合物)などとの鑑別。
AsburyとCornblathによる診断基準
必要条件
- 2肢以上の進行性の筋力低下
診断を支持する臨床所見
- 発症4週間以内に症状はピークに達する。
- 症状の進行が停止して2〜4週間後に症状が改善し始める。
- 四肢の腱反射低下〜消失
- 症状の左右対称性
- 軽度の感覚障害、異常感覚
- 脳神経麻痺(外眼筋麻痺、顔面神経麻痺、球麻痺)の存在
- 自律神経障害(頻脈、不整脈、血圧変動)の存在
- 発症時に発熱を欠く
診断を支持する検査所見
- 末梢神経伝導検査での異常(伝導速度低下、遠位潜時延長、伝導ブロック、F波潜時延長、複合筋活動電位低下など)
- 発症1週間以降における蛋白細胞解離(細胞数は90%で10/μl以下)
- 急性期血清での抗ガングリオシド抗体の上昇(特にIgGクラス)
診断を疑う所見
- 筋力低下の左右差が顕著で、かつその状態が持続
- 発症当初からの膀胱直腸障害の存在
- 50/μlを超える髄液細胞増多
- 髄液細胞文核における多核球優位
- 境界明瞭なレベルのある感覚障害
除外診断
- 末梢神経障害:有機溶媒中毒、ポルフィリン代謝異常、ジフテリア、鉛中毒、血管障害、栄養障害、CIDP(初発、急性発症)
- 神経筋接合部障害:重症筋無力症、有機リン、ボツリヌス、貝毒
- 筋疾患:筋炎、低カリウム血症、低リン血症、横紋筋融解、周期性四肢麻痺、旋毛虫症
- 脳幹障害:梗塞、炎症、脱髄、腫瘍
- 精神医学性:解離性障害
Hoらの電気生理学的基準
Hoらの基準は電気生理学的な診断基準であり、AIDPとAMANの区別においては非常に有用である。2N以上とは2つ以上の神経においてであり、ULNは正常上限、LLNは正常下限、DMLは運動神経遠位潜時、MCVは運動神経伝導速度、dCMAPは遠位刺激のCMAP振幅、pCMAPは近位刺激のCMAP振幅、TDは時間的分散の増大である。四肢で施行した方が診断基準を満たす確率は高くなる。
AIDP: 下記のいずれかひとつを2N以上で満たす。
- MCV < 90%LLN (dCMAP > 50%LLN) または < 85%LLN (dCMAP < 50%LLN)
- DML > 110%ULN (dCMAP > LLN) または > 120%LLN (dCMAP < LLN)
- 確実なTD(基準示されず)
- minimal F latency > 120%ULN
AMAN: 上記診断基準を満たさず、dCMAP < 80%LLN であること。
Haddenらの電気生理的基準
- normal: DML、minimal F latency、MCV、dCMAP、pCMAP/dCMAP比の全てが被検全神経で正常
- |primary demylinatin}: 下記のいずれかひとつを2N以上で満たすか、あるいは他の全ての神経が inexitable で、残った1NでdCMAP≧10%LLNでかつ下記の二つ以上を満たす。
- MCV < 90%LLN (dCMAP > 50%LLN) または < 85%LLN (dCMAP < 50%LLN)
- DML > 110%ULN (dCMAP > LLN) または > 120%LLN (dCMAP < LLN)
- pCMAP/dCMAP ratio < 0.5 かつ dCMAP ≧ 20%LLN
- minimal F latency > 120%ULN
- primary axonal: 上記脱髄の徴候(各下位項目)をいずれの神経でも全く有しない(あるいはdCMAP < 10%LLNの1Nでひとつまで満たしてよい)
- inexitable: 被検全神経でCMAP消失(あるいは1Nのみ導出されdCMAP < 10%LLN)
- equivocal: 上記いずれにもあてはまらない。
重症度指標
GBSの重症度の指標として、Hughesの運動機能尺度(functional grade)が使用されることが多い。
| 運動機能尺度 | 症状 |
|---|---|
| 0 | 正常 |
| 1 | 軽微な神経症候を認める |
| 2 | 歩行器、またはそれに相当する支持なしで5mの歩行が可能 |
| 3 | 歩行器、または支持があれば5mの歩行が可能 |
| 4 | ベッド上あるいは車椅子に限定(支持があっても5mの歩行が不可能) |
| 5 | 補助換気を要する |
| 6 | 死亡 |
治療
感染症の治療を行うことを基本とする。呼吸筋の障害が見られる患者に対しては人工呼吸器を使用する。これら支持療法のほかに
- 免疫グロブリン療法:機能予後の改善のため、現在では早期から大量投与することが推奨される(IgA欠損症の患者には禁忌)。
- 血漿交換療法:血中の抗体や補体を除去。欧米では主流。
- 免疫吸着療法:血中の抗体や補体を除去。
いずれの治療法が効果的かについての明らかな根拠はない。血漿交換が後遺症の軽減に有効であること、免疫グロブリン療法が血漿交換と同等の効果があるとされている。これらの大規模調査はAIDPが90%を占める欧米で施行されておりAMANが多い日本や中国では異なる可能性がある。AMANに対しては免疫グロブリン療法が血漿交換に勝るという意見もある。また血漿交換は特殊な設備が必要であり、2週間以内かつ早期治療という観点では免疫グロブリン療法の方に分があると考えられている。血漿交換に関しても単純血漿交換、二重濾過法、吸着法全てが同等とされているが大規模試験は行われていない。
かつて用いられたステロイド単独療法は行われなくなったが、免疫グロブリン療法とステロイドパルス療法の併用は長期予後には有意差は認められなかったが、回復期間の短縮がはかれる可能性が示唆されている。頻度としてAMANが多い日本では標準療法として免疫グロブリン療法とステロイドの併用を行うこともあり、その場合はソルメドロールなどのメチルプレドニゾロン500mg/5日で免疫グロブリン開始前に2時間かけて点滴静注で行われる場合が多い。併用療法をしない場合は重症感染症、管理不良の糖尿病、活動性胃潰瘍、重篤な骨粗鬆症、緑内障、HBVキャリアなどがある。
予後改善のため、長期にわたるリハビリテーションが必要となる。寝たきりによる褥瘡の予防、運動麻痺による関節拘縮の予防にも注意する。自律神経障害があればその管理も行う。
2018年には日本での多施設のランダム化比較試験によって、免疫グロブリン療法に加えて、エクリズマブを追加することで、4週で自立歩行までの回復が61%、偽薬では45%、24週での走行可能までが72%、偽薬では18%という結果が得られた[40]。
脚注
出典
- ^ a b c d “Guillain–Barré Syndrome Fact Sheet”. NIAMS (2016年6月1日). 2016年8月5日時点のオリジナルよりアーカイブ。2022年8月29日閲覧。
- ^ “Population incidence of Guillain-Barré syndrome: a systematic review and meta-analysis”. Neuroepidemiology 36 (2): 123–33. (2011). doi:10.1159/000324710. PMC 5703046. PMID 21422765.
- ^ a b Ferri, Fred F. (2016) (英語). Ferri's Clinical Advisor 2017: 5 Books in 1. Elsevier Health Sciences. p. 529. ISBN 9780323448383. オリジナルの2016-08-21時点におけるアーカイブ。
- ^ a b c “Guillain-Barré syndrome: pathogenesis, diagnosis, treatment and prognosis”. Nature Reviews. Neurology 10 (8): 469–82. (August 2014). doi:10.1038/nrneurol.2014.121. PMID 25023340.
- ^ a b c d e “Guillain-Barré syndrome”. The New England Journal of Medicine 366 (24): 2294–304. (June 2012). doi:10.1056/NEJMra1114525. PMID 22694000.
- ^ “レバ刺し食べた2人が食中毒、1人は重体 茨城の飲食店”. 朝日新聞デジタル. (2018年12月7日) 2018年12月7日閲覧。
- ^ “肉の生食に注意!”. 東京都福祉保健局. 2022年10月9日閲覧。
- ^ Vellozzi, C.; Iqbal, S.; Broder, K. (15 April 2014). “Guillain-Barre Syndrome, Influenza, and Influenza Vaccination: The Epidemiologic Evidence”. Clinical Infectious Diseases 58 (8): 1149–1155. doi:10.1093/cid/ciu005. PMID 24415636.
- ^ Parra B, et al. Guillain–Barré Syndrome Associated with Zika Virus Infection in Colombia. N Engl J Med 2016; 375:1513-1523. doi:10.1056/NEJMoa1605564
- ^ “Neurological complications of dengue virus infection”. The Lancet. Neurology 12 (9): 906–919. (September 2013). doi:10.1016/S1474-4422(13)70150-9. PMID 23948177.
- ^ “Zika virus: a previously slow pandemic spreads rapidly through the Americas”. The Journal of General Virology 97 (2): 269–273. (February 2016). doi:10.1099/jgv.0.000381. PMID 26684466.
- ^ “Guillain Barré syndrome and other immune mediated neuropathies: diagnosis and classification”. Autoimmunity Reviews 13 (4–5): 525–30. (April 2014). doi:10.1016/j.autrev.2014.01.033. PMID 24434363.
- ^ “Guillain-Barré syndrome and influenza vaccines: A meta-analysis”. Vaccine 33 (31): 3773–8. (July 2015). doi:10.1016/j.vaccine.2015.05.013. PMID 25999283.
- ^ “Guillain-Barré Syndrome and Vaccines”. CDC. 2022年8月24日閲覧。
- ^ “Risk of Guillain-Barré syndrome after seasonal influenza vaccination and influenza health-care encounters: a self-controlled study”. Lancet Infect Dis 13 (9): 769–76. (September 2013). doi:10.1016/S1473-3099(13)70104-X. PMID 23810252.
- ^ “Update on Guillain-Barré syndrome”. Journal of the Peripheral Nervous System 18 (2): 99–112. (June 2013). doi:10.1111/jns5.12020. PMID 23781958.
- ^ “Principal controversies in vaccine safety in the United States”. Clinical Infectious Diseases 69 (4): 726–731. (August 2019). doi:10.1093/cid/ciz135. PMID 30753348.
- ^ “今さら聞けないインフルエンザの予防接種の話~ワクチンの効果と、よくある誤解”. お薬Q&A〜Fizz Drug Information〜 (2021年7月19日). 2022年8月24日閲覧。
- ^ a b “Guillain-Barré syndrome after exposure to influenza virus”. The Lancet. Infectious Diseases 10 (9): 643–51. (September 2010). doi:10.1016/S1473-3099(10)70140-7. PMID 20797646.
- ^ Nelson, K. E. (2012). “Invited Commentary: Influenza Vaccine and Guillain-Barre Syndrome--Is There a Risk?”. American Journal of Epidemiology 175 (11): 1129–1132. doi:10.1093/aje/kws194. PMID 22582208.
- ^ a b “New safety communication regarding Shingrix vaccine”. U.S. Food and Drug Administration (2021年3月25日). 2021年10月18日閲覧。
- ^ “Risk of Guillain-Barre' Syndrome Following Recombinant Zoster Vaccine in Medicare Beneficiaries”. JAMA Internal Medicine (2021年11月1日). 2022年10月9日閲覧。
- ^ “Neurological associations of COVID-19”. The Lancet. Neurology 19 (9): 767–783. (September 2020). doi:10.1016/S1474-4422(20)30221-0. PMC 7332267. PMID 32622375.
- ^ “Guillain-Barré Syndrome Associated with SARS-CoV-2”. The New England Journal of Medicine 382 (26): 2574–2576. (June 2020). doi:10.1056/NEJMc2009191. PMC 7182017. PMID 32302082.
- ^ “The emerging spectrum of COVID-19 neurology: clinical, radiological and laboratory findings”. Brain 143 (10): 3104–3120. (July 2020). doi:10.1093/brain/awaa240. PMC 7454352. PMID 32637987.
- ^ Abu-Rumeileh, Samir; Abdelhak, Ahmed; Foschi, Matteo; Tumani, Hayrettin; Otto, Markus (2021). “Guillain-Barré syndrome spectrum associated with COVID-19: an up-to-date systematic review of 73 cases”. Journal of Neurology 268 (4): 1133–1170. doi:10.1007/s00415-020-10124-x. ISSN 1432-1459. PMC 7445716. PMID 32840686.
- ^ Finsterer, Josef; Scorza, Fulvio Alexandre; Scorza, Carla Alessandra; Fiorini, Ana Claudia (19 July 2021). “Peripheral neuropathy in COVID-19 is due to immune-mechanisms, pre-existing risk factors, anti-viral drugs, or bedding in the Intensive Care Unit”. Arquivos de Neuro-Psiquiatria 79 (10): 924–928. doi:10.1590/0004-282X-ANP-2021-0030. PMID 34287509.
- ^ Smeyne, Richard J.; Noyce, Alastair J.; Byrne, Matthew; Savica, Rodolfo; Marras, Connie (2021). “Infection and Risk of Parkinson's Disease”. Journal of Parkinson's Disease 11 (1): 31–43. doi:10.3233/JPD-202279. PMC 7990414. PMID 33361610.
- ^ a b c “欧州当局、アストラ製ワクチン副反応にギラン・バレー症候群追加” (2021年9月8日). 2021年9月9日閲覧。
- ^ “COVID-19 Vaccine Janssen: Guillain-Barré syndrome listed as a very rare side effect”. European Medicines Agency. 2021年9月13日閲覧。
- ^ (英語) Autoimmune damage to the nerves following Covid vaccines: EMA issued warning to patients and healthcare professionals. (2022-06-21).
- ^ “Coronavirus (COVID-19) Update: July 13, 2021”. FDA (2021年7月13日). 2022年10月9日閲覧。
- ^ “J&Jのコロナワクチン、まれな自己免疫疾患発症 米当局が警告”. ロイター (2021年7月21日). 2021年9月9日閲覧。
- ^ “FDA Adds Guillain-Barré Warning to J&J COVID-19 Vaccine”. HealthDay (2022年5月24日). 2022年10月9日閲覧。
- ^ “J&J社製のコロナワクチンでギラン・バレー症候群のリスク増、米FDA”. 薬事日報 (2021年7月27日). 2022年10月9日閲覧。
- ^ “Guillain-Barré syndrome following zimeldine treatment”. Journal of Neurology, Neurosurgery, and Psychiatry 48 (1): 65–9. (January 1985). doi:10.1136/jnnp.48.1.65. PMC 1028185. PMID 3156214.
- ^ “A paradigm shift in brain research”. Science 294 (5544): 1021–4. (November 2001). Bibcode: 2001Sci...294.1021C. doi:10.1126/science.1066969. PMID 11691978.
- ^ “The Rise and Sudden Fall of Zimelidine: The First SSRI”. 2022年10月9日閲覧。
- ^ “Georges Guillain's neurologic exploration of America”. Neurology 50 (5): 1451–5. (May 1998). doi:10.1212/WNL.50.5.1451. PMID 9596004.
- ^ 遠藤るりこ (2018-04-25日). “ギラン・バレー症候群に対する医師主導治験結果発表、新規治療の可能性示唆—千葉大ら”. QLife Pro 2018年4月29日閲覧。
参考文献
- Effect of methylprednisolone when added to standard treatment with intravenous immunoglobulin for Guillain-Barré syndrome: randomised trial.、Lancet 2004年1月17日、363(9404):192-6.PMID 14738791
- Clinical features, pathogenesis, and treatment of Guillain-Barré syndrome.van Doorn PA, Ruts L, Jacobs BC.、Lancet Neurol、2008年10月;7(10):939-50. Review.PMID 18848313
- The spectrum of antecedent infections in Guillain-Barré syndrome: a case-control study、Jacobs BC、Rothbarth PH、van der Meché FG、Herbrink P、Schmitz PI、de Klerk MA、van Doorn PA、Neurology、1998 Oct;51(4):1110-5.PMID 9781538
- Guillain-Barré syndrome after exposure to influenza virus.、Lehmann HC、Hartung HP、Kieseier BC、Hughes RA、Lancet Infect Dis. 2010年9月、10(9):643-51. Review.PMID 20797646
- Guillain-Barré syndrome、Hughes RA, Cornblath DR. Lancet 2005年11月5日;366(9497):1653-66. Review.PMID 16271648
- The immunobiology of Guillain-Barré syndromes、Willison HJ. J Peripher Nerv Syst. 2005年1月;10(2):94-112. Review.PMID 15958123
- Advances in understanding and treatment of immune-mediated disorders of the peripheral nervous system.、Kieseier BC, Kiefer R, Gold R, Hemmer B, Willison HJ, Hartung HP. Muscle Nerve 2004年8月;30(2):131-56. Review.PMID 15266629
- Infectious origins of, and molecular mimicry in, Guillain-Barré and Fisher syndromes.、Yuki N、Lancet Infect Dis. 2001年8月;1(1):29-37. Review.PMID 11871407
関連項目
外部リンク
- Guillain–Barré syndrome(英語) - WHO
- ギラン・バレー症候群 - 日本神経学会
- ギラン・バレー症候群、フィッシャー症候群診療ガイドライン2013|ガイドライン - 日本神経学会
- 重症副作用疾患対応別マニュアル ギラン・バレー症候群 - 厚生労働省
- ギラン-バレー症候群(GBS) - MSDマニュアル家庭版
- ギラン・バレー症候群(Guillain Barre syndrome,GBS)とはどのようなものか? - 近畿大学脳神経内科(神経内科)、2021年7月14日閲覧
