「酵素」の版間の差分
m →酵素の役割: 補因子・補酵素・補欠分子族の定義を微生物学・分子細胞生物学辞典の定義で訂正 |
m →補因子: 補酵素・補因子は酵素の構造要素でない。あるいはヘモグロビンなど酵素で無い例を整理する。 |
||
| 126行目: | 126行目: | ||
酵素は、親水基に覆われている表面から亀裂が入るかのように、内部まで裂目が入っていることが多い。反応をおこす部位はこうした亀裂の内部に存在し、その亀裂に基質がトラップされることによって反応が起きる。こうした、反応に中心的な役割を果たす部位を「活性中心」と呼ぶ。また、活性中心以外にも、補助的な役割([[補酵素]]など補因子)を担う基質分子を結合させる部位も存在する。こうした活性中心や補因子結合部位にはよく似た構造の分子が入ることとなるが、こうした分子は得てして反応が起きず、[[阻害剤]]として働く場合が多い。 |
酵素は、親水基に覆われている表面から亀裂が入るかのように、内部まで裂目が入っていることが多い。反応をおこす部位はこうした亀裂の内部に存在し、その亀裂に基質がトラップされることによって反応が起きる。こうした、反応に中心的な役割を果たす部位を「活性中心」と呼ぶ。また、活性中心以外にも、補助的な役割([[補酵素]]など補因子)を担う基質分子を結合させる部位も存在する。こうした活性中心や補因子結合部位にはよく似た構造の分子が入ることとなるが、こうした分子は得てして反応が起きず、[[阻害剤]]として働く場合が多い。 |
||
=== |
===補欠分子族=== |
||
酵素 |
酵素はタンパク質から構成されるが、タンパク質だけではなく非タンパク質性の分子である'''補欠分子族'''が組み込まれることが必要な酵素も存在する。<ref name="理化学辞典">補欠分子族、『理化学辞典』第五版、岩波書店</ref> |
||
* 配合団 — [[ヘム]]、[[クロロフィル]]、[[FAD]]、[[フラビン|FMN]]など |
|||
* 補酵素 — [[NAD|NAD<sup>+</sup>]]、[[NADP|NADP<sup>+</sup>]]など |
|||
* 金属 — [[ニッケル]]、[[鉄]]、[[マグネシウム]]、[[セレン]]など |
|||
配合団は酵素にかなりしっかりと結合した共同因子であり、この因子を外すには立体構造を解くなどの操作が必要である。生体内でもタンパク質からはなかなか離れず、遊離しない。 |
|||
補欠分子族は無機化合物の場合もあれば有機化合物の場合もある補因子の一種である。しかし酵素と常に結合している点で別の補因子である補酵素とは異なる。 |
|||
補酵素は逆に単独で存在し、反応が起きるときのみ酵素と複合体を作る。生体内を常に遊離しており、所在は多様である場合が多い。生体内での電子伝達を担うことが多い。 |
|||
[[カタラーゼ]]、[[P450]]などの活性中心に存在する[[ヘム|ヘム鉄]]などが代表的な補欠分子族である。あるいは金属プロテアーゼの[[亜鉛]]イオンなど直接タンパク質と結合している場合もある。生体が要求する微量金属元素は多くの場合で補欠分子族として酵素に組み込まれている。 |
|||
金属は、極めて固く結合しているものもあれば、透析などで取れてしまう場合もある。配合団の中に金属が配位されている事もある(ヘムには鉄、クロロフィルにはマグネシウム)。タンパク質内での電子伝達や活性中心、核酸への結合([[亜鉛|ジンク]]フィンガー)といった役割を担う。 |
|||
==酵素反応== |
==酵素反応== |
||
2007年1月18日 (木) 16:11時点における版
| この記事は秀逸な記事に推薦されています。秀逸な記事の選考にて、批評・投票を受け付けています。 |

酵素(こうそ)とは生体が行う化学反応(生化学反応)で触媒作用を示す生体関連物質のこと。酵素には作用する物質(基質)をえり好みする(基質特異性)ことと、殆ど副反応が進行しない(反応選択性)ことに特徴がある。生物が物質を吸収、輸送、代謝、排泄するさまざまな過程に酵素は関与している。およそ生体が物質を変化させ活用する場面において酵素が関与しない場面は無いといっても過言ではない。
酵素の役割
基質選択性と反応選択性は酵素が生体内の化学反応の進行を補助あるいは制御するという役割を発現する為名に重要である。生体内ではさまざまな物質が渾然一体となって存在する。酵素はその中で目的の化合物のみに作用するのである。体内での代謝過程の各段階では、それぞれに専用の酵素が存在し物質は次から次へと異なる酵素の作用によりその構造を変化させてゆく。多種多様な酵素が存在することで、小さな細胞内で多種多様な構造の化合物が秩序だって生成されている。
さて、基質特異性であるが例えば酵素は基質の立体構造を識別して基質選択性を発現する。また反応選択性について例を示すと第一級アルコールの酸化は、アルデヒド体だけではなくカルボン酸も生成するが、アルコールデヒドロゲナーゼ酵素の場合、アルデヒド体のみが生成する。
酵素作用を示す物質の殆どがタンパク質であることが知られているが、リボザイムなどタンパク質以外の酵素も知られている。タンパク質のみから成る酵素もあれば、酵素が活性を発現するのにタンパク質とともにそれ以外の無機あるいは有機化合物である補因子(Cofactor)を必要とする酵素もある。
補因子は、酵素がその活性を発現するためにタンパク質と結合した金属イオンやヘム鉄など補欠分子族(ほけつぶんしぞく、Prosthetic group)が組み込まれる場合もある。あるいは酵素の構造に組み込まれていないが、酵素反応が生じる際に基質と共存することが必要とされる低分子の有機化合物である補酵素(ほこうそ、Coenzyme)の場合もある[1]。例えば幾つかのビタミンは補酵素であることが知られている。[2]
また、醗酵なども酵素反応であるから、人間は有史以前より酵素を利用してきている。しかしその実体が解明されるのは19世紀に入ってからである。
酵素の発見
最初に発見された酵素はジアスターゼで、1832年にA.パヤン(Anselme Payan)とJ.F.ペルソ(Jean Francois Persoz)で命名も彼らによる。彼らは翌1833年には麦芽の無細胞抽出液によるでんぷんの糖化を発見し、生命(細胞)が存在しなくても、醗酵のプロセスの一部が進行することを始めて発見した。また、1836年にはT.シュワンにより、胃液中にタンパク質分解酵素のペプシンが発見され命名されている。
当時は、L.パスツールにより生命は自然発生せず、生命が無いところでは醗酵現象が起こらないことが発見されていた。したがって、「有機物は生命の助けを借りなければ作ることができない」というの生気説が広く信じられていたため、酵素作用が生命から切り離すことができるということは画期的な発見であった。
1896年にはE.ブブナーは酵母の無細胞抽出物を用いてアルコール発酵を達成し、生気説は完全に否定された。[3]
鍵と鍵穴説
1894年にドイツのエミール・フィッシャーによって酵素の基質特異性を説明する「鍵と鍵穴説」が提唱された。これは基質の形状と酵素のある部分の形状が鍵と鍵穴の関係にあり、形の似ていない物質は触媒されないと言うことを概念的に現したものであり、現在でも十分に通用する酵素の反応素過程のモデルである。しかしながらフィッシャーはこのモデルの実体がなんであるかについてはなんら科学的な実証を行なわなかった。
酵素とタンパク質
1926年にはJ.B.サムナー(James Batcheller Sumner)が、ナタマメウレアーゼの結晶化成功し、初めて酵素の実体を発見することになる。サムナー自身は結晶化したウレアーゼはタンパク質であると提唱したが、当時はサムナーが研究後進国の米国で研究していたこともあり、なかなか酵素の実体がタンパク質であることは認められなかった。
その後、タンパク質からなる酵素が次々と発見され、酵素の本体がタンパク質であることで、広く認められるようになった。
1986年にはトーマス・チェックらが、タンパク質以外で始めて酵素作用を示す物質を発見している。
酵素の特性
酵素は生体内での代謝経路のそれぞれの生化学反応を担当するために、有機化学で使用されるいわゆる触媒とは異なる特性を持つ。それは生体が代謝を制御する上で必須且つ有効な性質となっている。
基質特異性

クリックで拡大・説明
酵素は作用する物質を選択する能力をもち、その特性を基質特異性(きしつとくいせい、Substrate specificity)と呼ぶ。たとえばタンパク質を酸触媒で加水分解する場合は、ペプチド結合の任意の箇所に作用する為、色々な長さのアミノ酸配列のペプチドやアミノ酸が生成することになる。一方、酵素を作用させてタンパク質を分解する場合は、特定の場所のペプチドを加水分解したり、場合によっては基質として認識されずにまったく作用しない場合もある。
この酵素の特性は酵素研究の極く初期から認識されており、エミール・フィッシャーは「鍵と鍵穴説」というモデルを提唱している。しかし、鍵穴のしくみの手がかりがを入手するには、20世紀中旬以降にX線結晶解析で酵素分子の立体構造が特定できるようになるまで待つ必要があった。
すなわち、酵素であるタンパク質の立体構造には様々な大きさや形状のくぼみが存在し、それはタンパク質の一次配列に応じて決定付けられている。つまり、前述の鍵穴はまさにタンパク質立体構造のくぼみであり、酵素はくぼみの奥に存在する酵素の活性中心へ基質を導くことで酵素作用を発現する。
たとえば、有機化学の酸触媒酸触媒反応であれば、ペプチドもエステルやグリコシド結合も区別することなく同じ反応機構でいずれも加水分解するが、ペプチド分解酵素(ペプチターゼ)であれば特定のペプチド結合のみに作用し、他の種類のペプチドやしない。勿論、エステルやグリコシド結合にも作用しない。
今日では、X線結晶回折をして立体構造を決定しなくても過去の知見や計算機化学の発展により、タンパク質の一次配列情報やその設計図となる遺伝子の塩基配列情報からタンパク質の立体構造を予測することは可能になりつつある。そして更に、生物界に存在しないタンパク質酵素を設計することも可能であるし、タンパク質以外の物質で同様な手法により人工酵素を設計することも可能である。逆に生物界に存在する酵素に適合する基質を設計すると、各種酵素の阻害剤をつくること可能となる。酵素や阻害剤が設計できるようになったことは、医薬品や分子生物学研究の発展に役立っている。
反応特異性
生体内ではある1つの基質に着目しても、作用する酵素が違えば生成物も変わってくる。通常、酵素は1つの化学反応しか触媒しない性質を持ち、これを酵素の反応特異性と呼ぶ。
酵素が酵素特異性と反応特異性を持つために、消化酵素など幾つかの例外を別とすれば、通常のある酵素は生体内の複雑な代謝経路の1箇所のみを担当している。このことは、生体が恒常性維持するために酵素作用を制御する上で、基質特異性と反応特異性は重要な性質となる。すなわち、遺伝子が発現してその酵素たんぱく質が産生されなければ、その代謝経路も存在しない。また、代謝生産物による酵素のフィードバック阻害によってその物質だけ過剰な生産を動的に制御することが可能になる。
この様に、遺伝子の発現や代謝生産物のフィードバック阻害により酵素を制御するため、同じ生体内で同じ基質同じ酵素反応であっても、組織や細胞の種類が異なると、それぞれ種類の異なる酵素が同じ生化学反応を担当する場合がある。この様な関係の酵素を互いにアイソザイム(Isozyme)と呼ぶ。
誘導適合

クリックで拡大・説明
基質の結合した酵素は、それの結合していない酵素よりもエントロピーが減少していると考えられており、事実、基質を結合させた酵素はあらゆるストレス(熱や pH の変化など)に対して安定である。これは酵素のコンフォメーション変化が起きていると考えられており、基質が結合すると触媒反応に適した状態の形状になると考えられている。酵素の立体構造変化に従い、基質の立体構造も変化し遷移状態へと向かう。反応の遷移状態に向かう過程がエントロピーの減少とともに行なわれることによって活性化エネルギーを低下させていると考えられている。これらの誘導的な化学反応を生じる考え方を「誘導適合」という。
酵素反応と有機化学反応
酵素反応も触媒反応であるため、本質的には通常の化学反応と同様に可逆反応である。しかし上述の様に酵素には特有の性質があると同時に酵素の実体であるタンパク質の特性に左右されるため、有機化学反応とは異なる挙動を示すように見える。
一般に化学反応の進行する方向は基質や生成物の濃度、温度・圧力など熱力学的状態変化によって決定付けられる。言い換えると、化学反応は化学ポテンシャルが小さくなる方向に進行する。(記事 化学平衡や反応速度論に詳しい)。そしてその性質は酵素反応も同様である。
化学反応が進行し易いかどうかは、反応の活性化エネルギーのポテンシャルが高いか否かに大きく左右される。一般に触媒反応は化学反応の中でも活性化エネルギーが低いのが通常であるが、酵素反応の活性化エネルギーは特に低いものが多い。
| 反応名 | 触媒/酵素♦ | エネルギー値(cal/mol) |
|---|---|---|
| H2O2の分解 | (なし) | 18,000 |
| 白金コロイド | 11,000 | |
| カタラーゼ♦(Catalase;肝) | 5,000 | |
| ショ糖の加水分解 | H+ | 26,500 |
| サッカラーゼ♦(酵母) | 11,500 | |
| カゼインの加水分解 | HCl aq. | 20,000 |
| キモトリプシン♦(Trypsin) | 12,000 | |
| 酢酸エチルの加水分解 | H+ | 13.200 |
| リパーゼ♦(Lipase;膵) | 4,200 |
一般に活性エネルギーが15,000cal/molから10,000cal/molに低下すると、反応速度定数はおよそ4.5×107倍になる。
また、酵素の実体はタンパク質であり前述のようにタンパク質のコンホメーションが酵素の活性発現に深く関与している。タンパク質は熱、pH、塩濃度、溶媒の違いにより容易にコンホメーションを替え、場合によってはタンパク質が不可逆的に変化することで酵素作用を失活することもある。場合によっては、微生物の汚染により反応系中にペプチダーゼなど消化酵素が存在し失活することもある。
したがって良く言えば、水中や常温、常圧、中性付近の pHなど温和に条件で化学反応を進行させるともいえるし、悪く言えば至適温度・至適pHや水溶媒など反応条件が限定されるとも言える。
ただし、生物の多様性は非常に広いので好熱菌、好酸性菌、好アルカリ菌などの酵素(イクストリーモザイム)は極端な温度や pH に耐えうるとされており、こうした極限環境微生物の応用から酵素の工業利用が現実的になり始めている。
生物体内での所在
酵素は生物体内における反応の全てを起こしているといっても過言ではない。そのため、代謝反応の関与する生物体内であれば普遍的に存在するが、大まかに以下の場所に分けられる。
真核生物の場合は、各細胞内小器官ごとに所在の種類が異なってくるが、生体膜を中心にその外か、中か、生体膜内か、という分類が一番易しい。
可溶型酵素
細胞質に存在している酵素は得てして水にも良く溶け、「可溶性酵素」と呼ばれることが多い。細胞質での代謝にはこの可溶性酵素が多く関わっており、得てして球形である。酵素の外部は親水性アミノ酸、内部には疎水性アミノ酸が集まって、球形の立体構造を取っている。
細胞外酵素
細胞外の酵素は、細胞外に存在する物質を取り込みやすいように改変したりするために分泌される。また、生物に対して何らかの刺激(熱、pH、圧力などの変化)を与えると、その影響で多量に細胞外酵素を放出したりする現象が見られる。タンパク質分解酵素(プロテアーゼ)などがこの類に多く、可溶性酵素を同じく球形をしている場合が多い。また、細胞外の極めて厳しい環境に耐えるために得てして頑強な酵素が多く、構造生物学上最初に結晶化され立体構造が決定されていった酵素は細胞外酵素であることが多い。
生体膜酵素
生体膜に存在する酵素には、エネルギー保存や物質輸送に関与するものも多く、生体膜の機能を担う重要な酵素群(ATPアーゼ、ATP合成酵素、呼吸鎖複合体、バクテリオロドプシンなど)が多い。
の3種類に大分することができる。付着型のタンパク質は表面の一部が疎水性タンパク質となり、疎水性の脂質や脂質に付着しているシトクロムなどに結合している。埋没型は、タンパク質のほぼ全体が疎水性タンパク質に覆われており、膜脂質に極めて親和性が高い。貫通型は物質輸送に関わる場合が多い。膜を貫通して小孔を作っている部分はαヘリックスやβシートからなることが多い。あるいは、球形サブユニットが膜に円のように配置され、極めて大きな孔を生体膜に空けていることもある(核膜孔など)。
構造
酵素はアミノ酸配列によって特定の立体構造を取っており、可溶性の酵素であれば得てして球形をしている。しかしながら、サブユニット同士が結合して活性型となる酵素も存在し、そうした場合には球形のサブユニットが複数個結合した形を取ることもある。
サブユニットの構成が、全く同じタンパク質からなるものを「ホモ多量体」、異なるサブユニットからなるものを「ヘテロ多量体」という。また、サブユニット数に応じて、二量体、四量体など数字を頭に付ける。現在は二量体のことをダイマー (dimer)、四量体のことをテトラマー (tetramer) と英語で呼称することが一般的である。
こうしたサブユニット構成をとる酵素は多々あるが、例を挙げればクエン酸回路のリンゴ酸デヒドロゲナーゼは分子量およそ 35,000 のホモ二量体(ホモダイマー)であり、全体の分子量は 70,000 となる。あるいは硫酸還元菌の H2:シトクロムcオキシドレダクターゼは分子量約 60,000 の大サブユニットおよび分子量約 30,000の 小サブユニットから構成される、ヘテロ二量体(ヘテロダイマー)である。
酵素は、親水基に覆われている表面から亀裂が入るかのように、内部まで裂目が入っていることが多い。反応をおこす部位はこうした亀裂の内部に存在し、その亀裂に基質がトラップされることによって反応が起きる。こうした、反応に中心的な役割を果たす部位を「活性中心」と呼ぶ。また、活性中心以外にも、補助的な役割(補酵素など補因子)を担う基質分子を結合させる部位も存在する。こうした活性中心や補因子結合部位にはよく似た構造の分子が入ることとなるが、こうした分子は得てして反応が起きず、阻害剤として働く場合が多い。
補欠分子族
酵素はタンパク質から構成されるが、タンパク質だけではなく非タンパク質性の分子である補欠分子族が組み込まれることが必要な酵素も存在する。[5]
補欠分子族は無機化合物の場合もあれば有機化合物の場合もある補因子の一種である。しかし酵素と常に結合している点で別の補因子である補酵素とは異なる。
カタラーゼ、P450などの活性中心に存在するヘム鉄などが代表的な補欠分子族である。あるいは金属プロテアーゼの亜鉛イオンなど直接タンパク質と結合している場合もある。生体が要求する微量金属元素は多くの場合で補欠分子族として酵素に組み込まれている。
酵素反応
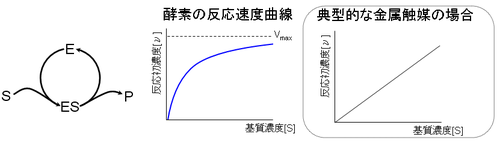
日本工業規格に「酵素は選択的な触媒作用を持つタンパク質を主成分とする生体高分子物質」(JIS K 3600-1310)と定義されているように触媒として利用されるが、化学工業などで用いられる典型的な金属触媒とは反応の特性が異なる。
まず第一に酵素反応の場合、基質濃度([S])が高くなると反応速度が飽和する現象が見られる。
まず説明の前提として触媒反応は(酵素反応も含めて)可逆反応なので系中の生成物濃度([P])が高まると反応速度が低減する。そのために反応速度を解析する為に、生成物濃度が0とみなせる初期反応速度で比較を行うのが通例である。
金属触媒は触媒濃度に依存せず基質濃度([S])の一次式で反応初速度([ν])が決定される。一方、酵素の場合は基質濃度を高く変えて測定し直してゆくと、双曲線を描いて飽和(初)速度Vmaxへと至る曲線を描く。
このことは、基質複合体(ES)を形成する状態が酵素反応の律速過程になっている為と考えられる。例えば金属触媒の場合、触媒粒子の表面は金属原子で覆われており無数の触媒部位が存在する。それに対して酵素の場合は基質に比べて酵素分子は巨大な場合が多く、活性中心も高々1箇所程度しか持たない。その為に金属触媒に比べて基質と触媒(酵素)との衝突頻度に比べて(活性中心に適合し)反応を起こす頻度が相対的に小さい。そして基質濃度が高まると少ない酵素の活性中心を基質が取り合うようになるので飽和現象が見られる。
また、酵素反応の時間応答を見ると、基質複合体を形成するのに有限の時間が必要なので、系に酵素を投入しても基質複合体濃度([ES])は急激には上昇せずに緩やかに上昇する。その後は生成物(P)の産生が始まるので複合体濃度[ES]は定常状態となることが観測される。このような酵素反応の時間応答では複合体濃度の立ち上がりの前定常状態とその後の定常状態が観測されるのも酵素反応の特徴である。[6]
そして酵素の飽和最大速度はVmaxと呼ばれる。そしてVmaxの半値に到達する基質濃度は後述のミカエリス・メンテン定数として知られており、いずれも酵素反応の重要なパラメーターである。
酵素反応と基質濃度
1913年L.ミカエリスとM.メンテンは酵素によるショ糖の加水分解反応を測定し、『鍵と鍵穴』モデルと実験結果から「酵素基質複合体モデル」を導き出し、酵素反応を定式化した。このモデルによると、酵素を用いた系では以下の式で反応が進行する。
- 酵素 (E) + 基質 (S) ES(酵素基質複合体) → E + 生産物 (P)
酵素と基質の反応を考えるとき、前述のように定常状態を示すので、酵素基質複合体を形成する過程は可逆過程として扱うことができる。一方、通常の実験系では生成物濃度は小さく0とみなせるので、生成物から酵素基質複合体からを生じる反応は無視しうる。
次に、各反応について以下の速度定数 (k) を当てはめる。
- k1: E+S → ES
- k−1: ES → E+S
- k2: ES → E+P
基質が十分量存在し、これらの物質の各濃度の釣り合いが取れる程度の反応が進行した状態をという。定常状態なので以下の式が成り立つ。
- k1[E][S] = k−1[ES] + k2[ES] ([ ]は各物質の濃度を現す)
ここで、以下の式が成立する。
- K = (k−1 + k2)/k1
この定常状態の時の平衡定数 Kは Km と表記され「ミカエリス・メンテン定数」と呼ばれる。ミカエリス・メンテン定数とは、酵素と基質の親和性を表すパラメータであり、実測値としては酵素の最大速度の2分の1の反応速度 (Vmax/2) を有する基質濃度となる。Km 値と基質親和性の関係は以下の通りである。
- Km値が低いと酵素と基質の親和性は高い(酵素と基質は相性が良い)
- Km値が高いと酵素と基質の親和性は低い(酵素と基質は相性が悪い)
Km 値の高低が親和性と逆の概念なため理解が困難かもしれないが、Km 値を実際に測定すると理解できる。
元来ミカエリスとメンテンの理論では E + S と ES との間の平衡を仮定しており Km はその意味での平衡定数に当たる。しかしこの仮定は k2 が k−1 よりはるかに小さい特別な場合にしか当てはまらないので、のちにブリッグスとホールデンがより一般的な定常条件を仮定し、その場合でも同様の式が成り立つことを示した。詳しくはミカエリス・メンテン式を参照。
また、Vmax と関連した分子活性 (kcat) という値が存在する。これはタンパク質1分子あたり、1秒間に何個の基質を触媒するか、と言うパラメータである。式は以下のように表される。
- kcat = 基質分子濃度 (M)/酵素分子濃度 (M) × 秒
ここで右辺は分子と分母に濃度の単位を持つのでこれを約すと、kcat は s−1 という単位で現される。例を挙げれば、酵素1分子あたり1秒間に100個の基質分子を触媒すれば 100 s−1 となる。極めて分子活性の高い酵素にカルボニックアンハイドラーゼという酵素があるが、この酵素は1秒当たり百万個の二酸化炭素を炭酸イオンに変化させる (kcat = 106 s−1)。
阻害様式と酵素反応速度
酵素は基質と構造の似た分子が存在したり、後述のアロステリック効果により反応速度が影響を受ける。その阻害様式により酵素の反応速度は独特の応答を示すので、反応速度や反応速度パラメーターを解析することで逆にどのような形式の阻害作用を受けているかを識別することができる。
阻害様式は大きく分けると次のように分類される
- 拮抗阻害(競争阻害)
- 拮抗的ではない阻害
- 非拮抗阻害
- 不拮抗阻害
- 混合型阻害
すなわち酵素の反応速度曲線を阻害剤のない原系の場合を青線、阻害剤の存在する系を赤線で示すつぎのようになる。
拮抗阻害の場合はVmaxは移動せず、Kmが移動する。一方、非拮抗阻害の場合はKmは移動せずVmaxが移動する。混合型阻害の場合は図に示さないが両方の寄与が見られる。
多くの場合、阻害剤が基質に類似している場合は拮抗阻害を示すことが多い。またアロステリック阻害は拮抗的ではない阻害に該当する。
それぞれの阻害様式の場合のミカエリス・メンテン式の定式化は記事ミカエリス・メンテン式に詳しい。
酵素触媒機構モデル
上に酵素の触媒としての特性を挙げたが、無機触媒や酸塩基触媒などと比べても非常に優れた特性を持つといえる。活性化エネルギーをいかにして下げるのか、基質特性はなぜ発揮されるのか、そうした酵素の基本的な特性について統一的な解答が得られたとはいえないが、今日では構造生物学の発展や組み換えタンパク質作成による変異導入などのテクニックを用いて、その片鱗が見えてきた。
基質の結合
酵素には活性中心という触媒反応に中心的な役割を果たす部分が存在するが、その近傍に基質を結合して触媒のために安定化させる「基質結合部位」を持っている。活性中心や基質結合部位にはアミノ酸の側鎖が適当に配置されている。乳酸デヒドロゲナーゼではN末端から数えて250番目のリシンが NAD+ の結合に関係している。また、セリンプロテアーゼと呼ばれるタンパク質分解酵素の一群は基質の結合部位にセリンが存在する。
また基質結合部位に基質が結合するにあたっては、基質は誘導的に酵素に結合すると考えられている。つまり酵素と基質が結合した状態が基質にとってはエントロピー的に減少するということである。この考え方を「エントロピー・トラップ」という。このエントロピー・トラップにより基質は誘導的に基質結合部位に結合していく。結果、活性中心付近における基質の濃度が上昇すると考えられている。基質濃度を上昇させることも化学反応を起こすための1つの条件である。酵素が低濃度基質条件下でも効率よく触媒するシステムにはこのエントロピー・トラップが関係していると考えられている。
酵素の内の酸塩基触媒部位
化学反応を起こさせるには pH が極端な状態に基質を置くのが有効な場合があり、酵素内でも同様の変化が起きていると考えられている。特に加水分解や脱水素反応は酸塩基触媒部位によるプロセスが重要であり、キモトリプシンなどでは以下のプロトンの伝達のモデルが考えられている。
- His57 がプロトンを負に荷電した Asp102 に譲渡する
- His57 が塩基となり、活性中心の Ser195 からプロトンを奪う
- Ser195 が活性化されて(負に荷電して)基質を攻撃する
- His57 がプロトンを基質に譲渡する
- Asp102 から His57 がプロトンを奪い 1. の状態に戻る
ここで His などはタンパク質を構成するアミノ酸残基の3文字略号を示し、右肩の数字は N 末端からの番号を表す。酵素の中で、酸塩基触媒として最も作用するのはヒスチジンである。ヒスチジンは等電点が pH 6 であり、生理的な条件に極めて近い。ヒスチジンはプロテアーゼ以外にも脱水素酵素の活性中心を担当している場合が多い。
以上、4項目の酵素反応過程について述べてきたが、これらの酵素に対する寄与は酵素ごとに異なっていると考えられている。これらの共同的な働きが酵素の基質特異性および活性化エネルギーの低下を起こしていると考えられている。この酵素の反応素過程を理解することは、
- 酵素基質特異性の人為的変化
- 触媒活性の上昇
- 異なる環境における能力の向上(高低温、高低 pH、高低圧など)
- 人工酵素の開発
など様々な酵素の実用的な技術に寄与すると考えられているが、その端緒についているとは考えがたい。事実、人間の設計した酵素では基質特性は低く、触媒活性も思うように上がらない。これらは酵素の反応素過程への理解が深まっていないことによると考えられている。今後、コンピュータや構造生物学の発展とともに人間の求める「スーパー酵素の開発」の挑戦は進行して行くと考えられている。一方で完全なる人工酵素では自然に追いつくのは不可能であり、自然に学ぶと言う考え方から、生物由来の酵素に人為的改変を加えていく方法も存在する。現在ではこうしたシミュレーションおよびネイティブの両方向から攻めていく傾向にある。
酵素反応の調節機構
一般に触媒反応は基質濃度、生成物濃度によりその反応速度が影響を受ける。生体内における触媒反応である酵素反応の場合、基質・生成物濃度以外にもさまざまな因子によりその速度が調整される。
ある複数の段階からなる代謝経路において酵素の直接の基質あるいは生成物以外のこの経路の代謝産物が酵素の速度を制御する場面が良く見られる。代謝生成物が上流過程の酵素反応を阻害することで、生成物が過剰になると産生を抑制する調節過程をフィードバック阻害と呼ぶ。
生体が酵素活性の大小を制御するには、酵素の量を制御する場合とその性質を変化させる場合がある。それらを分類すると、
- 酵素タンパク質の合成量制御による酵素量の増大
- 他の生体分子が酵素タンパク質と可逆的に作用することによる酵素活性の変化
- 酵素タンパク質が修飾されることによる酵素活性の変化
が挙げられる。[5]これらの内、1.は転写調節により遺伝子の発現量を変化させることで調整される(詳しくはオペロンおよびラクトースオペロンを参照。ただし原核生物のみ)。遺伝子が転写翻訳されて生産されるタンパク質から成る酵素は、一定の寿命を経た値後はたんぱく質分解酵素のプロテアーゼにより分解消失する。また遺伝子からタンパク質が生産されるにはある程度時間が必要である。したがって、ある程度長期間にわたる酵素活性の変動調節に遺伝子の発現量が酵素活性を調節していることがある。例えば、コレステロール代謝の律速段階であるHMG-CoAリダクターゼは細胞内のコレステロール量が減少すると、遺伝子より翻訳生産されコレステロールの生産量を増大させる。(詳しくは記事 コレステロール#調節を参照のこと)
2.や3.については酵素の質的な変化であり、1.の転写制御より素早い応答を示す。例えば、アロステリック効果によりフィードバック阻害がかかる場合は生産物が過剰になると酵素活性が低減し、生産物が減ると酵素活性は復元する。
あるいは、細胞内キナーゼで酵素タンパク質がリン酸化されて酵素活性が発現する場合は、リン酸化された酵素が分解消失したり、他の酵素によりリン酸基の修飾が除去されるまでは酵素活性は維持される。
アロステリック効果
アロステリック酵素は活性中心近傍の基質結合部位とは異なる場所に低分子物質を結合させ、その活性を変化させる。そうしたアロステリック効果を誘導する低分子物質を「アロステリックイフェクター」と呼ぶ。アスパラギン酸からリジンを合成する反応系では、最終産物のリジンがアロステリックイフェクターとなる。
アスパラギン酸→→→β-アスパルチルリン酸→→→→・・・→→リジン ↑ アスパラギン酸キナーゼ
リジンが少量であるときは、アスパラギン酸キナーゼはさかんに触媒作用を発揮するが、リジン過剰になるとアスパラギン酸キナーゼのリジン結合部位にリシンが結合し、アスパラギン酸キナーゼの活性が低下する。
アスパラギン酸→→→β-アスパルチルリン酸→→→→・・・→→リジン × ↓ ↑ ↓ アスパラギン酸キナーゼ-リジン複合体←---------
このほかに、アロステリックイフェクターが正の方向に作用するケースもあるが、反応最終生産物の関与するアロステリック効果は得てして活性を低下させる。このように、アロステリック効果は、生体内におけるフィードバック制御の一例である。詳しくはアロステリック効果を参照。
酵素の実生活への応用
- 食品
一般に流通している加工食品の多くは製造工程中に酵素反応を利用している。味噌や醤油、酒などの発酵食品はもちろん、でん粉を原料とした各種糖類の製造に用いられている。また果汁の清澄化や苦味除去、肉の軟化といった品質改良用途やリゾチームによる日持ち向上用途などが挙げられる。
これらは食品添加物として扱われ、以下に挙げるような酵素が使われている。ほとんどの場合、製造工程中に失活または除去されるので、加工助剤として原材料表示は省略されていることが多い。
酵素の分類法
酵素は触媒する反応によって分類されており、異なる生物でも反応が同じであれば同じ分類がなされる。酵素の分類はEC番号という数字によってなされている。EC番号は "EC X.X.X.X" (Xは数字)という表記がなされるが、左から右にかけて分類が細かくなっていく。一番左の数字と酵素の分類については以下の通りである。
- EC 1.X.X.X — オキシドレダクターゼ(酸化還元酵素)、酸化還元反応を触媒
- EC 2.X.X.X — トランスフェラーゼ(転移酵素)、原子団(官能基など)をある分子から別の分子へ転移する
- EC 3.X.X.X — ヒドロラーゼ(加水分解酵素)、加水分解反応を触媒
- EC 4.X.X.X — リアーゼ(脱離酵素)、原子団を二重結合あるいは、結合の解離の触媒
- EC 5.X.X.X — イソメラーゼ(異性化酵素)、分子の異性体を作る
- EC 6.X.X.X — リガーゼ(合成酵素)、ATPの加水分解エネルギーを利用して、2つの分子を結合させる
酵素の全てについてこの番号が割り振られており、現在約 3,000 種類ほどの反応が見つかっている。またある活性を担う酵素が他の活性を有することも多く、ATPアーゼなどはATP加水分解反応のほかにタンパク質の加水分解反応を持っている。
酵素の命名法
酵素の名前は国際生化学連合の酵素委員会によって命名され同時にEC番号も与えられる。酵素の名称には「常用名」と「系統名」が与えられる。常用名と系統名の違いについて例をあげながら説明する。
- 系統名 — アルコール:NAD+ オキシドレダクターゼ(酸化還元酵素)
- 常用名 — アルコールデヒドロゲナーゼ(脱水素酵素)
これらの酵素は全く同じ酵素であり、EC番号は EC 1.1.1.1 である。系統名は一般的に
- 基質分子の名称
- 共同的な反応であれば2つめの基質分子の名称
- 反応の名称
この中で、反応の名称は系統名の場合は規制されており、原則として
のいずれかが反応の名称となる。
また常用名は一般的に
- 基質分子の名称 — 補酵素は除いて基質のみ
- 詳細な反応の名称 — 基質分子に与えられる反応
ただし、基質が2種類存在するトランスケトラーゼなどでは、2つめの基質の名称を入れる場合が多い。反応の名称については、系統名に使用されるものよりも実際の反応に近い名称が与えられる。例えば酸化還元酵素ではオキシダーゼ、レダクターゼ、デヒドロゲナーゼなど。ただし、これらの規則に従わない特殊な酵素は多く、DNAポリメラーゼなどはその一つである。
1つのタンパク質中に2種類以上の活性を有する場合(可逆反応を触媒する酵素)は、必要に応じて文中では使い分ける。例えば呼吸鎖複合体IIのコハク酸デヒドロゲナーゼの場合は、
となる。補酵素は上記のように常用名には含まれない。
古くに発見され研究された酵素については、そのままの名称が使用されている。
などは命名規則に従わない例外である。
代表的な酵素
- DNAポリメラーゼ
- DNA依存性DNAポリメラーゼ
- 耐熱性DNAポリメラーゼ
- RNA依存性DNAポリメラーゼ(逆転写酵素)
- DNA依存性DNAポリメラーゼ
- DNAメチラーゼ
- RNAポリメラーゼ
- DNA依存性RNAポリメラーゼ
- RNAポリメラーゼI
- RNAポリメラーゼII
- RNAポリメラーゼIII
- RNA依存性RNAポリメラーゼ
- DNA依存性RNAポリメラーゼ
- ヌクレアーゼ
- DNase
- RNase
- アミノアシルtRNAシンセテース
- ペプチジルトランスフェラーゼ
- プロテアーゼ(タンパク質分解酵素)
- リン酸化酵素(キナーゼ)
- 脱リン酸化酵素(フォスファターゼ)
- 脂質分解酵素
- グリコシルトランスフェラーゼ
- 酸化酵素(オキシゲナーゼ)
- モノオキシゲナーゼ
- メタンモノオキシゲナーゼ (MMO)
- シトクロムP450
- ジオキシゲナーゼ
- ペルオキシダーゼ
- モノオキシゲナーゼ
工業用酵素
酵素に関する年表
- 19世紀
- 1833年 フランスのアンセルム・ペイアンとジーン・フランソア・ペルソは麦芽の抽出液より、デンプンを分解して単糖(グルコース)にする物質を分離した。彼らはこの物質を「ジアスターゼ」(現在、フランス語で「酵素」を意味する)と名づけた。
- 1836年 ドイツのセオドア・シュワンは胃液が動物の肉を溶かす作用があることを発見し、胃液から原因物質を分離した。この物質は「ペプシン」と名づけられた。これは植物のみならず動物にも同様の活性が存在することを証明したものである。
- 1857年 フランスのルイ・パスツールがアルコール発酵過程が微生物(当時は酵母の研究)活動に基づくものであると発表した。ただし、これは酵素という無生物が起こすものとはパスツールは証明しなかった。しかしながら、ドイツのユストゥス・フォン・リービッヒは微生物ではなく、細胞外の無生物因子(当時は「発酵素 (fermente)」という用語を用いた)が発酵に関与しているとして、この説を否定した。
- 1873年 スウェーデンのイェンス・ベルセリウスが「化学反応は触媒作用によって進行する」と言う概念を提唱した(この概念は酵素の概念が認められたがゆえである)。
- 1878年 ドイツのウィルヘルム・キューネが酵母(ギリシャ語で "zyme")の内部(ギリシャ語で "en")で発酵が起きることを受けて「酵素 (en-zyme)」という概念を提唱。
- 1894年 ドイツのエミール・フィッシャーが酵素の基質特異性を証明するために、酵素と基質の「鍵と鍵穴説」を発表した。
- 日本の高峰譲吉がタカジアスターゼを発見した。
- 1897年 ドイツのエドゥアルト・ブフナーが、酵母抽出液からアルコール発酵が起きることを証明した。
- 20世紀
- 1902年 イギリスのフェルディナント・ブラウンとフランスのアンリ・ルシャトリエは、スクラーゼの活性は酵素濃度に規定されることを観察し、反応の最中に基質と酵素は酵素基質複合体を作るという考えに至った(反応速度論の始まり)。
- 1907年 エドゥアルト・ブフナーが前述の功績を受けてノーベル化学賞を受賞。
- 1913年 ミカエリス、メンテンらがブラウンとルシャトリエの結果を受けて「ミカエリス・メンテン式」を発表。
- 1925年 G・E・ブリッグスとJ・B・S・ホールデンがミカエリス・メンテン式を発展させた「ブリッグス・ホールデンの速度論」を発表。
- 1926年 アメリカのジェームズ・サムナーがナタ豆から「ウレアーゼ」と呼ばれる酵素を結晶化して、酵素の本体がタンパク質であることを突き止めた(ただしこの実験は当時評価されなかった)。
- 1930年 アメリカのジョン・ノースロップがペプシン、トリプシン、キモトリプシンをタンパク質の結晶として抽出した。
- 1945年 アメリカのジョージ・ビードルとエドワード・テータムは1つの遺伝子が1つの酵素に対応することを発表した(一遺伝子一酵素説)。
- 1946年 サムナーとノースロップは酵素の本体がタンパク質であることを証明し、ノーベル化学賞を受賞した。
- 1955年 サンガーらはインスリンの一次構造を決定した。
- 1960年 アメリカのウィリアム・ スタインとスタンフォード・ムーアによって、リボヌクレアーゼのアミノ酸配列が決定された。
- 1965年 イギリスのデビッド・フィリップスはリゾチームと基質の複合体の立体構造を明らかにした(酵素として立体構造が決定されたのはこれが初めて)。
- 1968年 H.O.Smith, K.W.ウィルコックスらがDNAの制限酵素を発見した。
- 1969年 アメリカのロバート・メリフィールドが、ペプチド固相合成法を用いて、化学的にリポヌクレアーゼを合成した。
- 1972年 スタインとムーアは酵素の一次構造決定によりノーベル化学賞を得た。
- 1986年 アメリカのトーマス・チェックらによって触媒作用を有するRNAである「リボザイム」が発見された。これにより、触媒作用はタンパク質によらないという概念ができた。更に生命の起源はRNAから始まったとする「RNAワールド仮説」の元になっている。
- 1986年 アメリカのトラモンタノらは抗体酵素(abzyme)を発見した。
- 1989年 チェックらはリボザイムの発見によりノーベル化学賞を受賞した。
酵素の研究のさきがけとなった酵素(ペプシン、トリプシンなど)は酵素の規定の命名法に従わず、慣習的に現在でも当時の名称が使用されている。
出典
- ^ 『微生物学・分子細胞生物学辞典』第二版、朝倉書店
- ^ 『新生化学ガイドブック』、pp.82-119、南江堂 1969.
- ^ 平凡社、『世界大百科事典』
- ^ 『新生化学ガイドブック』、p.89、南江堂 1969.
- ^ a b 補欠分子族、『理化学辞典』第五版、岩波書店 引用エラー: 無効な
<ref>タグ; name "理化学辞典"が異なる内容で複数回定義されています - ^ 一島英治、『酵素の化学』、朝倉書店、1995 ISBN:4-254-14555-1