ヨーネ病


ヨーネ病(Johne's disease−paratuberculosis)は、マイコバクテリウム属のヨーネ菌(Mycobacterium avium subsp. paratuberculosis)の感染によって起こる慢性肉芽腫性腸炎で動物の感染症である。かつてはパラ結核とも呼ばれた[1]。感染動物に対する治療は行われず、屠殺される。
「ヨーネ病」の名前は、この細菌を発見したドイツ人の病理学者で獣医の Heinrich Albert Johne に由来する。
アメリカにはクローン病や多発性硬化症などとヨーネ菌の関連を疑う研究者や患者らが 人ヨーネ病財団(Human paratuberculosis fundation)を作り、学会や研究活動を行っている[2][3]。
本病の概要[編集]
1971年に家畜伝染病予防法により家畜法定伝染病に指定された。感受性動物は牛、羊、山羊などの反芻類[4]。キツネ、アナグマ、野ウサギ等の野生動物のヨーネ菌感染が疫学的問題として取り上げられている[5]。感染から発症までに数年間を要し数年間は明確な症状を呈さない不顕感染状態で推移する。発症すると、頑固で慢性的な下痢、削痩、泌乳量の低下を呈し、発症数ヶ月から1年以内に衰弱して死亡する[6]。家畜伝染病予防法における法定伝染病。搾乳牛および種畜を対象に5年ごとのELISAによる検査が義務付けられている。
感染様式[編集]
感染様式は経口感染。感染母牛から子牛への感染が伝播経路として重要で、発症前から病原体が排出される。感染動物からの糞便やまれに乳も感染源となる[6][7]。また、母牛から胎子子牛への胎盤経由の感染があるとの報告もある[8]。
診断方法[編集]
実際にヨーネ病の診断を行う場合には国が定めたヨーネ病検査マニュアル(PDF)に従うこと。以下にその概要を示す。
細菌学的診断方法[編集]
遺伝子検出法(分子生物学的診断法)[編集]
- PCR診断法 ヨーネ菌が有する特異的な遺伝子配列の存在を増幅して検出する方法である。用いる試薬やプライマーはヨーネ病検査マニュアル(PDF)に従うこと。
- 特異性や感度が最も高い検出法であるが、陽性結果で生菌と死菌の区別をすることはできない。
- 二本鎖DNAが増殖すると蛍光を発するサイバーグリーンという色素を反応系に加えてDNAの量を定量的に測定する定量PCR法が主流である。
- リアルタイムPCR法は定量PCRの一種であるが、ほぼ同じ意味で使われることもある。定量PCRでは電気泳動法により観察できる目的のDNAのバンドを直接測定することもできる。我が国をはじめ国際的に用いられているPCRのターゲットはIS900と呼ばれる部位だが、F57を用いても同等の増幅がみられるという[9]。
免疫学的診断方法[編集]
- ELISA法
- 血清中のヨーネ菌に対する抗体を検出するヨーネ病の診断法。企業が生産販売しているキットを購入して実施する。
- 市販の牛ヨーネ病診断用エライザキットを使用する。使用方法は製品添付の説明書に従う。ヨーネ病診断に世界的に使われてきたELISA法は、ヨーネ菌とは別の抗酸菌、ヨーネM. phlei菌体を検査用の血清に加えてヨーネ菌以外の共通抗体を除去(吸収操作という)して特異性を向上された、動物衛生研究所の横溝祐一博士の開発した技術によっている[10]。
- ヨーニン検査
- 皮内反応によりヨーネ菌感染個体の細胞性免疫反応を検出するヨーネ病の診断法。遅延性過敏反応を利用した細胞性免疫診断法の一つであるが感度は高くない。人や牛の結核病診断に用いるツベルクリン反応と同じ原理である。ヨーニン皮内反応用抗原を使用して検査する。使用方法は製品添付の説明書に従う。
- インターフェロンγ遊離試験
- ヒトの結核感染の診断としてはすでに実用化されている。感染により生じる細胞性免疫反応を特異的に検出する技術で、血液や白血球にヨーネ菌抗原を加えて培養すると、細胞性免疫記憶のあるリンパ球やマクロファージがインターフェロンγを培地中に出し、その濃度をELISA法などで測定する。
- 早期診断法として研究が進められているが、現在までに多くの論文が報告されており、国内特許も公開されている[11]。
- 「抗牛インターロイキン10抗体を用いた牛ヨーネ病のインターフェロンガンマELISA診断法の高感度化技術」が動物衛生研究所で開発されている[12]。(国内特許情報)(US特許情報)(フランス語特許情報)
- ヨーニンPPDを用いたインターフェロンガンマ診断法[13]
病理学的検査方法[編集]

肉眼的な観察[編集]
病理解剖に際しては空腸・回腸・回盲部粘膜の肥厚、顕著な雛壁の形成の有無を確認する。
腸粘膜の肥厚や皺壁形成が目立たないステージの感染病変もしばしば観察されるので、丁寧に観察する。
腸間膜リンパ節の髄様腫脹があることもある。
- 病理組織学的検査
粘膜固有層、粘膜下識及び腸リンパ節における類上皮細胞の「び慢性増殖」とラングハンス巨細胞の出現が特徴所見である。
このような修飾されたマクロファージ(類上皮細胞)の集塊状増殖を肉芽腫と呼ぶ。抗酸菌感染を疑う病変であるが、肉芽腫は他の菌や異物の刺激によっても形成される場合があるので鑑別診断が必要である。
山羊やめん羊のヨーネ菌感染では結核に見られるような乾酪性の肉芽腫が見られることがあるが、牛の場合にはほとんど見られない。
- 肉眼観察後に以下の各部位を病理組織検査用として採材する。
- 回腸末端部 回盲部より10cm位上
- 回盲部から30cm上
- 回盲部から50cm上
- 回盲部から1m上
- 回盲リンパ節
- 回腸部腸間膜リンパ節
- 空腸部腸間膜リンパ節
- 雌の場合には乳房上リンパ節
腸管の採取、固定方法[編集]
腸管は消化酵素に富む組織であるため死後変化をおこしやすいので、以下のとおりに採材する。
病理検査用の腸管は約10cmの長さで、管状に切り取り、管状のまま開かないで、切り取ったあと、一端をピンセットでつまんだまま腸を静かにホルマリン容器に入れ、ピンセットで固定している開口部から50mlのディスポ注射筒で10-20%中性緩衝ホルマリンを注ぎ込み、掴んだピンセットで腸組織を固定液に静かに沈め少し揺する。さらに2回ホルマリンを流し込み、静かに固定ビンに沈める。
- パラフィンブロック作製、染色、鏡検
病理組織を見るための組織の切り出しでは、腸管固定標本からは2-3カ所切り出すことが望ましい。そして通常の方法でパラフィン包埋を作り、ミクロトームにて薄切後、ヘマトキシリン・エオジン染色、必要に応じてチール・ネルゼン染色(抗酸菌染色)を行い鏡検する。腸の粘膜組織や腸間膜リンパ節において最も高頻度に肉芽腫病変が認められる。
日本国内における発生状況[編集]
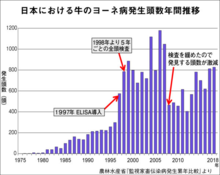
年間で500ー1000頭程度の感染が報告されている[14]。
2007年(平成19年)10月26日、日本ミルクコミュニティが10月24日から25日にかけて製造した牛乳の中に、ヨーネ病の疑いのある牛から採ったものが入っている可能性があるとして、東京、神奈川、千葉、埼玉、茨城、静岡、長野に出荷された計62万1088本の自主回収が行われた[15]。
令和元年のヨーネ病発生数は380戸 1,066頭となっている(家畜伝染病発生年報(県別・令和元年))[16]。
海外における発生状況[編集]

- アメリカの農場のヨーネ病汚染状況
2020年のアメリカ農務省のHPでは「2007年の乳牛NAHMSの調査に基づくと、米国の乳牛群の約68%に、大規模な乳牛群での牛群の有病率が100%に近い、ヨーネ病の検査で陽性となる牛が少なくとも1頭いる。バイオセキュリティプログラムを開始した牛群はほとんどないため、感染は拡大し続けている。感染は肉牛や山羊群れや羊群にそれほど広く分布していないように見える、それでもヨーネ病はすべての生産者にとって決定的な重要性を持っている。」と報告されている[17]。上記、2007年の乳牛NAHMSの調査によると、小農場で63.1%、中農場は75.1%、大農場では95.0%が汚染されていた[18]。
- ヨーロッパ諸国のヨーネ病汚染状況
EUとして統一された防疫の基準は存在しない。牛のJDの管理努力とプログラムはヨーロッパの国間で非常に多様で、ほとんどのヨーネ病管理プログラムは、衛生上の予防措置と組み合わせた診断検査および殺処分戦略に基づいてなされている。農場での高コスト、集中的な作業負荷、長期間かかること、現在の方法では限られた成果しか出ないなどの理由で、農民や獣医師による防疫プログラムへの参加の意欲は高くならないとされている[19]。EUにおけるヨーネ病の有病率の推定値が報告されている[20]。
オーストラリア[編集]
オーストラリアの獣医を対象に実施された調査では、獣医師の回答者のほぼ3分の1(32.2%)が、ヨーネ菌がクローン病の原因に関与している可能性が高いと考え、JDに対する予防対策を望んでいることが分かった[21]。

治療と予防[編集]
実用的なワクチンは無くワクチンによる予防出来ない。また、治療方法は無いため、感染動物は屠殺される[4]。
科学的な感染防止・治療方法が無いため、徹底的な衛生管理を行い感染機会を減らす為の施策が中心となる。農水省による牛のヨーネ病防疫対策要領によれば[22]、「適切な飼養衛生管理」として下記7項の実施が求められている。
- 適切な飼養衛生管理(抜粋)
牛の所有者は、適切な飼養衛生管理を行うため、次の(1)から(7)までに掲げる事項を行うものとする。
- 子牛は可能な限り早期に成牛(母牛を含む。)群から離して飼養すること。
- 子牛への初乳給与に当たっては、清浄確認が行われており、かつ、第3に掲げる発生予防対策を講じている農場の牛の初乳又は代用初乳を摂取させること。
- 分娩牛房は清潔に保つこと。
- 牛の排せつ物及び排せつ物を含む敷料については、草地等への直接還元は避け、切り返し等を十分に行い、完全に熟成(堆肥化)させること。
- 牛舎内、特に牛床、飼槽及びウォーターカップについては、常に清潔に保つよう、定期的に清掃し、その後、洗浄及び消毒を実施すること。
- 農場入口への消毒薬の散布、牛舎入口での専用作業靴への交換、踏込消毒槽の設置等による入場車両、作業靴の消毒等の必要な措置を講ずること。
- 日頃から飼養牛の健康状態を観察し、本病を疑う症状が確認された場合には速やかに獣医師又は都道府県に連絡し、必要な検査を受けること。
「十分に発酵が進んでいないサイレージはヨーネ菌の感染源になる可能性がある」と報告されている[23]
人の自己免疫疾患などとの関連[編集]

ヨーネ菌と人のクローン病との関係は、ヨーネ病とクローン病の強い類似性から、MAPがクローン病の病因である可能性があると長い間医師や研究者のなかで疑いを持たれてきた[24][25][26][27]。1913年、スコットランドの外科医であるトーマス・ケネディ・ダルジールは、彼の患者の病気の臨床的および肉眼的外観は、ヨーネ病の牛で報告されたものと非常に類似していると述べた[28]。ダルジールはヨーネ病の原因菌であるヨーネ菌を仮定した最初の科学者であると考えられている[29]。1932年に公式の医療機関として最初の論文報告がクローン医師(1884~1983年)らによりなされた、「クローン病は牛のヨーネ病によく似ており、ヨーネ菌によって起こっているのだろう」と明記された論文である[30]。
ヒトのクローン病は厚生労働省指定の特定難病疾患[31]である。患者数は30年ほどのあいだに約250倍に増加している。アメリカの患者数は日本の10倍である。2020年に多国籍研究機関が協力してまとめた炎症性腸疾患(IBD)の国際的発生状況がThe Lanset Gastroenerology & Hepatology誌に報告され、CDを含むIBDの国際的発生増加が指摘された[32]。CDとUCの有病率が最も高いのは北アメリカ、北ヨーロッパ、およびイギリスであるが、南ヨーロッパ、アジア、アフリカ、ラテンアメリカで増加し始めていることが指摘されている[27][32]。

小児期発症炎症性腸疾患
10代、幼児、さらにゼロ歳児での発症も報告されるようになってきた。近年、生まれて数週間の乳幼児が下痢症状を起こすケースが増えているということも世界的に小児科医のあいだで問題になっている(小児期発症炎症性腸疾患)[33]。子どもの場合、小児炎症性腸疾患(IBD)と呼ばれている。ヨーネ菌の人体への暴露が乳製品によることが知られていることから、粉ミルク摂取頻度の高い乳幼児における本病とヨーネ菌の関連線研究が指摘されている[27]。
中枢性脱髄疾患の一つで、神経のミエリン鞘が破壊され脳、脊髄、視神経などに病変が起こり、多様な神経症状が再発と寛解を繰り返す疾患で、日本では特定疾患に認定されている。この神経難病とヨーネ菌との関連を2011年に始めて報告したのはイタリアサルジニアのササリー大学のSechi教授らのグループである[34]。日本では順天堂大学脳神経内科のグループがヨーネ菌と多発性硬化症の関連について、特に食品に存在するヨーネ菌死菌の経口摂取との関連を含め先進的な成果を上げている[35]。日本の多発性硬化症患者の血清や脳脊髄液中にヨーネ菌に対する特異抗体が検出されている[36]。
自己免疫病の一種である1型糖尿病とヨーネ菌の関連も報告されている[37]。
ヨーネ菌の食品汚染[編集]
ヨーネ菌が牛乳中に排菌され子牛の感染源となることは知られているが[38][39][40][41]、マクロファージ内に感染して血行性に播種される事もある[42]ため、本菌が人獣共通感染症の病原体であることや自己免疫病の原因である疑いを指摘する論文が存在する。
牛乳や乳製品[編集]
牛乳の殺菌あほとんどの場合、低温殺菌の範囲内でなされるといわれているが生残するという報告もある。ただし、実験的研究によると、牛乳に多数のMAPが存在する場合、低温殺菌によってヨーネ菌が完全に不活化されない可能性があり、小売用の低温殺菌牛乳で実行可能なMAPが見つかった[43][44]。食品の汚染に関する系統的レビューでは、低温殺菌牛乳は必ずしもMAPを含まないわけではなく、肉や肉製品にMAPが含まれていることを否定することはできない[45]。MAPの生存は、低温殺菌牛乳の人工接種後のヨーグルトでも記録されている[46]。
チーズ[編集]
チーズは無殺菌牛乳により作られるものも多く、ヨーネ菌汚染の報告は多い[47]. チーズの原料乳にヨーネ菌 104~105 CFU/mlを混ぜて最長120日間の熟成期間にわたって菌数を調べたところ、103~104CFU/mlのヨーネ菌減少が確認され、生き残る菌があることが明らかにされた[48]。市販のチーズ中のヨーネ菌をPCR法と培養法で調べたところ、31.7%~3.6%が陽性だった[49]。
乳幼児用粉ミルク[編集]
チェコのパブリックらは7か国10社の市販粉ミルクをIS900PCRで調べたところ、25サンプル(49.0 %)が陽性だったと報告し、粉ミルクの生産者は、自主的にヨーネ菌フリーの牛乳を使用する必要があると考察している[50]。合計122個の粉ミルクサンプルを調べた研究では。9カ国12社の72ブランドで構成された合計122個の粉ミルクサンプルのPCR結果として6サンプルが陽性だったが、12週間と20週間の培養で増殖は見られなかった[51]。
牛肉[編集]
牛肉の全体的な有病率は低いと考えられているが[52]、牛肉からの分離報告がなされている[53]。調理による菌数減少はまだ研究されていませんが、ある研究では、log 10の細菌を2回以上減らすには、長い調理時間が必要であると推定されている[54]。ヨーネ菌が人獣共通感染症の病原体であると確認された場合、ヒトへの感染経路をよりよく特徴づけるために、さらなる研究が必要である[39]。
ヨーネ菌の死菌抗原を用いた実験モデル[編集]
クローン病の研究目的で様々な動物モデルが構築されている[55]。マウスのヨーネ菌死菌抗原を用いて人のクローン病によく似たマウスのクローン病モデルができたことが報告されている[56]。また、同様に、人の多発性硬化症の実験モデルであるマウスの実験的自己免疫性脳脊髄炎(EAE)をヨーネ菌死菌抗原を用いて作ることができ、病変は従来の結核菌死菌を使用したEAEの場合よりも重度であることが報告されている[57]。
ヨーネ菌の経口的ばく露と免疫原性・アレルギーの関連[編集]
日本人の成人の血清の調査研究によりヨーネ菌に対するIgG抗体、IgG4抗体を有することが報告された[58]。これは乳製品などに混入しているヨーネ菌死菌の繰り返し摂取により生じたものと考察された。また、花粉症などのアレルギーを有する成人にヨーネ菌に対するIgE抗体がより高く存在することも明らかにされた[59]。増加する自己免疫病だけでなく、アレルギー疾患の発生にもヨーネ菌が関与している可能性が示された。
国際ヨーネ病学会[編集]
ヨーネ病や関連する抗酸菌、そして人の自己免疫疾患との関連を研究する国際的な組織として、1989年に国際ヨーネ病学会が開設された。3年に1回、各国で国際学会が開催されている。関心のある人であれば誰でも参加することができる[60]。
日本ヨーネ病学会[編集]
日本ヨーネ病学会は、国際ヨーネ病傘下で国際学会を日本で開催するために2004年に動物衛生研究所のヨーネ病研究グループが中心に発足した専門学会である。2007年にはつくば市で国際会議場にて第9回ヨーネ病国際会議を主催した[61][62]。
国で論議されたヨーネ病[編集]
参議院においてヨーネ病について論議された議事録を参議院のデータベースで確認できる。また政府の食品安全委員会はこのように総括している。平成21 年度食品安全確保総合調査 「食品により媒介される感染症等に関する文献調査報告書」[63]
脚注[編集]
- ^ 横溝祐一、「牛ヨーネ病に関する最新知見と防疫戦略」 山口県獣医学会 The Yamaguchi journal of veterinary medicine. (26), 1-26, 1999-12, NAID 40004086776
- ^ “Advancing Human MAP Research”. Human Paratuberculosis Foundation, Inc.. 2021年1月21日閲覧。
- ^ “UNDERSTANDING CROHN’S DISEASE”. Human paratuerculosis foundation. 2021年1月23日閲覧。
- ^ a b ヨーネ病(Johne's disease-paratuberculosis) 農研機構(農業・食品産業技術総合研究機構)
- ^ 横溝祐一、牛ヨーネ病の清浄化推進に期待される疫学的研究 『獣医疫学雑誌』 Vol.5 (2001) No.1 P.1-13, doi:10.2743/jve.5.1
- ^ a b 横溝祐 一 (2001). “牛ヨーネ病の清浄化推進に期待 される疫学的研究”. 獣医疫学雑誌 1: 1-13.
- ^ ヨーネ病 JRA
- ^ 矢島りさ、曽地雄一郎、西清志、【原著】黒毛和種におけるヨーネ菌の胎子感染 日本獣医師会雑誌 Vol.68 (2015) No.3 p.167-172, doi:10.12935/jvma.68.167
- ^ Francesca Sidoti, Giuliana Banche, Sara Astegiano, Valeria Allizond, Anna Maria Cuffini, and Massimiliano Bergallo (2011). “Validation and standardization of IS900 and F57 real-time quantitative PCR assays for the specific detection and quantification of Mycobacterium avium subsp. paratuberculosis”. Canadian Journal of Microbiology 57: https://doi.org/10.1139/w11-022.
- ^ Yuichi YOKOMIZO, Hiroyuki YUGI, Richard S. MERKAL (1985). “A Method for Avoiding False-Positive Reactions in an Enzyme-Linked Immunosorbent Assay (ELISA) for the Diagnosis of Bovine Paratuberculosis”. The Japanese Journal of Veterinary Science 47: 111-119.
- ^ 特許公報(B2)_ヨーネ病の検査方法
- ^ 抗牛インターロイキン10抗体を用いた牛ヨーネ病のインターフェロンガンマELISA診断法の高感度化技術 - 農研機構
- ^ Veterinary Immunology and Immunopathology 148(1-2):48-54 · May 2011 with 86 Reads DOI: 10.1016/j.vetimm.2011.05.010
- ^ 監視伝染病の発生状況 農林水産省
- ^ ヨーネ病対策 農林水産省 (PDF)
- ^ “☆家畜伝染病発生年報(県別・令和元年)”. 農林水産省. 2021年1月21日閲覧。
- ^ “Johne’s Disease”. Animal and Plant Health Inspection Service, U.S. DEPARTMENT OF AGRICULTURE. 2021年1月21日閲覧。
- ^ “NAHMS Dairy Studies”. Animal and Plant Health Inspection Service, U.S. DEPARTMENT OF AGRICULTURE. 2021年1月21日閲覧。
- ^ Johannes Lorenz Khol, Walter Baumgartner (2012). “Examples and suggestions for the control of paratuberculosis in European cattle”. Jpn J Vet Res 60 Suppl: S1-7.
- ^ EFSA Panel on Animal Health and Welfare (AHAW) Simon More Anette Bøtner Andrew Butterworth Paolo Calistri Klaus Depner Sandra Edwards Bruno Garin‐Bastuji Margaret Good Christian Gortázar Schmidt Virginie Michel Miguel Angel Miranda Søren Saxmose Nielsen Mohan Raj Liisa Sihvonen Hans Spoolder Jan Arend Stegeman Hans‐Hermann Thulke Antonio Velarde Preben Willeberg Christoph Winckler Francesca Baldinelli Alessandro Broglia Gabriele Zancanaro Beatriz Beltrán‐Beck Lisa Kohnle Joana Morgado Dominique Bicout (2017). “Assessment of listing and categorisation of animal diseases within the framework of the Animal Health Law (Regulation (EU) No 2016/429): paratuberculosis”. FASA journal 15: https://doi.org/10.2903/j.efsa.2017.4960.
- ^ Kamal R. Acharya , Karren M. Plain, Richard J. Whittington and Navneet K. Dhand (2020). “Australian Veterinarians’ Perceptions Regarding the Zoonotic Potential of Mycobacterium avium Subspecies Paratuberculosis”. Vet. Sci 7: https://doi.org/10.3390/vetsci7010033.
- ^ 牛のヨーネ病防疫対策要領 (平成25年4月1日24消安第5999号) (PDF)
- ^ 片山信也、田山ちぐさ、藤田巧 ほか、サイレージ発酵がヨーネ菌(Mycobacterium avium sub sp. paratuberculosis)の生残に及ぼす影響 日本草地学会誌 Vol.46 (2000) No.3-4 p.282-288, doi:10.14941/grass.46.282_1
- ^ Momotani E, Romona NM, Yoshihara K, Momotani Y, Hori M, Ozaki H and Ikegami M (2012). “Molecular pathogenesis of bovine paratuberculosis and Human inflammatory bowel diseases”. Vet Immunol Immunopathol 148.
- ^ Marta Maia Bosca-Watts, Joan Tosca, Rosario Anton, Maria Mora, Miguel Minguez, and Francisco Mora (2015). “Pathogenesis of Crohn’s disease: Bug or no bug”. World J Gastrointest Pathophysiol. 6: 1–12.
- ^ R J Chiodini (1989). “Crohn's disease and the mycobacterioses: a review and comparison of two disease entities.”. Clin Microbiol Rev 2: 90–117.
- ^ a b c Mycobacterium avium subspecies paratuberculosis causes Crohn's disease in some inflammatory bowel disease patients. World J Gastroenterol. (2014 Jun 21)
- ^ TK Dalziel (1913). “Chronic interstitial enteritis”. The British Medical Journal, 2: 1068-1070.
- ^ Saleh A Naser, Sudesh R Sagramsingh, Abed S Naser, and Saisathya Thanigachalam (2014). “Mycobacterium avium subspecies paratuberculosis causes Crohn's disease in some inflammatory bowel disease patients”. World J Gastroenterol 20: 7403–7415.
- ^ Crohn BB, Ginzburg L, Oppenheimer GD (1952). “Regional ileitis; a pathologic and clinical entity”. Am J Med 13: 583–590.
- ^ “クローン病(指定難病96)”. 難病情報センター. 2021年1月20日閲覧。
- ^ a b GBD 2017 Inflammatory Bowel Disease Collaborators (2019). “The global, regional, and national burden of inflammatory bowel disease in 195 countries and territories, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017”. The Lanset Gastroenterology and hepatology 5: 17-30.
- ^ 小児期発症炎症性腸疾患の病態把握、診断基準確立および将来的な治療研究基盤確立のための研究 - 国立成育医療研究センター 平成28年度研究課題 総括研究報告書 27-12
- ^ Davide Cossu, Eleonora Cocco, Daniela Paccagnini, Speranza Masala, Niyaz Ahmed, Jessica Frau, Maria Giovanna Marrosu, and Leonardo A. Sechi (2011). “Association of Mycobacterium avium subsp. paratuberculosis with Multiple Sclerosis in Sardinian Patients”. PLoS One 6: doi: 10.1371/journal.pone.0018482.
- ^ “多発性硬化症の発症にはヨーネ菌が関与する可能性 ~死菌の経口摂取がリスクになる~”. 順天堂大学. 2021年1月23日閲覧。
- ^ Kazumasa Yokoyama, Davide Cossu, Yasunobu Hoshino, Yuji Tomizawa, Eiichi Momotani, Nobutaka Hattori (2018). “Anti-Mycobacterial Antibodies in Paired Cerebrospinal Fluid and Serum Samples from Japanese Patients with Multiple Sclerosis or Neuromyelitis Optica Spectrum Disorder”. J Clin Med 7: 522.
- ^ Association between Lipoprotein Levels and Humoral Reactivity to Mycobacterium avium subsp. paratuberculosis in Multiple Sclerosis, Type 1 Diabetes Mellitus and Rheumatoid Arthritis(1型糖尿病とヨーネ菌の関連)
- ^ Kaur P, Filia G, Singh SV, Patil PK, K S Sandhu Search articles by 'K S Sandhu'Sandhu KS (2010). “Molecular detection and typing of Mycobacterium avium subspecies paratuberculosis from milk samples of dairy animals.”. Tropical Animal Health and Production 47: 1031-1035.
- ^ a b Kamal R. Acharya, Karren M. Plain, Richard J. Whittington and Navneet K. Dhand * (2020). “Australian Veterinarians’ Perceptions Regarding the Zoonotic Potential of Mycobacterium avium Subspecies Paratuberculosis”. Vet. Sci. 7: https://doi.org/10.3390/vetsci7010033.
- ^ Kundan Kumar Chaubey, Shoor Vir Singh, Saurabh Gupta, Manju Singh, Jagdip Singh Sohal, Naveen Kumar, Manoj Kumar Singh, Ashok Kumar Bhatia & Kuldeep Dhama (2017). “Mycobacterium avium subspecies paratuberculosis – an important food borne pathogen of high public health significance with special reference to India: an update”. Veterinary Quarterly 37: 282-299.
- ^ I R Grant (2003). “Mycobacterium paratuberculosis and milk”. Acta Vet Scand 44: 261-266.
- ^ G J Koenig, G F Hoffsis, W P Shulaw, S Bech-Nielsen, D M Rings, G St-Jean (1993). “Isolation of Mycobacterium paratuberculosis from mononuclear cells in tissues, blood, and mammary glands of cows with advanced paratuberculosis”. Am J Vet Res 54: 1441-1555.
- ^ “Short communication: Recovery of viable Mycobacterium avium subspecies paratuberculosis from retail pasteurized whole milk in Brazil”. Journal of Dairy Science 95: 6946-6948. (2012).
- ^ Carvalho IA, Silva VO, Vidigal PM, Silva A Jr, Moreira MA. (2010). “Genetic evaluation of IS900 partial sequence of Mycobacterium avium subsp. paratuberculosis Brazilian isolates from bovine milk”. Trop Anim Health Prod 44: 1331-4.
- ^ M M Eltholth, V R Marsh, S Van Winden, F J Guitian (2009). “Contamination of food products with Mycobacterium avium paratuberculosis: a systematic review”. J Appl Microbiol 107: 1061-1071.
- ^ L Van Brandt, K Coudijzer, L Herman, C Michiels, M Hendrickx, G Vlaemynck (2011). “Survival of Mycobacterium avium ssp. paratuberculosis in yoghurt and in commercial fermented milk products containing probiotic cultures”. J Appl Microbiol 110: 1252-1261.
- ^ P.P.F. Albuquerque, R.D.S. Cezar, J.W. Pinheiro Junior, G. Grazielle Nascimento, A.S. Santos , R.A. Mota (2019). “Occurrence of Mycobacterium avium subsp. paratuberculosis in coalho cheese in the State of Pernambuco, Brazil”. Arq. Bras. Med. Vet. Zootec. 71: 1917-1921.
- ^ U. Spahr and K. Schafroth (2001). “Fate of Mycobacterium avium subsp. paratuberculosis in Swiss Hard and Semihard Cheese Manufactured from Raw Milk”. Appl Environ Microbiol. 57: 4199–4205.
- ^ John Ikonomopoulos, Ivo Pavlik, Milan Bartos, Petra Svastova, Wuhib Yayo Ayele, Petr Roubal, John Lukas, Nigel Cook, Maria Gazouli (2005). “Detection of Mycobacterium avium subsp. paratuberculosis in Retail Cheeses from Greece and the Czech Republic”. APPLIED AND ENVIRONMENTAL MICROBIOLOGY 71: 8934-8936.
- ^ K. HRUSKA, M. BARTOS, P. KRALIK, I. PAVLIK (2005). “Mycobacterium avium subsp. paratuberculosisin powdered infant milk: paratuberculosis in cattle – the public health problem to be solved”. Veterinarni Medicina 50: 327-335.
- ^ Kamal R Acharya, Navneet K Dhand, Richard J Whittington, Karren M Plain (2017). “Detection of Mycobacterium avium subspecies paratuberculosis in powdered infant formula using IS900 quantitative PCR and liquid culture media”. Int J Food Microbiol 257: 1-9.
- ^ Hisako Okura, Nils Toft, Nicola Pozzato, Annalucia Tondo, and Søren Saxmose Nielsen (2011). “Apparent Prevalence of Beef Carcasses Contaminated with Mycobacterium avium subsp. paratuberculosis Sampled from Danish Slaughter Cattle”. Vet Med Int 2011: doi: 10.4061/2011/152687.
- ^ Marta Alonso-Hearn, Elena Molina, Marivi Geijo, Patricia Vazquez, Iker Sevilla, Joseba M. Garrido, and Ramon A. Juste (2009). “Isolation of Mycobacterium avium subsp. paratuberculosis from Muscle Tissue of Naturally Infected Cattle”. FOODBORNE PATHOGENS AND DISEASE 6: 514-518.
- ^ Philipp Hammer, Hans-Georg C Walte, Sönke Matzen, Jann Hensel, Christian Kiesne (2013). “Inactivation of Mycobacterium avium subsp. paratuberculosis during cooking of hamburger patties”. J Food Prot 79: 1194-201.
- ^ Cominelli F, Arseneau KO, Rodriguez-Palacios A, Pizarro TT. (2017). “Uncovering Pathogenic Mechanisms of Inflammatory Bowel Disease Using Mouse Models of Crohn's Disease-Like Ileitis: What is the Right Model?”. Cell Mol Gastroenterol Hepatol 6: 19-32.
- ^ Eiichi Momotani, Hiroshi Ozaki, Masatoshi Hori, Shizuo Yamamoto, Takashi Kuribayashi, Shigetoshi Eda, and Masahiro Ikegami (2012). “Mycobacterium avium subsp. paratuberculosis lipophilic antigen causes Crohn’s disease-type necrotizing colitis in Mice”. Springerplus 1: 47.
- ^ Davide Cossu, Kazumasa Yokoyama, Tamami Sakanishi, Eiichi Momotani, Nobutaka Hattori (2019). “Adjuvant and antigenic properties of Mycobacterium avium subsp. paratuberculosis on experimental autoimmune encephalomyelitis”. J Neuroimmunol. 330: 174-177.
- ^ Shigeru Otsubo, Davide Cossu, Shigetoshi Eda, Yuriko Otsubo, Leonardo Antonio Sechi, Tsuyoshi Suzuki, Yumiko Iwao, Shizuo Yamamoto, Takashi Kuribayashi, and Eiichi Momotani (2015). “Seroprevalence of IgG1 and IgG4 Class Antibodies Against Mycobacterium avium subsp. paratuberculosis in Japanese Population”. Foodborne Pathogens and Disease: https://doi.org/10.1089/fpd.2015.1956.
- ^ D. Cossu, S. Otsubo, Y. Otsubo, S. Eda, T. Suzuki, Y. Iwao, T. Kuribayashi, S. Yamamoto, L. A. Sechi, and E. Momotani (2017). “Mycobacterium avium Subsp. paratuberculosis Induces Specific IgE Production in Japanese People with Allergies”. Int J Inflam: doi: 10.1155/2017/7959154.
- ^ “International Association for Paratuberculosis”. International Association for Paratuberculosis. 2021年1月21日閲覧。
- ^ “Proceedings of the 9th International Colloquium on Paratuberculosis”. International Association for Paratuberculosis. 2021年1月21日閲覧。
- ^ “Proceedings of the 9 th International Colloquium on Paratuberculosis”. 農研機構. 2021年1月21日閲覧。
- ^ “食品により媒介される感染症等に関する文献調査報告書”. 内閣府食品安全委員会. 2021年1月23日閲覧。
参考文献[編集]
- 百溪英一、吉野知男、ヨーネ病の病理発生と防疫について 『日本獣医師会雑誌』 Vol.42 (1989) No.4 P.229-237, doi:10.12935/jvma1951.42.229
関連項目[編集]
外部リンク[編集]
- 国際ヨーネ病学会 International Association for Paratuberculosisホームページ
- 日本ヨーネ病学会ホームページ (New)
- 日本ヨーネ病学会FaceBook
- 一般社団法人比較医学研究所ホームページ
- ヨーネ病 JRA
- ヨーネ病 独立行政法人 北海道立総合研究機構 畜産試験場
