水素原子
| 水素原子 | |
|---|---|
 水素原子 | |
| 概要 | |
| 名称、記号 | protium,1H |
| 中性子 | 0 |
| 陽子 | 1 |
| 核種情報 | |
| 天然存在比 | 99.985% |
| 同位体質量 | 1.007825 u |
| スピン角運動量 | 1⁄2+ |
| 余剰エネルギー | 7288.969± 0.001 keV |
| 結合エネルギー | 0.000± 0.0000 keV |
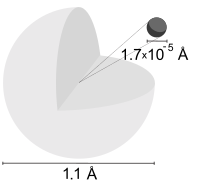
水素は地球上では他の原子との化合物(例えば、水)を作るか、水素分子(H2)の状態で存在していることが多く、単に水素と言えば一般的には水素分子のことを指す。
電気分解などにより単離した水素原子や、酸素や窒素などと結びついた水素原子は、反応性が高く、その還元作用のため活性水素 (Active hydrogen) と呼ばれる[2][3]。
生成と反応
[編集]H-H結合は、298 Kでの結合解離エンタルピーが435.88 kJ/molと最も強い結合の1つである。この強い結合のため、水素分子は高温になるまでほとんど解離しない。3,000 Kで解離度は7.85%である[4]。
- H2 ⇌ 2 H
水素原子は反応性が非常に高く、ほぼ全ての元素と結合できる。
同位体
[編集]最も豊富な同位体である水素1、プロティウム、軽水素は中性子を含まない。一方、重水素や三重水素等の他の水素の同位体は1つかそれ以上の中性子を含む。下記の式は3つ全ての同位体に対して適用できるが、同位体ごとに若干異なるリュードベリ定数を用いる必要がある。
量子理論的分析
[編集]水素原子は単純な二体問題の系として多くの分析的な単純解を生成してきたことから、量子力学や量子場理論において特別に重要な意味を持つ。
1913年、ニールス・ボーアは多くの仮定を置いて単純化することで、水素原子のエネルギー準位及びスペクトル周波数を得た。ボーアの原子模型の基礎であるこれらの仮定は完全に正しくはないが、かなり正しいエネルギー値が得られた。ボーアの原子模型では、それぞれのエネルギー準位は整数値の量子数 n で識別され、
で与えられるエネルギーを持つ。ここで、me は電子の静止質量、c は光速、α は微細構造定数である。周波数とエネルギー値に関するボーアの結論は、1925年から26年にかけてのシュレーディンガー方程式の解と同値のものである。水素についてのシュレーディンガー方程式の解は解析解であり、水素のエネルギー準位とスペクトル線の周波数についての簡単な表現を与える。シュレーディンガー方程式の解は他に2つの量子数と様々な量子状態での電子の波動関数の形を与えるためボーアの原子模型よりもさらに詳細な情報が得られ、これにより原子結合の異方的な性質が説明できる。
シュレーディンガー方程式はもっと複雑な原子や分子にも適用できる。電子か核子の数が1つを超えると解は解析的には求められず、コンピュータ計算か仮定の単純化が必要となる。
シュレーディンガー方程式は非相対性理論的な量子力学にしか適用できないため、水素原子に関して得られる解は完全に正確なものではない。このことは相対論的量子力学に基づくディラック方程式によって改善される。
シュレーディンガー方程式の解
[編集]水素原子のシュレーディンガー方程式の解は、核子によるクーロンポテンシャルは等方的であるという事実を用いる。結果として得られた基底状態の固有関数(軌道)自体は等方的である必要はないものの、それらの角座標への依存はこのポテンシャルの等方性から得られるものである。ハミルトニアンの固有状態(即ちエネルギー固有状態)は、角運動量演算子の同時固有状態として選ぶことができる。これは、核子の周りでの電子の軌道運動において角運動量が保存されるという事実と合致する。従って、エネルギー固有状態は2つの角運動量量子数 l と m (どちらも整数)により分類することができる。角運動量量子数 l (= 0,1,2,...) は角運動量の大きさを決定し、磁気量子数 m (= -l, ..., +l) は任意に選んだz軸への角運動量の射影を決定する。
波動関数の全角運動量と角運動量射影の数学的な表現に加え、波動関数の放射方向依存の表現も見出す必要がある。これは 1/r クーロンポテンシャル(ラゲールの陪多項式)から導ける。ここから3つ目の量子数 n (= 1,2,3, ...) が得られる。水素のこの量子数は原子の全エネルギーと関連している。
角運動量の保存のため、l が同じで m が異なる状態は同じエネルギーを持つ。さらに水素原子の場合は、n が同じで l が異なる状態は縮退している(即ち同じエネルギーを持つ)。しかしこれは水素に特有の性質で、1/r とは異なるポテンシャルを持つ、より複雑な原子に対しては当てはまらない。
電子のスピン角運動量を考慮に入れると、2つの値を取りうる最後の量子数(z軸に沿った電子の角運動量の射影)が得られる。従って、水素中の電子のあらゆる固有状態は4つの量子数で完全に記述することができる。量子力学の規則によると、電子の実際の状態はこれらの状態の重ね合わせである。このことは、z軸の方向の取り方が任意であることも説明できる。
シュレーディンガー理論の代替
[編集]ヴェルナー・ハイゼンベルクの行列力学においては、水素原子は角運動量とラプラス・ルンゲ・レンツベクトルから生み出される四次元回転対称性(O(4)-対称性)を用いて、ウォルフガング・パウリによって初めて解かれた[5]。O(4)-対称性をO(4,2)に拡張することによって、全体のスペクトルと全ての遷移状態が1つの既約群表現に内包される[6]。
1979年(非相対論的な)水素原子について、リチャード・P・ファインマンの経路積分の範囲で初めて解かれた[7][8]。この成果はファインマンの方法の適用範囲を大きく広げた。
水素原子の固有状態についての数学的概要
[編集]1928年、ポール・ディラックは特殊相対性理論と完全に両立できる方程式(ディラック方程式)を発見し、その結果として波動関数を正負のエネルギー(物質と反物質)および両方向のスピンからなる4成分のディラック・スピノルで表した。この方程式の解はシュレーディンガー方程式の解よりも正確な以下の結果を与える。
エネルギー準位
[編集]微細構造を含みラムシフトや超微細構造を含まない水素原子のエネルギー準位はディラックの微細構造表現により与えられる。
ここで α は微細構造定数、j は |l ± 1/2| に等しくスピンの方向に依存する全角運動量量子数である。この式は、ニールス・ボーアとシュレーディンガーによって得られた下記のエネルギーを補正している。角括弧で囲まれた値は相対論的効果に由来する因子であり,ほぼ1に近い。n = 1 における角括弧の前の因子 はリュードベリ定数と呼ばれ、ボーアの原子模型
から最初に発見された。ここで、me は電子の静止質量、e は電気素量、h はプランク定数、ε0 は真空の誘電率である。この定数はエネルギーのリュードベリ単位という形で原子物理学においてよく用いられる。
上記のリュードベリ定数の正確な値は、核子は電子と比べて無限に重いことを仮定する。軽水素、重水素、三重水素では、この定数は系の換算質量を用いることで単純な電子の質量を用いるのと比べて若干改善される。しかし核子が電子よりも遥かに重いため値はほぼ同じになる。電子1つの水素のリュードベリ定数を RM とすると、R は
で与えられる。ここで M は原子核の質量である。軽水素では、me/M の値は約1/1836である。重水素、三重水素ではこの値はそれぞれ約1/3670、1/5497である。これらの値を分母の1に加えるとR の値の補正値となる。
波動関数
[編集]
球面座標系において、標準位置での波動関数は
で与えられる。ここで、
- ρ = 2r / na0,
- a0 はボーア半径、
- は、n - l - 1 次の一般化されたラゲールの陪多項式であり、著者によって様々に定義されるがここではMessiah[10]やMathematica[11]による定義に従う。
- は、l 次 m 桁の球面調和関数である。
量子数は以下の値を取る:
さらに、これらの波動関数は規格化され、直交関数列化される。
ここで |n, l, m⟩ はブラ-ケット記法で表した波動関数 ψnlm、δ はクロネッカーのデルタである[12]。
角運動量
[編集]角運動量演算子の固有値は
水素の電子軌道の可視化
[編集]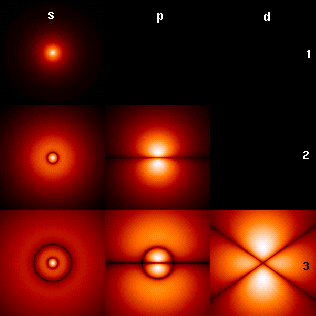
右図は水素原子の最初のいくつかの軌道(エネルギー固有関数)を示している。これらは確率振幅の断面図を表している(黒色は密度0、白色は最大密度である)。角運動量量子数 l はそれぞれの列に示されている(s は l = 0 、p は l = 1、d は l = 2 を意味する)。主量子数 n はそれぞれの行の右に示されている。全ての図において磁気量子数 m は 0 としており、断面図はxz平面である。基底状態、即ち最もエネルギーの低い状態では、電子は常に 1s の状態にある(n = 1, l =0)。
図中で最初の軌道以外に現れる黒い線は、波動関数の節、即ち確率密度が 0 になる地点である(より正確には、節は極座標でシュレーディンガー方程式を解いた時に得られる球面調和関数で表される)。
量子数がこれらの節の形を決める。
出典
[編集]- ^ Palmer, D. (13 September 1997). “Hydrogen in the Universe”. NASA. 5 February 2008閲覧。
- ^ 「活性水素」『岩波理化学辞典』第5版、371ページ。
- ^ 小項目事典,世界大百科事典内言及, 日本大百科全書(ニッポニカ),ブリタニカ国際大百科事典. “活性水素とは”. コトバンク. 2021年10月18日閲覧。
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Pauli, W (1926). “Über das Wasserstoffspektrum vom Standpunkt der neuen Quantenmechanik”. Zeitschrift für Physik 36: 336–363. Bibcode: 1926ZPhy...36..336P. doi:10.1007/BF01450175.
- ^ Kleinert H. (1968). “Group Dynamics of the Hydrogen Atom”. Lectures in Theoretical Physics, edited by W.E. Brittin and A.O. Barut, Gordon and Breach, N.Y. 1968: 427–482.
- ^ Duru I.H., Kleinert H. (1979). “Solution of the path integral for the H-atom”. Physics Letters B 84 (2): 185–188. Bibcode: 1979PhLB...84..185D. doi:10.1016/0370-2693(79)90280-6.
- ^ Duru I.H., Kleinert H. (1982). “Quantum Mechanics of H-Atom from Path Integrals”. Fortschr. Phys 30 (2): 401–435. Bibcode: 1982ForPh..30..401D. doi:10.1002/prop.19820300802.
- ^ P.J. Mohr, B.N. Taylor, and D.B. Newell (2011), "The 2010 CODATA Recommended Values of the Fundamental Physical Constants" (Web Version 6.0). This database was developed by J. Baker, M. Douma, and S. Kotochigova. Available: http://physics.nist.gov/constants. National Institute of Standards and Technology, Gaithersburg, MD 20899. Link to R∞, Link to hcR∞
- ^ Messiah, Albert (1999). Quantum Mechanics. New York: Dover. pp. 1136. ISBN 0-486-40924-4
- ^ LaguerreL. Wolfram Mathematica page
- ^ Introduction to Quantum Mechanics, Griffiths 4.89
関連文献
[編集]- David J. Griffiths, David J. (1995). Introduction to Quantum Mechanics. Prentice Hall. ISBN 0-13-111892-7 Section 4.2 deals with the hydrogen atom specifically, but all of Chapter 4 is relevant.
- Bransden, B.H.; C.J. Joachain (1983). Physics of Atoms and Molecules. Longman. ISBN 0-582-44401-2
- Kleinert, H. (2009). Path Integrals in Quantum Mechanics, Statistics, Polymer Physics, and Financial Markets, 4th edition, Worldscibooks.com, World Scientific, Singapore (also available online physik.fu-berlin.de)
関連項目
[編集]
外部リンク
[編集]- Physics of hydrogen atom on Scienceworld
- Interactive graphical representation of orbitals
- Applet which allows viewing of all sorts of hydrogenic orbitals
- The Hydrogen Atom: Wave Functions, and Probability Density "pictures"
- Basic Quantum Mechanics of the Hydrogen Atom
- "Research team takes image of hydrogen atom" Kyodo News, Friday, 5 November 2010 – (includes image)


![{\displaystyle {\begin{aligned}E_{jn}&=-m_{\text{e}}c^{2}\left[1-\left(1+\left[{\dfrac {\alpha }{n-j-{\frac {1}{2}}+{\sqrt {\left(j+{\frac {1}{2}}\right)^{2}-\alpha ^{2}}}}}\right]^{2}\right)^{-1/2}\right]\\&\approx -{\dfrac {m_{\text{e}}c^{2}\alpha ^{2}}{2n^{2}}}\left[1+{\dfrac {\alpha ^{2}}{n^{2}}}\left({\dfrac {n}{j+{\frac {1}{2}}}}-{\dfrac {3}{4}}\right)\right].\end{aligned}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd377e088f4bbbce38acade57dfee9270da4e684)











