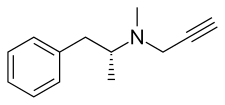
セレギリン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 発音 | [səˈlɛdʒɪliːn] sə-LEJ-i-leen |
| 販売名 | Eldepryl, Jumex, Zelapar, Emsam, others[1] |
| Drugs.com | monograph |
| MedlinePlus | a697046 |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 | |
| 法的規制 | |
| 投与経路 | By mouth, transdermal (patch) |
| 薬物動態データ | |
| 生物学的利用能 | 10% (oral), 73% (patch) |
| 血漿タンパク結合 | 94% |
| 代謝 | Intestines and liver |
| 代謝物質 | N-Desmethylselegiline, L-amphetamine, L-methamphetamine |
| 半減期 | 10 hours (oral)[要出典], 18–25 hours[要出典] (transdermal) |
| 排泄 | Urine |
| 識別 | |
| CAS番号 |
14611-51-9 14611-52-0 (HCl) |
| ATCコード | N04BD01 (WHO) QN06AX90 (WHO) |
| PubChem | CID: 26757 |
| IUPHAR/BPS | 6639 |
| DrugBank |
DB01037 |
| ChemSpider |
24930 |
| UNII |
2K1V7GP655 |
| KEGG |
D03731 |
| ChEBI |
CHEBI:9086 |
| ChEMBL |
CHEMBL972 |
| 別名 | L-Deprenyl; (R)-(–)-N,α-Dimethyl-N-2-propynylphenethylamine; (R)-(–)-N-Methyl-N-2-propynylamphetamine; (R)-(–)-N-2-propynylmethamphetamine |
| 化学的データ | |
| 化学式 | C13H17N |
| 分子量 | 187.281 |
| |
セレギリン(英: Selegiline)は、パーキンソン病および大うつ病性障害の治療に使用される薬である[1]。L-deprenylとしても知られ、ブランド名エフピー、Eldepryl 、Emsamの下で販売されている。パーキンソン病には経口摂取錠剤の形で、うつ病には皮膚に適用されるパッチとして提供される。 ただし日本では経口投与の錠剤のみである(後述)。
セレギリンはモノアミンオキシダーゼ阻害剤として作用し、脳内のモノアミン神経伝達物質のレベルを増加させる。典型的な臨床用量では、セレギリンは選択的かつ不可逆的なモノアミンオキシダーゼB(MAO-B)の阻害剤であり、脳内のドーパミンのレベルを増加させる。より高用量では、その特異性を失いMAO-Aも阻害し、脳内のセロトニン 、ノルエピネフリン、およびドーパミンのレベルを増加させる。
医療用途[編集]
パーキンソン病[編集]
錠剤の形で、セレギリンはパーキンソン病の症状を治療するために使用される[2]。単剤療法として適応外使用されてきたが、レボドパ(L -DOPA)などの薬物の補助剤として最もよく使用されている[3] [4]。セレギリンをレボドパに追加する理論的根拠は、必要なレボドパの用量を減らし、したがってレボドパ療法における運動合併症を減らすことにある[5]。また、セレギリンは、レボドパ治療が必要になる時点を、診断後約11か月から約18か月まで遅らせる[6]。セレギリンが神経保護剤として作用し、疾患の進行速度を低下させるといういくつかのエビデンスがあるが、これには議論がある。
セレギリンはまた、アルツハイマー病における認知症の緩和治療として、適応外使用されている[4]。
日本ではパーキンソン病治療剤(選択的MAO-B阻害剤)のセレギリン塩酸塩(Selegiline hydrochloride)錠剤としてジェネリック医薬品がある。先発品のエフピー錠は口腔内崩壊錠(OD錠)。
うつ病[編集]
セレギリンはまた、大うつ病性障害の治療として、経皮パッチで投与される[7][8]。
2015年に発表された量的レビューでは、重要な試験のプールされた結果について、症状軽減のためのセレギリンパッチの治療必要数(number needed to treat; NNT、効果の大きさの兆候なので、数が少ない方が良い)は11であり、寛解については9[8]である。 害を及ぼすのに必要な数 (number needed to harm、NNTの逆数、ここでは高い数が望ましい)は、性的副作用の387から適用部位の反応の7までの範囲だった。救われるか害を受ける可能性(likelihood to be helped or harmed; LHH)に関して、分析により、セレギリンパッチは、寛解につながる可能性と副作用による中止につながる可能性が3.6倍高かったことが示された。寛解vs不眠症の発生率のLHHは2.1、寛解vs不眠症による中止のLHHは32.7だった。寛解vs不眠症および性機能障害のLHHは、どちらも非常に低かった。
日本ではパッチ剤は販売されていない。
注意欠陥多動性障害[編集]
一部の研究では、セレギリンは、子供[9][10][11]と成人の両方で注意欠陥多動性障害 (ADHD)の治療にメチルフェニデートと同じくらい効果的であるが、副作用、特に食欲抑制、不安、頭痛、睡眠妨害が少ないことがわかっている[12][13]。 パーキンソン病の治療に使用されるMAO-B阻害剤であるセレギリンは、チトクロームP450によってL-デスメチルセレギリン、L-アンフェタミン、およびL-メタンフェタミンに代謝される[14][15]。
特別な集団[編集]
ヒトへのすべての用途とすべての剤型で、セレギリンは妊娠カテゴリCである。妊娠した実験動物を用いた研究では、胎児への悪影響が示されているが、ヒトを対象とした適切な研究は無い[2] [7]。
副作用[編集]
レボドパと併用した錠剤の副作用には、頻度の高い順に、吐き気、幻覚、錯乱、うつ病、バランスの喪失、不眠症、不随意運動の増加、興奮、徐脈または不整脈、妄想、高血圧、狭心症の発症または増加、および失神[2]。 副作用のほとんどは、高ドーパミンシグナル伝達が原因であり、レボドパの用量を減らすことで緩和できる[1]。
うつ病のパッチ剤の主な副作用には、貼付部位反応、不眠症、下痢、喉の痛み などがある[7] 。セレギリンパッチは、特に若い人に対して自殺企図リスク上昇の可能性という黒枠警告があり、2007年以降のすべての抗うつ薬と同様である[16]。
相互作用[編集]
経口剤とパッチ剤の両方とも、セレギリンはセロトニン症候群を引き起こす可能性のある薬物( SSRIや咳止め薬の デキストロメトルファンなど)を組み合わせることに対して、強い警告が表示される [2] [7] [17]。セレギリンとオピオイド鎮痛薬のペチジンの併用は、深刻な副作用を引き起こす可能性があるため推奨されない。トラマドールやメタドンなどのいくつかの他の合成オピオイド、およびさまざまなトリプタンは 、セロトニン症候群の可能性があるため禁忌[18] [19]。
エチニルエストラジオールとプロゲスチンを含む 経口避妊薬(OC)は、セレギリンのバイオアベイラビリティを10倍から20倍増加させる[20]。セレギリン血中濃度が上がることで、MAO-B選択性の喪失につながる可能性があり、セレギリンがMAO-Aも同様に阻害し始める可能性がある。これにより、セロトニン作動薬と組み合わせると、チラミン誘発性高血圧発症や、セロトニン毒性などの、非選択的MAOIの副作用に対する感受性が高まる。
経口錠剤とパッチ剤はいずれも、MAO阻害剤に関連する高血圧の危機を回避するための食事制限がある[2] [7]。パッチ剤は、開発に際し、食事制限を克服する目的もあった。臨床試験は成功したことを示した。さらに、2006年4月から2010年10月までの市販後調査では、29,141回の薬物への曝露のうち、高血圧イベントまたは高血圧の可能性のある自己報告は13件のみであり、客観的な臨床データを伴うものは無かった[8]。パッチによる薬物送達法の最低用量(6 mg / 24時間)には、食事制限は必要ない[21]。 古い非選択的MAOIとの組み合わせであろうと、可逆的MAO-A阻害剤モクロベミドとの組み合わせであろうと、パッチおよび経口製剤の高用量には、低チラミン食が必要となる[17]。
薬理学[編集]
薬力学[編集]
セレギリンはMAO-Bの選択的阻害剤であり、共有結合することにより不可逆的に阻害する[1] [22]。ドーパミンの分解をブロックすることにより効果を発揮し、それによりドーパミン活性を増加させる[23]。セレギリンの神経保護特性の可能性は、MAO-B作動によって放出される遊離酸素ラジカルから近くのニューロンを保護することによるかもしれない。高用量では、セレギリンはMAO-Bに対する選択性を失い、 MAO-Aも阻害する 。
セレギリンはCYP2A6も阻害し、結果としてニコチンの効果を高めることができる[24]。セレギリンは、σ1受容体もまた活性化するようである。これらの受容体に対して比較的高い親和性を有し、約 400 nM[25] [26]。
薬物動態[編集]
セレギリンの経口バイオアベイラビリティは約10%で、分子は脂溶性であるため、脂肪食と一緒に摂取すると増加する[1] [27]。セレギリンとその代謝産物は、血漿タンパク質に広範囲に結合する(94%)。セレギリンは 血液脳関門を通過して脳に入り、 視床 、 大脳基底核 、 中脳 、および帯状回に最も集中する[4] [7]。
セレギリンは大部分が腸と肝臓で代謝される。未変化体と代謝物は尿中に排泄される[1]。
セレギリンの口腔内投与(OD)は、生物学的利用能が5倍高くなり、血中濃度がより再現性が高く上昇し、アンフェタミン代謝産物が経口投与錠剤よりも少なくなる[28]。
代謝[編集]
セレギリンはシトクロムP450によって代謝されてL-デスメチルセレギリンとL-メタンフェタミンになり、後者はメタンフェタミンのエナンチオマー(鏡像異性体)の1つである[14] [15]。デスメチルセレギリンはMAO-Bに対していくらかの活性を持っているが、セレギリンよりもはるかに小さい[23][22]。CYP2C19によってさらに代謝されると考えられている[29]。L-メタンフェタミンはL- アンフェタミンに変換される(セレギリンを服用している人も、薬物スクリーニング検査でアンフェタミンまたはメタンフェタミンの検査で陽性となる場合がある)[30]。アンフェタミン代謝物は、神経伝達物質であるドーパミンとノルエピネフリンの再取り込みを阻害するセレギリンの能力に寄与している可能性があるが、起立性低血圧と幻覚とも関連している[31] [32]。アンフェタミン代謝産物はヒドロキシル化され、フェーズII代謝では、グルクロニルトランスフェラーゼによって抱合される。
新しい抗パーキンソンMAO-B阻害剤のラサギリンは、アンフェタミンのような特性を持たない1(R)-aminoindanに代謝される[33]。
パッチ[編集]
パッチをヒトに適用した後、セレギリン含量の平均25%から30%が24時間にわたって全身的に送達される。経皮投与は、経口投与と比較して、セレギリンへの曝露が有意に高く、すべての代謝産物への曝露が低くなる。これは、経口投与剤の広範な初回通過代謝と、パッチ剤の低い初回通過代謝によるものである。貼付する場所は、薬がどのように分布するかについて重要な要素ではない。ヒトでは、セレギリンは皮膚に蓄積せず、皮膚で代謝されない[7]。
化学[編集]
セレギリンは、 フェネチルアミンおよびアンフェタミン化学ファミリーに属する。 L-deprenyl、および (R)-(–)-N,α-dimethyl-N-(2-propynyl)phenethylamineまたは (R)-(–)-N-methyl-N-2-propynylamphetamineとしても知られている。この化合物は、窒素原子にプロパルギル基 が結合したレボメタンフェタミン(L-メタンフェタミン)の誘導体である。 この詳細は、フェネチルアミングループの古いMAO-B阻害剤であるパルギリンから借用したものである[34]。セレギリンは、ラセミ混合物デプレニルの左旋性エナンチオマー。
セレギリンは、臭化プロパルギルを使用した (−)-メタンフェタミンのアルキル化によって合成される[35][36] [37] [38]。
アンフェタミンクラスの臨床で使用されているもう1つのMAOIは、トラニルシプロミンである。

歴史[編集]
結核薬イプロニアジドを服用している人々が、服用により気分を高めたという発見と、その後、薬効はおそらくMAOの阻害によるものであるという発見が続き、多くの研究者や製薬企業が抗うつ薬として使用するMAO阻害剤を発見しようと試み始めた。 ハンガリーの製薬企業であるChinoin(1993年以降はサノフィの一部)のZoltan Ecseriによって、セレギリンは発見された [39]。彼らは、E-250と呼んでいた [40] :66–67 。Chinoinは1962年にこの薬の特許を取得し、この化合物は1965年に英語で科学文献に最初に発表された:67 [41] 。実験動物とヒトにおけるE-250の、生物学と影響に関する研究は、 ブダペストにあるセンメルヴァイス大学のヨーゼフノール(József Knoll)グループによって行われた :67。

デプレニル(Deprenyl)は、 エナンチオマーと呼ばれる2つの異性体の混合物であるラセミ化合物である。さらなる研究により、1967年の発表では、左旋性鏡像異性体(l体)がより強力なMAO阻害剤であり、その後の研究で、単一の鏡像異性体L-デプレニルを用いて行われたことが判明した[40] :67 [42] [43]。
1971年、ノールは、セレギリンが選択的にモノアミンオキシダーゼ(MAO-B)を阻害し、非選択的MAO阻害剤が起こす悪名高い「チーズ効果(cheese effect)」(チラミン含有食品が引き起こす高血圧危機; hypertensive crisis)を生じにくいことを示した。 数年後、ウィーンに拠点を置く2人のパーキンソン病研究者、Peter RiedererとWalther Birkmayerは、セレギリンがパーキンソン病に有用である可能性があることを認識した。彼らの同僚の一人、Moussa B.H. Youdimがブダペストのノールを訪れ、セレギリンをウィーンに持ち帰った。1975年、Birkmayerのグループはパーキンソン病におけるセレギリンの効果に関する最初の論文を発表した[43] [44]。
1970年代には、それが抗老化薬または媚薬として有用であるかもしれないという推測もあった[45]。
ニュージャージー州のSomerset Pharmaceuticalsは、米国でセレギリンを開発する権利を取得しており、1987年、FDAに新薬申請(new drug application; NDA)を提出し、米国でパーキンソン病薬販売申請をした[46]。NDAの審査中、Somersetは2つのジェネリック医薬品会社、マイランとBolan Pharmaceuticalsによって吸収合併された。セレギリンは、1989年にFDAによってパーキンソン病の承認を受けた。
1990年代、ハーバードメディカルスクールの関連であるマクリーン病院(McLean Hospital)のJ. Alexander Bodkinは、MAO阻害剤の既知の食事制限を回避するために、Somersetと共同で経皮パッチを用いたセレギリンの送達を開発した[45] [47] [48]。Somersetは、2006年にパッチ販売のFDA承認を取得した [49]。
社会と文化[編集]
E for Ecstasy (英国で、ストリートドラッグエクスタシーの使用を検討している本)で、作家、活動家、エクスタシーの擁護者であるニコラス・サンダーズ(Nicholas Saunders)は、特定の薬物の混在物(consignment)としてセレギリンが含まれていることを示す試験結果を強調した[50]。「ストロベリー(Strawberry)」「シッティングダック(Sitting Duck)」として知られるエクスタシー錠の混在物として、サンダースが著すところによると、「 ケタミン 、エフェドリン 、セレギリンの潜在的に危険な組み合わせ」が含まれていた[51]。
米国の小説家グレッグ・ハーウィッツ(Gregg Hurwitz)の作品「Out of the Dark」[52]で、セレギリン(Emsam)とチラミン含有食品は、米国大統領を暗殺するために使用された。
獣医の使用[編集]
獣医学では、セレギリンはAnipryl(Zoetis社)のブランド名で販売されている。イヌの認知機能障害の治療に用いられ、より高用量では、下垂体依存性副腎皮質機能亢進症(PDH)にも用いられる[53] [54]。イヌの認知機能障害は、ヒトのアルツハイマー病様の認知症の一種。セレギリン治療を受けた老犬は、睡眠パターンの改善、失禁の減少、活動レベルの増加を示し、ほとんどが1か月で改善を示す[55] [56]。セレギリンにはイヌ用としてのみ表示されているが、認知機能障害のある老猫にも適応外使用されてきた [57]。
下垂体依存性副腎皮質機能亢進症の治療におけるセレギリンの有効性には、議論がある[53]。理論的には、ドーパミンのレベルを上げることで作用し、 ACTHの放出を抑制し 、最終的にコルチゾールのレベルを低下させる[57]。一方、セレギリンは下垂体前葉(ほとんどのイヌのケースを含む)の病変によって引き起こされるPDHの治療にのみ有効であると主張する人もいる[58]。改善の最大の兆候は腹部膨満の減少である[55]。
イヌでは副作用は一般的ではないが、嘔吐、下痢、聴力の低下、 唾液分泌 、体重の減少、行動過多、無気力、 見当識障害 、反復運動などの行動の変化が含まれる[54] [58]。
セレギリンはウマには臨床効果がないと考えられている[58]。
脚注[編集]
- ^ a b c d e f “Selegiline”. Drugs.com. 2016年2月7日閲覧。
- ^ a b c d e Selegiline oral label. Updated December 31, 2008
- ^ “Clinical applications of MAO-inhibitors”. Current Medicinal Chemistry 11 (15): 2033–43. (August 2004). doi:10.2174/0929867043364775. PMID 15279566.
- ^ a b c “Selegiline Hydrochloride Monograph for Professionals”. Drugs.com. 2018年2月23日閲覧。
- ^ “Monoamine oxidase type B inhibitors in early Parkinson's disease: meta-analysis of 17 randomised trials involving 3525 patients”. BMJ 329 (7466): 593. (September 2004). doi:10.1136/bmj.38184.606169.AE. PMC 516655. PMID 15310558.
- ^ “Selegiline's neuroprotective capacity revisited”. Journal of Neural Transmission 110 (11): 1273–8. (November 2003). doi:10.1007/s00702-003-0083-x. PMID 14628191.
- ^ a b c d e f g Emsam label Last revised Sept 2014. Index page at FDA
- ^ a b c “Placing transdermal selegiline for major depressive disorder into clinical context: number needed to treat, number needed to harm, and likelihood to be helped or harmed”. Journal of Affective Disorders 151 (2): 409–17. (November 2013). doi:10.1016/j.jad.2013.06.027. PMID 23890583.
- ^ Mohammadi MR, Ghanizadeh A, Alaghband-Rad J, Tehranidoost M, Mesgarpour B, Soori H (2004). “Selegiline in comparison with methylphenidate in attention deficit hyperactivity disorder children and adolescents in a double-blind, randomized clinical trial.”. J Child Adolesc Psychopharmacol 14 (3): 418–25. doi:10.1089/cap.2004.14.418. PMID 15650498.
- ^ Akhondzadeh S, Tavakolian R, Davari-Ashtiani R, Arabgol F, Amini H (2003). “Selegiline in the treatment of attention deficit hyperactivity disorder in children: a double blind and randomized trial.”. Prog Neuropsychopharmacol Biol Psychiatry 27 (5): 841–5. doi:10.1016/S0278-5846(03)00117-9. PMID 12921918.
- ^ Rubinstein S, Malone MA, Roberts W, Logan WJ (2006). “Placebo-controlled study examining effects of selegiline in children with attention-deficit/hyperactivity disorder.”. J Child Adolesc Psychopharmacol 16 (4): 404–15. doi:10.1089/cap.2006.16.404. PMID 16958566.
- ^ Mohammadi, M; Akhondzadeh, S; Fadai, F; Mohammadi, MR (2009). “Selegiline in Comparison with Methylphenidate in Treatment of Adults with Attention Deficit Hyperactivity Disorder: A Double-blind, Randomized Trial”. Iran J Psychiatry 4.
- ^ Wood, DR; Reinherr, FW; Wender, PH (1983). “The use of L-deprenyl in the treatment of attention deficit disorder, residual type (ADD, RT)”. Psychopharmacol Bull 19: 627–629.
- ^ a b “Deprenyl (selegiline), a selective MAO-B inhibitor with active metabolites; effects on locomotor activity, dopaminergic neurotransmission and firing rate of nigral dopamine neurons”. The Journal of Pharmacology and Experimental Therapeutics 259 (2): 841–7. (November 1991). PMID 1658311.
- ^ a b Lemke, Thomas L.; Williams, David A, eds (2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. p. 434. ISBN 978-1609133450
- ^ “Expanding the black box - depression, antidepressants, and the risk of suicide”. The New England Journal of Medicine 356 (23): 2343–6. (June 2007). doi:10.1056/NEJMp078015. PMID 17485726.
- ^ a b “Safety of selegiline (deprenyl) in the treatment of Parkinson's disease”. Drug Safety 19 (1): 11–22. (July 1998). doi:10.2165/00002018-199819010-00002. PMID 9673855.
- ^ Csoti, Ilona; Storch, Alexander; Müller, Walter; Jost, Wolfgang H. (December 1, 2012). “Drug interactions with selegiline versus rasagiline”. Basal Ganglia 2 (4, Supplement): S27–S31. doi:10.1016/j.baga.2012.06.003. ISSN 2210-5336.
- ^ “Monoamine oxidase inhibitors, opioid analgesics and serotonin toxicity”. British Journal of Anaesthesia 95 (4): 434–41. (October 2005). doi:10.1093/bja/aei210. PMID 16051647.
- ^ “Dose linearity study of selegiline pharmacokinetics after oral administration: evidence for strong drug interaction with female sex steroids”. British Journal of Clinical Pharmacology 47 (3): 249–54. (March 1999). doi:10.1046/j.1365-2125.1999.00891.x. PMC 2014223. PMID 10215747.
- ^ “The selegiline transdermal system (emsam): a therapeutic option for the treatment of major depressive disorder”. P & T 33 (4): 212–46. (April 2008). PMC 2730099. PMID 19750165.
- ^ a b Factor, Steward A.; Weiner, William (2007). Parkinson's Disease: Diagnosis & Clinical Management (2nd ed.). Demos Medical Publishing. pp. 503, 505. ISBN 978-1-934559-87-1
- ^ a b Katzung, Bertram G. (2004). Basic and Clinical Pharmacology (9th ed.). Lange Medical Books/McGraw Hill. pp. 453. ISBN 978-0-07-141092-2
- ^ “Selegiline is a mechanism-based inactivator of CYP2A6 inhibiting nicotine metabolism in humans and mice”. The Journal of Pharmacology and Experimental Therapeutics 324 (3): 992–9. (March 2008). doi:10.1124/jpet.107.133900. PMID 18065502.
- ^ Itzhak, Yossef (1994). Sigma Receptors. Academic Press. pp. 84. ISBN 978-0-12-376350-1
- ^ Acetylcholine, Sigma Receptors, CCK and Eicosanoids, Neurotoxins. Taylor & Francis. (1993). pp. 124. ISBN 978-0-7484-0063-8
- ^ “Absorption and presystemic metabolism of selegiline hydrochloride at different regions in the gastrointestinal tract in healthy males”. Pharmaceutical Research 13 (10): 1535–40. (October 1996). doi:10.1023/A:1016035730754. PMID 8899847.
- ^ “A new formulation of selegiline: improved bioavailability and selectivity for MAO-B inhibition”. Journal of Neural Transmission 110 (11): 1241–55. (November 2003). doi:10.1007/s00702-003-0036-4. PMID 14628189.
- ^ “Selegiline metabolism and cytochrome P450 enzymes: in vitro study in human liver microsomes”. Pharmacology & Toxicology 86 (5): 215–21. (May 2000). doi:10.1034/j.1600-0773.2000.pto860504.x. PMID 10862503.
- ^ “Methamphetamine and amphetamine derived from the metabolism of selegiline”. Journal of Forensic Sciences 40 (6): 1100–2. (November 1995). doi:10.1520/JFS13885J. PMID 8522918.
- ^ “Contrasting neuroprotective and neurotoxic actions of respective metabolites of anti-Parkinson drugs rasagiline and selegiline”. Neuroscience Letters 355 (3): 169–72. (January 2004). doi:10.1016/j.neulet.2003.10.067. PMID 14732458.
- ^ “Are metabolites of l-deprenyl (selegiline) useful or harmful? Indications from preclinical research”. Journal of Neural Transmission. Supplementum 48: 61–73. (January 1, 1996). doi:10.1007/978-3-7091-7494-4_6. ISBN 978-3-211-82891-5. PMID 8988462.
- ^ “Clinical pharmacology of rasagiline: a novel, second-generation propargylamine for the treatment of Parkinson disease”. Journal of Clinical Pharmacology 45 (8): 878–94. (August 2005). doi:10.1177/0091270005277935. PMID 16027398.
- ^ Miklya (2014年3月13日). “The History of Selegiline/(-)-Deprenyl the First Selective Inhibitor of B-Type Monoamine Oxidase and The First Synthetic Catecholaminergic Activity Enhancer Substance” (英語). International Network for the History of Neuropsychopharmacology. 2016年1月7日閲覧。
- ^ J. Knoll, E. Sanfai, DE 1568277 (1966).
- ^ J. Hermann Nee Voeroes, Z. Ecsery, G. Sabo, L. Arvai, L. Nagi, O. Orban, E. Sanfai, アメリカ合衆国特許第 4,564,706号 (1986)
- ^ B. Brunova, M. Ferenc, EP 344675 (1989)
- ^ “2-Methyl-3-butyn-2-ol as an acetylene precursor in the Mannich reaction. A new synthesis of suicide inactivators of monoamine oxidase”. The Journal of Organic Chemistry 42 (15): 2637–7. (July 1977). doi:10.1021/jo00435a026. PMID 874623.
- ^ “Sanofi Extends Holding in Chinoin”. The Pharma Letter (1993年9月19日). 2020年3月31日閲覧。
- ^ a b Magyar, Kálmán (2011). “The pharmacology of selegiline”. In Youdim, Moussa. Monoamine Oxidases and Their Inhibitors. International Review of Neurobiology. 100. Academic Press. ISBN 978-0-12-386468-0
- ^ “Phenylisopropylmethylpropinylamine (E-250), a new spectrum psychic energizer”. Archives Internationales de Pharmacodynamie et de Therapie 155 (1): 154–64. (May 1965). PMID 4378644.
- ^ “Comparative pharmacological analysis of the optical isomers of phenyl-isopropyl-methyl-propinylamine (E-250)”. Acta Physiologica Academiae Scientiarum Hungaricae 32 (4): 377–87. (1967). PMID 5595908.
- ^ a b Healy, David (2000). “The psychopharmacology of life and death. Interview with Joseph Knoll.”. The Psychopharmacologists, Vol. III: Interviews. London: Arnold. pp. 81–110. ISBN 978-0-340-76110-6
- ^ “The potentiation of the anti akinetic effect after L-dopa treatment by an inhibitor of MAO-B, Deprenil”. Journal of Neural Transmission 36 (3–4): 303–26. (1975). doi:10.1007/BF01253131. PMID 1172524.
- ^ a b Cromie (2002年11月7日). “Bodkin is Patching up Depression”. Harvard University Gazette. 2007年9月8日閲覧。
- ^ Seaman, John T.; Landry, John T. (2011). Mylan: 50 Years of Unconventional Success: Making Quality Medicine Affordable and Accessible. University Press of New England. pp. 50. ISBN 978-1-61168-269-4
- ^ “Selegiline transdermal system: in the treatment of major depressive disorder”. Drugs 67 (2): 257–65; discussion 266–7. (2007). doi:10.2165/00003495-200767020-00006. PMID 17284087.
- ^ Duffy, Mary (2002年12月3日). “Patch Raises New Hope For Beating Depression”. The New York Times. ISSN 0362-4331
- ^ “Emsam: the first year”. Psychiatry 4 (6): 19–21. (June 2007). PMC 2921248. PMID 20711332.
- ^ Saunders, Nicholas; Heron, Liz (1993). E for Ecstasy. London: N. Saunders. ISBN 978-0-9501628-8-1. OCLC 29388575[要ページ番号]
- ^ Saunders. “Test results of 30 samples of Ecstasy bought in British clubs between 11/94 and 7/95”. 2020年3月31日閲覧。
- ^ Hurwitz, Gregg (2019). Out of the dark. p. 431. ISBN 9780718185480
- ^ a b “Selegiline Treatment of Canine Pituitary-Dependent Hyperadrenocorticism”. Australian Veterinary Journal (2004年). 2010年11月29日時点のオリジナルよりアーカイブ。2011年4月8日閲覧。 (PDF)
- ^ a b Eghianruwa, Kingsley (2014). Essential Drug Data for Rational Therapy in Veterinary Practice. AuthorHouse. pp. 127–128. ISBN 978-1-4918-0010-2
- ^ a b “Anipryl Tablets for Animal Use”. Drugs.com. 2017年8月31日閲覧。
- ^ Lundgren. “Canine Cognitive Dysfunction”. Veterinary Partner. 2011年4月8日閲覧。
- ^ a b Riviere, Jim E.; Papich, Mark G. (2013). Veterinary Pharmacology and Therapeutics. John Wiley & Sons. pp. 530. ISBN 978-1-118-68590-7
- ^ a b c Papich, Mark G. (2015). Saunders Handbook of Veterinary Drugs: Small and Large Animal. Elsevier Health Sciences. p. 722. ISBN 978-0-323-24485-5
