シュウ酸塩

シュウ酸イオン(しゅうさんイオン、英語:oxalate ion、IUPAC名:エタン二酸イオン ethanedioate ion)は化学式が C2O42−または (COO)22− で表される2価陰イオンである。シュウ酸分子からプロトンが2個脱離することで生成する。シュウ酸イオンを含む塩をシュウ酸塩(しゅうさんえん、oxalate salt)という。シュウ酸ナトリウム(Na2C2O4)は、よく知られた水溶性のシュウ酸塩である。それに対して、シュウ酸ジフェニル((C6H5)2C2O4)などのシュウ酸のエステルはシュウ酸塩ではない。シュウ酸イオンは錯体を作ることもできる。配位子としての名称はオキサラト(oxalato)、略号はoxである。
尿路結石の原因となるシュウ酸カルシウムを始め、シュウ酸イオンは多くの金属イオンと不溶性のシュウ酸塩を作る。
構造[編集]
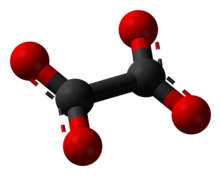
シュウ酸イオンの構造としては、図に示した平面型と、O–C–C–O の二面角が90°であるねじれ型の2つが考えられる。シュウ酸塩の結晶中ではたいていの場合、平面分子のD2hに近い分子対称性を持っていることが、X線結晶構造解析によって示されている[1]。特に、M2C2O4 (M = Li, Na, K) の無水物の結晶では、シュウ酸イオンは正確にD2hの平面配座をとる[2][3]。しかし、これらのシュウ酸塩を水に溶かして水溶液にすると、水中に放出されたシュウ酸イオンはねじれ形配座に変化することが、振動分光法の結果から示唆されている[1]。また、セシウム塩無水物(Cs2C2O4)では、結晶中でも O–C–C–O の二面角が81(1)°になっていることが2003年に明らかにされた[注 1][4]。すなわち、Cs2C2O4 の結晶中では、シュウ酸イオンはねじれ形配座をとり、D2dの構造に近い。興味深いことにルビジウム塩無水物(Rb2C2O4)には多形が存在し、一方はカリウム塩と、他方はセシウム塩と同じ構造である。したがって、多形の一つは平面型の、もう一つはねじれ型のシュウ酸イオンを結晶中に含む。
理論計算によると、シュウ酸イオン(C2O42−)の周りに他のイオンや分子が何もない場合には、ねじれ形配座の方が平面配座よりも安定であり、その差はおよそ2–6 kcal/molと求められている[5][6][7]。この結果は、2つの CO2− は共役していない、という解釈と矛盾なく一致する[1]。もし CO2− が共役していたなら、間の炭素-炭素結合は二重結合性を帯びるので、通常の単結合よりも短くなるはずである。しかし実際には、シュウ酸イオンの炭素-炭素結合は平面配座の場合でも通常より少し長くなる[4]。ねじれ型より平面型が不安定になるのは、酸素原子間の静電反発が平面型で最大になることに起因している。
重要なのは、シュウ酸イオンはシュウ酸第二鉄カリウムなどに見られるように二座のキレート配位子となることである。二座で1個の金属原子に配位した場合は、必ず平面配座をとる。
配位子[編集]
シュウ酸イオンは金属イオンに対してよい配位子となる。2箇所で金属と配位結合し、MO2C2 という五員環を作る。代表的な錯イオンはトリスオキサラト鉄(III)酸イオン([Fe(C2O4)3]3−) である。オキサリプラチンという薬は白金にシュウ酸イオンが配位した錯体である。この薬は白金製剤として良く知られているシスプラチンより水への溶解度が向上し、かつ服用制限の原因となっていた副作用の腎毒性を軽減した。シュウ酸やシュウ酸イオンは過マンガン酸イオンによって酸化される。この酸化還元反応の鍵となる反応中間体は、シュウ酸イオンが3価のマンガンイオンに配位した錯イオン([Mn(C2O4)]+)である[8][9]。シュウ酸は3価の鉄イオン(Fe3+)と水に可溶な錯イオンを作るので、サビ取りに利用されている。
シュウ酸との関係[編集]
水溶液中でのシュウ酸の存在形態は、水溶液のpHにより変化する。どのように変化するかは、以下で述べるように、シュウ酸の酸解離定数から分かる。
他の多塩基酸と同様、シュウ酸のプロトンも1個ずつ段階的に脱離していく。シュウ酸分子(H2C2O4)からプロトンが1個脱離すると、1価の陰イオンであるシュウ酸水素イオン(HC2O4−)が生成する。1段目のプロトン脱離反応の平衡定数 (Ka)は9.1 × 10-2 (pKa = 1.04) である[10]。この比較的大きな酸解離定数は、かなり低いpHからシュウ酸水素イオンが生成することを意味する。シュウ酸水素イオンとシュウ酸分子の存在比は pH = 1.04 で 1 : 1 であり、pHの上昇とともにシュウ酸分子の存在比は減少する。シュウ酸水素イオンからさらにプロトンが1個脱離すると、2価の陰イオンであるシュウ酸イオン(C2O42−)が生成する。2段目のプロトン脱離反応の平衡定数は1.51 × 10-4 (pKa = 3.82) である[10]。シュウ酸イオンとシュウ酸水素イオンの存在比は pH = 3.82 で 1 : 1 に達し、このpHでシュウ酸分子はほとんど存在しない。よりpHの高い中性あるいはアルカリ性の水溶液では、シュウ酸水素イオンもなくなって、ほぼ全てシュウ酸イオンとして存在する。
シュウ酸の定量分析では、H2C2O4 と HC2O4− と C2O42− のモル濃度の合計を「シュウ酸」(oxalic acid)の分析濃度と呼ぶ。個々のモル濃度は平衡濃度と呼ばれ、それぞれ記号 [H2C2O4], [HC2O4−], [C2O42−] で表される[11]。
シュウ酸水素イオンはシュウ酸の共役塩基であり、シュウ酸イオンの共役酸でもある。シュウ酸水素イオンを陰イオンとして含む塩は酸性塩であり、シュウ酸水素塩と呼ばれる。また、酸性シュウ酸塩、重シュウ酸塩などと呼ばれることもある。重シュウ酸イオン(bioxalate ion)はシュウ酸水素イオンの古い別名である。
天然における存在[編集]
シュウ酸塩は炭水化物の不完全酸化によって合成され、植物中に大量に存在する。
シュウ酸塩が豊富な植物には、シロザ、スイバ、カタバミ属の植物などがある。ルバーブやソバの根や葉もシュウ酸が豊富である[12]。その他のシュウ酸を多く含む食物を、下の表に降順に並べている。 茶葉には他の植物より高濃度でシュウ酸が含まれているが、茶は通常茶葉を熱湯で煎じ出してから作られるため、飲料での濃度は低い。
| シュウ酸塩の多い食べ物[13] | ||
|---|---|---|
| 食物 | 単位量 |
シュウ酸塩 含有量 (mg) |
| テーブルビート(緑、調理済) | 1⁄2杯 | 916 |
| スベリヒユ(葉、調理済) | 1⁄2杯 | 910 |
| ルバーブ(茎、無糖) | 1⁄2杯 | 860 |
| ホウレンソウ(調理済) | 1⁄2杯 | 750 |
| ビート(調理済) | 1⁄2杯 | 675 |
| フダンソウ(スイス産、葉、調理済) | 1⁄2杯 | 660 |
| ルバーブ(缶詰) | 1⁄2杯 | 600 |
| ホウレンソウ(冷凍) | 1⁄2杯 | 600 |
| ビート(漬物) | 1⁄2杯 | 500 |
| ヨウシュヤマゴボウ(緑、調理済) | 1⁄2杯 | 476 |
| エンダイブ(生) | 長い葉20枚 | 273 |
| ココアパウダー(乾燥) | 1⁄3杯 | 254 |
| タンポポ(緑、調理済) | 1⁄2杯 | 246 |
| オクラ(調理済) | 8–9ポンド | 146 |
| サツマイモ(調理済) | 1⁄2杯 | 141 |
| ケール(調理済) | 1⁄2杯 | 125 |
| ピーナッツ(生) | 1⁄3杯 (1+3⁄4 オンス) | 113 |
| カブ(緑、調理済) | 1⁄2杯 | 110 |
| チョコレート(甘くしていないもの) | 1オンス | 91 |
| パースニップ(角切り、調理済) | 1⁄2杯 | 81 |
| コラールグリーン(調理済) | 1⁄2杯 | 74 |
| ペカン(ハーブ、生) | 1⁄3杯(1+1⁄4オンズ) | 74 |
| 茶 (煎じ出し4分間) | お湯7fl oz(約200mL)にティースプーン(小さじ)1杯 | 72 |
| 穀物胚芽(トーストしたもの) | 1⁄4杯 | 67 |
| グーズベリー | 1⁄2杯 | 66 |
| ジャガイモ(アイダホ産、白、焼いたもの) | 中1個 | 64 |
| ニンジン(調理済) | 1⁄2杯 | 45 |
| リンゴ(生、皮ごと) | 中1個 | 41 |
| メキャベツ(調理済) | 中6–8個 | 37 |
| イチゴ(生) | 1⁄2杯 | 35 |
| セロリ(生) | 2本 | 34 |
| ミルクチョコレートバー | 1本(1.02 オンス:約30g) | 34 |
| ラズベリー(黒、生) | 1⁄2杯 | 33 |
| オレンジ(可食部) | 中1個 | 24 |
| サヤインゲン(調理済) | 1⁄2杯 | 23 |
| チャイブ(生、切ったもの) | テーブルスプーン(大さじ)1杯 | 19 |
| リーキ(生) | 1⁄2杯 | 15 |
| ブラックベリー(生) | 1⁄2杯 | 13 |
| コンコード | 1⁄2杯 | 13 |
| ブルーベリー(生) | 1⁄2杯 | 11 |
| フサスグリ | 1⁄2杯 | 11 |
| アンズ、生 | 中2個 | 10 |
| ラズベリー(赤色、生) | 1⁄2杯 | 10 |
| ブロッコリー(調理済) | 大1株 | 6 |
| クランベリージュース | コップ1⁄2杯(4オンス) | 6 |
身体への作用[編集]

体内では、シュウ酸イオンはカルシウムイオン(Ca2+)や鉄(II)イオン(Fe2+)などの2価の陽イオンと結合してそれらのシュウ酸塩を作り、尿から小さな結晶として排出される。この結晶が大きくなると尿路結石となり、やがてはネフロンを塞ぐこととなる。結石は約80%がシュウ酸カルシウム由来であるとされる[14]。体内のシュウ酸を減らす食べ物が近年注目を集めている[15]。
痛風の人やそのリスクが高い人は[16]、シュウ酸が多い食べ物を避けるべきとされている[17]。
カドミウムはビタミンCをシュウ酸に変換する触媒となる。これは食事や仕事、喫煙などでカドミウムへの曝露が多い人々の間で問題となっている。
ラットにカルシウムのサプリメントとシュウ酸の多い食事を与えると、腸内でシュウ酸カルシウムが生成し、体内への吸収が97%のラットで抑えられたという研究結果が出ている[18][19]。
粉末状のシュウ酸塩は養蜂でミツバチヘギイタダニから蜂を守るための殺虫剤として用いられる。
予備的な証拠から体内の微生物をうまく調整することでシュウ酸の体外への排出量を増やすことができることが示されている[21]。
シュウ酸過多による病気[編集]
シュウ酸を摂りすぎたことによる症状を蓚酸症(hyperoxalemia)といい、特に尿中に多量のシュウ酸が含まれている状態を高シュウ酸尿症という。
後天性[編集]
一般的なものではないが、シュウ酸の過剰摂取(例えば、家畜がBassia hyssopifoliaなどのシュウ酸の多い植物を食べたり、ヒトが紅茶やカタバミといった特にシュウ酸の多いものを摂取した場合)によってシュウ酸の毒性により尿路結石ができたり、最悪の場合死亡したりすることもある。ニューイングランド・ジャーナル・オブ・メディシンには"ほぼ確実にアイスティーの飲み過ぎによって"深刻な腎臓病(英語版)になった56歳の男性の症例が報告されている。彼は"毎日8オンスグラス16杯" (およそ3+3⁄4リットル)もの紅茶を飲んでいたとされる。この論文の著者は深刻な腎臓病は腎不全の過小診断の原因となり、尿蛋白や尿円柱中の大量のシュウ酸カルシウムによらない不可解な腎不全であるおそれがあるので、患者の食事歴を徹底的に調べることを提案した[22]。腸内細菌のうちOxalobacter formigenesなどのシュウ酸分解菌はこれらの症状を緩和してくれる[23]。
先天性[編集]
原発性高シュウ酸尿症は遺伝性の珍しい病気であるが、シュウ酸の排出が増え、シュウ酸結石を持つ可能性が高くなる病気である。
関連項目[編集]
脚注[編集]
注釈[編集]
- ^ 81(1)°と表記した場合、(1)は測定値81°に対し1°の不確かさを含むことを示している。
出典[編集]
- ^ a b c Dean, Philip A. W. (2012). “The Oxalate Dianion, C2O2−
4: Planar or Nonplanar?”. Journal of Chemical Education 89 (3): 417–418. Bibcode: 2012JChEd..89..417D. doi:10.1021/ed200202r. - ^ Reed, D. A.; Olmstead, M. M. (1981). “Sodium oxalate structure refinement”. Acta Crystallographica Section B 37 (4): 938–939. doi:10.1107/S0567740881004676.
- ^ Beagley, B.; Small, R. W. H. (1964). “The structure of lithium oxalate”. Acta Crystallographica 17 (6): 783–788. doi:10.1107/S0365110X64002079.
- ^ a b Dinnebier, Robert E.; Vensky, Sascha; Panthöfer, Martin; Jansen, Martin (2003). “Crystal and Molecular Structures of Alkali Oxalates: First Proof of a Staggered Oxalate Anion in the Solid State”. Inorganic Chemistry 42 (5): 1499–507. doi:10.1021/ic0205536. PMID 12611516.
- ^ Clark, Timothy; Schleyer, Paul von Ragué (1981). “Conformational preferences of 34 valence electron A2X4 molecules: Anab initio Study of B2F4, B2Cl4, N2O4, and C2O2−
4”. Journal of Computational Chemistry 2: 20–29. doi:10.1002/jcc.540020106. - ^ Dewar, Michael J.S.; Zheng, Ya-Jun (1990). “Structure of the oxalate ion”. Journal of Molecular Structure: THEOCHEM 209: 157–162. doi:10.1016/0166-1280(90)85053-P.
- ^ Herbert, John M.; Ortiz, J. V. (2000). “Ab Initio Investigation of Electron Detachment in Dicarboxylate Dianions”. The Journal of Physical Chemistry A 104 (50): 11786–11795. Bibcode: 2000JPCA..10411786H. doi:10.1021/jp002657c.
- ^ 内田真、吉野諭吉「微量金属の触媒作用」『化学教育』第21巻第4号、日本化学会、1973年、273-277頁、doi:10.20665/kagakukyouiku.21.4_273。
- ^ 早川久雄「高校化学指導上の問題点 : 現場の先生方の指摘に答える(<特集>新しい高校学習指導要領に加えられた化学の諸概念)」『化学教育』第19巻第3号、日本化学会、1971年、244-251頁、doi:10.20665/kagakukyouiku.19.3_244。
- ^ a b 25℃でイオン強度が0.10のときの値。「11.3 有機酸・塩基の酸解離定数」『化学便覧 基礎編』 II、日本化学会 編(改訂5版)、丸善出版、2014年、340頁。ISBN 978-4621073414。
- ^ Christian, Gary D.『分析化学』 I.基礎編、原口紘炁 監訳(原書6版)、丸善、2005年、166頁。ISBN 9784621075548。
- ^ Streitweiser, Andrew, Jr.; Heathcock, Clayton H. (1976). Introduction to Organic Chemistry. Macmillan. p. 737
- ^ Resnick, Martin I.; Pak, Charles Y. C. (1990). Urolithiasis, A Medical and Surgical Reference. W.B. Saunders Company. pp. 158. ISBN 0-7216-2439-1
- ^ Coe; Evan; Worcester (2005). “Kidney stone disease”. The Journal of Clinical Investigation 115 (10): 2598–608. doi:10.1172/JCI26662. PMC 1236703. PMID 16200192.
- ^ Betsche, T.; Fretzdorff, B. (2005). “Biodegradation of oxalic acid from spinach using cereal radicles”. Journal of Agricultural and Food Chemistry 53 (25): 9751–8. doi:10.1021/jf051091s. PMID 16332126.
- ^ “UMMC Condition Guide: Gout”. 2016年6月24日閲覧。
- ^ “UPMC Article, Low Oxalate Diet”. 2016年6月24日閲覧。
- ^ Morozumi, Makoto; Hossain, Rayhan Zubair; Yamakawa, Ken'ichi; Hokama, Sanehiro; Nishijima, Saori; Oshiro, Yoshinori; Uchida, Atsushi; Sugaya, Kimio et al. (2006). “Gastrointestinal oxalic acid absorption in calcium-treated rats”. Urological research 34 (3): 168–72. doi:10.1007/s00240-006-0035-7. PMID 16705467.
- ^ Hossain, R. Z.; Ogawa, Y.; Morozumi, M.; Hokama, S.; Sugaya, K. (2003). “Milk and calcium prevent gastrointestinal absorption and urinary excretion of oxalate in rats”. Frontiers in Bioscience 8 (1–3): a117–25. doi:10.2741/1083. PMID 12700095.
- ^ Pabuççuoğlu, Uğur (2005). “Aspects of oxalosis associated with aspergillosis in pathology specimens”. Pathology – Research and Practice 201 (5): 363–8. doi:10.1016/j.prp.2005.03.005. PMID 16047945.
- ^ Lieske, J. C.; Goldfarb, D. S.; De Simone, C.; Regnier, C. (2005). “Use of a probiotic to decrease enteric hyperoxaluria”. Kidney International 68 (3): 1244–9. doi:10.1111/j.1523-1755.2005.00520.x. PMID 16105057.
- ^ Syed, Fahd; Mena Gutiérrez, Alejandra; Ghaffar, Umbar (2 April 2015). “A Case of Iced-Tea Nephropathy”. ニューイングランド・ジャーナル・オブ・メディシン 372 (14): 1377–1378. doi:10.1056/NEJMc1414481. PMID 25830441.
- ^ Siener, R.; Bangen, U.; Sidhu, H.; Hönow, R.; von Unruh, G.; Hesse, A. (2013). “The role of Oxalobacter formigenes colonization in calcium oxalate stone disease”. Kidney International 83 (June): 1144–9. doi:10.1038/ki.2013.104. PMID 23536130.
