エスシタロプラム
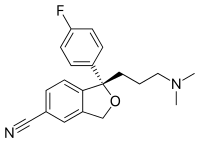 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| 臨床データ | |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 投与経路 | 経口投与 |
| 薬物動態データ | |
| 生物学的利用能 | 80% |
| 血漿タンパク結合 | ~56% |
| 代謝 | CYP2C19 CYP3A4 CYP2D6 |
| 半減期 | 24.6~55.8時間 (20mg, β相, 単回) |
| 排泄 | 尿中: 35.1% |
| 識別 | |
| CAS番号 | 128196-01-0 (塩基) |
| ATCコード | N06AB10 (WHO) (塩基) |
| PubChem | CID: 146570 |
| DrugBank | DB01175 |
| ChemSpider | 129277 |
| KEGG | D07913 |
| 化学的データ | |
| 化学式 | C20H21FN2O |
| 分子量 | 324.3919g/mol(塩基)[2] |
| |
エスシタロプラム (Escitalopram) とは、選択的セロトニン再取り込み阻害薬 (SSRI) と呼ばれる抗うつ薬の一つである。レクサプロの商品名で販売されている。日本では2011年4月より販売されている。
エスシタロプラムは、アメリカ合衆国では90年代からあるSSRIのシタロプラムの光学異性体のうちのS体である。
開発と販売[編集]
デンマークのルンドベック社により合成・開発され、2001年にスウェーデンで承認された。
エスシタロプラムシュウ酸塩として、レクサプロ (Lexapro) の商標で発売されている。日本では2011年4月にレクサプロとして製造承認され、製造販売:持田製薬、プロモーション提携:田辺三菱製薬[注釈 1]として2011年8月より販売されている。2022年には、後発医薬品も発売開始している。
2010年10月現在には世界96ヶ国で使用されており、2010年8月現在で投与された患者数は2億3千万人以上にも上る。
適応[編集]
特徴[編集]

光学分割されたS-シタロプラム(エスシタロプラム)は既存のSSRIのなかで、最も選択的なセロトニン再取り込み阻害作用を有しており、ノルアドレナリンの1,190倍、ドパミンの19,000倍のセロトニン再取り込み阻害作用がin vitroで確認されている。
他にも薬剤開発後に光学分離された薬剤としてオフロキサシンやレボフロキサシン、セチリジン、レボセチリジンなどがあげられる。反対にR-シタロプラムは、エスシタロプラムのセロトニン再取り込み阻害作用を競合的に阻害し、その作用を減弱させる。
他にR-シタロプラムは、ヒスタミンH1受容体阻害作用やCYP2D6阻害作用を有している。そのため、ヒスタミンH1受容体を介した傾眠や鎮静、CYP2D6阻害作用による薬物相互作用のような副作用が発現する可能性がある。
有効性[編集]
日本うつ病学会のうつ病の診療ガイドラインは、有効性に関する様々な報告を併せて解釈すると、有効性と忍容性において、SSRI、SNRI、ミルタザピンを含む新しい抗うつ薬に優劣はつけられないとしている[3]。
以下は個々の研究である。
うつ病患者を対象とした各種SSRIの試験をメタアナリシスしたMANGA Studyにおける2009年の報告では、セルトラリンと共に最も有効性、忍容性が高いSSRIとして評価されているが、研究者はセルトラリンを推奨しているという報告がある[4]。
4つの二重盲検試験をプール解析した報告は、SNRIのベンラファキシンやデュロキセチンと同程度の有効性であるが、重篤な場合に忍容性が良いことを報告した[5]。コクラン共同計画によるレビューは、治療開始から2週間後の有効性と忍容性において、シタロプラムおよびフルオキセチン、デュロキセチンとの違いを検出している[6]。
エスシタロプラムは、C型肝炎治療におけるインターフェロン-αに伴う副作用である抑うつを予防するうえで有効と報告された[7]。
代謝[編集]
エスシタロプラムはCYP2C19、CYP2D6、CYP3A4で代謝され、N-脱メチル化が主要代謝経路である。
一次代謝物としてS-demethyl体 (S-DCT) 、二次代謝物にはCYP2D6のみが関与してS-didemethyl体 (S-DDCT) が産生される。
白人の20人に1人がCYP2D6を、日本人の5人に1人がCYP2C19遺伝子を欠損、あるいは低活性であるとの報告がある。そのため、日本の第I相試験では代謝などの薬物動態を考慮して、被験者をCYP2C19遺伝子型が欠損している群 (PM) と欠損していない群 (EM) に分けて行った。イギリスでもCYP2C19EMの白人のみを対象とした臨床試験が行われたが、薬物動態の推移は日本人と概ね類似していた[8]。しかし、日本人に比べて白人被験者のほうが血中濃度が低かった。これは白人被験者のほうが体重が大きい (体重あたりの投与量が少なくなる) ことに起因する。
単回投与ではCYP2C19PMが同EMに比べ、AUCが2倍以上になったという結果も出ている[1]。
脚注[編集]
注釈[編集]
出典[編集]
- ^ a b 佐藤宏宣、平安良雄「Escitalopram臨床薬物動態試験――単回投与および反復投与試験(日本)」『臨床精神薬理』第14巻第5号、2011年5月。
- ^ “DrugBank: Escitalopram (DB01175)”. 2011年4月27日閲覧。
- ^ 日本うつ病学会 (26 July 2012). 日本うつ病学会治療ガイドライン (pdf) (Report) (2012 Ver.1 ed.). p. 28.
- ^ Cipriani, Andrea; Furukawa, Toshiaki A; Salanti, Georgia; Geddes, John R; Higgins, Julian PT; Churchill, Rachel; Watanabe, Norio; Nakagawa, Atsuo et al. (2009). “Comparative efficacy and acceptability of 12 new-generation antidepressants: a multiple-treatments meta-analysis”. The Lancet 373 (9665): 746–758. doi:10.1016/S0140-6736(09)60046-5. PMID 19185342.
- ^ Kornstein SG, Li D, Mao Y, Larsson S, Andersen HF, Papakostas GI (2009). “Escitalopram versus SNRI antidepressants in the acute treatment of major depressive disorder: integrative analysis of four double-blind, randomized clinical trials”. CNS Spectrums 14 (6): 326–33. PMID 19668123.
- ^ Cipriani, Andrea; Santilli, Claudio; Furukawa, Toshi A; Signoretti, Alessandra; Nakagawa, Atsuo; McGuire, Hugh; Churchill, Rachel; Barbui, Corrado et al. (2009). “Escitalopram versus other antidepressive agents for depression”. The Cochrane Database of Systematic Reviews (2): CD006532. doi:10.1002/14651858.CD006532.pub2. PMC 4164382. PMID 19370639.
- ^ Schaefer M, Sarkar R, Knop V, et al. (2012). “Escitalopram for the Prevention of Peginterferon-α2a–Associated Depression in Hepatitis C Virus–Infected Patients Without Previous Psychiatric Disease”. Annals of Internal Medicine 157 (2): 94. doi:10.7326/0003-4819-157-2-201207170-00006. PMID 22801672.
- ^ 佐藤宏宣、平安良雄「Escitalopram臨床薬物動態試験―単回投与および反復投与試験(英国)」『臨床精神薬理』第14巻第5号、2011年5月。
参考文献[編集]
- Stephen M. Stahl. 精神薬理学エッセンシャルズ 神経科学的基本と応用 第3版. ISBN 978-4-89592-640-9
