テロメラーゼ

テロメラーゼ (英: telomerase) は、真核生物の染色体末端(テロメア)の特異的反復配列を伸長させる酵素。テロメア伸長のテンプレート(鋳型)となるRNA構成要素と逆転写酵素活性を持つ触媒サブユニットおよびその他の制御サブユニットによって構成されている[1][2][3][4][5]。
テロメラーゼ活性が低い細胞は、一般に細胞分裂ごとにテロメアの短縮が進み、やがてヘイフリック限界と呼ばれる細胞分裂の停止が起きる[6][7][8]。テロメラーゼは、ヒトでは生殖細胞・幹細胞・がん細胞などでの活性が認められ、それらの細胞が分裂を継続できる性質に関与している[1]。このことから、活性を抑制することによるがん治療、および活性を高めることによる細胞分裂寿命の延長、その両面から注目を浴びている。
酵素によりテロメアが伸長されることは、1973年にアレクセイ・オロヴニコフ (Alexey Olovnikov) によって最初に予測された[9]。彼はまた細胞老化に関するテロメア仮説およびがんとテロメアの関連について示唆を行った。
1985年にカリフォルニア大学のキャロル・W・グライダーとエリザベス・H・ブラックバーンは、テトラヒメナからこの酵素を単離したことを公表した[10]。グライダーとブラックバーンはジャック・W・ショスタクと共に、テロメアとテロメラーゼに関する一連の研究で[10][11][12]、2009年ノーベル生理学・医学賞を受賞した[13][14]。
概要
[編集]構造と機能
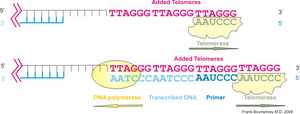
[編集]テロメラーゼはテロメア配列の鋳型となるRNAと逆転写酵素、その他の制御サブユニットからなる複合体である[1]。RNA構成要素はTERC (Telomere RNA Component, TRとも表記) 、逆転写酵素はTERT (Telomere Reverse Transcriptase) と呼ばれる。このRNAの長さはテトラヒメナで159塩基長、ヒトで451塩基長、出芽酵母で約1,300塩基長と様々である。逆転写酵素の活性部位はRNA型トランスポゾンがコードするそれと相同性がある。過剰発現の実験から、テロメラーゼ活性自体はRNAと逆転写酵素の二つの構成因子で十分であることがわかっているが[1]、テロメラーゼは生体内において巨大な複合体 (1MDa以上) を形成しており、正常な機能には他の構成サブユニットも必要である。
ヒトのテロメラーゼは、TERT[2]、TERC[3]、ジスケリン (dyskerin) [4]、TEP1[5]などのサブユニットによって構成されており、それらは異なる染色体上の遺伝子座にコードされている。TERT翻訳産物(タンパク質)は、非翻訳RNAであるTERCと一緒に折りたたまれる。TERTは一本鎖テロメア反復配列を付加できるように染色体の周囲を覆う二股の構造をとる。TERTとテロメアの鋳型を含むTERCは隣接している。ヒトTERCでは鋳型配列領域は 3'-CAAUCCCAAUC-5'であり、これを元にTERTはテロメアの3'側へ塩基を付加する(脊椎動物では6塩基配列5'-TTAGGG-3'(GGTTAG)を付加するが、他の生物では別の配列)[15]。テロメラーゼは、この塩基付加を繰り返し、染色体のテロメアの伸長を行う。
コクヌストモドキ (Tribolium castaneum) TERTのタンパク質構造の詳細な解析が、2008年に行われた[16]。このTERTは4つの保存されたドメイン(TRBD[17], fingers, palm, thumb)を含むタンパク質であり、レトロウイルスの逆転写酵素・ウイルスのRNAポリメラーゼ・バクテリオファージのDNAポリメラーゼ(ファミリーB)と共通の特徴を持つ環状構造をとっている。
テロメアおよびテロメラーゼの分子機構に関する実験には均一な細胞群を用いることが求められるため、主に出芽酵母やテトラヒメナといった単細胞生物、および哺乳類では培養細胞を用いて研究が行われている。テロメラーゼは細胞周期のS期(DNA合成期)にテロメアに誘導されて機能する。出芽酵母の研究では、テロメラーゼは細胞内で最も短いテロメアから優先的に伸長させていくことがわかりつつあり、長すぎるテロメアには抑制的に働く機構が見いだされている。
活性
[編集]テロメラーゼの活性については、生物・組織・細胞の種類によって異なることが知られている。真核単細胞生物は例外なくテロメラーゼ活性を持ち、真核多細胞生物では生殖細胞にはテロメラーゼ活性があるが体細胞での活性はさまざまである[1]。植物においては調べられた殆どの体細胞でテロメラーゼ活性があり、このことが株分けなど栄養生殖でほぼ無限に増殖できる不死性を持つ一因になっていると考えられている。ヒトでは生殖細胞・幹細胞以外での活性がほとんど見られないが、同じ脊椎動物でも魚類・マウス・チンパンジーでは体細胞でのテロメラーゼ活性が観察されている[1]。
ヒトでのテロメラーゼ構成要素の発現をみると、RNA構成要素TERCは体細胞でも発現しており、酵素活性は触媒サブユニットTERTの発現で調節されている[18]。ヒト培養細胞でゲノム中のTERTを強制発現をさせることは困難であるが、人為的に別のプロモーターを付加したTERTを導入することにより細胞の不死化を行うことができる。ヒトのがん組織の多くではテロメラーゼが大量に存在しており、がん細胞の不死化の原因の一つと考えられている[18](一部のがん組織はテロメラーゼ陰性[19])。また、生殖細胞は個体を超えて世代を継続させる一種の不死性を持つが、テロメラーゼが恒常的に発現していることがその一因となっている。
臨床関連
[編集]がん
[編集]ヒトのがん組織の多くではテロメラーゼの活性化がおきており、その観察される割合は肺がんの80%から食道がんの95%に及ぶ[20]。一方、テロメラーゼ活性の制限要因であるTERTの発現が見られない腫瘍も観察されており[21]、それらではALT(Alternative Lengthening of Telomeres)と呼ばれるテロメア長を維持する別の機構が見出されている[19][22]。
ヒトのがん細胞とテロメラーゼとの関係についての説明は以下のようなものである[23]。
- ヘイフリック限界に達した正常細胞は、p53遺伝子やRb遺伝子などのがん抑制遺伝子の働きによって細胞分裂停止が起きる。
- がん抑制遺伝子に突然変異が起きた細胞は、上記の限界を超えて分裂を続け、テロメア短縮もさらに継続する。
- 通常はこれらの異常細胞は、p53経路による細胞死か、染色体の構造異常による細胞死を迎える。この過程の中で、ゲノムの不安定化が起こり、さらにさまざまな変異を誘発することがある。
- 上記の中の一部には、TERTの恒常的発現を獲得する変異細胞があり、それらはテロメラーゼの活性化を通して染色体を安定化させ、腫瘍形成に至る。
このようにテロメラーゼ遺伝子自体ががん化の直接原因ではないが、がん組織の形成増殖にとってテロメラーゼ活性化が必要である場合が多いため、テロメラーゼを標的とした抗がん剤の開発が行われている[19][23]。その例として、ヒトTERC(hTR)を標的とするGRN163/GRN163L(ジェロン社)[24][25]、テロメア短縮を誘導するBIBR1532(ベーリンガーインゲルハイム社)[26]、テロメア構造の安定化に作用するテロメスタチン[27][28]などがある。
個体老化
[編集]遺伝的な要因による早老症として、ヘリカーゼ遺伝子を原因とするウェルナー症候群・ブルーム症候群 (Bloom syndrome) 、DNA修復に関連するキナーゼ遺伝子ATMを原因とする毛細血管拡張性運動失調症、ゲノム損傷修復の関連遺伝子を原因とするナイミーヘン症候群 (Nijmegen breakage syndrome) などが知られている[29]。これら早老症患者の細胞では分裂寿命が短くなりテロメア短縮も早まる事例があるとする報告や[29]、さまざまな早老症がテロメア短縮と関連しているとする報告がある[30]。これら遺伝子群のDNA修復機能とテロメア長の維持との正確な関連は判明しておらず、個体老化(早老症)とテロメア短縮との関連について研究が進められている。
テロメラーゼを利用した療法が、ヒトの老化を回避して寿命を延長させることにも使われると考える医師もいる[31]。しかしながら、テロメラーゼの活性化には、細胞老化防止の可能性[32]と、正常細胞のがん化の一因となり個体寿命の短縮化をもたらす可能性があること[33]の両面が指摘されており、アンチエイジングへの応用についての評価は定まっていない。
他のヒトの疾患
[編集]テロメラーゼおよびその触媒サブユニットTERTは、がん・早老症以外の疾患との関係も調べられている。
TERTと関係すると考えられている疾患としては、再生不良性貧血[34]、猫鳴き症候群 (Cri du chat Syndrome,CdCS) がある。CdCSは、5番染色体短腕(5p)の末端部分の欠損を含んでいる複雑な障害である。TERTは5p領域(染色体上の位置 5p15)にあり、TERTの欠損はCdCSの原因または関与要因として示唆されてきた[35]。
先天性角化異常症 (dyskeratosis congenita, DCまたはDKC) は、テロメラーゼ活性と関連する骨髄の疾患である[36]。症例の35%はX染色体連鎖(伴性遺伝)の劣性遺伝子疾患であり、5%は常染色体性の優性遺伝子疾患、残り60%は原因不明である[37][38]。X連鎖劣性の場合はジスケリン[39](染色体上の位置 Xq28)、常染色体性優性の場合はTERC[40](染色体上の位置 3q26.2)またはTERT[41]の変異が原因となっている。DC患者は、いろいろな他の徴候だけでなく、異常な網状皮膚色素沈着、白板症(口腔粘膜の白い肥厚)と爪の発育異常として現れるひどい骨髄不全を示す。X連鎖または常染色体性どちらのDC患者でも、同じ年齢のほかの人よりも短いテロメアと欠陥のあるテロメラーゼ活性を示す[38][42]。常染色体優性DCの患者家系の一つでは、世代が進むにつれ、テロメア短縮の率の増加および発症する年齢の低下現象(表現促進)、すなわち各々の世代での悪化が見られる例も存在する[43]。
脚注
[編集]- ^ a b c d e f 井出(2006), pp. 1103–4.
- ^ a b Jabion TERT
- ^ a b Jabion TERC
- ^ a b Jabion DKC1
- ^ a b Jabion TEP1
- ^ Hayflick L, Moorhead PS (1961). “The serial cultivation of human diploid cell strains”. Exp Cell Res 25: 585-621. PMID 13905659.
- ^ 東京都老人総合研究所「ヒト胎児肺線維芽細胞(ヘイフリックモデル)」
- ^ GEヘルスケア・ジャパン株式会社「バイオダイレクトメール vol.40 細胞夜話WI細胞〜Hayflick Limit発見の立役者」
- ^ Olovnikov AM (1973). “A theory of marginotomy. The incomplete copying of template margin in enzymic synthesis of polynucleotides and biological significance of the phenomenon”. J Theor Biol. 41 (1): 181-90. PMID 4754905.
- ^ a b Greider CW Blackburn EH (1985). “Identification of a specific telomere terminal transferase activity in Tetrahymena extracts”. Cell 43 (2 Pt 1): 405–13. PMID 3907856.
- ^ Szostak JW, Blackburn EH (1982). “Cloning yeast telomeres on linear plasmid vectors”. Cell 29 (1): 245-55. PMID 6286143.
- ^ Greider CW, Blackburn EH (1989). “A telomeric sequence in the RNA of Tetrahymena telomerase required for telomere repeat synthesis”. Nature 337 (6205): 331-7. PMID 2463488.
- ^ AFPBB News(2009年10月06日フランス通信社発信ニュース)「ノーベル医学賞、寿命をつかさどるテロメアとテロメラーゼ酵素とは?」
- ^ The Nobel Prize in Physiology or Medicine 2009; The Telomere– Function and Synthesis(pdf)
- ^ Gavory G, Farrow M, Balasubramanian S (2002). “Minimum length requirement of the alignment domain of human telomerase RNA to sustain catalytic activity in vitro”. Nucleic Acids Res. 30 (20): 4470-80. PMID 12384594.
- ^ Gillis AJ, Schuller A, Skordalakes E (2008), “Structure of the Tribolium castaneum telomerase catalytic subunit TERT”, Nature 455 (7213): 633–7, PMID 18758444
- ^ Rouda S, Skordalakes E. (2007), “Structure of the RNA-binding domain of telomerase: implications for RNA recognition and binding”, Structure 15 (11): 1403-12, PMID 17997966
- ^ a b 井出(2006), pp. 1105–9.
- ^ a b c 井出(2006), p. 1110.
- ^ 井出(2006), p. 1109.(fig.30).
- ^ Bryan TM, Englezou A, Gupta J, Bacchetti S, Reddel RR. (1995). "Telomere elongation in immortal human cells without detectable telomerase activity." EMBO J. 14(17):4240-8. PMID 7556065
- ^ Henson JD, Neumann AA, Yeager TR, Reddel RR (2002). “Alternative lengthening of telomeres in mammalian cells”. Oncogene 21 (4): 598-610. PMID 11850785.
- ^ a b 清宮(2006), pp. 26–30.
- ^ Asai A, Oshima Y, Yamamoto Y et al. (2003). “A novel telomerase template antagonist (GRN163) as a potential anticancer agent”. Cancer Res 63 (14): 3931-9. PMID 12873987.
- ^ Dikmen ZG, Gellert GC, Jackson S et al. (2005). “In vivo inhibition of lung cancer by GRN163L: a novel human telomerase inhibitor”. Cancer Res 65 (17): 7866-73. PMID 16140956.
- ^ Damm K, Hemmann U, Garin-Chesa P et al. (2001). “A highly selective telomerase inhibitor limiting human cancer cell proliferation”. EMBO J. 20 (24): 6958-68. PMID 11742973.
- ^ Shin-ya K, Wierzba K, Matsuo K et al. (2001). “Telomestatin, a novel telomerase inhibitor from Streptomyces anulatus”. J Am Chem Soc. 123 (6): 1262-3. PMID 11456694.
- ^ Tauchi T, Shin-ya K, Sashida G et al. (2006). “Telomerase inhibition with a novel G-quadruplex-interactive agent, telomestatin: in vitro and in vivo studies in acute leukemia”. Oncogene 25 (42): 5719-25. PMID 16652154.
- ^ a b 井出(2006), p. 1101.
- ^ Blasco MA. "Telomeres and human disease: aging, cancer, and beyond." Nat Rev Genet. 2005 Aug; 6(8):611-22. PMID 16136653
- ^ Fossel M (1998 Jun 3). “Telomerase and the aging cell: implications for human health”. JAMA 279 (21): 1732-5. PMID 9624027.
- ^ Tomás-Loba A, Flores I, Fernández-Marcos PJ, Cayuela ML, Maraver A, Tejera A, Borrás C, Matheu A, Klatt P, Flores JM, Viña J, Serrano M, Blasco MA. "Telomerase reverse transcriptase delays aging in cancer-resistant mice." Cell. 2008 Nov 14;135(4):609-22 PMID 19013273
- ^ de Magalhaes JP, Toussain O. "Telomeres and telomerase: a modern fountain of youth?" Rejuvenation Res. 2004 Summer; 7(2):126-33 PMID 15312299
- ^ Yamaguchi H, Calado RT, Ly H et al. (2005). “Mutations in TERT, the gene for telomerase reverse transcriptase, in aplastic anemia”. New England Journal of Medicine 352 (14): 1413–24. PMID 15814878.
- ^ Zhang A, Zheng C, Hou M et al. (2003). “Deletion of the telomerase reverse transcriptase gene and haploinsufficiency of telomere maintenance in Cri du chat syndrome”. Am J Hum Genet. 72 (4): 940–8. PMID 12629597.
- ^ Yamaguchi(2007), pp. 202–9.
- ^ Yamaguchi(2007), p. 202.
- ^ a b Marrone A, Walne A, Dokal I (2005). “Dyskeratosis congenita: telomerase, telomeres and anticipation”. Curr Opin Genet Dev. 15 (3): 249–57. PMID 15917199.
- ^ Heiss NS, Knight SW, Vulliamy TJ et al. (1998). “X-linked dyskeratosis congenita is caused by mutations in a highly conserved gene with putative nucleolar functions”. Nat Genet. 19 (1): 32-8. PMID 9590285.
- ^ Vulliamy T, Marrone A, Goldman F et al. (2001). “The RNA component of telomerase is mutated in autosomal dominant dyskeratosis congenita”. Nature 413 (6854): 432-5. PMID 11574891.
- ^ Vulliamy TJ, Walne A, Baskaradas A et al. (2005). “Mutations in the reverse transcriptase component of telomerase (TERT) in patients with bone marrow failure”. Blood Cells Mol Dis. 34 (3): 257-63. PMID 15885610.
- ^ Vulliamy TJ, Knight SW, Mason PJ, Dokal I (2001). “Very short telomeres in the peripheral blood of patients with X-linked and autosomal dyskeratosis congenita”. Blood Cells Mol Dis. 27 (2): 353–7. PMID 11259155.
- ^ Armanios M, Chen JL, Chang YP et al. (2005). “Haploinsufficiency of telomerase reverse transcriptase leads to anticipation in autosomal dominant dyskeratosis congenita”. PNAS 102 (44): 15960–4. doi:10.1073/pnas.0508124102. PMID 16247010.
参考文献
[編集]- 井出利憲「細胞増殖のしくみ—細胞周期,癌遺伝子,細胞老化—」(pdf)『薬学雑誌』第126巻第11号、日本薬学会、2006年、1087-1115頁、PMID 17077613、2012年10月29日閲覧。 (総説)
- 清宮啓之 (2006). “テロメア維持機構をターゲットとしたがん治療” (pdf). Drug Delivery System 21 (1): 24-31 2012年10月29日閲覧。.(総説)
- Yamaguchi H (2007). “Mutations of telomerase complex genes linked to bone marrow failures” (PDF). J Nippon Med Sch. 74 (3): 202-9. doi:10.1272/jnms.74.202. PMID 17625368 2012年10月29日閲覧。. (Review article) 日本語抄録「骨髄機能不全にかかわるテロメラーゼ複合体遺伝子の変異」
関連項目
[編集]外部リンク
[編集]- 藤原俊義、田中紀章「テロメラーゼ活性を標的とした悪性腫瘍に対するウイルス療法の開発」(PDF)『ウイルス』第58巻第1号、日本ウイルス学会、2008年、11-18頁、2012年10月29日閲覧。
- Kaszubowska L (2008). “Telomere shortening and ageing of the immune system” (PDF). J Physiol Pharmacol. 59 (Suppl 9): 169-86. PMID 19261979 2012年10月29日閲覧。. (Review article)
- Vulliamy TJ, Marrone A, Knight SW, Walne A, Mason PJ, Dokal I (2006). “Mutations in dyskeratosis congenita: their impact on telomere length and the diversity of clinical presentation”. Blood 107 (7): 2680-5. PMID 16332973 2012年10月29日閲覧。.
- 東京都老人総合研究所. “老化の原因に関する主な仮説”. 2012年10月29日閲覧。
