トロポン
| トロポン[1] | |
|---|---|

|
|
Cyclohepta-2,4,6-trien-1-one | |
| 識別情報 | |
| CAS登録番号 | 539-80-0 |
| PubChem | 10881 |
| ChemSpider | 10419 |
| J-GLOBAL ID | 200907036462650633 |
| |
| |
| 特性 | |
| 化学式 | C7H6O |
| モル質量 | 106.12 g/mol |
| 密度 | 1.094 g/mL |
| 沸点 |
113 °C (15 mmHg) |
| 危険性 | |
| 引火点 | >113 °C |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
トロポン(tropone)または2,4,6-シクロヘプタトリエン-1-オン(2,4,6-cycloheptatrien-1-one)は、非ベンゼノイド芳香族として、有機化学における重要性を持つ有機化合物である[2]。トロポンは3つの共役アルケン基とケト基を持つ7つの炭素原子からなる環で構成される。関連化合物のトロポロン(2-ヒドロキシ-2,4,6-シクロヘプタトリエン-1-オン)はケト基の隣にヒドロキシ基を有する。
トロポン構造は、コルヒチンやスチピタチン酸、ヒノキチオール、プベルル酸といった生体分子において見られる。
トロポンは1951年から知られており、「シクロヘプタトリエニリウムオキシド」とも呼ばれる。トロポロンの名称は1945年に芳香族としての性質と結び付けて、マイケル・J・S・デュワーによって命名された[3]。
性質
[編集]1945年、デュワーはトロポン類が芳香族性を有すると提唱した。カルボニル基は分極し、炭素原子上に部分正電荷、酸素原子上に部分負電荷を有する (A)。炭素原子が完全な正電荷を持つ極端な場合 (B) は、芳香族6電子系であるトロピリウムイオン環 (C) が形成される。
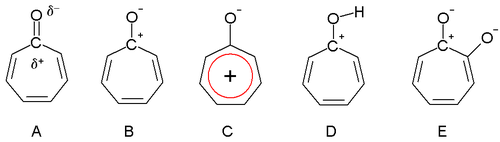
トロポロン (E) は酸性であり、pKaは7(フェノール 〔10〕と安息香酸〔4〕の間)である。フェノールと比較して酸性度が上がったのは、通常の共鳴安定化のためである。トロポン類とそれほどではないにせよトロポロン類は塩基性 (D) も示し、これは芳香族安定化が理由である。この性質は酸と容易に塩を形成することで観察できる。シクロヘプタノンの双極子モーメントがわずか3.04 D(デバイ)なのに対して、トロポンの双極子モーメントは4.17 デバイであり、これも芳香族性の証拠とみることができる。
合成
[編集]トロポン類およびその誘導体の有機合成には膨大な手法が存在する。例えば、シクロヘプタトリエンの二酸化セレン酸化[4]や、トロピノンからホフマン脱離およびブロモ化によって間接的に得る方法である。

反応
[編集]トロポンは高温で水酸化カリウムにより安息香酸へ異性化する。多くの誘導体も対応するアレーン化合物へ異性化する。
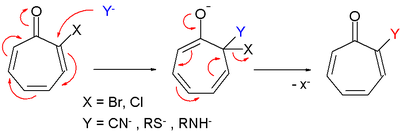
トロポンは臭素などと求電子置換反応を起こすが、反応は1,2-付加生成物を与え、芳香族求電子置換反応ではない。
トロポン誘導体は芳香族求核置換反応と非常に似た求核置換反応をも起こす。
トロポンはジエンであり、マレイン酸無水物とディールス・アルダー反応を起こす。
トロポンは桂皮アルデヒドと [8+3] 環化を起こすことも明らかにされている[5]。
脚注
[編集]- ^ Tropone at Sigma-Aldrich
- ^ Peter L. Pauson (1955). “Tropones and Tropolones”. Chem. Rev. 55 (1): 9 - 136. doi:10.1021/cr50001a002.
- ^ M. J. S. Dewar (1945). “Structure of Stipitatic Acid”. Nature 155 (3924): 50–51. doi:10.1038/155050b0.
- ^ Karl R. Dahnke and Leo A. Paquette (1993). "INVERSE ELECTRON-DEMAND DIELS-ALDER CYCLOADDITION OF A KETENE DITHIOACETAL. COPPER HYDRIDE-PROMOTED REDUCTION OF A CONJUGATED ENONE. 9-DITHIOLANOBICYCLO[3.2.2]NON-6-EN-2-ONE FROM TROPONE". Organic Syntheses (英語). 71: 181. doi:10.15227/orgsyn.071.0181。; Collective Volume, vol. 9, p. 396
- ^ Vijay Nair, Manojkumar Poonoth, Sreekumar Vellalath, Eringathodi Suresh, and Rajasekaran Thirumal (2006). “An N-Heterocyclic Carbene-Catalyzed [8 + 3] Annulation of Tropone and Enals via Homoenolate”. J. Org. Chem. 71 (23): 8964 - 8965. doi:10.1021/jo0615706.