統合失調症の原因
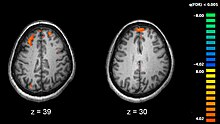
統合失調症の原因(とうごうしっちょうしょうのげんいん)では、統合失調症の発病因子と考えられる仮説・要素について述べる。なお、様々な要素が提言されているが、いずれも仮説の域を出ていない[1]。
遺伝と環境の両方が関係しているが、遺伝要因の影響が大きいと考えられている[2]。脳に器質的な障害が発生することによるかどうかは両論ある。病因については、神経伝達物質の一つであるドーパミン作動性神経の不具合によるという仮説をはじめ、様々な仮説が提唱されている。
しかし、明確な原因は未だに確立されておらず、発病メカニズムは不明である。仮説は何百という多岐な数に及ぶため、特定的な原因の究明が非常に煩わしく困難であるのが、今日の精神医学・脳科学の発達上の限界・壁である。
リスク因子[編集]
一卵性双生児双子研究において、一致率が約50%と高いが100%ではないことなどから、遺伝的要因と環境要因の両方が発症に関与していると考えられている[3]。遺伝形式も不明で、信頼できる原因遺伝子の同定もされていない。双子研究のメタ分析によると、統合失調症の遺伝率は約80%とかなり高い[2][注釈 1]。遺伝率は研究によってばらくつが、1990年以降の論文では80%以上の高い値を示すものが多い[2]。
社会的下層階級[4]、出生時の合併症[5]や父親の高齢[注釈 2][6]、冬生まれ[7]、妊娠中の大きなストレス[8]や幼年期に於ける飢餓[9]、毒素への曝露[10]、薬物乱用[11]などによるトキソプラズマの感染[12]などは有意に統合失調症発症リスクを増加させるものとしている。
アメリカで行われた調査では日照量の多い地域と土壌中のセレン濃度の多い地域では極めて珍しく、そうでない地域では有病率の比較で相対リスクが高いとの結果が報告されている[13]。
仮説一覧[編集]
2008年の『統合失調症治療ガイドライン』では、ストレス脆弱性モデルと、生物学的モデル(薬物療法)に基づいている[14]。
ストレス脆弱性モデル[編集]
ストレスが小さくても、統合失調症にかかりやすい素因(あいまいに耐える力が弱い)、脆弱性が大きければ発病してしまうと考える。また、脆弱性はあまりなくてもストレスが大きければ発病すると考える。内因を素因、心因をストレスとする、原因を内因と心因の両方にもとめる学説である。統合失調症に関しては、個体の抗病的閾値が低下し、これにストレスが脆弱性の閾値(しきいち)を超えると発症されるとされるがその詳細は論じられていない。ストレスとは精神的な緊張・不安・恐怖・興奮・飢餓・感染・過労・睡眠不足・運動不足といった、ごく普通の社会的な生活で起こる諸情である。さらには、寒暑・騒音・化学物質などの要素も含む。
1977年、ZubenとSpringによって、ライフイベントからくるストレスが原因になる、という説が唱えられた[15]。参考文献に挙げた岡田『統合失調症』87ページにも、ライフイベントが重なると発症しやすいとある。
かつての心因説[編集]
かつては精神分析が盛んであり、幼少期に原因があるという仮説が語られた。
ダブルバインドの理論は、親から2つの互いに矛盾するメッセージを受け取った子供が、それをうまく処理することができず、しかしそれに応えようとして発病するという仮説である。 high EE(Expressed Emotio)の説では、否定的なメッセージを送りやすい家庭で育つことと再発率が関係しているとする。
このような心因説が、統合失調症の原因として唱えられ、患者の家族が不当に苦しんだ時代があったが、その後の研究で旧来の心因説は否定され、発病後の症状悪化の要因ではあっても決定原因ではない。また抗精神病薬が登場すると、生物学的な仮説へと注目が集まっていった。
ドーパミン仮説[編集]
中脳辺縁系におけるドーパミンの過剰が、幻覚や妄想といった陽性症状に関与しているという仮説[16]。実際にドーパミンD2受容体遮断作用をもつ抗精神病薬のクロルプロマジンが、陽性症状に有効であるため提唱された。しかし、ドーパミン遮断剤投与後、効果が現れるのが長期修正を暗示させる7日から10日後であること、ドーパミン受容体は後方細胞だけでなく前方細胞にも存在すること、またドーパミンD2ファミリーに異型が発見されたことにより、臨床医や神経生物学者からは批判も多い。
生物学研究では、皮質下のDA受容体密度の増加による受容体感受性の高まり(ドーパミンの過剰ではない)を暗示する研究も存在するが、むしろ前頭葉や前部帯状回などで、ドーパミン受容体結合能の低下を示唆する研究の方が多い[注釈 3]。
近年、ドーパミンをコントロールする抗精神病薬の副作用で、脳が萎縮するという研究結果が開示された[18][19][20]。
ドーパミン作動性の薬剤は、統合失調症の陽性症状を誘発することが分かっている。覚醒剤は、統合失調症の陽性症状に類似した症状を誘発させる。これは薬物誘発性の覚醒剤精神病であり、統合失調症ではない。
グルタミン酸仮説[編集]
アメリカで薬物のフェンサイクリジン(PCP)の乱用が流行した際、一時的に統合失調症に似た症状を誘発させ、後にNMDA受容体アンタゴニスト作用によるものと考えられた[16]。薬物誘発性の精神病であり、統合失調症ではない。後にPCPに代わりMK-801を用いた基礎研究が行われている。
麻酔薬として開発され、のちに暴力性の副作用のため使用が断念されたフェンサイクリジンを投与すると、統合失調症様の陽性症状および陰性症状がみられたこと、フェンサイクリジンがグルタミン酸受容体(NMDA受容体)の遮断薬であることがのちに判明し、グルタミン酸受容体(NMDA受容体)の異常が統合失調症の発症に関与しているという仮説がある。実際に欧米を中心に従来の抗精神病薬とグルタミン酸受容体(NMDA受容体)作動薬であるグリシン、D-サイクロセリン、D-セリンを併用投与すると抗精神病薬単独投与より陰性症状や認知機能障害の改善度が高くなることが報告されている。将来的に、グルタミン酸受容体に作用する抗精神病薬の開発が期待されている。
抗NMDA受容体抗体脳炎は2007年に提唱された比較的新しく発見された疾患であるが、グルタミン酸の受容体であるNMDA受容体機能低下による統合失調症と共通病態と考えられ、統合失調症様な症状が生じる[21]。
統合失調症のモデル生物作成にMK-801(ジゾシルピン)やフェンサイクリジンが使用される[22]。一時的な投与は精神病の模倣を、慢性投与は神経病理学的な変化をもたらす[23]。反復投与により、概ね薬効の強さに関連して永続的な神経変性が生じる。MK-801はヒトにおいても長期間に渡って異常思考や健忘などの強い後遺症が残る。いくつかの研究では習慣性が見出されている。
ドーパミン作動性の薬剤が陽性症状のみを誘発させるのに対し、NMDA受容体拮抗剤は陽性症状と陰性症状の両方を誘発させることが分かっている。
内因性カンナビノイド仮説[編集]
大麻の成分であるカンナビジオール (CBD) は、抗精神病薬の特性が報告されており、統合失調症の患者への臨床試験有効性が報告されている[24]。
遺伝的な要素[編集]
統合失調症患者と対照群の脳内で、別々の働きをする49種類の遺伝子の状態を比較した研究では、統合失調症患者に脳細胞間のシグナリングに欠陥が確認され、ドーパミンやミエリンを生成する遺伝子の働きには、統合失調症患者と対照群の間に差異は確認されていない[25]。
アラキドン酸などの脂肪酸を脳へ取り込むタンパク質Fabp7が、遺伝的に脳への脂肪酸取り込みの弱い患者と統合失調症との関連性が発見されている[26]。プレパルス抑制が弱いと、統合失調症の患者はささいな小さな音で驚くような傾向が見られる[27]。
ある特定の遺伝子の欠損や入れ違いで環境とは無関係に遺伝するタイプと、食生活や運動不足といった環境と遺伝の両方とが関係して起きるタイプの2つの疾患がある、後者のが統合失調症患者の大多数を占めるとされる[28]。
大阪精神医学研究所新阿武山病院の菊山裕貴医師は、統合失調症の脳体積が減る遺伝子は健常者の脳の成熟に必要不可欠で、統合失調症が数万人に一人のまれな遺伝病ではないことが裏付けているとしている。高い知能を持つ人の脳体積は思春期以降、強く減るとし、統合失調症の遺伝子が無くなってしまったら天才が生まれなくなる、としている[29]。
2012年、藤田保健衛生大学の研究チームは、日本人の発症に関係する遺伝子「NOTCH4」の配列を突き止めたと発表した[30]。2014年、米ハーバード大学と英ケンブリッジ大学、藤田保健衛生大学などの国際研究チームは、統合失調症の発症に関わる特定済みのものも含め108の遺伝子領域を確認したと、英科学誌ネイチャー電子版に発表した[31]。
単一精神病仮説[編集]
統合失調症、躁うつ病、うつ病、自閉症、注意欠陥・多動性障害(ADHD)などの精神疾患が、共通の遺伝子を原因に発症するとする仮説。近年の遺伝子解析技術の進歩で、精神疾患の遺伝子が疾患群で共通することが分かってきており、再び脚光を浴びるようになってきている[32]。
カルボニルストレス説[編集]
近年、グリオキサラーゼ代謝と呼ばれる機構があり、統合失調症患者のDNAを用いて遺伝子解析を行ったところ、患者の20%に酵素活性の低下を引き起こす遺伝子変異を同定した研究結果が報告されている[33]。ヒトの血中や臓器に含まれる糖や脂質、タンパク質などが変性したもので、カルボキシル基に関与する酵素群のひとつが、他の分子へ二酸化炭素の付加を触媒する、このことがペントシジン、カルボキシメチルリジン、ピラリンなどの糖化最終産物 (advanced glycation end-products: AGEs)[34] をメイラード反応から生成してしまい、過剰な最終糖化物質を体外へ代謝させるビタミンB6(ピリドキシン)が体内で枯渇してしまう[35]。クエン酸回路の変形回路であるグリオキサラーゼ代謝が体内でおこなわれているが、ストレスや過剰な運動で活性酸素や二酸化炭素が血中に多く現われて、最終糖化物質を尿中に排出させる亢進がおこり、結果としてビタミンB6を消費してしまう[36]。糖や脂質およびタンパク質を混合して長期間に放置しておくと、化学的に変性した物質、つまり最終糖化物質が産生される。瓶詰め・缶詰・調味料などを長期間保存したり、空気中に晒して置くことでも産生するが、それら消費期限をすぎた飲食物を摂取すると腸管から吸収されてしまう、このことでカルボニルストレスを増大する。日常生活において飲食物の摂取などで得られるビタミンB6の量を上回る摂取が必要となるビタミンB6依存症に陥っているケースがあり、正常時の数十倍の摂取ではないとホロ酵素を合成できない場合があるが、ビタミンB6だけの摂取で酵素活性の改善率は必ずしも良くなるとはいえず、他のコエンザイム(補酵素)も関与してる可能性がある、これは代謝回路がいくつもの化学変移をおこすものである。
- チアミン二リン酸やピリドキサールリン酸を補酵素としている。
アメリカで行われた統合失調症患者のAGEsの報告で、高濃度になっている患者が多数報告され、AGEsと活性化ビタミンB6との兼ね合いが注目されている。[37]
神経発達症仮説[編集]
統合失調症の初発患者において脳の容積が一部低下していたり、死後脳において脳の構造異常が見られたりする例があることから、脳の発達段階での何らかの障害が関与しているとする仮説[16]。
名城大学の鍋島俊隆らは統合失調症の一部は、胎児期の脳神経系の神経発達症が原因であることを明らかにした[38]。鍋島教授らは統合失調症の候補遺伝子で、神経系の成長を促す「DISC1」に注目し、マウスを使った実験によってこのことを確かめた。脳のDISC1を一時的に働かないようにすると、成長したマウスは音に過敏に反応したり、認知機能が低下したりするなど、統合失調症に特有の症状を示した。マウスは統合失調症の治療薬の投与で症状は改善し、また、脳の神経細胞の数は正常だが、回路が未熟で、機能が低下していた。鍋島教授は「統合失調症の特徴をここまで再現したマウスはなかった。治療薬の開発に役立てたい」と話したという。
しかしながら、脳の構造的異常が意味するところは今のところ不明である。例えば、もともと脳に異常があるために症状が発現(統合失調症を発症)したのか、慢性的で長期に渡る罹患と治療の結果、症状や服薬などの影響が脳を変成させた可能性との鑑別が困難であることがこの問題の研究上の課題として挙げられる。また、この両者は矛盾せずに両立することができるが、現時点でも脳を見ただけで統合失調症か否かを鑑別できるわけではなく、そもそもMRIやCTといった検査方法で発見できるのはマクロな異常だけであるので、原因がミクロな異常にあった場合や単一的というより複合的であった場合、こうしたマクロ的アプローチの有効性は低いものとなる。また、脳検査で何らかの異常な所見を示す患者よりも示さない患者の方が多いことも、多くの研究者が「統合失調症患者の脳研究」を放棄した理由の一つである。
Two-hit theory[編集]
胎生期と思春期に、2回にわたる何らかの脳へのダメージを受けて発症するという仮説。
薬物[編集]
世界保健機関は2004年に以下のように報告している。コカインとアンフェタミンの使用率が高い国では、一般集団と比較して統合失調症の患者において、使用率が2倍から5倍の間で高く、いくつかの仮説につながっている[39]。ニコチンにおいても統合失調症の患者では喫煙率が高いが、そのような仮説は提唱されていない[39]。しかし、ニコチンが軽い精神刺激薬であることを考えると驚くべきことではないと世界保健機関は報告している[39]。
胎児期のビタミンD欠乏仮説[編集]
冬や春に生まれた人は、発症リスクが上がるなど、胎児期のビタミンD欠乏が、発症リスクを大幅に上げると指摘されている[40]。
アドレノクロム仮説[編集]
現在、日本の精神医学会では否定的であり、前述のドーパミン仮説が通説となっている。アドレノクロムが過剰という仮説で、ビタミンのナイアシンを多量に摂取する治療法が試みられる。統合失調症の患者の8割程度が良くなると記述してある出版物もある。
原因として食物を挙げている。ビタミンやミネラルの不足により、アドレノクロムを代謝できなくなるという。血液検査でビタミン・ミネラルの量を検査する病院もある。このことは糖分の多い清涼飲料水などを多飲するようなペットボトル症候群において低血糖症が誘起されて、体内でアドレノクロムが産生される。過剰な糖分の摂取により体内中のビタミン・ミネラルが排出され、アドレノクロムを代謝できなくなくなり、脳内のアドレノクロムが過剰になって統合失調症の症状を呈するとする文献もある。
副腎髄質より分泌されるホルモンであり、また交感神経の末端から出される神経伝達物質の変異は、脳内でチロシン→ドーパ→ドーパミン→ノルアドレナリン→アドレナリン→ストレスや過度な運動により、酸化してアドレノクロムとなる。低血糖症や糖尿病の症状を『統合失調症』と誤診する医療機関もある。
脂肪酸仮説[編集]
多価不飽和脂肪酸は神経の発達に不可欠であり、統合失調症の人ではその代謝障害が繰り返し報告されており、2010年代にはω-3脂肪酸の投与研究が進展してきている[41]。ハイリスク群が3週間服用する研究を行い、その約7年後では、偽薬では発症率40%であったのに比較して約10%と、発症率は約30%低下した[42]。
その他の仮説[編集]
ウイルス、前頭葉機能の低下などの仮説は様々に提唱されている。
妊娠初期にインフルエンザに罹ることで、生まれてくる子供が統合失調症になる確率が3倍になるという研究もある[43]。
脚注[編集]
注釈[編集]
出典[編集]
- ^ 世界保健機関 1998, Chapt.1.
- ^ a b c Sullivan et al (2003). “Schizophrenia as a complex trait: evidence from a meta-analysis of twin studies”. Archives of general psychiatry 60 (12): 1187.
- ^ 統合失調症(厚生労働省)
- ^ 世界保健機関 1998, Chapt.3.3.
- ^ Cannon M, Jones PB, Murray RM (2002). “Obstetric complications and schizophrenia: historical and meta-analytic review”. Am J Psychiatry 159 (7): 1080–92. PMID 12091183.
- ^ a b Sipos, A. (2004). “Paternal age and schizophrenia: a population based cohort study”. BMJ 329 (7474): 1070–0. doi:10.1136/bmj.38243.672396.55. ISSN 0959-8138.
- ^ Davies G, Welham J, Chant D, Torrey EF, McGrath J (2003). “A systematic review and meta-analysis of Northern Hemisphere season of birth studies in schizophrenia”. Schizophr Bull 29 (3): 587–93. PMID 14609251.
- ^ Weinstock M (2001). “Alterations induced by gestational stress in brain morphology and behaviour of the offspring”. Prog. Neurobiol. 65 (5): 427–51. PMID 11689280.
- ^ Susser E, Neugebauer R, Hoek HW, Brown AS, Lin S, Labovitz D, Gorman JM (1996). “Schizophrenia after prenatal famine. Further evidence”. Arch. Gen. Psychiatry 53 (1): 25–31. PMID 8540774.
- ^ Bresnahan M, Schaefer CA, Brown AS, Susser ES (2005). “Prenatal determinants of schizophrenia: what we have learned thus far?”. Epidemiol Psichiatr Soc 14 (4): 194–7. PMID 16396427.
- ^ Bühler B, Hambrecht M, Löffler W, an der Heiden W, Häfner H (2002). “Precipitation and determination of the onset and course of schizophrenia by substance abuse--a retrospective and prospective study of 232 population-based first illness episodes”. Schizophr. Res. 54 (3): 243–51. PMID 11950549.
- ^ Mortensen PB, Nørgaard-Pedersen B, Waltoft BL, Sørensen TL, Hougaard D, Yolken RH (2007). “Early infections of Toxoplasma gondii and the later development of schizophrenia”. Schizophr Bull 33 (3): 741–4. doi:10.1093/schbul/sbm009. PMC 2526131. PMID 17329231.
- ^ 『統合失調症 本当の理由』P78。
- ^ 精神医学講座担当者会議(監修)、佐藤光源、丹羽真一、井上新平(編集)『統合失調症治療ガイドライン』(第2版)医学書院、2008年。ISBN 978-4-260-00646-0。
- ^ 統合失調症・うつ病プロジェクトのホームページ
- ^ a b c 尾関祐二、藤井久彌子、統合失調症の分子病態研究 脳と精神の医学 2009年 20巻 4号 p.347-353, doi:10.11249/jsbp.20.347
- ^ http://www.akita-u.ac.jp/hkc/eventa/item.cgi?pro2&10
- ^ Ho BC, Andreasen NC, Ziebell S, Pierson R, Magnotta V (2011). “Long-term antipsychotic treatment and brain volumes: a longitudinal study of first-episode schizophrenia”. Arch. Gen. Psychiatry 68 (2): 128–37. doi:10.1001/archgenpsychiatry.2010.199. PMC 3476840. PMID 21300943.
- ^ 抗精神病薬による脳への負の影響。その1 灰白質への影響 場末P科病院の精神科医のblog 2022年9月27日閲覧。
- ^ 抗精神病薬による脳への負の影響。その2 白質への影響 場末P科病院の精神科医のblog 2022年9月27日閲覧。
- ^ 「抗 NMDA 受容体抗体脳炎の臨床と病態」臨床神経,49:774―778, 2009
- ^ Rung JP, Carlsson A, Rydén Markinhuhta K, Carlsson ML. (June 2005). “(+)-MK-801 induced social withdrawal in rats; a model for negative symptoms of schizophrenia.”. Prog. Neuropsychopharmacol. Biol. Psychiatry. 29 (5): 827–32. doi:10.1016/j.pnpbp.2005.03.004. PMID 15916843.
- ^ Braun I, Genius J, Grunze H, Bender A, Möller HJ, Rujescu D. (December 2007). “Alterations of hippocampal and prefrontal GABAergic interneurons in an animal model of psychosis induced by NMDA receptor antagonism.”. Schizophr. Res. 97 (1–3): 254–63. doi:10.1016/j.schres.2007.05.005. PMID 17601703.
- ^ Rohleder, Cathrin; Müller, Juliane K.; Lange, Bettina; et al. (2016). “Cannabidiol as a Potential New Type of an Antipsychotic. A Critical Review of the Evidence”. Frontiers in Pharmacology 7: 422. doi:10.3389/fphar.2016.00422. PMC 5099166. PMID 27877130.
- ^ Analysis of gene expression in two large schizophrenia cohorts identifies multiple changes associated with nerve terminal function Molecular Psychiatry advance online publication 3 March 2009
- ^ 胎児期の不飽和脂肪酸代謝不全を示唆する統合失調症の遺伝子を発見 独立行政法人 理化学研究所プレスリリース
- ^ アラキドン酸が神経新生促進と精神疾患予防に役立つ可能性を発見 科学技術振興機構, 東北大学, 理化学研究所
- ^ メンタルヘルスマガジン こころの元気PLUS 2011年2月号 P.44 特定非営利活動法人 地域精神保健福祉機構
- ^ こころの科学「統合失調症のひろば」2014年春号No.3 p.104 日本評論社 大阪精神医学研究所新阿武山病院 菊山裕貴 "ヒトはなぜ精神病になるのか、我々はどうすべきか" ISBN 978-4535907430
- ^ 中日メディカルサイト2012年7月7日閲覧
- ^ Reardon, Sara (2014). “Gene-hunt gain for mental health”. Nature 511 (7510): 393–393. doi:10.1038/511393a. ISSN 0028-0836.
- ^ The Network and Pathway Analysis Subgroup of the Psychiatric Genomics Consortium Affiliations (2015). “Psychiatric genome-wide association study analyses implicate neuronal, immune and histone pathways”. Nature Neuroscience 18 (2): 199–209. doi:10.1038/nn.3922. ISSN 1097-6256.
- ^ Arai M, Itokawa M, et al (2010). “Enhanced Carbonyl Stress in a Subpopulation of Schizophrenia”. Archives of General Psychiatry 67 (6): 589. doi:10.1001/archgenpsychiatry.2010.62. ISSN 0003-990X.
- ^ 生体内糖化反応(グリゲーション)
- ^ [1] ビタミンB6欠乏の欄参照
- ^ [2] ピリドキサミン (Pyridoxamine) のAGEs阻害活性
- ^ 臨床家がなぜ研究をするのか -精神科医が20年の研究の足跡を振り返るとき 星和書店 糸川昌成 ISBN 4791108353
- ^ 2010年2月
- ^ a b c 世界保健機関 2004, pp. 174–175.
- ^ Darryl W. Eyles, Maciej Trzaskowski (2018). “The association between neonatal vitamin D status and risk of schizophrenia”. Scientific Reports. doi:10.1038/s41598-018-35418-z.
- ^ Pawełczyk, Tomasz; Grancow, Marta; Kotlicka-Antczak, Magdalena; et al. (2015). “Omega-3 fatty acids in first-episode schizophrenia - a randomized controlled study of efficacy and relapse prevention (OFFER): rationale, design, and methods”. BMC Psychiatry 15 (1): 97. doi:10.1186/s12888-015-0473-2. PMC 4456694. PMID 25934131.
- ^ “【神経科学】オメガ3の精神病予防効果は長続きする”. natureasia.com (2015年8月12日). 2016年12月28日閲覧。
- ^ 日経サイエンス編「インフルエンザで神経疾患に?」『日経サイエンス』2004年12月号、日経サイエンス、2004年
参考文献[編集]
- Schizophrenia and Public Health - Japanese version (Report). 世界保健機関. 1998.
関連項目[編集]
外部リンク[編集]
- 環境リスクと統合失調症の保護因子(英語)


