「アバカビル」の版間の差分
en:Abacavir 2021年4月25日 (日) 21:45 より不足部分を翻訳。 タグ: サイズの大幅な増減 ビジュアルエディター |
|||
| 57行目: | 57行目: | ||
}} |
}} |
||
<!-- Definition and uses --> |
<!-- Definition and uses --> |
||
'''アバカビル''' |
'''アバカビル'''(abacavir, ABC)は[[後天性免疫不全症候群|HIV/エイズ]]の予防と治療に用いられる[[医薬品|薬剤]]である<ref name=AHFS2015>{{cite web|title=Abacavir Sulfate|url=https://www.drugs.com/monograph/abacavir-sulfate.html|publisher=The American Society of Health-System Pharmacists|accessdate=31 July 2015|deadurl=no|archiveurl=https://web.archive.org/web/20131608003500/http://www.drugs.com/monograph/abacavir-sulfate.html|archivedate=8 September 2017|df=}}</ref><ref>{{drugs.com|ppa|abacavir}}</ref>。他の[[Nucleoside analog|核酸系]][[逆転写酵素阻害剤|逆写酵素阻害薬]](NRTIs)と同様に、アバカビルはその他の[[HIV medications|HIV治療薬]]と併用され、単体での使用は勧められない<ref>{{cite web|url=https://aidsinfo.nih.gov/drugs/257/abacavir/0/patient/|title=Abacavir|website=AIDSinfo|access-date=2016-11-08|url-status=live|archive-url=https://web.archive.org/web/20170306063920/https://aidsinfo.nih.gov/drugs/257/abacavir/0/patient|archive-date=2017-03-06|df=dmy-all}}</ref>。投与法は錠剤または液体の経口であり、3か月以上の子供にも投与できる<ref name=AHFS2015/><ref name=Yu2008/>。 |
||
<!-- Side effects and mechanism --> |
<!-- Side effects and mechanism --> |
||
アバカビルは一般的に忍容性が高い<ref name=Yu2008/>。主な副作用は嘔吐、 [[不眠症]]、発熱、疲労感など |
アバカビルは一般的に忍容性が高い<ref name=Yu2008/>。主な副作用は嘔吐、 [[不眠症]]、発熱、疲労感などである<ref name=AHFS2015/>。重度の副作用には[[Hypersensitivity|過敏症]]、[[Liver damage|肝障害]]、[[Lactic acidosis|乳酸アシドーシス]]が挙げられる<ref name=AHFS2015/>。[[遺伝子診断|遺伝子検査]]により過敏症になるリスクが高いか診断できる<ref name=AHFS2015/>。過敏症の症状は発疹、嘔吐、息切などである<ref name=Yu2008>{{cite journal|last1=Yuen|first1=GJ|last2=Weller|first2=S|last3=Pakes|first3=GE|title=A review of the pharmacokinetics of abacavir.|journal=Clinical pharmacokinetics|date=2008|volume=47|issue=6|pages=351–71|doi=10.2165/00003088-200847060-00001|pmid=18479171}}</ref>。アバカビルはNRTIの類型に分類される薬剤であり、その作用機序は[[ヒト免疫不全ウイルス|HIVウイルス]][[Viral replication|複製]]に必要な酵素である[[逆転写酵素]]を阻害することで効果がある<ref name=Gov2016>{{cite web|url=http://www.hiv.va.gov/patient/treat/NRTIs.asp|title=Nucleoside reverse transcriptase inhibitors (NRTIs or 'nukes') - HIV/AIDS|website=www.hiv.va.gov|access-date=2016-11-08|deadurl=no|archiveurl=https://web.archive.org/web/20161109083725/http://www.hiv.va.gov/patient/treat/NRTIs.asp|archivedate=2016-11-09|df=}}</ref>。NRTIに分類されるアバカビルは[[Carbocyclic nucleoside|炭素環式ヌクレオシド]]である<ref name=AHFS2015/>。 |
||
<!-- History and culture --> |
<!-- History and culture --> |
||
アバカビルは米国で1988年に特許認可され、1998年に使用認可された<ref>{{cite book| |
アバカビルは米国で1988年に特許認可され、1998年に使用認可された<ref>{{cite book|title=Medical Genetics Summaries|chapter=Abacavir Therapy and HLA-B*57:01 Genotype|chapter-url=https://www.ncbi.nlm.nih.gov/books/NBK315783/|veditors=Pratt VM, McLeod HL, Rubinstein WS, Scott SA, Dean LC, Kattman BL, Malheiro AJ|display-editors=3|publisher=[[National Center for Biotechnology Information]] (NCBI)|year=2015|pmid=28520363|id=Bookshelf ID: NBK315783|vauthors=Dean L|url=https://www.ncbi.nlm.nih.gov/books/NBK61999/|access-date=2019-01-14}}</ref><ref>{{cite journal|year=2002|title=Genetic variations in HLA-B region and hypersensitivity reactions to abacavir|journal=Lancet|volume=359|issue=9312|pages=1121–1122|doi=10.1016/s0140-6736(02)08158-8|pmid=11943262|vauthors=Hetherington S, Hughes AR, Mosteller M, Shortino D, Baker KL, Spreen W, Lai E, Davies K, Handley A, Dow DJ, Fling ME, Stocum M, Bowman C, Thurmond LM, Roses AD|s2cid=9434238|display-authors=3}}</ref>。[[WHO必須医薬品モデル・リスト|世界保健機関の必須医薬品リスト]]に掲載されており、最も効果的で安全な[[医療制度]]に必要とされる薬剤である<ref name=WHO19th>{{cite web|title=WHO Model List of Essential Medicines (19th List)|url=http://www.who.int/medicines/publications/essentialmedicines/EML_2015_FINAL_amended_NOV2015.pdf?ua=1|work=World Health Organization|accessdate=8 December 2016|date=April 2015|deadurl=no|archiveurl=https://web.archive.org/web/20161213052708/http://www.who.int/medicines/publications/essentialmedicines/EML_2015_FINAL_amended_NOV2015.pdf?ua=1|archivedate=13 December 2016|df=}}</ref>。[[後発医薬品]]として入手できる<ref name=AHFS2015/>。[[開発途上国]]での2014年の卸売価格は1日分$0.36~$0.83米ドルである<ref>{{cite journal|year=2010|title=Ancestry and disease in the age of genomic medicine|journal=New England Journal of Medicine|volume=363|issue=16|pages=1551–1558|doi=10.1056/nejmra0911564|pmid=20942671|vauthors=Rotimi CN, Jorde LB}}</ref>。米国での2016年の卸売価格は通常量1か月分$70.50米ドルである<ref name=NAC2016>{{cite web|title=NADAC as of 2016-12-07 {{!}} Data.Medicaid.gov|url=https://data.medicaid.gov/Drug-Prices/NADAC-as-of-2016-12-07/ry9m-tx78|website=Centers for Medicare and Medicaid Services|accessdate=12 December 2016|deadurl=no|archiveurl=https://web.archive.org/web/20161221003023/https://data.medicaid.gov/Drug-Prices/NADAC-as-of-2016-12-07/ry9m-tx78|archivedate=21 December 2016|df=}}</ref>。一般的にアバカビルはその他のHIV治療薬と混合され、[[アバカビル・ラミブジン・ジドブジン]]、[[ドルテグラビル・アバカビル・ラミブジン]]、[[アバカビル・ラミブジン]]などの合剤で販売される<ref name=Yu2008/><ref name=Gov2016/>。 |
||
== 効能・効果 == |
|||
[[ファイル:Abacavir_(Ziagen)_300mg.jpg|サムネイル|アバカビル錠]] |
|||
* HIV感染症<ref name=":0">{{Cite web|title=ザイアジェン錠300mg 添付文書|url=https://www.info.pmda.go.jp/go/pack/6250014F1036_2_09/?view=frame&style=XML&lang=ja|website=www.info.pmda.go.jp|accessdate=2021-06-01|publisher=PMDA}}</ref> |
|||
: アバカビルを用いる際には、他の抗HIV薬と併用しなければならない<ref name=":0" />。 |
|||
== 副作用 == |
|||
重大な副作用として知られているものは、[[過敏症]](約5%)、[[膵炎]](1.09%)、[[スティーブンス・ジョンソン症候群|皮膚粘膜眼症候群]]、[[中毒性表皮壊死症|中毒性表皮壊死融解症]]、[[乳酸アシドーシス]](0.16%)、脂肪沈着による重度の肝腫大([[脂肪肝]])(0.16%)である<ref name=":0" />。この内<u>過敏症</u>については時に致死的な経過を辿るものがある旨の警告欄が設けられている<ref name=":0" />。この過敏症は多くは治療開始後6週以内(中央値11日)に発現する。また、{{仮リンク|免疫再構築症候群|en|Immune reconstitution inflammatory syndrome}}が生じ、投与後の免疫回復に伴い症候性・無症候性日和見感染への炎症反応や自己免疫疾患が発生する事がある<ref name=":0" />。 |
|||
一般的な副作用としては、[[嘔気]]、[[頭痛]]、[[疲労|疲労感]]、[[嘔吐]]、[[下痢]]、食欲不振、[[睡眠障害]]などがある。稀に、[[アスパラギン酸アミノ基転移酵素|AST]]・[[アラニンアミノ基転移酵素|ALT]]の上昇、[[抑うつ]]、[[不安障害|不安]]、[[発熱]]・[[悪寒]]、[[上気道感染症|上気道感染]]、乳酸アシドーシス、[[高トリグリセリド血症]]、[[リポジストロフィー]]などが起こる<ref>{{cite web|url=https://online.epocrates.com/noFrame/showPage.do?method=drugs&MonographId=2043&ActiveSectionId=5|title=Abacavir Adverse Reactions|website=Epocrates Online|accessdate=2021-06-01}}</ref><ref>{{Cite web|title=Abacavir (Professional Patient Advice)|url=https://www.drugs.com/ppa/abacavir.html|website=Drugs.com|accessdate=2021-06-01|language=en}}</ref>。 |
|||
肝障害のある患者は、アバカビルを使用する事で症状を悪化させる可能性があるため、注意が必要である。肝疾患の兆候としては、吐き気や嘔吐、腹痛、濃色尿、[[黄疸]]、白目の黄変などが挙げられる。アバカビルなどのヌクレオシド系薬剤の使用により、極稀に乳酸アシドーシスを引き起こす事がある。乳酸アシドーシスの兆候としては、速いまたは不規則な心拍、異常な筋肉痛、疲労、呼吸困難、嘔気や嘔吐を伴う胃痛等がある<ref>{{cite web|url=https://aidsinfo.nih.gov/drugs/257/abacavir/0/patient/|title=Abacavir|website=AIDSinfo|access-date=2016-11-08|url-status=live|archive-url=https://web.archive.org/web/20170306063920/https://aidsinfo.nih.gov/drugs/257/abacavir/0/patient|archive-date=2017-03-06|df=dmy-all}}</ref>。他にも、心臓発作のリスク増加に繋がる可能性がある{{mcn|date=September 2019}}。 |
|||
アバカビル耐性ウイルスは、[[ラミブジン]]、[[ジダノシン]]、[[ザルシタビン]]などの他のHIV特異的抗レトロウイルス薬にも耐性を示す場合がある<ref>{{Cite journal|last=Tisdale|first=M.|last2=Alnadaf|first2=T.|last3=Cousens|first3=D.|date=1997-05|title=Combination of mutations in human immunodeficiency virus type 1 reverse transcriptase required for resistance to the carbocyclic nucleoside 1592U89|url=https://pubmed.ncbi.nlm.nih.gov/9145875|journal=Antimicrobial Agents and Chemotherapy|volume=41|issue=5|pages=1094–1098|doi=10.1128/AAC.41.5.1094|issn=0066-4804|pmid=9145875|pmc=PMC163856}}</ref>。プロテアーゼ阻害薬との[[交差耐性]]を示す可能性は低い<ref name=":0" />。 |
|||
アバカビルを生後3ヶ月未満の乳児に投与する際の安全性は知られていない<ref name=":0" />。 |
|||
=== 過敏症症候群 === |
|||
アバカビルに対する[[過敏症]]は,[[ヒト白血球型抗原|ヒト白血球抗原]]B[[遺伝子座]]の特定の対立遺伝子、即ちHLA-B*5701と強く関連している<ref>{{cite journal|year=2008|title=HLA-B*5701 screening for hypersensitivity to abacavir|url=http://researchrepository.murdoch.edu.au/id/eprint/8930/|journal=New England Journal of Medicine|volume=358|issue=6|pages=568–579|doi=10.1056/nejmoa0706135|pmid=18256392|vauthors=Mallal S, Phillips E, Carosi G, Molina JM, Workman C, Tomazic J, Jägel-Guedes E, Rugina S, Kozyrev O, Cid JF, Hay P, Nolan D, Hughes S, Hughes A, Ryan S, Fitch N, Thorborn D, Benbow A, ((PREDICT-1 Study Team))|display-authors=3}}</ref><ref>{{cite journal|year=2006|title=Prospective genetic screening decreases the incidence of abacavir hypersensitivity reactions in the Western Australian HIV cohort study|journal=Clinical Infectious Diseases|volume=43|issue=1|pages=99–102|doi=10.1086/504874|pmid=16758424|vauthors=Rauch A, Nolan D, Martin A, McKinnon E, Almeida C, Mallal S|display-authors=3|doi-access=free}}</ref><ref>{{cite book|和書|title=Medical Genetics Summaries|chapter=Abacavir Therapy and HLA-B*57:01 Genotype|chapter-url=https://www.ncbi.nlm.nih.gov/books/NBK315783/|veditors=Pratt VM, McLeod HL, Rubinstein WS, Scott SA, Dean LC, Kattman BL, Malheiro AJ|display-editors=3|publisher=[[National Center for Biotechnology Information]] (NCBI)|year=2015|pmid=28520363|id=Bookshelf ID: NBK315783|vauthors=Dean L|url=https://www.ncbi.nlm.nih.gov/books/NBK61999/|access-date=2019-01-14}}</ref>。HLA-B*5701の保有率と人種との間には関連性が認められる。HLA-B*5701の保有率は、[[ヨーロッパ系アメリカ人]]で平均3.4~5.8%、[[インド系アメリカ人]]で17.6%、[[ヒスパニック系アメリカ人]]で3.0%、[[中国系アメリカ人]]で1.2%と推定されている<ref>{{cite journal|year=2002|title=Genetic variations in HLA-B region and hypersensitivity reactions to abacavir|journal=Lancet|volume=359|issue=9312|pages=1121–1122|doi=10.1016/s0140-6736(02)08158-8|pmid=11943262|vauthors=Hetherington S, Hughes AR, Mosteller M, Shortino D, Baker KL, Spreen W, Lai E, Davies K, Handley A, Dow DJ, Fling ME, Stocum M, Bowman C, Thurmond LM, Roses AD|s2cid=9434238|display-authors=3}}</ref><ref>{{cite journal|year=2002|title=Association between presence of HLA*B5701, HLA-DR7, and HLA-DQ3 and hypersensitivity to HIV-1 reverse-transcriptase inhibitor abacavir|journal=Lancet|volume=359|issue=9308|pages=727–732|doi=10.1016/s0140-6736(02)07873-x|pmid=11888582|vauthors=Mallal S, Nolan D, Witt C, Masel G, Martin AM, Moore C, Sayer D, Castley A, Mamotte C, Maxwell D, James I, Christiansen FT|s2cid=12923232|display-authors=3}}</ref>。アフリカ系集団におけるHLA-B*5701の保有率には大きなばらつきがある。[[アフリカ系アメリカ人]]におけるHLA-B*5701の保有率は、平均で1.0%、ナイジェリアの[[ヨルバ族]]では0%、ケニアの[[ルヒヤ族]]では3.3%、ケニアの[[マサイ族]]では13.6%と推定されているが、これらの平均値は標本集団内での頻度の変動が大きいことに由来する<ref>{{cite journal|year=2010|title=Ancestry and disease in the age of genomic medicine|journal=New England Journal of Medicine|volume=363|issue=16|pages=1551–1558|doi=10.1056/nejmra0911564|pmid=20942671|vauthors=Rotimi CN, Jorde LB}}</ref>。 |
|||
過敏症症候群では以下の症状が多臓器および全身に発現する<ref name=":0" /><ref>{{cite journal|year=2009|title=Successful translation of pharmacogenetics into the clinic: the abacavir example|journal=Molecular Diagnosis & Therapy|volume=13|issue=1|pages=1–9|doi=10.1007/bf03256308|issn=1177-1062|pmid=19351209|vauthors=Phillips E, Mallal S|s2cid=45896364}}</ref>。 |
|||
* 皮疹 |
|||
* 発熱 |
|||
* 胃腸症状(嘔気、嘔吐、下痢、腹痛等) |
|||
* 疲労感、倦怠感 |
|||
* 呼吸器症状(呼吸困難、咽頭痛、咳等)等 |
|||
過敏症症候群の症状は、通常、アバカビルを使用した治療後6週間以内に現れ、HIV、免疫再構築症候群、他の薬剤に関連する過敏症症候群、感染症の症状と混同される事がある<ref>{{cite journal|year=2007|title=Drug hypersensitivity in HIV|journal=Current Opinion in Allergy and Clinical Immunology|volume=7|issue=4|pages=324–330|doi=10.1097/aci.0b013e32825ea68a|pmid=17620824|vauthors=Phillips E, Mallal S|s2cid=37549824}}</ref>。[[アメリカ食品医薬品局|米国食品医薬品局]](FDA)は、2008年7月24日にアバカビルおよびアバカビルを含む医薬品に関する注意喚起を行っており<ref>{{cite web|url=https://www.fda.gov/drugs/drugsafety/postmarketdrugsafetyinformationforpatientsandproviders/ucm123927.htm|title=Information for Healthcare Professionals: Abacavir (marketed as Ziagen) and Abacavir-Containing Medications|date=2008-07-24|publisher=[[Food and Drug Administration]] (FDA)|archive-url=https://web.archive.org/web/20131211024108/https://www.fda.gov/drugs/drugsafety/postmarketdrugsafetyinformationforpatientsandproviders/ucm123927.htm|archive-date=2013-12-11|url-status=dead|access-date=2013-11-29|df=dmy-all}}</ref>、FDAが承認したアバカビルの添付文書では、HLA-B*5701対立遺伝子の治療前スクリーニングと、この対立遺伝子を有する被験者に対する代替療法の使用が推奨されている<ref>{{cite web|url=https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=ca73b519-015a-436d-aa3c-af53492825a1|title=Ziagen- abacavir sulfate tablet, film coated label|date=30 September 2015|publisher=[[DailyMed]]|access-date=2019-09-09|url-status=live|archive-url=https://web.archive.org/web/20170111183846/https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=ca73b519-015a-436d-aa3c-af53492825a1|archive-date=2017-01-11|df=dmy-all}}</ref>。更に、臨床薬理遺伝学実装コンソーシアム(CPIC)およびオランダ薬理遺伝学作業部会(DPWG)も又、HLA-B*5701対立遺伝子を持つ個人に対して、代替療法の使用を推奨している<ref>{{cite journal|date=May 2011|title=Pharmacogenetics: from bench to byte--an update of guidelines|journal=Clin Pharmacol Ther|volume=89|issue=5|pages=662–73|doi=10.1038/clpt.2011.34|pmid=21412232|vauthors=Swen JJ, Nijenhuis M, de Boer A, Grandia L, Maitland-van der Zee AH, Mulder H, Rongen GA, van Schaik RH, Schalekamp T, Touw DJ, van der Weide J, Wilffert B, Deneer VH, Guchelaar HJ|s2cid=2475005|display-authors=3|doi-access=free}}</ref><ref>{{cite journal|date=May 2014|title=Clinical Pharmacogenetics Implementation Consortium Guidelines for HLA-B Genotype and Abacavir Dosing: 2014 update|journal=Clin Pharmacol Ther|volume=95|issue=5|pages=499–500|doi=10.1038/clpt.2014.38|pmid=24561393|pmc=3994233|vauthors=Martin MA, Hoffman JM, Freimuth RR, Klein TE, Dong BJ, Pirmohamed M, Hicks JK, Wilkinson MR, Haas DW, Kroetz DL, ((Clinical Pharmacogenetics Implementation Consortium))|display-authors=3}}</ref>。[[ファイル:Epikutanni-test.jpg|サムネイル|[[パッチテスト]]]]アバカビルに対する過敏性反応の有無を判定する為に、皮膚{{仮リンク|パッチテスト|en|Patch test}}が行われる事があるが、AHSを発症し易い患者でもパッチテストに反応しない場合がある<ref>{{cite journal|year=2008|title=A review of drug patch testing and implications for HIV clinicians|journal=AIDS|volume=22|issue=9|pages=999–1007|doi=10.1097/qad.0b013e3282f7cb60|pmid=18520343|vauthors=Shear NH, Milpied B, Bruynzeel DP, Phillips EJ|s2cid=2972984|display-authors=3}}</ref>。 |
|||
アバカビルに対する過敏症の疑いが生じた場合、HLA-B*5701対立遺伝子を持たない患者を含む全ての患者で、アバカビルの治療を直ちにかつ永久に中止する必要がある。2011年3月1日、FDAは、アバカビルの安全性に関する継続的なレビューを行い、本剤に関連して心臓発作のリスクが増加する可能性があることを通知した<ref>{{cite web|title=FDA Drug Safety Communication: Safety Review update of Abacavir and possible increased risk of heart attack|publisher=[[Food and Drug Administration]] (FDA)|date=1 March 2011|url=https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-safety-review-update-abacavir-and-possible-increased-risk-heart-attack|access-date=9 September 2019}}</ref>。しかし、FDAが実施した26の研究の[[メタアナリシス]]では、アバカビルの使用と心臓発作との関連性は認められなかった<ref>{{cite news|url=https://www.drugs.com/fda/abacavir-ongoing-safety-review-possible-increased-risk-heart-attack-12914.html|title=FDA Alert: Abacavir - Ongoing Safety Review: Possible Increased Risk of Heart Attack|work=Drugs.com|access-date=2013-11-29|archive-url=https://web.archive.org/web/20131210144028/http://www.drugs.com/fda/abacavir-ongoing-safety-review-possible-increased-risk-heart-attack-12914.html|archive-date=2013-12-10|url-status=live|df=dmy-all}}</ref><ref>{{cite journal|date=December 2012|title=No association of abacavir use with myocardial infarction: findings of an FDA meta-analysis|journal=J Acquir Immune Defic Syndr|volume=61|issue=4|pages=441–7|doi=10.1097/QAI.0b013e31826f993c|pmid=22932321|vauthors=Ding X, Andraca-Carrera E, Cooper C, Miele P, Kornegay C, Soukup M, Marcus KA|s2cid=7997822|display-authors=3}}</ref>。 |
|||
=== 免疫病原性 === |
|||
アバカビル過敏症症候群のメカニズムは、HLA-B*5701から生成されるタンパク質の変化に関連している。アバカビルは、HLA-B*5701タンパク質に高い特異性で結合し、抗原結合部位の形状と化学的性質を変化させる。この結果、[[免疫寛容]]度が変化し、その後、アバカビル特異的な[[細胞傷害性T細胞]]が活性化され、アバカビル過敏症症候群として知られる全身性の反応が生じる<ref>{{cite journal|year=2012|title=Immune self-reactivity triggered by drug-modified HLA-peptide repertoire|journal=Nature|volume=486|issue=7404|pages=554–8|bibcode=2012Natur.486..554I|doi=10.1038/nature11147|pmid=22722860|vauthors=Illing PT, Vivian JP, Dudek NL, Kostenko L, Chen Z, Bharadwaj M, Miles JJ, Kjer-Nielsen L, Gras S, Williamson NA, Burrows SR, Purcell AW, Rossjohn J, McCluskey J|s2cid=4408811|display-authors=3}}</ref>。 |
|||
== 相互作用 == |
|||
アバカビルや一般的な[[逆転写酵素阻害剤#ヌクレオシドアナログ逆転写酵素阻害剤(NARTIsまたはNRTIs)|NRTI]]は肝代謝を受けないので、[[シトクロムP450|CYP酵素]]やこれらの酵素に作用する薬剤との相互作用は極少ない(無いに等しい)。とはいえ、アバカビルの吸収や利用可能性に影響を与える相互作用の僅かな例が知られている。以下に、アバカビルの投与中に起こり得る一般的な薬物・食品の相互作用の例を示す。 |
|||
* {{仮リンク|チプラナビル|en|Tipranavir}}や[[リトナビル]]などのプロテアーゼ阻害薬は、[[グルクロン酸抱合]]代謝の誘導によりアバカビルの血清濃度を低下させる可能性がある。アバカビルは、[[アルコールデヒドロゲナーゼ|アルコール脱水素酵素]]とグルクロニド化の両方によって代謝される<ref name=":3">Prescribing information. Ziagen (abacavir). Research Triangle Park, NC: GlaxoSmithKline, July 2002</ref><ref>{{cite journal|year=2007|title=Mechanisms of Pharmacokinetic and Pharmacodynamic Drug Interactions Associated with Ritonavir-Enhanced Tipranavir|journal=Pharmacotherapy|volume=27|issue=6|pages=888–909|doi=10.1592/phco.27.6.888|pmid=17542771|vauthors=Vourvahis M, Kashuba AD|s2cid=23591048}}</ref>。 |
|||
* [[エタノール]]は、アルコール脱水素酵素を阻害する事で、アバカビルの濃度が上昇する可能性がある<ref name=":3" /><ref>{{cite journal|year=2000|title=", "Pharmacokinetic Interaction of Abacavir (1592U89) and Ethanol in Human Immunodeficiency Virus-Infected Adults|journal=Antimicrob Agents Chemother|volume=44|issue=6|pages=1686–90|doi=10.1128/aac.44.6.1686-1690.2000|pmid=10817729|pmc=89933|vauthors=McDowell JA, Chittick GE, Stevens CP, Edwards KD, Stein DS|display-authors=3}}</ref>。 |
|||
*[[メサドン]]は、アバカビルの治療効果を低下させる可能性がある。一方、アバカビルは、メタドンの血清濃度を低下させる可能性がある<ref>{{cite journal|year=2006|title=Effectiveness and safety of abacavir, lamivudine, and zidovudine in antiretroviral therapy-naive HIV-infected patients: results from a large multicenter observational cohort|journal=J Acquir Immune Defic Syndr|volume=41|issue=2|pages=154–159|doi=10.1097/01.qai.0000194231.08207.8a|pmid=16394846|vauthors=Berenguer J, Pérez-Elías MJ, Bellón JM, Knobel H, Rivas-González P, Gatell JM, Miguélez M, Hernández-Quero J, Flores J, Soriano V, Santos I, Podzamczer D, Sala M, Camba M, Resino S, ((Spanish Abacavir, Lamivudine, and Zidovudine Cohort Study Group))|s2cid=17609676|display-authors=3}}</ref><ref>Dolophine(methadone) [prescribing information]. Columbus, OH: Roxane Laboratories, Inc.; March 2015.</ref>。 |
|||
* [[オルリスタット]]は、抗レトロウイルス薬の血清濃度を低下させる可能性がある。この相互作用のメカニズムは完全には解明されていないが、オルリスタットによるアバカビルの吸収低下が原因と考えられている<ref>{{cite journal|year=2016|title=Orlistat: weight lost at cost of HIV rebound|journal=J Antimicrob Chemother|volume=71|issue=6|pages=1739–1741|doi=10.1093/jac/dkw033|pmid=26945709|vauthors=Gervasoni C, Cattaneo D, Di Cristo V, Castoldi S, Gervasi E, Clementi E, Riva A|display-authors=3|doi-access=free}}</ref>。 |
|||
* アバカビルなどのMRP2阻害薬([[多剤耐性関連タンパク質]]2阻害薬)ファミリーの薬剤が、[[カボザンチニブ]]の血清濃度を上昇させる可能性がある<ref>Cometriq (cabozantinib) [prescribing information]. South San Francisco, CA: Exelixis, Inc.; May 2016.</ref>。 |
|||
== 作用機序 == |
|||
アバカビルは、ヌクレオシド系[[逆転写酵素阻害剤|逆転写酵素阻害薬]]で、ウイルスの[[DNA複製|複製]]を阻害する。アバカビルは[[グアノシン]]アナログであり、リン酸化されてカルボビル三リン酸(CBV-TP)となり、ウイルスのDNAに組み込まれる。CBV-TPがウイルスDNAに組み込まれると、[[転写 (生物学)|転写]]およびHIVの[[逆転写酵素]]が阻害される<ref name=":2">Product Information: ZIAGEN(R) oral tablets, oral solution, abacavir sulfate oral tablets, oral solution. ViiV Healthcare (per Manufacturer), Research Triangle Park, NC, 2015.</ref>。 |
|||
== 薬物動態 == |
|||
アバカビルは経口投与され、速やかに吸収され、83%の高い[[バイオアベイラビリティ]]を有する<ref>[https://pubmed.ncbi.nlm.nih.gov/10453964/ Abacavir: absolute bioavailability, bioequivalence of three oral formulations, and effect of food]. G. E. Chittick, C. Gillotin, J. A. McDowell, Y. Lou, K. D. Edwards, W. T. Prince, D. S. Stein. Affiliations, [[PMID]]: 10453964 {{DOI|10.1592/phco.19.11.932.31568}}.</ref>。アバカビルは食事の有無に拘らず服用出来る<ref>Amelia Jones. [https://www.aidsmap.com/about-hiv/food-requirements-anti-hiv-medications Food requirements for anti-HIV medications], May 2019.</ref>。 |
|||
アバカビルは血液脳関門を通過する事が出来る。アバカビルは、主に[[アルコールデヒドロゲナーゼ|アルコール脱水素酵素]]と[[グルクロン酸転移酵素]]という酵素によって代謝され、不活性な[[カルボン酸|カルボン酸塩]]と[[グルクロニド|グルクロニド代謝物]]となる。[[半減期 (薬学)|半減期]]は約1.5~2.0時間である。肝障害がある場合、アバカビルの半減期は58%増加する<ref>"[https://academic.oup.com/cid/article/40/6/909/347821 Abacavir Pharmacokinetics in Hepatic Dysfunction]". David L. Wyles, John G. Gerber, Clinical Infectious Diseases, Volume 40, Issue 6, 15. March 2005, Pages 909–910, Published: 15 March 2005.</ref>。 |
|||
アバカビルは、尿(83%)および糞(16%)への排泄により除去される<ref>"[https://pubmed.ncbi.nlm.nih.gov/18479171/ A review of the pharmacokinetics of abacavir]". Geoffrey J. Yuen, Steve Weller, Gary E. Pakes. Affiliations, [[PMID]]: 18479171 {{DOI|10.2165/00003088-200847060-00001}}.</ref>。[[血液透析]]や[[腹膜透析]]でアバカビルを除去出来るか否かは不明である<ref name=":2" />。 |
|||
== 関連文献 == |
|||
* {{cite book|title=Medical Genetics Summaries|chapter=Abacavir Therapy and HLA-B*57:01 Genotype|chapter-url=https://www.ncbi.nlm.nih.gov/books/NBK315783/|veditors=Pratt VM, McLeod HL, Rubinstein WS, Scott SA, Dean LC, Kattman BL, Malheiro AJ|display-editors=3|publisher=[[National Center for Biotechnology Information]] (NCBI)|date=April 2018|pmid=28520363|vauthors=Dean L|url=https://www.ncbi.nlm.nih.gov/books/NBK61999/}} |
|||
== 外部リンク == |
|||
* {{cite web|url=https://druginfo.nlm.nih.gov/drugportal/rn/136470-78-5|publisher=U.S. National Library of Medicine|work=Drug Information Portal|title=Abacavir|accessdate=2021-06-01}} |
|||
* {{cite web|url=https://druginfo.nlm.nih.gov/drugportal/rn/188062-50-2|publisher=U.S. National Library of Medicine|work=Drug Information Portal|title=Abacavir sulfate|accessdate=2021-06-01}} |
|||
* [http://www.pharmgkb.org/pathway/PA166104634 Abacavir pathway on PharmGKB] |
|||
== 出典 == |
== 出典 == |
||
{{Reflist}} |
{{Reflist|30em}} |
||
{{抗HIV薬}} |
|||
{{デフォルトソート:あはかひる}} |
{{デフォルトソート:あはかひる}} |
||
[[Category:WHOエッセンシャルドラッグ]] |
[[Category:WHOエッセンシャルドラッグ]] |
||
2021年6月1日 (火) 05:29時点における版
 | |
 Chemical structure of abacavir | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 発音 |
[əˈbækəvɪər] ( |
| 販売名 | Ziagen, others[1] |
| Drugs.com | monograph |
| MedlinePlus | a699012 |
| ライセンス | EMA:リンク |
| 胎児危険度分類 | |
| 法的規制 | |
| 投与経路 | By mouth (solution or tablets) |
| 薬物動態データ | |
| 生物学的利用能 | 83% |
| 代謝 | Liver |
| 半減期 | 1.54 ± 0.63 h |
| 排泄 | Kidney (1.2% abacavir, 30% 5'-carboxylic acid metabolite, 36% 5'-glucuronide metabolite, 15% unidentified minor metabolites). Fecal (16%) |
| 識別 | |
| CAS番号 |
136470-78-5 |
| ATCコード | J05AF06 (WHO) |
| PubChem | CID: 441300 |
| DrugBank |
DB01048 |
| ChemSpider |
390063 |
| UNII |
WR2TIP26VS |
| KEGG |
D07057 |
| ChEBI |
CHEBI:421707 |
| ChEMBL |
CHEMBL1380 |
| NIAID ChemDB | 028596 |
| 化学的データ | |
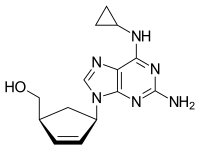
| 化学式 | C14H18N6O |
| 分子量 | 286.332 g/mol |
| |
| 物理的データ | |
| 融点 | 165 °C (329 °F) |
アバカビル(abacavir, ABC)はHIV/エイズの予防と治療に用いられる薬剤である[1][2]。他の核酸系逆写酵素阻害薬(NRTIs)と同様に、アバカビルはその他のHIV治療薬と併用され、単体での使用は勧められない[3]。投与法は錠剤または液体の経口であり、3か月以上の子供にも投与できる[1][4]。
アバカビルは一般的に忍容性が高い[4]。主な副作用は嘔吐、 不眠症、発熱、疲労感などである[1]。重度の副作用には過敏症、肝障害、乳酸アシドーシスが挙げられる[1]。遺伝子検査により過敏症になるリスクが高いか診断できる[1]。過敏症の症状は発疹、嘔吐、息切などである[4]。アバカビルはNRTIの類型に分類される薬剤であり、その作用機序はHIVウイルス複製に必要な酵素である逆転写酵素を阻害することで効果がある[5]。NRTIに分類されるアバカビルは炭素環式ヌクレオシドである[1]。
アバカビルは米国で1988年に特許認可され、1998年に使用認可された[6][7]。世界保健機関の必須医薬品リストに掲載されており、最も効果的で安全な医療制度に必要とされる薬剤である[8]。後発医薬品として入手できる[1]。開発途上国での2014年の卸売価格は1日分$0.36~$0.83米ドルである[9]。米国での2016年の卸売価格は通常量1か月分$70.50米ドルである[10]。一般的にアバカビルはその他のHIV治療薬と混合され、アバカビル・ラミブジン・ジドブジン、ドルテグラビル・アバカビル・ラミブジン、アバカビル・ラミブジンなどの合剤で販売される[4][5]。
効能・効果
- HIV感染症[11]
- アバカビルを用いる際には、他の抗HIV薬と併用しなければならない[11]。
副作用
重大な副作用として知られているものは、過敏症(約5%)、膵炎(1.09%)、皮膚粘膜眼症候群、中毒性表皮壊死融解症、乳酸アシドーシス(0.16%)、脂肪沈着による重度の肝腫大(脂肪肝)(0.16%)である[11]。この内過敏症については時に致死的な経過を辿るものがある旨の警告欄が設けられている[11]。この過敏症は多くは治療開始後6週以内(中央値11日)に発現する。また、免疫再構築症候群が生じ、投与後の免疫回復に伴い症候性・無症候性日和見感染への炎症反応や自己免疫疾患が発生する事がある[11]。
一般的な副作用としては、嘔気、頭痛、疲労感、嘔吐、下痢、食欲不振、睡眠障害などがある。稀に、AST・ALTの上昇、抑うつ、不安、発熱・悪寒、上気道感染、乳酸アシドーシス、高トリグリセリド血症、リポジストロフィーなどが起こる[12][13]。
肝障害のある患者は、アバカビルを使用する事で症状を悪化させる可能性があるため、注意が必要である。肝疾患の兆候としては、吐き気や嘔吐、腹痛、濃色尿、黄疸、白目の黄変などが挙げられる。アバカビルなどのヌクレオシド系薬剤の使用により、極稀に乳酸アシドーシスを引き起こす事がある。乳酸アシドーシスの兆候としては、速いまたは不規則な心拍、異常な筋肉痛、疲労、呼吸困難、嘔気や嘔吐を伴う胃痛等がある[14]。他にも、心臓発作のリスク増加に繋がる可能性がある[要出典医学]。
アバカビル耐性ウイルスは、ラミブジン、ジダノシン、ザルシタビンなどの他のHIV特異的抗レトロウイルス薬にも耐性を示す場合がある[15]。プロテアーゼ阻害薬との交差耐性を示す可能性は低い[11]。
アバカビルを生後3ヶ月未満の乳児に投与する際の安全性は知られていない[11]。
過敏症症候群
アバカビルに対する過敏症は,ヒト白血球抗原B遺伝子座の特定の対立遺伝子、即ちHLA-B*5701と強く関連している[16][17][18]。HLA-B*5701の保有率と人種との間には関連性が認められる。HLA-B*5701の保有率は、ヨーロッパ系アメリカ人で平均3.4~5.8%、インド系アメリカ人で17.6%、ヒスパニック系アメリカ人で3.0%、中国系アメリカ人で1.2%と推定されている[19][20]。アフリカ系集団におけるHLA-B*5701の保有率には大きなばらつきがある。アフリカ系アメリカ人におけるHLA-B*5701の保有率は、平均で1.0%、ナイジェリアのヨルバ族では0%、ケニアのルヒヤ族では3.3%、ケニアのマサイ族では13.6%と推定されているが、これらの平均値は標本集団内での頻度の変動が大きいことに由来する[21]。
過敏症症候群では以下の症状が多臓器および全身に発現する[11][22]。
- 皮疹
- 発熱
- 胃腸症状(嘔気、嘔吐、下痢、腹痛等)
- 疲労感、倦怠感
- 呼吸器症状(呼吸困難、咽頭痛、咳等)等
過敏症症候群の症状は、通常、アバカビルを使用した治療後6週間以内に現れ、HIV、免疫再構築症候群、他の薬剤に関連する過敏症症候群、感染症の症状と混同される事がある[23]。米国食品医薬品局(FDA)は、2008年7月24日にアバカビルおよびアバカビルを含む医薬品に関する注意喚起を行っており[24]、FDAが承認したアバカビルの添付文書では、HLA-B*5701対立遺伝子の治療前スクリーニングと、この対立遺伝子を有する被験者に対する代替療法の使用が推奨されている[25]。更に、臨床薬理遺伝学実装コンソーシアム(CPIC)およびオランダ薬理遺伝学作業部会(DPWG)も又、HLA-B*5701対立遺伝子を持つ個人に対して、代替療法の使用を推奨している[26][27]。

アバカビルに対する過敏性反応の有無を判定する為に、皮膚パッチテストが行われる事があるが、AHSを発症し易い患者でもパッチテストに反応しない場合がある[28]。
アバカビルに対する過敏症の疑いが生じた場合、HLA-B*5701対立遺伝子を持たない患者を含む全ての患者で、アバカビルの治療を直ちにかつ永久に中止する必要がある。2011年3月1日、FDAは、アバカビルの安全性に関する継続的なレビューを行い、本剤に関連して心臓発作のリスクが増加する可能性があることを通知した[29]。しかし、FDAが実施した26の研究のメタアナリシスでは、アバカビルの使用と心臓発作との関連性は認められなかった[30][31]。
免疫病原性
アバカビル過敏症症候群のメカニズムは、HLA-B*5701から生成されるタンパク質の変化に関連している。アバカビルは、HLA-B*5701タンパク質に高い特異性で結合し、抗原結合部位の形状と化学的性質を変化させる。この結果、免疫寛容度が変化し、その後、アバカビル特異的な細胞傷害性T細胞が活性化され、アバカビル過敏症症候群として知られる全身性の反応が生じる[32]。
相互作用
アバカビルや一般的なNRTIは肝代謝を受けないので、CYP酵素やこれらの酵素に作用する薬剤との相互作用は極少ない(無いに等しい)。とはいえ、アバカビルの吸収や利用可能性に影響を与える相互作用の僅かな例が知られている。以下に、アバカビルの投与中に起こり得る一般的な薬物・食品の相互作用の例を示す。
- チプラナビルやリトナビルなどのプロテアーゼ阻害薬は、グルクロン酸抱合代謝の誘導によりアバカビルの血清濃度を低下させる可能性がある。アバカビルは、アルコール脱水素酵素とグルクロニド化の両方によって代謝される[33][34]。
- エタノールは、アルコール脱水素酵素を阻害する事で、アバカビルの濃度が上昇する可能性がある[33][35]。
- メサドンは、アバカビルの治療効果を低下させる可能性がある。一方、アバカビルは、メタドンの血清濃度を低下させる可能性がある[36][37]。
- オルリスタットは、抗レトロウイルス薬の血清濃度を低下させる可能性がある。この相互作用のメカニズムは完全には解明されていないが、オルリスタットによるアバカビルの吸収低下が原因と考えられている[38]。
- アバカビルなどのMRP2阻害薬(多剤耐性関連タンパク質2阻害薬)ファミリーの薬剤が、カボザンチニブの血清濃度を上昇させる可能性がある[39]。
作用機序
アバカビルは、ヌクレオシド系逆転写酵素阻害薬で、ウイルスの複製を阻害する。アバカビルはグアノシンアナログであり、リン酸化されてカルボビル三リン酸(CBV-TP)となり、ウイルスのDNAに組み込まれる。CBV-TPがウイルスDNAに組み込まれると、転写およびHIVの逆転写酵素が阻害される[40]。
薬物動態
アバカビルは経口投与され、速やかに吸収され、83%の高いバイオアベイラビリティを有する[41]。アバカビルは食事の有無に拘らず服用出来る[42]。
アバカビルは血液脳関門を通過する事が出来る。アバカビルは、主にアルコール脱水素酵素とグルクロン酸転移酵素という酵素によって代謝され、不活性なカルボン酸塩とグルクロニド代謝物となる。半減期は約1.5~2.0時間である。肝障害がある場合、アバカビルの半減期は58%増加する[43]。
アバカビルは、尿(83%)および糞(16%)への排泄により除去される[44]。血液透析や腹膜透析でアバカビルを除去出来るか否かは不明である[40]。
関連文献
- “Abacavir Therapy and HLA-B*57:01 Genotype”. Medical Genetics Summaries. National Center for Biotechnology Information (NCBI). (April 2018). PMID 28520363
外部リンク
- “Abacavir”. Drug Information Portal. U.S. National Library of Medicine. 2021年6月1日閲覧。
- “Abacavir sulfate”. Drug Information Portal. U.S. National Library of Medicine. 2021年6月1日閲覧。
- Abacavir pathway on PharmGKB
出典
- ^ a b c d e f g h “Abacavir Sulfate”. The American Society of Health-System Pharmacists. 2017年9月8日時点のオリジナルよりアーカイブ。2015年7月31日閲覧。
- ^
- ^ “Abacavir”. AIDSinfo. 2017年3月6日時点のオリジナルよりアーカイブ。2016年11月8日閲覧。
- ^ a b c d Yuen, GJ; Weller, S; Pakes, GE (2008). “A review of the pharmacokinetics of abacavir.”. Clinical pharmacokinetics 47 (6): 351–71. doi:10.2165/00003088-200847060-00001. PMID 18479171.
- ^ a b “Nucleoside reverse transcriptase inhibitors (NRTIs or 'nukes') - HIV/AIDS”. www.hiv.va.gov. 2016年11月9日時点のオリジナルよりアーカイブ。2016年11月8日閲覧。
- ^ “Abacavir Therapy and HLA-B*57:01 Genotype”. Medical Genetics Summaries. National Center for Biotechnology Information (NCBI). (2015). PMID 28520363. Bookshelf ID: NBK315783 2019年1月14日閲覧。
- ^ “Genetic variations in HLA-B region and hypersensitivity reactions to abacavir”. Lancet 359 (9312): 1121–1122. (2002). doi:10.1016/s0140-6736(02)08158-8. PMID 11943262.
- ^ “WHO Model List of Essential Medicines (19th List)”. World Health Organization (2015年4月). 2016年12月13日時点のオリジナルよりアーカイブ。2016年12月8日閲覧。
- ^ “Ancestry and disease in the age of genomic medicine”. New England Journal of Medicine 363 (16): 1551–1558. (2010). doi:10.1056/nejmra0911564. PMID 20942671.
- ^ “NADAC as of 2016-12-07 | Data.Medicaid.gov”. Centers for Medicare and Medicaid Services. 2016年12月21日時点のオリジナルよりアーカイブ。2016年12月12日閲覧。
- ^ a b c d e f g h “ザイアジェン錠300mg 添付文書”. www.info.pmda.go.jp. PMDA. 2021年6月1日閲覧。
- ^ “Abacavir Adverse Reactions”. Epocrates Online. 2021年6月1日閲覧。
- ^ “Abacavir (Professional Patient Advice)” (英語). Drugs.com. 2021年6月1日閲覧。
- ^ “Abacavir”. AIDSinfo. 2017年3月6日時点のオリジナルよりアーカイブ。2016年11月8日閲覧。
- ^ Tisdale, M.; Alnadaf, T.; Cousens, D. (1997-05). “Combination of mutations in human immunodeficiency virus type 1 reverse transcriptase required for resistance to the carbocyclic nucleoside 1592U89”. Antimicrobial Agents and Chemotherapy 41 (5): 1094–1098. doi:10.1128/AAC.41.5.1094. ISSN 0066-4804. PMC PMC163856. PMID 9145875.
- ^ “HLA-B*5701 screening for hypersensitivity to abacavir”. New England Journal of Medicine 358 (6): 568–579. (2008). doi:10.1056/nejmoa0706135. PMID 18256392.
- ^ “Prospective genetic screening decreases the incidence of abacavir hypersensitivity reactions in the Western Australian HIV cohort study”. Clinical Infectious Diseases 43 (1): 99–102. (2006). doi:10.1086/504874. PMID 16758424.
- ^ 「Abacavir Therapy and HLA-B*57:01 Genotype」『Medical Genetics Summaries』National Center for Biotechnology Information (NCBI)、2015年。PMID 28520363。Bookshelf ID: NBK315783。2019年1月14日閲覧。
- ^ “Genetic variations in HLA-B region and hypersensitivity reactions to abacavir”. Lancet 359 (9312): 1121–1122. (2002). doi:10.1016/s0140-6736(02)08158-8. PMID 11943262.
- ^ “Association between presence of HLA*B5701, HLA-DR7, and HLA-DQ3 and hypersensitivity to HIV-1 reverse-transcriptase inhibitor abacavir”. Lancet 359 (9308): 727–732. (2002). doi:10.1016/s0140-6736(02)07873-x. PMID 11888582.
- ^ “Ancestry and disease in the age of genomic medicine”. New England Journal of Medicine 363 (16): 1551–1558. (2010). doi:10.1056/nejmra0911564. PMID 20942671.
- ^ “Successful translation of pharmacogenetics into the clinic: the abacavir example”. Molecular Diagnosis & Therapy 13 (1): 1–9. (2009). doi:10.1007/bf03256308. ISSN 1177-1062. PMID 19351209.
- ^ “Drug hypersensitivity in HIV”. Current Opinion in Allergy and Clinical Immunology 7 (4): 324–330. (2007). doi:10.1097/aci.0b013e32825ea68a. PMID 17620824.
- ^ “Information for Healthcare Professionals: Abacavir (marketed as Ziagen) and Abacavir-Containing Medications”. Food and Drug Administration (FDA) (2008年7月24日). 2013年12月11日時点のオリジナルよりアーカイブ。2013年11月29日閲覧。
- ^ “Ziagen- abacavir sulfate tablet, film coated label”. DailyMed (2015年9月30日). 2017年1月11日時点のオリジナルよりアーカイブ。2019年9月9日閲覧。
- ^ “Pharmacogenetics: from bench to byte--an update of guidelines”. Clin Pharmacol Ther 89 (5): 662–73. (May 2011). doi:10.1038/clpt.2011.34. PMID 21412232.
- ^ “Clinical Pharmacogenetics Implementation Consortium Guidelines for HLA-B Genotype and Abacavir Dosing: 2014 update”. Clin Pharmacol Ther 95 (5): 499–500. (May 2014). doi:10.1038/clpt.2014.38. PMC 3994233. PMID 24561393.
- ^ “A review of drug patch testing and implications for HIV clinicians”. AIDS 22 (9): 999–1007. (2008). doi:10.1097/qad.0b013e3282f7cb60. PMID 18520343.
- ^ “FDA Drug Safety Communication: Safety Review update of Abacavir and possible increased risk of heart attack”. Food and Drug Administration (FDA) (2011年3月1日). 2019年9月9日閲覧。
- ^ “FDA Alert: Abacavir - Ongoing Safety Review: Possible Increased Risk of Heart Attack”. Drugs.com. オリジナルの2013年12月10日時点におけるアーカイブ。 2013年11月29日閲覧。
- ^ “No association of abacavir use with myocardial infarction: findings of an FDA meta-analysis”. J Acquir Immune Defic Syndr 61 (4): 441–7. (December 2012). doi:10.1097/QAI.0b013e31826f993c. PMID 22932321.
- ^ “Immune self-reactivity triggered by drug-modified HLA-peptide repertoire”. Nature 486 (7404): 554–8. (2012). Bibcode: 2012Natur.486..554I. doi:10.1038/nature11147. PMID 22722860.
- ^ a b Prescribing information. Ziagen (abacavir). Research Triangle Park, NC: GlaxoSmithKline, July 2002
- ^ “Mechanisms of Pharmacokinetic and Pharmacodynamic Drug Interactions Associated with Ritonavir-Enhanced Tipranavir”. Pharmacotherapy 27 (6): 888–909. (2007). doi:10.1592/phco.27.6.888. PMID 17542771.
- ^ “", "Pharmacokinetic Interaction of Abacavir (1592U89) and Ethanol in Human Immunodeficiency Virus-Infected Adults”. Antimicrob Agents Chemother 44 (6): 1686–90. (2000). doi:10.1128/aac.44.6.1686-1690.2000. PMC 89933. PMID 10817729.
- ^ “Effectiveness and safety of abacavir, lamivudine, and zidovudine in antiretroviral therapy-naive HIV-infected patients: results from a large multicenter observational cohort”. J Acquir Immune Defic Syndr 41 (2): 154–159. (2006). doi:10.1097/01.qai.0000194231.08207.8a. PMID 16394846.
- ^ Dolophine(methadone) [prescribing information]. Columbus, OH: Roxane Laboratories, Inc.; March 2015.
- ^ “Orlistat: weight lost at cost of HIV rebound”. J Antimicrob Chemother 71 (6): 1739–1741. (2016). doi:10.1093/jac/dkw033. PMID 26945709.
- ^ Cometriq (cabozantinib) [prescribing information]. South San Francisco, CA: Exelixis, Inc.; May 2016.
- ^ a b Product Information: ZIAGEN(R) oral tablets, oral solution, abacavir sulfate oral tablets, oral solution. ViiV Healthcare (per Manufacturer), Research Triangle Park, NC, 2015.
- ^ Abacavir: absolute bioavailability, bioequivalence of three oral formulations, and effect of food. G. E. Chittick, C. Gillotin, J. A. McDowell, Y. Lou, K. D. Edwards, W. T. Prince, D. S. Stein. Affiliations, PMID: 10453964 doi:10.1592/phco.19.11.932.31568.
- ^ Amelia Jones. Food requirements for anti-HIV medications, May 2019.
- ^ "Abacavir Pharmacokinetics in Hepatic Dysfunction". David L. Wyles, John G. Gerber, Clinical Infectious Diseases, Volume 40, Issue 6, 15. March 2005, Pages 909–910, Published: 15 March 2005.
- ^ "A review of the pharmacokinetics of abacavir". Geoffrey J. Yuen, Steve Weller, Gary E. Pakes. Affiliations, PMID: 18479171 doi:10.2165/00003088-200847060-00001.
