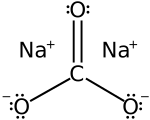
炭酸ナトリウム
| 炭酸ナトリウム | |
|---|---|
| |
| |
| |
別称 炭酸ソーダ ソーダ灰(無水物) | |
| 識別情報 | |
| CAS登録番号 | 497-19-8 5968-11-6(一水和物) 6132-02-1(十水和物) |
| PubChem | 10340 |
| ChemSpider | 9916 |
| EC番号 | 207-838-8 |
| E番号 | E500(i) (pH調整剤、固化防止剤) |
| RTECS番号 | VZ4050000 |
| 特性 | |
| 化学式 | Na2CO3 |
| モル質量 | 105.9884 g/mol(無水物) 124.00 g/mol(一水和物) 286.14 g/mol(十水和物) |
| 外観 | 吸湿性の白色固体 |
| 密度 | 2.54 g/cm3(無水物) 2.25 g/cm3(一水和物) 1.46 g/cm3(十水和物) |
| 融点 |
851 °C, 1124K(無水物) |
| 沸点 |
1600 °C(無水物) |
| 水への溶解度 | 22 g/100 ml (20 °C) 7 g/100 g (0 °C) 21.6 g/100 g (20 °C) 45 g/100 g (100 °C)[1] |
| 溶解度 | アルコール、エタノールに不溶 |
| 塩基解離定数 pKb | 3.67 |
| 屈折率 (nD) | 1.495(無水物) 1.420(一水和物) |
| 構造 | |
| 配位構造 | 三方両錐形 |
| 危険性 | |
| 安全データシート(外部リンク) | Safety Data Sheet External MSDS |
| EU分類 | 刺激性 (Xi) |
| EU Index | 011-005-00-2 |
| NFPA 704 | |
| Rフレーズ | R36 |
| Sフレーズ | S2 S22 S26 |
| 引火点 | 不燃性 |
| 関連する物質 | |
| その他の陰イオン | 炭酸水素ナトリウム |
| その他の陽イオン | 炭酸リチウム 炭酸カリウム 炭酸ルビジウム 炭酸セシウム |
| 関連物質 | 炭酸アンモニウム ナトロン 過炭酸ナトリウム トロナ |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
炭酸ナトリウム(たんさんナトリウム、sodium carbonate、別名:炭酸ソーダ[2])は組成式 (Na2CO3)で表されるアルカリ金属炭酸塩。水酸化ナトリウムとその半分の物質量の二酸化炭素を反応させるか、炭酸水素ナトリウムを熱すると得られる。
化学的性質
[編集]基本的性質
[編集]pHは11.3(1%水溶液)[2]。水溶液中では以下の 1. のように電離するが、 2. の平衡は著しく左に偏っているため、CO2−
3 イオンが水から H+ イオンを奪う能力が強く 3. のように反応してOH−イオンを生じる。(加水分解)
そのために、水溶液は塩基性を示し、味は苦い。菓子を作る際加えるベーキングパウダーは炭酸水素ナトリウムが主成分であり、熱分解して炭酸ナトリウムが生じるとアルカリ性となり苦味を呈するため、中和剤として酒石酸も加えてある。
ソーダ灰と洗濯ソーダ
[編集]水分をまったく含まない無水塩はソーダ灰という[2]。
また、結晶構造中に10個の水分子を含むもの(十水和物)は洗濯ソーダ(washing soda)といい、古くから綿布の洗濯に利用されてきた[2]。
十水和物 (Na2CO3・10H2O) は風解して一水和物 (Na2CO3・H2O) になる。輸送時、体積および質量を減じるために300 °C以上で焼いて無水塩とする。
製造法
[編集]歴史的な製造法
[編集]中東の草木、塩生植物、スコットランドの昆布、スペインの海藻のようなナトリウムが豊富な環境で育った植物の灰から抽出されていた。これらのナトリウムが豊富な植物の灰は、炭酸カリウムが得られる木材の灰と異なっていたため、ソーダ灰(soda ash)として呼ばれるようになった[3]。これらは19世紀初頭までヨーロッパおよび他の地域で行われていた。
湖水などに溶解した炭酸ナトリウムは、水の蒸発により析出し湖底で自然に採れることがある。これらの鉱物はナトロンとよばれた。エジプトの乾燥した湖等で得られ、ガラスの原料やミイラ製造に使用された。
炭酸ナトリウムの無水鉱物状態のものは非常にまれであり、ナトライト(natrite)と呼ばれる。タンザニアのオルドイニョ・レンガイ火山からも噴出する。過去にも同様の噴出はあったと考えられるが、地表では不安定で、水に浸食されている可能性がある。たとえばロシアのコラ半島では、炭酸ナトリウム、トロナ(Na3H(CO3)2・2H2O)、セスキ炭酸ナトリウム(Na2CO3・NaHCO3)の3種の鉱物形態で存在している。トロナ、セスキ炭酸ナトリウムは現在でも炭酸ナトリウムの原料として採掘されている。
工業的な製造法
[編集]工業的には天然に産出するトロナを原料に精製するか、塩水からソルベイ法(アンモニアソーダ法)で製造される[2]。世界的には、全生産量のうちおよそ28 %が天然由来となっている[4]。
利用・用途
[編集]中華麺のかん水やコンニャクの凝固剤として利用される[5]。塩基性であるため小麦粉中の色素が黄色を呈するので、うどんと異なり中華麺は黄色い。
工業上は粉せっけんや合成洗剤のアルカリ助剤として配合され(炭酸塩と表示)、粉末状の洗剤では乾燥剤の役目もある[5]。
洗浄力の強いアルカリ性で10水塩の炭酸ソーダは洗濯ソーダと呼ばれ洗濯に利用されてきた[2]。家庭用では皮脂汚れなどの汚れの洗濯、油汚れの下処理、血液などのタンパク質汚れに対する汚れ落としなどに利用される[2]。ただし、機械油や化粧品が原因の油汚れ、頑固な泥汚れ、衣類等のシミの漂白には不向きである[2]。セスキ炭酸ナトリウムよりも強い塩基性で使用量は少なくなるが、より手荒れを起こしやすくゴム手袋の着用などが必要である[5]。また、セスキ炭酸ナトリウムに比べると水に溶けにくい[5]。炭酸ソーダは吸湿すると固くなってしまう性質がある[5]。
古代エジプトではナトロンという天然鉱物をミイラ作りに利用していたが、これはナトロンに多く含まれる炭酸ナトリウムの脱水作用を利用したものとされている[5]。
脚注
[編集]- ^ https://web.archive.org/web/20060411081802/http://www.ndctz.com/sodaash.htm
- ^ a b c d e f g h i 生活と科学社『アルカリと酸で洗う本 -洗濯と掃除、そしてキッチン』せせらぎ出版、2011年、4頁。
- ^ “minerals.usgs.gov/minerals”. アメリカ地質調査所. 2018年3月11日閲覧。[1]
- ^ Soda Ash - Geotimes -May 2006[2] - USGS
- ^ a b c d e f 生活と科学社『アルカリと酸で洗う本 -洗濯と掃除、そしてキッチン』せせらぎ出版、2011年、5頁。
関連項目
[編集]- 灰汁
- ルブラン法 - 18世紀末に発明され、19世紀の中頃までの間まで盛んに用いられた炭酸ナトリウムの工業的製造法
- 侯德榜法 - 1930年代に中国の化学者 侯德榜が開発した製造法
- en:Residual sodium carbonate index






