フェノールフタレイン
| フェノールフタレイン | |
|---|---|
 低pH (0−8.2) での構造
| |
3,3-bis(4-hydroxyphenyl)isobenzofuran-1(3H)-one | |
| 識別情報 | |
| CAS登録番号 | 77-09-8 |
| PubChem | 4764 |
| ChemSpider | 4600 |
| KEGG | D05456 |
| ChEMBL | CHEMBL63857 |
| |
| |
| 特性 | |
| 化学式 | C20H14O4 |
| モル質量 | 318.32 g mol−1 |
| 外観 | 白色または淡黄色固体 |
| 密度 | 1.277 g cm−3 (32 °C) |
| 融点 |
258 - 263 °C, 534-536 K ([1]) |
| 水への溶解度 | 不溶 |
| ほかの溶媒への溶解度 | ベンゼンに不溶、エタノールとエーテルに非常に溶ける、DMSOにわずかに溶ける
LambdaMax = 552 nm (1st) |
| 危険性 | |
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H341, H350, H361[1] |
| Pフレーズ | P201, P281, P308+313[1] |
| EU分類 | |
| NFPA 704 | |
| Rフレーズ | R22, R40, R45, R62, R68, |
| Sフレーズ | S53, S45 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
フェノールフタレイン (phenolphthalein) は化学式 C20H14O4 の有機化合物である。分析化学において 酸塩基指示薬として用いられる。白色または淡黄色の固体であり、水には非常に溶けにくい。PP、HIn、もしくはphph と略されることがある。滴定に広く利用される。
粉末のほか、エタノール-水の溶液が試薬として市販されている。フェノールフタレインをエタノールに溶かし、水で希釈したものは酸塩基指示薬としてアルカリ性の検出に用いられ、赤紫色(濃い桃色)を呈する。濃度が濃ければ、紫色にもなることがある。強塩基の場合は、非常にゆっくりと色が消えていき、無色となる。色の変化は、構造が変わることで起こり、pH < 8.3 の酸性側で無色、pH > 10.0 の塩基性側で赤紫色を示す。なお、pH > 13.4では、さらに構造が変化し、無色となる。以下の4つは各pHにおけるフェノールフタレインの構造式である。
| 化学種 | In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| 構造式 |  |
 |
 |

|
| モデル |  |
 |
 |

|
| pH | <-1 H2SO4中[2] | 0−8.3 | 8.3−13.4 | >13.4 |
| 酸性度 | 強酸性 | 酸性または中性 | 塩基性 | 強塩基性 |
| 色 | オレンジ | 無色 | ピンクからフクシャ | 無色 |
| 画像 |  |
 |
合成
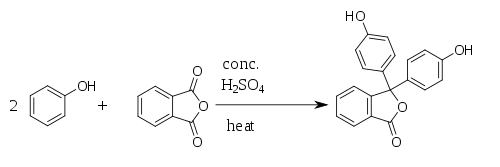
[編集]フェノールフタレインは無水フタル酸と2つのフェノールの3つの分子を酸性条件で縮合させることにより合成される。この反応は1871年、アドルフ・フォン・バイヤーによって発見された[3][4][5]。
用途
[編集]
| |||||||||||||||
フェノールフタレインは一世紀以上にわたって下剤に利用されてきたが、げっ歯類の実験結果より、発癌性の疑いが認められたため、現在では一般用医薬品から除外されている[7][8][9]。
フェノールフタレインはカスル・マイヤー試験として知られる血液の検出にも用いられる。乾燥した検体を綿棒か濾紙に集める。初めにアルコール、次にフェノールフタレイン、最後に過酸化水素水を検体に数滴ずつたらす。検体にヘモグロビンが含まれていれば、色がピンクに変わる。この反応が陽性を示せば、検体には血液が含まれると考えられる。この実験は検体を壊さないため、検体を使用してさらに実験を行う際に適している。しかしこの実験はヒト以外の生物の血液でも同じように反応するため、さらに実験を行う際にはその血液がヒト由来であるかどうか調べる必要がある。
またおもちゃにも使用されており、つや消しのインクや、バービーの髪を染める際に使用される。バービーの髪には空気中で二酸化炭素と反応(潮解)する水酸化ナトリウムが加えられている。この反応では水素イオンが発生し、呈色が始まるpHの数値が下がる。
髪の"魔法の"縞をはっきりさせるためには、水酸化ナトリウム水溶液を噴霧することが必要である。隠れた縞は上記のプロセスに従って呈色する。その色はまた上記のプロセスに従って空気中の二酸化炭素を吸収し、元に戻る。チモールフタレイン(英語版)はこれと同じ目的で、同じような過程を通して青色を呈色する[10]。
フェノールフタレインは、酸塩基の指示薬として化学の実験で広く使用されている。溶液が酸性の場合は色は変わらないが、塩基性の場合は赤紫色となる。またメチルレッド、ブロモチモールブルー、チモールブルーと共に万能指示薬の材料となる。
また、フェノールフタレインが酸と塩基の違いを色で示すことを利用し、コンクリートの中に炭酸塩が含まれているかどうか調べる検査にも応用されている。コンクリートは通常ポルトランドセメントが水と反応してできる水酸化カルシウムのために強塩基性を示す。新しいコンクリートの細孔中でのpHは14を超えるが、コンクリートの中で水和物が二酸化炭素と反応して炭酸塩となる。この反応は表層部でしか起こらないが、pHの値は8.5〜9まで下がる。この反応には1%のフェノールフタレイン溶液を使用し、新しいコンクリートは鮮やかなピンクに変色する。しかし、上記の反応を起こした後では、色の変化は起こらない。
生理学
[編集]一世紀以上の長きにわたって下剤として使用されてきたが、齧歯類での実験結果より発癌性が疑われたため、多くの国で使用が中止されている。動物実験から卵巣腫瘍の原因となっている可能性が疑われたため、過去に下剤としてフェノールフタレインを含む薬物を連用していた集団で卵巣腫瘍のリスクが上昇しているかどうか調査されたが、ヒトでのリスク上昇は観察されていない[11]。フェノールフタレインはトロンビンやタプシガルギンを抑制することで細胞内のカルシウム量が増加し、細胞へのカルシウムのカルシウム放出依存性チャンネル(SOCE)を経由した流入を抑制する[12]。
脚注
[編集]- ^ a b c d Phenolphthalein
- ^ Wittke, Georg (1 March 1983). “Reactions of phenolphthalein at various pH values”. Journal of Chemical Education 60 (3): 239. Bibcode: 1983JChEd..60..239W. doi:10.1021/ed060p239. ISSN 0021-9584.
- ^ Baeyer, A. (1871). “Ueber eine neue Klasse von Farbstoffen”. Berichte der Deutschen Chemischen Gesellschaft 4 (2): 555–558. doi:10.1002/cber.18710040209.
- ^ Baeyer, A. (1871). “Ueber die Phenolfarbstoffe”. Berichte der Deutschen Chemischen Gesellschaft 4 (2): 658–665. doi:10.1002/cber.18710040247.
- ^ Baeyer, A. (1871). “Ueber die Phenolfarbstoffe”. Polytechnisches Journal 201 (89): 358–362.
- ^ https://www.tcichemicals.com/JP/ja/p/P0094
- ^ Spiller, H. A.; Winter, M. L.; Weber, J. A; Krenzelok, E. P.; Anderson, D. L.; Ryan, M. L. (May 2003). “Skin Breakdown and Blisters from Senna-Containing Laxatives in Young Children”. The Annals of Pharmacotherapy 37 (5): 636–639. doi:10.1345/aph.1C439. ISSN 1060-0280. PMID 12708936.
- ^ Dunnick, J. K.; Hailey, J. R. (1996). “Phenolphthalein Exposure Causes Multiple Carcinogenic Effects in Experimental Model Systems” (pdf). Cancer Research 56 (21): 4922–4926. PMID 8895745.
- ^ Tice, R. R.; Furedi-Machacek, M.; Satterfield, D.; Udumudi, A.; Vasquez, M.; Dunnick, J. K. (1998). “Measurement of Micronucleated Erythrocytes and DNA Damage during Chronic Ingestion of Phenolphthalein in Transgenic Female Mice Heterozygous for the p53 Gene”. Environmental and Molecular Mutagenesis 31 (2): 113–124. doi:10.1002/(SICI)1098-2280(1998)31:2<113::AID-EM3>3.0.CO;2-N. ISSN 0893-6692. PMID 9544189.
- ^ Toystore
- ^ Cooper, G. S.; Longnecker, M. P.; Peters, R. K. (2004). “Ovarian Cancer Risk and Use of Phenolphthalein-Containing Laxatives”. Pharmacoepidemiology and Drug Safety 13 (1): 35–39. doi:10.1002/pds.824. PMID 14971121.
- ^ Dobrydneva, Y.; Wilson, E.; Abelt, C. J.; Blackmore, P. F. (2009). “Phenolphthalein as a Prototype Drug for a Group of Structurally Related Calcium Channel Blockers in Human Platelets”. Journal of Cardiovascular Pharmacology 53 (3): 231–240. PMID 19247192.
関連項目
[編集]外部リンク
[編集]- フェノールフタレイン溶液 理科ねっとわーく(一般公開版) - ウェイバックマシン(2017年10月5日アーカイブ分) - 文部科学省 国立教育政策研究所
- 指示薬ごとの滴定の様子 - chemguide
- フェノールフタレイン (試薬) JISK8799:2020


