「集団免疫」の版間の差分
Smilesworth (会話 | 投稿記録) en:Herd immunity (03:45, 13 January 2020 UTC) を翻訳 |
(相違点なし)
|
2020年2月9日 (日) 02:06時点における版
この記事は英語から大ざっぱに翻訳されたものであり、場合によっては不慣れな翻訳者や機械翻訳によって翻訳されたものかもしれません。 |

集団免疫(しゅうだんめんえき、英: herd immunity, herd effect, community immunity, population immunity, social immunity)とは、ある感染症に対して集団の大部分が免疫を持っている際に生じる間接的な保護効果であり、免疫を持たない人を保護する手段である[1][2]。多数の人々が免疫を持っている集団では感染の連鎖が断ち切られる可能性が高く、病気の拡大は治まるか緩やかなものとなる[3]。あるコミュニティにおいて免疫を持っている人の割合が高ければ高いほど、免疫を持たない人が感染者と接触する可能性は低くなる[1]。
個人の免疫は、感染症からの回復や予防接種によって獲得される[3]。一部の人々は医学的理由により免役を獲得することができず、集団免疫はこれらの人々に対する重要な保護手段となる[4][5]。免疫を持つ人々の割合が一定の値に達すると、集団免疫によって病気が徐々に集団から排除されるようになる[5]。この排除が世界中で達成されれば感染の数は永続的にゼロまで減少する可能性があり、この状態が撲滅または根絶と呼ばれる[6]。この手法によって天然痘は1977年に根絶され、他の感染症についても地域的な排除が行われている[7]。集団免疫は全ての感染症に適用されるわけでなく、伝染、つまりある人から他の人へうつる疾患のみに適用される[5]。例えば、破傷風は感染症であるが伝染しないため、集団免疫は適用されない[4]。
集団免疫を意味する"herd immunity"という語は、1923年に初めて用いられた[1]。1930年代に多くの小児が麻疹に対して免疫を獲得すると、免疫を持たない小児の間でも新たな感染の数が一時的に低下することが観察され、自然発生する現象として認識された[8]。その後、予防接種による集団免疫の誘導が一般的なものとなり、多くの感染症において拡大防止に成功した[9]。予防接種への反対が集団免疫の課題となっており、予防接種率が不十分なコミュニティでは予防可能な病気が根強く残ったり、再発生が起きたりしている[10][11][12]。
影響
免疫を持たない人々の保護

一部の人は、予防接種後に免疫を獲得できなかったり、医学的理由により予防接種を受けることができなかったりする[4][14][15]。また新生児も、安全上の理由やワクチンの効果を失わせる受動免疫のため、多くのワクチンを受けることができない[16]。HIV/AIDS、リンパ腫、白血病、骨髄のがん、脾臓の機能不全、化学療法や放射線療法などのために免疫不全状態となっている人は以前持っていた免疫を失っている可能性があり、また免疫不全のためにワクチンも役に立たない可能性がある[4][14][16][17]。一般的にワクチンは完璧ではなく、一部の人の免疫系ではワクチンに対する適切な免疫応答による長期免疫の獲得が起こらない可能性がある。そのため、予防接種を受けた人でもその一部は免疫を失っている可能性がある[1][18][19]。また、ワクチンに対する禁忌症によって特定の人々は免疫を獲得できない場合がある[14]。これらの人々は免疫を持たないだけでなく、その健康状態のために感染による合併症を発症するリスクも高いが、集団内の十分な割合の人々が免疫を持っていれば保護することができる可能性がある[4][14][19][20]。
ある年齢集団で高い水準の免疫が獲得されれば、他の年齢集団に対しても集団免疫を形成することができる[7]。百日咳の予防接種を成人に対して行うことで、合併症のリスクが最も高い新生児でも発生数が低下する[21][22]。新生児への伝染の大部分は身近な家族から起こるため、このことは特に重要である[7][19]。同様に、小児への肺炎球菌の予防接種は、予防接種を受けていない年下の兄弟の肺炎球菌感染症の発生数を減少させる[23]。肺炎球菌とロタウイルスに対する予防接種は、通常これらのワクチンを接種していない年上の小児や成人でも肺炎球菌やロタウイルスの感染を原因とする入院を減少させる効果が示されている[23][24][25]。インフルエンザは若い年齢集団よりも高齢集団でより重症となる傾向があるが、この集団では年齢に伴う免疫系の衰えによってインフルエンザワクチンの効果は失われてゆく[7][26]。しかし、季節性インフルエンザの予防接種を学齢期の児童に対して優先的に行うことで、高齢者に対してもある程度の保護効果が得られることが示されている[7][26]。
性感染症に関しては、一方の性に高水準の免疫があれば両方の性に集団免疫がもたらされる[9][27][28]。一方の性を対象とした性感染症ワクチンは、対象となる性でのワクチン接種率が高ければ、両性で性感染症が大きく減少する[27][28][29]。しかし、女性に対する予防接種による集団免疫がホモセクシュアルの男性にまで及ぶことはない[28]。対象となる性でのワクチン接種率が低い場合、十分な保護効果を得るためには他の性でも免疫付与を行う必要がある[27][28]。性感染症の根絶を困難にしているのは、高リスクな性行動である。感染の大部分は中程度のリスクの人物で起こるものの、他人への伝染の大部分は高リスクな性行動を行う人物によって生じている[9]。これらの理由により、両性の高リスクな人物への免疫付与を行うことが集団免疫の確立には必要である[9][28]。
選択圧
集団免疫はそれ自身が特定のウイルスに対する選択圧として働き、ウイルスの進化に影響を与える。このケースでは、エスケープ変異株(escape mutant)と呼ばれる、集団免疫を回避してより容易に拡大できる新たな株の出現が促進される[30][31]。分子レベルでは、ウイルスの表面抗原(一般的にはウイルスのカプシドタンパク質)をコードするウイルスゲノム領域に変異が蓄積してエピトープが変化する、抗原ドリフトと呼ばれる変化が生じる[32][33]。その他にも、抗原シフトと呼ばれる、別々のウイルスゲノム断片の再集合による変化が生じて新たな血清型が生み出されることもある。こちらは複数の株が出回っているときに起こりやすくなる[30][34]。このような変化が生じるとメモリーT細胞はもはやウイルスを認識できず、そのため人々は優勢株に対して免疫がない状態となる[33][34]。インフルエンザとノロウイルスのいずれの場合も、流行することで新たな優勢株が出現するまで一時的に集団免疫が誘導されるため、流行は連続的な波となる[32][34]。このウイルスの進化は集団免疫に対する課題となっており、特定の血清型に対する効果にとどまらない、広域中和抗体(broadly neutralizing antibody)や「ユニバーサルワクチン」(universal vaccine、万能ワクチン)の開発が現在行われている[31][35][36]。
血清型の置換
ある血清型に対し高水準の免疫が存在するためにその血清型の有病率が減少し、そこへ置き換わる形で他の血清型が増加する、血清型置換(serotype replacement)または血清型シフト(serotype shifting)と呼ばれる現象が生じることがある[37][38]。肺炎球菌Streptococcus pneumoniaeに対する初期のワクチンは、薬剤耐性型を含む、ワクチンに含まれる血清型の鼻咽頭保菌率を大きく減少させたが、その減少はワクチンに含まれない血清型の保菌率の増加によって完全に相殺された[23][37][38][39]。しかし、ワクチンに含まれない血清型はワクチンに含まれる血清型よりも侵襲性が低かったため、疾患の発生数が比例して増加することはなかった[37]。その後、新たに出現した血清型にも効果がある肺炎球菌ワクチンが導入され、その増加に対抗することができるようになった[23]。将来的なさらなるシフトの可能性は残されているが、それに対処する戦略としては、ワクチンに含まれる血清型の拡張や、より多くの表面抗原を含む全細胞不活化ワクチン、または複数の血清型に存在するタンパク質を標的としたワクチンの開発などが挙げられる[23][40]。
病気の根絶
ある集団において十分な期間、集団免疫が確立され維持された場合、病気は排除を余儀なくされ、伝染は蔓延しなくなる[5]。世界中で病気の排除が達成され、発生数が永続的にゼロまで低下した場合、病気の根絶が宣言される[6]。そのため、病気の根絶は感染症の拡大をコントロールする公衆衛生の取り組みの最終的な影響または結果であると考えることができる[6][7]。病気の根絶には、病気の罹患率と死亡率を皆無にすることができる、個人や医療提供者、政府にとって金銭的節約になる、病気のコントロールに使われていたリソースを他の物事に充てることができるようになる、といった利点が存在する[6]。これまでに、牛疫と天然痘の2つの病気が集団免疫と予防接種によって根絶されている[1][7][41]。現在ポリオに対しても集団免疫による根絶の取り組みが行われているが、市民の現代医療に対する不安や不信が根絶を困難なものにしている[1][42]。十分なだけの人々が予防接種を受けようとしない場合、義務的予防接種も根絶の取り組みには有益である可能性がある[43][44][45][46]。
フリーライダー
集団免疫はフリーライダー問題に対して脆弱である[47]。免疫を持たない人、特に予防接種を受けないことを選択した人は、免疫を持つ人々によって作られた集団免疫にただ乗りすることになる[47]。集団内のフリーライダーがの数が増加すると、予防できる病気のアウトブレイクがより起こりやすくなり、集団免疫の消失のためにより深刻な事態となる[10][11][12][44][46]。ただ乗りを選ぶ人の理由は、知覚的な有効性のなさ[48]、感染のリスクよりもワクチンに関するリスクのほうが大きいという考え[1][11][12][48]、ワクチンや公衆衛生当局に対する不信[49]、バンドワゴン効果や集団思考[44][50]、社会規範や同調圧力[48]、宗教的信念[11]などさまざまである。予防接種率が十分に高い場合、他の人がすでに十分に免疫を持っているので自分が免疫を持つ必要はないと確信し、ただ乗りを行う可能性が高くなる[1][46]。
機構
| 疾患 | 感染経路 | R0 | HIT |
|---|---|---|---|
| 麻疹 | 空気感染 | 12–18 | 92–95% |
| 百日咳 | 飛沫感染 | 12–17[52] | 92–94% |
| ジフテリア | 唾液 | 6–7 | 83–86% |
| 風疹 | 飛沫感染 | ||
| 天然痘 | 5–7 | 80–86% | |
| ポリオ | 糞口感染 | ||
| 流行性耳下腺炎(おたふくかぜ) | 飛沫感染 | 4–7 | 75–86% |
| SARS | 2–5[53] | 50–80% | |
| エボラ出血熱 (2014年の西アフリカエボラ出血熱流行) |
体液 | 1.5–2.5[54] | 33–60% |
| インフルエンザ (インフルエンザ・パンデミック) |
飛沫感染 | 1.5–1.8[52] | 33–44% |
病気に対して免疫を持つ人は病気の拡大の障壁として機能し、他人への伝染を低下させたり防いだりする[3]。個人の免疫は自然感染や予防接種などの人為的手段によって獲得される[3]。免疫を持つ人の割合が集団免疫閾値(herd immunity threshold、HIT)または集団免疫レベル(herd immunity level、HIL)と呼ばれる臨界比率に達すると、病気は集団内に維持されなくなり、病気の蔓延は終息する[5][30]。この閾値は基本再生産数 R0 から計算することができる。R0は、均質で十分に混ざり合う集団、すなわち全ての人々が接触を行う、完全に感受性の集団において、個々の症例から新たに引き起こされる感染の平均数である[9][30][43]。集団内で感染に対して感受性の人々の割合を S とすると、
となる地点で伝染は定常状態となる。Sは、免疫を持つ人の割合 p を用いて (1 - p) と書き換えることができる。すると、上の式は次のように変形される。
- → →
p が等式の左辺に来るように変形し、新たに pc と書かれた値が集団内での病気の伝染の拡大を止めるために必要な臨界比率、すなわち集団免疫閾値(HIT)である[9]。R0は伝染性の指標として機能し、R0値が低い場合はHITは低くなり、一方R0値が高い場合はHITは高くなる[30][43]。例えば、R0が 2 の場合、HITは理論上わずか50%であるが、R0が 10 の場合HITは90%となる[30]。これらの計算は集団が完全に感受性である、つまり病気に対する免疫を持っている人がいないことを仮定している。現実には、どの病気のどの時期の場合でも、免疫を持つ人は集団内にさまざまな割合で存在する[9]。このことを考慮するために実効再生産数 Re(effective reproductive number、Rt と書かれることもある)が用いられ、時点 t における感受性集団の割合をR0に乗ずることで、時点 t に引き起こされる感染の平均数が得られる。Reが 1 より低く維持された場合、集団内での症例は徐々に減少し、病気は排除される[9][30][55]。ある集団において病気に対する免疫を持つ人の割合がHITを上回ると、症例数はより早く減少し、アウトブレイクはさらに起こりにくくなり、起こったとしてもより小規模なものとなる[1][9]。Reが 1 を上回ると、病気は発生数の減少はみられなくなり、集団内を活発に拡散し、通常よりも多くの人々に感染が起こる[44][55]。
これらの計算には、集団が均質で十分に混ざり合う、すなわち集団内の全ての人々が接触を行うという2つ目の仮定を行っているが、現実の集団は限られた数の他人と比較的密接な接触を行って密集する傾向のある社会ネットワークとしての記述のほうが適切である。このようなネットワークでは、地理的・物理的に近接している人物の間でのみ伝染が起こる[1][43][44]。ネットワークの形状とサイズによって病気のHITは変化する可能性が高く、発生数は増加したり減少したりする[30][43]。均質でない集団においては、R0は感染力を持つ「典型的な」人物によって引き起こされる症例数の指標とみなされ、個々人がネットワーク内でどのように相互作用するかに依存するようになる[1]。ネットワーク内での相互作用はネットワーク間の相互作用よりも一般的であり、高度に連結されたネットワークでは病気の伝染はより容易に起こり、R0とHITは連結の少ないネットワークに必要な値よりも高くなる[1][44]。
増強
予防接種
集団内の免疫の水準を高める主要な方法は、予防接種である[1][56]。予防接種の概念は牛痘にかかった酪農家が天然痘に対して免疫を有するという観察に基づいたもので、天然痘予防のための牛痘ウイルスの接種として開始された[42]。十分な開発が行われたワクチンは、自然感染よりもはるかに安全な方法で保護効果をもたらす。一般的にワクチンが保護を行おうとする病気を引き起こすことはなく、重大な副作用は自然感染による合併症よりきわめて低頻度である[57][58]。免疫系は自然感染とワクチンの区別を行わず、どちらに対しても能動免疫を形成するため、予防接種によって誘導される免疫は、病気に罹患し回復する過程で誘導される免疫と同様のものである[59]。予防接種による集団免疫を達成するため、ワクチン製造者は不全率(免疫が誘導されない、または減衰する率)の低いワクチンの生産を目指し、政策立案者はその利用の推奨を目指す[56]。ワクチンの導入に成功し広く利用されるようになると、ワクチンによって保護される病気の発生数の急激な減少が観察され、必然的にその病気による入院者数や死者数も減少する[60][61][62]。
ワクチンの効果が100%であると仮定すると、集団免疫閾値を計算する式は、病気を排除するのに必要な予防接種水準 Vc を計算するためにも利用することができる[1]。しかし、ワクチンの効果は多くの場合完璧ではないため、ワクチンの有効率 E(effectiveness)を考慮に入れる必要があり、Vcは次のようになる。
E が (1 − 1/R0) よりも小さい場合、集団が完全に予防接種を受けた場合でも病気の排除は不可能になる[1]。同様に、無細胞百日咳ワクチンでみられるように、ワクチンによって誘導された免疫が減衰することがあるため、集団免疫を維持するためにはより高い水準の追加免疫が必要である[1][21]。集団内での病気の蔓延が終息すると、自然感染による集団内の感受性割合の低下がなくなり、予防接種がこの減少に寄与する唯一の手段となる[9]。有病率とワクチンの接種率、有効率との関係は、集団免疫閾値から有効率 E と集団内で予防接種を受けている割合 pv の積を引いたものとなる[9]。
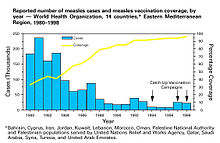
ワクチンの接種率またはワクチンの有効率の増加のいずれも病気の発生数をさらに低下させる[9]。症例数の減少率は病気のR0に依存し、R0の値が小さいほど急激な減少がみられる[9]。ワクチンは通常、特定の集団に対する医学的理由による禁忌が少なくとも1つは存在する。しかし、ワクチンの有効性と接種率が十分に高ければ、このような人々を集団免疫によって保護することができる[15][17][20]。ワクチンの有効性は、常にではないが、多くの場合受動免疫によって低下する[63][64]。そのため、一部のワクチンに関しては追加接種が推奨されていたり、他のワクチンに関しては受動免疫が消失するまで投与されなかったりする[16][20]。
受動免疫
個人の免疫は、病原体に対する抗体を持つ人物から他の人物へ移行することで、受動的にも獲得される。自然現象としては移行抗体があり、主にIgG抗体が胎盤や初乳を通じて胎児や新生児に移行する[65][66]。また人為的に行うことも可能であり、免疫を持つ人物の血清や血漿を感受性の人物への注入することにより受動免疫の獲得が行われる[59][67]。受動免疫による保護効果は即座に発揮されるが、数週間から数か月で減衰するため、集団免疫への寄与は一時的なものである[5][59][68]。インフルエンザや破傷風など、胎児や新生児が特に重症となる疾患に関しては、妊娠女性が子供への抗体移行を目的とした免疫獲得を行う場合がある[15][69][70]。同様に、感染に見舞われる可能性が高い、または感染による合併症を発症しやすいといった高リスク集団に関しても、感染を防いだり症状を軽減するために抗体の準備を行う場合がある[67]。
費用便益分析
予防接種プログラムの費用便益分析を行う際に、集団免疫が考慮に入れられる場合が多い。高い水準の免疫による正の外部性と見なされており、集団内に集団免疫が形成されない場合には出現しない、病気の減少による付加的な便益が生み出される[71][72]。そのため、費用便益分析に集団免疫を組み込むことによって費用便益比はより良いものとなり、予防接種によって防止された症例数は増大することとなる[72]。集団免疫の便益の評価を行う研究デザインとしては、成員が予防接種を受けた家庭での発生数の記録、予防接種が行われた地理的エリアと行われていないエリアの集団のランダム化比較、予防接種プログラム導入前後の発生数の観察などが行われている[73]。これらからは直接的な保護効果のみから予測される水準を超えて発生数が減少する場合があることが観察され、集団免疫がその減少に寄与していることが示唆される[73]。血清型置換が考慮に入れられた場合、予防接種から予測される便益は低下する[72]。
歴史

さまざまな程度の免疫を持つマウス集団での疾患致死率を調査する研究において、集団全体の免疫を意味する用語として"herd immunity"という語が1923年に初めて使用された[74]。集団免疫は1930年代には自然発生する現象として認識されていた。A. W. Hedrichはボルティモアにおける麻疹の疫学についての研究を発表し、多くの小児が麻疹に対する免疫を獲得したのち、感受性の小児の間でも新たな感染の数が一時的に減少したことに注目した[8]。この知見にもかかわらず、麻疹をコントロールし除去する取り組みは1960年代に麻疹ワクチンの集団予防接種が開始されるまで成功しなかった[8]。その後の集団予防接種や、病気の根絶についての議論、予防接種の費用便益分析によって、"herd immunity"という語が広く用いられるようになった[1]。1970年代に病気の集団免疫閾値の計算に用いられる定理が開発された[1]。1960年代から1970年代の天然痘根絶運動を通じて、アウトブレイクの拡大を防ぐために感染した人物の周囲の全ての人物に免疫付与を行う包囲接種(ring vaccination)が行われるようになった[75]。
集団予防接種と包囲接種が行われるようになると、集団免疫の複雑さと困難が現れるようになった。感染症の拡大のモデル化は当初、集団全体が感受性であり良く混ざり合うといった、現実には存在しない多数の仮定をしていたため、より正確なモデルの開発が行われている[1]。近年、出回っている微生物の優勢株が集団免疫のために変化する可能性があることが認識されたが、それは集団免疫が微生物に対する選択圧としてはたらく、またはある株に対する集団免疫が他の既存株の拡大をもたらすためである[32][38]。ワクチンに対する論争や予防接種に反対するさまざまな理由によって、特定のコミュニティでは集団免疫が低下したり消失したりしており、予防可能な病気が根強く残ったり、再発生が起きたりしている[10][11][12]。
出典
- ^ a b c d e f g h i j k l m n o p q r s Fine, P.; Eames, K.; Heymann, D. L. (1 April 2011). “'Herd immunity': A rough guide”. Clinical Infectious Diseases 52 (7): 911–16. doi:10.1093/cid/cir007. PMID 21427399.
- ^ Gordis, L. (14 November 2013). Epidemiology. Elsevier Health Sciences. pp. 26–27. ISBN 978-1455742516 2015年3月29日閲覧。
- ^ a b c d Merrill, R. M. (2013). Introduction to Epidemiology. Jones & Bartlett Publishers. pp. 68–71. ISBN 978-1449645175 2015年3月29日閲覧。
- ^ a b c d e “Herd Immunity”. Oxford Vaccine Group, University of Oxford. 2017年12月12日閲覧。
- ^ a b c d e f Somerville, M.; Kumaran, K.; Anderson, R. (19 January 2012). Public Health and Epidemiology at a Glance. John Wiley & Sons. pp. 58–59. ISBN 978-1118308646 2015年3月29日閲覧。
- ^ a b c d Cliff, A.; Smallman-Raynor, M. (11 April 2013). Oxford Textbook of Infectious Disease Control: A Geographical Analysis from Medieval Quarantine to Global Eradication. Oxford University Press. pp. 125–36. ISBN 978-0199596614 2015年3月29日閲覧。
- ^ a b c d e f g Kim, T. H.; Jonhstone, J.; Loeb, M. (September 2011). “Vaccine herd effect”. Scandinavian Journal of Infectious Diseases 43 (9): 683–89. doi:10.3109/00365548.2011.582247. PMC 3171704. PMID 21604922.
- ^ a b c * Hinman, A. R.; Orenstein, W. A.; Papania, M. J. (1 May 2004). “Evolution of measles elimination strategies in the United States”. The Journal of Infectious Diseases 189 (Suppl 1): S17–22. doi:10.1086/377694. PMID 15106084.
*Sencer, D. J.; Dull, H. B.; Langmuir, A. D. (March 1967). “Epidemiologic basis for eradication of measles in 1967”. Public Health Reports 82 (3): 253–56. doi:10.2307/4592985. JSTOR 4592985. PMC 1919891. PMID 4960501. - ^ a b c d e f g h i j k l m Garnett, G. P. (1 February 2005). “Role of Herd Immunity in Determining the Effect of Vaccines against Sexually Transmitted Disease”. The Journal of Infectious Diseases 191 (Suppl 1): S97–106. doi:10.1086/425271. PMID 15627236.
- ^ a b c Quadri-Sheriff, M.; Hendrix, K. S.; Downs, S. M.; Sturm, L. A.; Zimet, G. D.; Finnell, S. M. (September 2012). “The role of herd immunity in parents' decision to vaccinate children: a systematic review”. Pediatrics 130 (3): 522–30. doi:10.1542/peds.2012-0140. PMID 22926181.
- ^ a b c d e Dubé, E.; Laberge, C.; Guay, M.; Bramadat, P.; Roy, R.; Bettinger, J. (August 2013). “Vaccine hesitancy: an overview”. Human Vaccines & Immunotherapeutics 9 (8): 1763–73. doi:10.4161/hv.24657. PMC 3906279. PMID 23584253.
- ^ a b c d Ropeik, D. (August 2013). “How society should respond to the risk of vaccine rejection”. Human Vaccines & Immunotherapeutics 9 (8): 1815–18. doi:10.4161/hv.25250. PMC 3906287. PMID 23807359.
- ^ “The case for vaccination”. North & South. Bauer Media. 2015年8月24日時点のオリジナルよりアーカイブ。2015年7月3日閲覧。
- ^ a b c d Cesaro, S.; Giacchino, M.; Fioredda, F.; Barone, A.; Battisti, L.; Bezzio, S.; Frenos, S.; De Santis, R.; Livadiotti, S.; Marinello, S.; Zanazzo, A. G.; Caselli, D. (2014). “Guidelines on vaccinations in paediatric haematology and oncology patients”. Biomed Res. Int. 2014: 707691. doi:10.1155/2014/707691. PMC 4020520. PMID 24868544.
- ^ a b c Munoz, F. M. (2013). “Maternal immunization: An update for pediatricians”. Pediatric Annals 42 (8): 153–58. doi:10.3928/00904481-20130723-09. PMID 23910028.
- ^ a b c National Center for Immunization and Respiratory Diseases (2011). “General recommendations on immunization – recommendations of the Advisory Committee on Immunization Practices (ACIP)”. MMWR. Recommendations and Reports : Morbidity and Mortality Weekly Report. Recommendations and Reports / Centers for Disease Control 60 (2): 1–64. PMID 21293327.
- ^ a b Wolfe, R. M. (2012). “Update on adult immunizations”. The Journal of the American Board of Family Medicine 25 (4): 496–510. doi:10.3122/jabfm.2012.04.100274. PMID 22773718.
- ^ Esposito, S; Bosis, S; Morlacchi, L; Baggi, E; Sabatini, C; Principi, N (2012). “Can infants be protected by means of maternal vaccination?”. Clinical Microbiology and Infection 18 Suppl 5: 85–92. doi:10.1111/j.1469-0691.2012.03936.x. PMID 22862749.
- ^ a b c Rakel, D.; Rakel, R. E. (2015). Textbook of Family Medicine. Elsevier Health Sciences. pp. 99, 187. ISBN 978-0323313087 2015年3月30日閲覧。
- ^ a b c Tulchinsky, T. H.; Varavikova, E. A. (26 March 2014). The New Public Health: An Introduction for the 21st Century. Academic Press. pp. 163–82. ISBN 978-0124157675 2015年3月30日閲覧。
- ^ a b McGirr, A; Fisman, D. N. (2015). “Duration of Pertussis Immunity After DTaP Immunization: A Meta-analysis”. Pediatrics 135 (2): 331–43. doi:10.1542/peds.2014-1729. PMID 25560446.
- ^ Zepp, F; Heininger, U; Mertsola, J; Bernatowska, E; Guiso, N; Roord, J; Tozzi, A. E.; Van Damme, P (2011). “Rationale for pertussis booster vaccination throughout life in Europe”. The Lancet Infectious Diseases 11 (7): 557–70. doi:10.1016/S1473-3099(11)70007-X. PMID 21600850.
- ^ a b c d e Pittet, L. F.; Posfay-Barbe, K. M. (2012). “Pneumococcal vaccines for children: A global public health priority”. Clinical Microbiology and Infection 18 Suppl 5: 25–36. doi:10.1111/j.1469-0691.2012.03938.x. PMID 22862432.
- ^ Nakagomi, O; Iturriza-Gomara, M; Nakagomi, T; Cunliffe, N. A. (2013). “Incorporation of a rotavirus vaccine into the national immunisation schedule in the United Kingdom: A review”. Expert Opinion on Biological Therapy 13 (11): 1613–21. doi:10.1517/14712598.2013.840285. PMID 24088009.
- ^ Lopman, B. A.; Payne, D. C.; Tate, J. E.; Patel, M. M.; Cortese, M. M.; Parashar, U. D. (2012). “Post-licensure experience with rotavirus vaccination in high and middle income countries; 2006 to 2011”. Current Opinion in Virology 2 (4): 434–42. doi:10.1016/j.coviro.2012.05.002. PMID 22749491.
- ^ a b Kim, T. H. (2014). “Seasonal influenza and vaccine herd effect”. Clinical and Experimental Vaccine Research 3 (2): 128–32. doi:10.7774/cevr.2014.3.2.128. PMC 4083064. PMID 25003085.
- ^ a b c Lowy, D. R.; Schiller, J. T. (2012). “Reducing HPV-associated cancer globally”. Cancer Prevention Research 5 (1): 18–23. doi:10.1158/1940-6207.CAPR-11-0542. PMC 3285475. PMID 22219162.
- ^ a b c d e Lenzi, A; Mirone, V; Gentile, V; Bartoletti, R; Ficarra, V; Foresta, C; Mariani, L; Mazzoli, S et al. (2013). “Rome Consensus Conference – statement; human papilloma virus diseases in males”. BMC Public Health 13: 117. doi:10.1186/1471-2458-13-117. PMC 3642007. PMID 23391351.
- ^ Garland, S. M.; Skinner, S. R.; Brotherton, J. M. (2011). “Adolescent and young adult HPV vaccination in Australia: Achievements and challenges”. Preventive Medicine 53 Suppl 1: S29–35. doi:10.1016/j.ypmed.2011.08.015. PMID 21962468.
- ^ a b c d e f g h Rodpothong, P; Auewarakul, P (2012). “Viral evolution and transmission effectiveness”. World Journal of Virology 1 (5): 131–34. doi:10.5501/wjv.v1.i5.131. PMC 3782273. PMID 24175217.
- ^ a b Corti, D; Lanzavecchia, A (2013). “Broadly neutralizing antiviral antibodies”. Annual Review of Immunology 31: 705–42. doi:10.1146/annurev-immunol-032712-095916. PMID 23330954.
- ^ a b c Bull, R. A.; White, P. A. (2011). “Mechanisms of GII.4 norovirus evolution”. Trends in Microbiology 19 (5): 233–40. doi:10.1016/j.tim.2011.01.002. PMID 21310617.
- ^ a b Ramani, S; Atmar, R. L.; Estes, M. K. (2014). “Epidemiology of human noroviruses and updates on vaccine development”. Current Opinion in Gastroenterology 30 (1): 25–33. doi:10.1097/MOG.0000000000000022. PMC 3955997. PMID 24232370.
- ^ a b c Pleschka, S (2013). “Overview of Influenza Viruses”. Swine Influenza. Current Topics in Microbiology and Immunology. 370. pp. 1–20. doi:10.1007/82_2012_272. ISBN 978-3642368707. PMID 23124938
- ^ Reperant, L. A.; Rimmelzwaan, G. F.; Osterhaus, A. D. (2014). “Advances in influenza vaccination”. F1000Prime Reports 6: 47. doi:10.12703/p6-47. PMC 4047948. PMID 24991424.
- ^ Han, T; Marasco, W. A. (2011). “Structural basis of influenza virus neutralization”. Annals of the New York Academy of Sciences 1217: 178–90. doi:10.1111/j.1749-6632.2010.05829.x. PMC 3062959. PMID 21251008.
- ^ a b c Weinberger, D. M.; Malley, R; Lipsitch, M (2011). “Serotype replacement in disease after pneumococcal vaccination”. The Lancet 378 (9807): 1962–73. doi:10.1016/S0140-6736(10)62225-8. PMC 3256741. PMID 21492929.
- ^ a b c McEllistrem, M. C.; Nahm, M. H. (2012). “Novel pneumococcal serotypes 6C and 6D: Anomaly or harbinger”. Clinical Infectious Diseases 55 (10): 1379–86. doi:10.1093/cid/cis691. PMC 3478140. PMID 22903767.
- ^ Dagan, R (2009). “Impact of pneumococcal conjugate vaccine on infections caused by antibiotic-resistant Streptococcus pneumoniae”. Clinical Microbiology and Infection 15 Suppl 3: 16–20. doi:10.1111/j.1469-0691.2009.02726.x. PMID 19366365.
- ^ Lynch Jp, 3rd; Zhanel, G. G. (2010). “Streptococcus pneumoniae: Epidemiology and risk factors, evolution of antimicrobial resistance, and impact of vaccines”. Current Opinion in Pulmonary Medicine 16 (3): 217–25. doi:10.1097/MCP.0b013e3283385653. PMID 20375783.
- ^ Njeumi, F; Taylor, W; Diallo, A; Miyagishima, K; Pastoret, P. P.; Vallat, B; Traore, M (2012). “The long journey: A brief review of the eradication of rinderpest”. Revue Scientifique et Technique (International Office of Epizootics) 31 (3): 729–46. PMID 23520729.
- ^ a b Smith, K. A. (2013). “Smallpox: Can we still learn from the journey to eradication?”. The Indian Journal of Medical Research 137 (5): 895–99. PMC 3734679. PMID 23760373.
- ^ a b c d e Perisic, A; Bauch, C. T. (2009). “Social contact networks and disease eradicability under voluntary vaccination”. PLoS Computational Biology 5 (2): e1000280. doi:10.1371/journal.pcbi.1000280. PMC 2625434. PMID 19197342.
- ^ a b c d e f Fu, F; Rosenbloom, D. I.; Wang, L; Nowak, M. A. (2011). “Imitation dynamics of vaccination behaviour on social networks”. Proceedings of the Royal Society B: Biological Sciences 278 (1702): 42–49. doi:10.1098/rspb.2010.1107. PMC 2992723. PMID 20667876.
- ^ Wicker, S; Maltezou, H. C. (2014). “Vaccine-preventable diseases in Europe: Where do we stand?”. Expert Review of Vaccines 13 (8): 979–87. doi:10.1586/14760584.2014.933077. PMID 24958075.
- ^ a b c Fukuda, E.; Tanimoto, J. (2014). Impact of Stubborn Individuals on a Spread of Infectious Disease under Voluntary Vaccination Policy. Springer. pp. 1–10. ISBN 978-3319133591 2015年3月30日閲覧。
- ^ a b Barrett, Scott (2014). “Global Public Goods and International Development”. In J. Warren Evans, Robin Davies. Too Global To Fail: The World Bank at the Intersection of National and Global Public Policy in 2025. World Bank Publications. pp. 13–18. ISBN 978-1464803109
- ^ a b c Gowda, C; Dempsey, A. F. (2013). “The rise (and fall?) of parental vaccine hesitancy”. Human Vaccines & Immunotherapeutics 9 (8): 1755–62. doi:10.4161/hv.25085. PMC 3906278. PMID 23744504.
- ^ Ozawa, S; Stack, M. L. (2013). “Public trust and vaccine acceptance – international perspectives”. Human Vaccines & Immunotherapeutics 9 (8): 1774–78. doi:10.4161/hv.24961. PMC 3906280. PMID 23733039.
- ^ Parker, A. M.; Vardavas, R; Marcum, C. S.; Gidengil, C. A. (2013). “Conscious consideration of herd immunity in influenza vaccination decisions”. American Journal of Preventive Medicine 45 (1): 118–21. doi:10.1016/j.amepre.2013.02.016. PMC 3694502. PMID 23790997.
- ^ Unless noted, R0 values are from: History and Epidemiology of Global Smallpox Eradication Archived 2017-03-17 at the Wayback Machine. From the training course titled "Smallpox: Disease, Prevention, and Intervention". The Centers for Disease Control and Prevention and the World Health Organization. Slide 17. Retrieved 13 March 2015.
- ^ a b Biggerstaff, M; Cauchemez, S; Reed, C; Gambhir, M; Finelli, L (2014). “Estimates of the reproduction number for seasonal, pandemic, and zoonotic influenza: A systematic review of the literature”. BMC Infectious Diseases 14: 480. doi:10.1186/1471-2334-14-480. PMC 4169819. PMID 25186370.
- ^ Wallinga, J; Teunis, P (2004). “Different epidemic curves for severe acute respiratory syndrome reveal similar impacts of control measures”. American Journal of Epidemiology 160 (6): 509–16. doi:10.1093/aje/kwh255. PMID 15353409.
- ^ Althaus, C. L. (2014). “Estimating the Reproduction Number of Ebola Virus (EBOV) During the 2014 Outbreak in West Africa”. PLoS Currents 6. doi:10.1371/currents.outbreaks.91afb5e0f279e7f29e7056095255b288. PMC 4169395. PMID 25642364.
- ^ a b Dabbaghian, V.; Mago, V. K. (27 October 2013). Theories and Simulations of Complex Social Systems. Springer. pp. 134–35. ISBN 978-3642391491 2015年3月29日閲覧。
- ^ a b Rashid, H; Khandaker, G; Booy, R (2012). “Vaccination and herd immunity: What more do we know?”. Current Opinion in Infectious Diseases 25 (3): 243–49. doi:10.1097/QCO.0b013e328352f727. PMID 22561998.
- ^ Maglione, M. A.; Das, L; Raaen, L; Smith, A; Chari, R; Newberry, S; Shanman, R; Perry, T et al. (2014). “Safety of vaccines used for routine immunization of U.S. Children: A systematic review”. Pediatrics 134 (2): 325–37. doi:10.1542/peds.2014-1079. PMID 25086160.
- ^ Demicheli, V; Rivetti, A; Debalini, M. G.; Di Pietrantonj, C (2012). “Vaccines for measles, mumps and rubella in children”. Cochrane Database of Systematic Reviews. 2. CD004407. doi:10.1002/14651858.CD004407.pub3. PMC 6458016. PMID 22336803
- ^ a b c Pommerville, J. C. (2 December 2014). Fundamentals of Microbiology: Body Systems Edition. Jones & Bartlett Publishers. pp. 559–63. ISBN 978-1284057102 2015年3月30日閲覧。
- ^ Papaloukas, O; Giannouli, G; Papaevangelou, V (2014). “Successes and challenges in varicella vaccine”. Therapeutic Advances in Vaccines 2 (2): 39–55. doi:10.1177/2051013613515621. PMC 3991154. PMID 24757524.
- ^ Shann, F (2013). “Nonspecific effects of vaccines and the reduction of mortality in children”. Clinical Therapeutics 35 (2): 109–14. doi:10.1016/j.clinthera.2013.01.007. PMID 23375475.
- ^ Visser, A; Hoosen, A (2012). “Haemophilus influenzae type b conjugate vaccines - a South African perspective”. Vaccine 30 Suppl 3: C52–57. doi:10.1016/j.vaccine.2012.06.022. hdl:2263/20792. PMID 22939022.
- ^ Leuridan, E; Sabbe, M; Van Damme, P (2012). “Measles outbreak in Europe: Susceptibility of infants too young to be immunized”. Vaccine 30 (41): 5905–13. doi:10.1016/j.vaccine.2012.07.035. PMID 22841972.
- ^ Hodgins, D. C.; Shewen, P. E. (2012). “Vaccination of neonates: Problem and issues”. Vaccine 30 (9): 1541–59. doi:10.1016/j.vaccine.2011.12.047. PMID 22189699.
- ^ Chucri, T. M.; Monteiro, J. M.; Lima, A. R.; Salvadori, M. L.; Kfoury Jr, J. R.; Miglino, M. A. (2010). “A review of immune transfer by the placenta”. Journal of Reproductive Immunology 87 (1–2): 14–20. doi:10.1016/j.jri.2010.08.062. PMID 20956021.
- ^ Palmeira, P; Quinello, C; Silveira-Lessa, A. L.; Zago, C. A.; Carneiro-Sampaio, M (2012). “IgG placental transfer in healthy and pathological pregnancies”. Clinical and Developmental Immunology 2012: 1–13. doi:10.1155/2012/985646. PMC 3251916. PMID 22235228.
- ^ a b Parija, S. C. (10 February 2014). Textbook of Microbiology & Immunology. Elsevier Health Sciences. pp. 88–89. ISBN 978-8131236246 2015年3月30日閲覧。
- ^ Detels, R.; Gulliford, M.; Karim, Q. A.; Tan, C. C. (1 February 2015). Oxford Textbook of Global Public Health. Oxford University Press. p. 1490. ISBN 978-0199661756 2015年3月30日閲覧。
- ^ Demicheli, Vittorio; Barale, Antonella; Rivetti, Alessandro (2015-07-06). “Vaccines for women for preventing neonatal tetanus”. The Cochrane Database of Systematic Reviews (7): CD002959. doi:10.1002/14651858.CD002959.pub4. ISSN 1469-493X. PMID 26144877.
- ^ Swamy, G. K.; Garcia-Putnam, R (2013). “Vaccine-preventable diseases in pregnancy”. American Journal of Perinatology 30 (2): 89–97. doi:10.1055/s-0032-1331032. PMID 23271378.
- ^ Bärnighausen, T.; Bloom, D. E.; Cafiero-Fonseca, E. T.; O'Brien, J. C. (26 August 2014). “Valuing vaccination”. Proc Natl Acad Sci U S A 111 (34): 12313–19. doi:10.1073/pnas.1400475111. PMC 4151736. PMID 25136129.
- ^ a b c Deogaonkar, R.; Hutubessy, R.; van der Putten I.; Evers S.; Jit M. (16 October 2012). “Systematic review of studies evaluating the broader economic impact of vaccination in low and middle income countries”. BMC Public Health 12: 878. doi:10.1186/1471-2458-12-878. PMC 3532196. PMID 23072714.
- ^ a b Jit, M.; Newall, A. T.; Beutels, P. (April 2013). “Key issues for estimating the impact and cost-effectiveness of seasonal influenza vaccination strategies”. Hum Vaccin Immunother 9 (4): 834–40. doi:10.4161/hv.23637. PMC 3903903. PMID 23357859.
- ^ Topley, W. W. C.; Wilson, G. S. (May 1923). “The Spread of Bacterial Infection. The Problem of Herd-Immunity”. The Journal of Hygiene 21 (3): 243–249. doi:10.1017/s0022172400031478. PMC 2167341. PMID 20474777.
- ^ Strassburg, M. A. (1982). “The global eradication of smallpox”. American Journal of Infection Control 10 (2): 53–59. doi:10.1016/0196-6553(82)90003-7. PMID 7044193.
外部リンク
- A visual simulation of herd immunity written by Shane Killian and modified by Robert Webb






