サルビノリンA
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 法的規制 |
|
| 投与経路 | Buccal/Sublingual, Smoking |
| 識別 | |
| CAS番号 |
83729-01-5 |
| ATCコード | none |
| PubChem | CID: 128563 |
| IUPHAR/BPS | 1666 |
| ChemSpider |
113947 |
| ChEMBL |
CHEMBL445332 |
| 化学的データ | |
| 化学式 | C23H28O8 |
| 分子量 | 432.46362 g/mol |
| |
| 物理的データ | |
| 融点 | 238 - 240 °C (460 - 464 °F) (also reported 242-244 °C)[1] |
| 沸点 | 760.2 °C (1,400.4 °F) |
| 水への溶解量 | 25.07 mg/L at 25 °C (water, est) mg/mL (20 °C) |
| 比旋光度 | -45.3 °C at 22 deg C/D (c = 8.530 CHCl3); -41 °C at 25°C/D (c = 1 in CHCl3) |
サルビノリンA(Salvinorin A)は、原住民であるマサテコ族のシャーマンが歴史的に幻覚剤として用いてきたサルビア・ディビノラムの主要な活性向精神性分子である[2]。
ジメチルトリプタミン、シロシビン、メスカリン等の他の天然に生じる幻覚剤分子とは、窒素原子を含まない点で構造的に異なる。そのため、アルカロイドではなく、テルペノイドに分類される[3]。また、他の幻覚剤とは主観的体験も異なり、解離性とされている[2]。
サルビノリンAの向精神性の活性は、摂取法によって、効果が数分から1時間程度続く[4]。
サルビノリンAは、構造的に類似した他のサルビノリン類とともに見られる。サルビノリンは、trans-ネオクレロダンジテルペンである。κ-オピオイド受容体のアゴニストであり、アルカロイド以外でこの受容体に作用する物質として初めて発見された。薬理機構は、ブライアン・L・ロスの研究室で解明された。
歴史[編集]
サルビノリンAは、1982年にメキシコでアルフレド・オルテガらにより発見され命名された。彼らは、分光法とX線回折を合わせて用い、この化合物が二環式ジテルペンを持つ構造であることを明らかにした[5]。ほぼ同じ時期、Leander Julián Valdés IIIは、博士課程研究の一環としてこの分子を単離し、1983年に発表した[6]。Valdésはこの物質をディビノラム(divinorum)と名付け、またそのアナログを単離してディビノラムBと名付けた。その後、この研究が1984年に発表された後、それぞれサルビノリンA、サルビノリンBという名前に訂正された[7]。Valdésは、後にサルビノリンCも単離した。
薬理学[編集]
サルビノリンAは、化学式C23H28O8のtrans-ネオクレロダンジテルペンである[8]。他の既知のオピオイド受容体リガンドとは異なり、塩基性窒素原子を含まずアルカロイドではない[9]。サルビノリンAは、LSD、メスカリン等の「古典的な」 幻覚剤の主な作用の原因となる、分子標的の5-HT2Aセロトニン受容体には作用しない[9]。
力価と選択性[編集]
サルビノリンAは、一番少なくて200μgの用量で効果を示す[8][10][11]。ただし、20-30μgで作用するLSDのような合成化合物は、もっと力価が高い[12]。研究により、サルビノリンAは、強いκ-オピオイド受容体アゴニストであることが明らかになった[8]。解離定数が1.0 nM(ナノモル/L)と低いことが示すとおり、この受容体に高い親和性がある[13]。マウスにおけるサルビノリンAの作用がκ-オピオイド受容体のアンタゴニストによって阻害されたことが報告されている[14]。さらに、最近になって、サルビノリンAはドーパミンD2受容体のさらに強いパーシャルアゴニストとしても作用することが示された。親和性は5-10 nMで、内活性は40-60%であった。EC50は48 nMで、κ-オピオイド受容体の235 nMより約5倍も高かった[15]。これは、ドーパミンD2受容体も、その効果において重要な役割を果たしていることを示している[15]。
サルビノリンAは、この作用機序を介して幻視の状態を誘発することが知られている、唯一の天然に生じる物質である。エナドリン、ケタゾシン、ペンタゾシンやその関連化合物等の合成κ-オピオイドアゴニストは、同様の幻覚および解離作用を示す。
サルビノリンAの力価は、毒性とは異なる。ヒトが曝露されている何倍もの量を慢性的に投与されたマウスに、臓器障害は見られなかった。しかし、血圧に対しては、サルビノリンAの投与後、20-40分後に、対照群と比べて1.5-2倍の上昇が見られたという報告があるが、統計的な結論は出せていない[16]。
腸運動に対する効果[編集]
サルビノリンAには、強いκ-オピオイド活性化作用によって、過剰な腸運動を妨げる能力がある。回腸の組織に対するサルビノリンAの作用機構は、「シナプス前作用」と呼ばれる。これは、電流に誘導される収縮を変化できるが、外生のアセチルコリンに対しては影響を与えない[17]。サルビノリンAによる腸組織の収縮抑制作用の薬理学的に重要な点は、これが炎症を起こした組織でのみ働き、通常の組織では働かないため。副作用が少ないという点である[18]。
溶解性[編集]
サルビノリンAは、エタノールやアセトンのような有機溶媒に溶解するが、水にはほとんど溶けない[19]。カンナビノイドやクルクミノイド等の関連するテルペノイドと同様に、脂質にも溶解させることができる。
尿中の検出[編集]
580 μgの純粋な薬物を吸ったヒトは、最初の1時間での尿中のサルビノリンA量は、2.4-10.9 μg/Lとなるが、1.5時間後には、ガスクロマトグラフィーや液体クロマトグラフィーでの検出限界以外まで落ちる[20]。
関連化合物[編集]
サルビア・ディビノラムからは、他のサルビノリンやジビナトリン、サルビニシン等、他のテルペノイドが多く単離されている。しかし、これらの物質の中には、κ-オピオイド受容体とμM以下のレベルの高い親和性を持つものはなく、これらがこの植物による精神活性に寄与しているという証拠はない[21][22]。
合成[編集]
生合成[編集]
サルビノリンAの生合成の出発物質は、炭素13と水素2で同位体標識した前駆体を用いて、核磁気共鳴と質量分析法による分析で解明された。その結果、植物のテルペノイド合成で一般的なメバロン酸経路ではなく、1-デオキシ-D-キシルロース-5-リン酸経路(非メバロン酸経路)によって生合成されることが明らかになった[23]。
テルペノイドは、イソペンテニル二リン酸とジメチルアリル二リン酸の、2つの5炭素前駆体から生合成される。核磁気共鳴と質量分析を用いたZjawionyの研究により、サルビノリンAの生合成は、1-デオキシ-D-キシルロース-5-リン酸経路を通ることが示唆された。 この経路では、解糖系の中間体であるD-グリセルアルデヒド-3-リン酸とピルビン酸が脱炭酸により、1-デオキシ-D-キシルロース-5-リン酸に変換する。続いてNADPHによる還元で、4-ジホスホシチジル-2-C-メチル-D-エリトリトール、4-ジホスホシチジル-2C-メチル-D-エリトリトール-2-リン酸の中間体を経て、2C-メチル-D-エリトリトール-2,4-シクロ二リン酸が生じる。ここから、イソペンテニル二リン酸とジメチルアリル二リン酸が生成する。

ジメチルアリル二リン酸のイオン化により生じるアリル炭素から、trans位に新しい二重結合を持ったモノテルペン二リン酸であるゲラニルピロリン酸が生成される。続いてイソペンテニル二リン酸が付加することで、ジテルペンのゲラニルゲラニルピロリン酸が生成する。ゲラニルゲラニルピロリン酸の求電子付加による環化が起き、さらにメチル基と水素化物基が転位することで、クレロダン二リン酸が生成する。さらに酸化と環化を経ることで、クレロダンからサルビノリンAが生合成される。

他の多くの植物由来の幻覚剤と同様に、サルビノリンAは、葉の表皮の外側に存在する腺毛状突起から分泌される[24][25]。
化学合成[編集]
渡環のマイケル付加を用いたサルビノリンAの全不斉合成は、2007年にエヴァンスらにより達成された。30工程で収率は約4.5%だった[26]。より最近では日本のグループが24工程、0.15%の収率を得た[27]。
分子内ディールス・アルダー反応によるサルビノリンAのtrans-デカリン環へのアプローチは、フォーサイスらにより記述された[28]。
サルビノリンAの合成の試みは、RMIT大学のグループによっても、α,β-不飽和ラクトンの官能基を有するシクロヘキサノンからの収束的合成により行われた[29]。
他のサルビノリン[編集]
サルビノリンAは、サルビア・ディビノラムに含まれるいくつかの構造的に関連したサルビノリンのうちの1つである。サルビノリンAは、不活性なサルビノリンBをアセチル化することで得られる。脱アセチル化アナログのサルビノリンBは、ヒトへの活性を欠く。サルビノリンCは、サルビノリンAよりも強い効力を持つ可能性があると考えられているが、ヒトでの試験や受容体結合検査では裏付けられていない。サルビノリンAは、恐らく唯一活性を持つ天然のサルビノリンである[22]。
| 名前 | 構造 | R1 | R2 | 活性 |
|---|---|---|---|---|
| サルビノリンA |  |
-OCOCH3 | − | 活性 |
| サルビノリンB | -OH | − | 不活性 | |
| サルビノリンC | 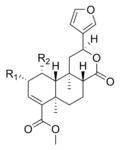 |
-OCOCH3 | -OCOCH3 | 未知 |
| サルビノリンD | -OH | -OCOCH3 | 不活性 | |
| サルビノリンE | -OCOCH3 | -OH | 不活性 | |
| サルビノリンF | -H | -OH | 未知 |
最近発見されたサルビノリンJは、構造的にはサルビノリンEに最も近く、17番炭素に第二級アルコールではなくケトンが結合している[30]。
半合成アナログ[編集]
サルビノリン誘導体の研究では、多くの半合成化合物が作成されており、そのうちいくつかはサルビノリンBから容易に合成することができる。大部分の誘導体は、サルビノリンAと同様に選択的κ-オピオイドアゴニストであるが、より強力なものもあり、最も強い2-エトキシメチルサルビノリンBは、サルビノリンAよりも10倍も強い。ヘルキノリンのように、κ-オピオイドへの活性が弱く、μ-オピオイド受容体のアゴニストとしての活性が強いものもある[31][32][33][34][35][36][37][38]。
薬理学的作用[編集]
サルビノリンAのヒトへの作用に関する研究は少ない。そのうちの1つでは、作用のピークは約2分後であり、主観的効果はセロトニン作動性幻覚剤と重なり、想起や認識記憶の一時的な障害であることが示された[39]。
アイオワ大学の研究者による研究で、鎮痛剤や薬物依存症の治療薬として用いられる可能性があることが示された[40][41]。κ-オピオイドアゴニストは、アルコール、コカイン、オピエートなど全ての種類の依存に非常に有効である[42]。
規制[編集]
サルビノリンAは、その向精神作用と鎮痛作用のため、サルビア・ディビノラムとともに規制されることがある。
スウェーデン[編集]
リクスダーゲンの保健省は、2006年4月1日時点で、Lagen om förbud mot vissa hälsofarliga varor法の下でサルビノリンAを「健康に害のあるもの」(”health hazerd”)に分類しており、販売や所持を禁じている[43]。
出典[編集]
- ^ salvinorin A, PubChem 2012年11月23日閲覧。
- ^ a b “Dose-related Effects of Salvinorin A in Humans: Dissociative, Hallucinogenic, and Memory Effects”. National Center for Biotechnology Information (2012年11月8日). 2014年9月4日閲覧。
- ^ “Salvia Chemistry”. 2014年9月4日閲覧。 “Unique in it’s structure, salvinorin A is considered a diterpenoid and not an alkaloid (opiates fall into this category), due to it’s lack of nitrogen atoms.”
- ^ Roth BL, Baner K, Westkaemper R, Siebert D, Rice KC, Steinberg S, Ernsberger P, Rothman RB (2002). “Salvinorin A: a potent naturally occurring nonnitrogenous κ opioid selective agonist”. Proceedings of the National Academy of Sciences U.S.A. 99 (18): 11934–9. doi:10.1073/pnas.182234399. PMC 129372. PMID 12192085.
- ^ Ortega A, Blount JF, Manchard PD. (1982). “Salvinorin, a new trans-neoclerodane diterpene from Salvia divinorum (Labiatae)”. Journal of the Chemical Society, Perkins Transactions I: 2505–8. doi:10.1039/P19820002505.
- ^ Valdés LJJ III (1983). The pharmacognosy of Salvia divinorum (Epling and Jativa-M): An Investigation of Ska Maria Pastora (Mexico) (PhD thesis). University of Michigan.
- ^ Valdés III LJJ, Butler WM, Hatfield GM, Paul AG, Koreeda M. (1984). “Divinorin A, a psychotropic terpenoid, and divinorin B from the hallucinogenic Mexican mint Salvia divinorum”. Journal of Organic Chemistry 49 (24): 4716–20. doi:10.1021/jo00198a026.
- ^ a b c Prisinzano TE (2005). “Psychopharmacology of the hallucinogenic sage Salvia divinorum”. Life Sciences 78 (5): 527–31. doi:10.1016/j.lfs.2005.09.008. PMID 16213533.
- ^ a b Harding WW, Schmidt M, Tidgewell K, Kannan P, Holden KG, Gilmour B, Navarro H, Rothman RB, Prisinzano TE (2006). “Synthetic studies of neoclerodane diterpenes from Salvia divinorum: semisynthesis of salvinicins A and B and other chemical transformations of salvinorin A”. Journal of Natural Products 69 (1): 107–12. doi:10.1021/np050398i. PMC 2544632. PMID 16441078.
- ^ Imanshahidi M, Hosseinzadeh H (2006). “The pharmacological effects of Salvia species on the central nervous system”. Phytotherapy Research 20 (6): 427–37. doi:10.1002/ptr.1898. PMID 16619340. "However, when smoked (in a manner similar to free base cocaine), the compound is effective in doses of 200–500 μg and produces visions that last from 30 minutes to an hour or two, while doses over 2 mg are effective for much longer. At doses greater than 500 μg the subject is often no longer aware of their surroundings and may enter an uncontrollable delirium. This compound is the most potent naturally occurring hallucinogen thus far isolated."
- ^ Marushia, Robin (2002). “Salvia divinorum: The Botany, Ethnobotany, Biochemistry and Future of a Mexican Mint”. Ethnobotany. オリジナルのOctober 7, 2007時点におけるアーカイブ。 2006年12月23日閲覧。.
- ^ Greiner T, Burch NR, Edelberg R (1958). “Psychopathology and psychophysiology of minimal LSD-25 dosage; a preliminary dosage-response spectrum”. AMA Archives of Neurology and Psychiatry 79 (2): 208–10. doi:10.1001/archneurpsyc.1958.02340020088016. PMID 13497365.
- ^ Lee D, Ma Z, Liu-Chen L, Wang Y, Chen Y, Carlezon W, Cohen B. (2005). “New neoclerodane diterpenoids isolated from the leaves of Salvia divinorum and their binding affinities for human K opioid receptors”. Bioorganic and Medicinal Chemistry 13 (19): 5635–9. doi:10.1016/j.bmc.2005.05.054. PMID 16084728.
- ^ Zhang Y, Butelman ER, Schlussman SD, Ho A, Kreek MJ (2005). “Effects of the plant-derived hallucinogen salvinorin A on basal dopamine levels in the caudate putamen and in a conditioned place aversion assay in mice: agonist actions at kappa opioid receptors”. Psychopharmacology (Berl.) 179 (3): 551–8. doi:10.1007/s00213-004-2087-0. PMID 15682306.
- ^ a b Seeman P, Guan HC, Hirbec H (2009). “Dopamine D2High receptors stimulated by phencyclidines, lysergic acid diethylamide, salvinorin A, and modafinil”. Synapse 63 (8): 698–704. doi:10.1002/syn.20647. PMID 19391150.
- ^ Mowry M, Mosher M, Briner W (2003). “Acute physiologic and chronic histologic changes in rats and mice exposed to the unique hallucinogen salvinorin A” (PDF). Journal of Psychoactive Drugs 35 (3): 379–82. doi:10.1080/02791072.2003.10400021. PMID 14621136.
- ^ Capasso R, Borrelli F, Capasso F, Siebert DJ, Stewart DJ, Zjawiony JK, Izzo AA (2006). “The hallucinogenic herb Salvia divinorum and its active ingredient salvinorin A inhibit enteric cholinergic transmission in the guinea-pig ileum”. Neurogastroenterology and Motility 18 (1): 69–75. doi:10.1111/j.1365-2982.2005.00725.x. PMID 16371085.
- ^ Capasso R, Borrelli F, Zjawiony J, Kutrzeba L, Aviello G, Sarnelli G, Capasso F, Izzo AA (2007). “The hallucinogenic herb Salvia divinorum and its active ingredient salvinorin A reduce inflammation-induced hypermotility in mice”. Neurogastroenterology and Motility 20 (2): 142–8. doi:10.1111/j.1365-2982.2007.00994.x. PMID 17931335.
- ^ “Salvia divinorum”. European Monitoring Centre for Drugs and Drug Addiction. 2014年9月4日閲覧。 “Salvinorin A is unstable in basic solutions and is soluble in conventional organic solvents, including acetone, acetonitrile, chloroform, dimethyl sulfoxide and methanol, but is essentially insoluble in hexane and water.”
- ^ Pichini S, Abanades S, Farré M, Pellegrini M, Marchei E, Pacifici R, Torre Rde L, Zuccaro P (2005). “Quantification of the plant-derived hallucinogen salvinorin A in conventional and non-conventional biological fluids by gas chromatography/mass spectrometry after Salvia divinorum smoking”. Rapid Communications in Mass Spectrometry 19 (12): 1649–1656. doi:10.1002/rcm.1970. ISSN 1097-0231. PMID 15915477. "Salvinorin A was not detected in urine samples collected from 1.5–9.5 h after smoking, probably because of a dilution effect, which yielded concentrations below the LOD obtainable with this methodology."
- ^ Bigham AK, Munro TA, Rizzacasa MA, Robins-Browne RM (2003). “Divinatorins A-C, new neoclerodane diterpenoids from the controlled sage Salvia divinorum”. Journal of Natural Produects 66 (9): 1242–4. doi:10.1021/np030313i. PMID 14510607.
- ^ a b Munro TA, Rizzacasa MA (2003). “Salvinorins D-F, new neoclerodane diterpenoids from Salvia divinorum, and an improved method for the isolation of salvinorin A”. Journal of Naturla Products 66 (5): 703–5. doi:10.1021/np0205699. PMID 12762813.
- ^ Kutrzeba L, Dayan FE, Howell J, Feng J, Giner JL, Zjawiony JK (2007). “Biosynthesis of salvinorin A proceeds via the deoxyxylulose phosphate pathway”. Phytochemistry 68 (14): 1872–81. doi:10.1016/j.phytochem.2007.04.034. PMC 2065853. PMID 17574635.
- ^ Siebert DJ (2004). “Localization of salvinorin A and related compounds in glandular trichomes of the psychoactive sage, Salvia divinorum”. Annals of Botany 93 (6): 763–71. doi:10.1093/aob/mch089. PMID 15087301. "A peltate glandular trichome on the abaxial leaf surface", and "The fact that most of the salvinorin content of fresh leaves can be extracted into chloroform without the solvent penetrating the epidermis indicates that these compounds are secreted externally to the epidermis."
- ^ Kunkle D (2007年). “Leaf glandular trichome (Salvia divinorum)”. Dennis Kunkel Microscopy, Inc. 2011年10月14日閲覧。
- ^ Scheerer JR, Lawrence JF, Wang GC, Evans DA (2007). “Asymmetric synthesis of salvinorin A, a potent kappa opioid receptor agonist”. Journal of the American Chemical Society 129 (29): 8968–9. doi:10.1021/ja073590a. PMID 17602636.
- ^ Nozawa M, Suka Y, Hoshi T, Suzuki T, Hagiwara H (2008). “Total synthesis of the hallucinogenic neoclerodane diterpenoid salvinorin A”. Organic Letters 10 (7): 1365–8. doi:10.1021/ol800101v. PMID 18311991.
- ^ Burns AC, Forsyth CJ. (2008). “Intramolecular Diels−Alder/Tsuji allylation assembly of the functionalized trans-decalin of salvinorin A”. Organic Letters 10 (1): 97–100. doi:10.1021/ol7024058. PMID 18062692.
- ^ Lingham AR, Hügel HM, Rook TJ (2006). “Studies towards the synthesis of salvinorin A”. Australian Journal of Chemistry 59 (5): 340–8. doi:10.1071/CH05338.
- ^ Kutrzeba L, Ferreira Z (2009). “Salvinorins J from Salvia divinorum: mutarotation in the neoclerodane system”. Journal of Natural Products 72 (7): 1361–3. doi:10.1021/np900181q. PMID 19473009.
- ^ Lee DY, Karnati VV, He M, Liu-Chen LY, Kondaveti L, Ma Z, Wang Y, Chen Y, Beguin C, Carlezon WA, Cohen B (2005). “Synthesis and in vitro pharmacological studies of new C(2) modified salvinorin A analogues”. Bioorganic & Medicinal Chemistry Letters 15 (16): 3744–7. doi:10.1016/j.bmcl.2005.05.048. PMID 15993589.
- ^ Munro TA, Duncan KK, Xu W, Wang Y, Liu-Chen LY, Carlezon WA, Cohen BM, Béguin C (2008). “Standard protecting groups create potent and selective κ opioids: salvinorin B alkoxymethyl ethers”. Bioorganic & Medicinal Chemistry 16 (3): 1279–86. doi:10.1016/j.bmc.2007.10.067. PMC 2568987. PMID 17981041.
- ^ Harding WW, Tidgewell K, Byrd N, Cobb H, Dersch CM, Butelman ER, Rothman RB, Prisinzano TE (2005). “Neoclerodane diterpenes as a novel scaffold for mu opioid receptor ligands”. Journal of Medicinal Chemistry 48 (15): 4765–71. doi:10.1021/jm048963m. PMID 16033256.
- ^ Tidgewell K, Harding WW, Lozama A, Cobb H, Shah K, Kannan P, Dersch CM, Parrish D, Deschamps JR, Rothman RB, Prisinzano TE (2006). “Synthesis of salvinorin A analogues as opioid receptor probes”. Journal of Natural Products 69 (6): 914–8. doi:10.1021/np060094b. PMID 16792410.
- ^ Holden KG, Tidgewell K, Marquam A, Rothman RB, Navarro H, Prisinzano TE (2007). “Synthetic studies of neoclerodane diterpenes from Salvia divinorum: exploration of the 1-position”. Bioorganic and Medicinal Chemistry Letters 17 (22): 6111–5. doi:10.1016/j.bmcl.2007.09.050. PMC 2111044. PMID 17904842.
- ^ Lee DY, He M, Liu-Chen LY, Wang Y, Li JG, Xu W, Ma Z, Carlezon WA, Cohen B (2006). “Synthesis and in vitro pharmacological studies of new C(4)-modified salvinorin A analogues”. Bioorganic & Medicinal Chemistry Letters 16 (21): 5498–502. doi:10.1016/j.bmcl.2006.08.051. PMID 16945525.
- ^ Béguin C, Richards MR, Li JG, Wang Y, Xu W, Liu-Chen LY, Carlezon WA, Cohen BM (2006). “Synthesis and in vitro evaluation of salvinorin A analogues: effect of configuration at C(2) and substitution at C(18)”. Bioorganic & Medicinal Chemistry Letters 16 (17): 4679–85. doi:10.1016/j.bmcl.2006.05.093. PMID 16777411.
- ^ US 2007/0213394 A1, Beguin C, Carlezon WA, Cohen BM, He M, Lee D Y-W, Richards MR, Liu-Chen L-Y, "Salvinorin derivatives and uses thereof", published 2007-09-13, assigned to Temple University
- ^ MacLean, Katherine A.; Johnson, Matthew W.; Reissig, Chad J.; Prisinzano, Thomas E.; Griffiths, Roland R. (2012). “Dose-related effects of salvinorin A in humans: dissociative, hallucinogenic, and memory effects”. Psychopharmacology 226 (2): 381–392. doi:10.1007/s00213-012-2912-9. ISSN 0033-3158.
- ^ Masis, Julie (2007年2月28日). “Mexican drug gains U.S. following”. Reuters. オリジナルの2007年5月28日時点におけるアーカイブ。 2007年8月22日閲覧。
- ^ Prisinzano, Thomas; Kevin Tidgewell and Wayne W. Harding (2005). “k Opioids as potential treatments for stimulant dependence”. The AAPS Journal (Springer New York) 7 (3): E592–E599. doi:10.1208/aapsj070361. ISSN 1550-7416. PMC 2751263. PMID 16353938.
- ^ Xuei X, Dick D, Flury-Wetherill L, Tian HJ, Agrawal A, Bierut L, Goate A, Bucholz K, Schuckit M, Nurnberger J Jr, Tischfield J, Kuperman S, Porjesz B, Begleiter H, Foroud T, Edenberg HJ (November 2006). “Association of the kappa-opioid system with alcohol dependence”. Molecular psychiatry 11 (11): 1016–24. doi:10.1038/sj.mp.4001882. PMID 16924269.
- ^ http://www.notisum.se/rnp/sls/sfs/20060167.pdf
関連文献[編集]
- Chavkin, Charles; Sud, Sumit; Jin, Wenzhen; Stewart, Jeremy; Zjawiony, Jordan K.; Siebert, Daniel J.; Toth, Beth Ann; Hufeisen, Sandra J. et al. (2004). “Salvinorin A, an active component of the hallucinogenic sage Salvia divinorum is a highly efficacious κ-opioid receptor agonist: structural and functional considerations”. Journal of Pharmacology and Experimental Therapeutics 308 (3): 1197–203. doi:10.1124/jpet.103.059394. PMID 14718611 2007年3月24日閲覧。.
- Munro, Thomas A.; Rizzacasa, Mark A.; Roth, Bryan L.; Toth, Beth A.; Yan, Feng (January 2005). “Studies toward the pharmacophore of salvinorin A, a potent kappa opioid receptor agonist”. Journal of Medicinal Chemistry 48 (2): 345–8. doi:10.1021/jm049438q. PMC 2777653. PMID 15658846.[リンク切れ]
- Baselt, Randall C. (2008). Disposition of Toxic Drugs and Chemicals in Man (8th ed.). Foster City, CA: Biomedical Publications. pp. 1405–6. ISBN 978-0- 9626523-7-0.
外部リンク[編集]
- Salvia divinorum (2007) – EMCDDA drugs profile
- The Salvia divinorum – Research and Information Center (Daniel Siebert)
- Salvia divinorum – Erowid vault
- Lycaeum Salvinorin A
- Tryptamind Salvinorin A Downloadable salvinorin extraction photos.
