「ザナミビル」の版間の差分
2014年には、完全な臨床試験データに基づく分析が公開され、見直しが求められる |
|||
| 22行目: | 22行目: | ||
}} |
}} |
||
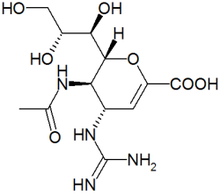
'''ザナミビル''' (Zanamivir) は、世界で最初に開発された[[インフルエンザ]]治療薬。ザナミビル水和物として[[グラクソ・スミスクライン]]社により商品名「'''リレンザ'''」が販売されている。[[A型インフルエンザウイルス]]、[[B型インフルエンザウイルス]]に効果を示すが、[[C型インフルエンザウイルス]]には無効である。 |
'''ザナミビル''' (Zanamivir) は、世界で最初に開発された[[インフルエンザ]]治療薬。ザナミビル水和物として[[グラクソ・スミスクライン]]社により商品名「'''リレンザ'''」が販売されている。[[A型インフルエンザウイルス]]、[[B型インフルエンザウイルス]]に効果を示すが、[[C型インフルエンザウイルス]]には無効である。 |
||
2014年には、完全な臨床試験データに基づく分析が公開され、この新たな証拠に基づいて備蓄するほどの恩恵があるのかの見直しが求められるとされた<ref name="BMJCoch"/>。 |
|||
== 概要 == |
== 概要 == |
||
| 28行目: | 30行目: | ||
経口での[[生物学的利用能|絶対的生物学的利用能]]が2%程度と低いため、経口投与はできず、非経口経路投与に限られる。そのため、リレンザはザナミビル水和物ドライパウダーを吸入投与して用いられる。インフルエンザウイルスは、主に上気道より感染し、ウイルスは増殖し、発症する。リレンザは、薬物を吸入法により使用するため、薬物が迅速に上気道に到達する。そのため、経口投与する薬剤よりも即効性がある。 |
経口での[[生物学的利用能|絶対的生物学的利用能]]が2%程度と低いため、経口投与はできず、非経口経路投与に限られる。そのため、リレンザはザナミビル水和物ドライパウダーを吸入投与して用いられる。インフルエンザウイルスは、主に上気道より感染し、ウイルスは増殖し、発症する。リレンザは、薬物を吸入法により使用するため、薬物が迅速に上気道に到達する。そのため、経口投与する薬剤よりも即効性がある。 |
||
同剤は「ディスクへラー」という専用の吸入器によって吸入投与するが、吸入投与法が一般的に、小児、高齢者には難しい。そのため、簡単に経口投与できるタミフル(オセルタミビル)の発売後、[[ノイラミニダーゼ阻害薬]]におけるリレンザのシェアが激減した。ところが[[2006年]] - [[2007年]]のインフルエンザシーズンに、日本国内においてタミフル投与例での異常行動が世間の注目を浴びたこと(薬剤との因果関係は不明)により、本剤が見直された。また、タミフルに比べて[[耐性]]が起きにくいことが分かった<ref>2011年2月15日 |
同剤は「ディスクへラー」という専用の吸入器によって吸入投与するが、吸入投与法が一般的に、小児、高齢者には難しい。そのため、簡単に経口投与できるタミフル(オセルタミビル)の発売後、[[ノイラミニダーゼ阻害薬]]におけるリレンザのシェアが激減した。ところが[[2006年]] - [[2007年]]のインフルエンザシーズンに、日本国内においてタミフル投与例での異常行動が世間の注目を浴びたこと(薬剤との因果関係は不明)により、本剤が見直された。また、タミフルに比べて[[耐性]]が起きにくいことが分かった<ref>『朝日新聞』2011年2月15日、朝刊23面</ref>。 |
||
[[2008年]] - [[2009年]]の季節性インフルエンザシーズンにおいてオセルタミビルの耐性ウイルスの出現により、リレンザの使用量は、前シーズンより大幅に増大した。 |
[[2008年]] - [[2009年]]の季節性インフルエンザシーズンにおいてオセルタミビルの耐性ウイルスの出現により、リレンザの使用量は、前シーズンより大幅に増大した。 |
||
| 40行目: | 42行目: | ||
*2007年1月 - 日本でタミフルと同様にインフルエンザに対する予防投与が認可。 |
*2007年1月 - 日本でタミフルと同様にインフルエンザに対する予防投与が認可。 |
||
*2013年2月 - 日本の厚生労働省は、2009年から2012年にリレンザを投与された患者3人にアレルギー性[[ショック]]が発生し、そのうちの1人(30代女性、予防投与)が死亡したことを発表<ref name="yomiuri20130228">{{cite news|title=リレンザ ショック症状3人|publisher=読売新聞社|date=2013-02-28|pages=38面|edition=14版|newspaper=読売新聞 朝刊}}</ref>。 |
*2013年2月 - 日本の厚生労働省は、2009年から2012年にリレンザを投与された患者3人にアレルギー性[[ショック]]が発生し、そのうちの1人(30代女性、予防投与)が死亡したことを発表<ref name="yomiuri20130228">{{cite news|title=リレンザ ショック症状3人|publisher=読売新聞社|date=2013-02-28|pages=38面|edition=14版|newspaper=読売新聞 朝刊}}</ref>。 |
||
<!--記述重複ないし将来事項*: タミフルの異常行動症例による使用制限でリレンザは、注目される薬剤となった。しかし、ザナミビル(リレンザ)でも異常行動症例が報告された。ただし、異常行動を伴う精神神経症状は、[[インフルエンザ脳症]]である可能性もあり、薬剤との因果関係は現在のところ不明である。2009年現在、抗インフルエンザ薬は、ザナミビル、オセルタミビル以外には無く、リスクと有効性を比較すれば、有効性を重視する以外に無い。--> |
|||
==有効性== |
|||
[[英国国立医療技術評価機構]](NICE)による2008年のインフルエンザの予防のための[[診療ガイドライン]]においては、慢性呼吸器疾患などの指定されたリスク群を除いて、季節性インフルエンザの予防のためのザナミビルの使用は推奨されない<ref name="TA158">{{cite report |author=英国国立医療技術評価機構|authorlink=英国国立医療技術評価機構|title=Influenza (prophylaxis) - amantadine, oseltamivir and zanamivir (TA158) |url=http://guidance.nice.org.uk/TA158 |date=2008-09 |publisher=National Institute for Health and Clinical Excellence |pages=1.3, 1.7|accessdate=2014-06-26}}</ref>、治療においては発症から48時間以内といった条件を満たした場合に推奨できる<ref name="TA168">{{cite report |author=英国国立医療技術評価機構|authorlink=英国国立医療技術評価機構|title=Influenza - zanamivir, amantadine and oseltamivir (review) (TA168)|url=http://guidance.nice.org.uk/TA168 |date=2009-03 |publisher=National Institute for Health and Clinical Excellence |pages=1.5|accessdate=2014-06-26}}</ref>。 |
|||
しかし2014年には、完全な臨床試験のデータに基づいた分析が公開され、わずかな有益性と有害なリスクの増加を示しているため、ガイドラインは改定されるべきであり、各国は(オセルタミビル:タミフルと共に)備蓄するほどの恩恵があるのかの見直しが求められる、としている<ref name="pmid24718923">{{cite journal|last1=Jefferson|first1=Tom|last2=Jones|first2=Mark A|last3=Doshi|first3=Peter|last4=Del Mar|first4=Chris B|last5=Hama|first5=Rokuro|last6=Thompson|first6=Matthew J|last7=Spencer|first7=Elizabeth A|last8=Onakpoya|first8=Igho|last9=Mahtani|first9=Kamal R|last10=Nunan|first10=David|last11=Howick|first11=Jeremy|last12=Heneghan|first12=Carl J|last13=Jefferson|first13=Tom|title=Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children|journal=The Cochrane Database of Systematic Reviews|pages=CD008965|year=2014|pmid=24718923|doi=10.1002/14651858.CD008965.pub4|url=http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD008965.pub4/abstract}}</ref><ref name="BMJCoch">{{cite press release|author=BMJ and Cochrane|title=Tamiflu & Relenza: how effective are they?|publisher=Cochrane Collaboration |date=10 April 2014|url=http://www.cochrane.org/features/tamiflu-relenza-how-effective-are-they|accessdate=2014-04-10}}、邦訳:{{PDFlink|[http://www.npojip.org/sokuho/no168-3.pdf BMJ誌(英国医師会雑誌)プレスリリース]}}</ref>。 |
|||
== 脚注 == |
== 脚注 == |
||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
=== 出典 === |
|||
{{reflist}} |
{{reflist}} |
||
==外部リンク== |
==外部リンク== |
||
*[http://www.glaxosmithkline.co.jp/healthcare/medicine/relenza/index.html |
*[http://www.glaxosmithkline.co.jp/healthcare/medicine/relenza/index.html リレンザ] (グラクソ・スミスクライン) |
||
{{インフルエンザ}} |
{{インフルエンザ}} |
||
{{DEFAULTSORT:さなみひる}} |
{{DEFAULTSORT:さなみひる}} |
||
2014年6月26日 (木) 00:10時点における版
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 投与経路 | 吸入 |
| 薬物動態データ | |
| 生物学的利用能 | 2%(経口) |
| 血漿タンパク結合 | 10% 以上 |
| 代謝 | ほとんどなし |
| 半減期 | 2.5–5.1 時間 |
| 排泄 | 尿中 |
| 識別 | |
| CAS番号 | 139110-80-8 |
| ATCコード | J05AH01 (WHO) |
| PubChem | CID: 60855 |
| DrugBank | APRD00378 |
| KEGG | D00902 |
| 化学的データ | |
| 化学式 | C12H20N4O7 |
| 分子量 | 332.31 g/mol |
ザナミビル (Zanamivir) は、世界で最初に開発されたインフルエンザ治療薬。ザナミビル水和物としてグラクソ・スミスクライン社により商品名「リレンザ」が販売されている。A型インフルエンザウイルス、B型インフルエンザウイルスに効果を示すが、C型インフルエンザウイルスには無効である。
2014年には、完全な臨床試験データに基づく分析が公開され、この新たな証拠に基づいて備蓄するほどの恩恵があるのかの見直しが求められるとされた[1]。
概要
ノイラミニダーゼ (NA) と呼ばれる酵素によりウイルスが感染細胞表面から遊離することを阻害し、他の細胞への感染・増殖を抑制する。そのため、ノイラミニダーゼを持たないC型インフルエンザウイルスには無効。インフルエンザウイルスの増殖を抑制する作用を持つ薬剤であるため、感染初期(発症後48時間以内)における治療開始が有効である。インフルエンザ症状が発症後48時間以降に治療を開始した際の有用性は確立されていない。同様の作用機序を持つ薬剤としてオセルタミビル(リン酸オセルタミビル、タミフル)がある。
経口での絶対的生物学的利用能が2%程度と低いため、経口投与はできず、非経口経路投与に限られる。そのため、リレンザはザナミビル水和物ドライパウダーを吸入投与して用いられる。インフルエンザウイルスは、主に上気道より感染し、ウイルスは増殖し、発症する。リレンザは、薬物を吸入法により使用するため、薬物が迅速に上気道に到達する。そのため、経口投与する薬剤よりも即効性がある。
同剤は「ディスクへラー」という専用の吸入器によって吸入投与するが、吸入投与法が一般的に、小児、高齢者には難しい。そのため、簡単に経口投与できるタミフル(オセルタミビル)の発売後、ノイラミニダーゼ阻害薬におけるリレンザのシェアが激減した。ところが2006年 - 2007年のインフルエンザシーズンに、日本国内においてタミフル投与例での異常行動が世間の注目を浴びたこと(薬剤との因果関係は不明)により、本剤が見直された。また、タミフルに比べて耐性が起きにくいことが分かった[2]。
2008年 - 2009年の季節性インフルエンザシーズンにおいてオセルタミビルの耐性ウイルスの出現により、リレンザの使用量は、前シーズンより大幅に増大した。
歴史
- 1989年 - オーストラリアのビオタ (Biota) 社が、初めてのノイラミニダーゼ阻害薬としてザナミビルを開発。
- 1990年 - ビオタ社がグラクソ(現在のグラクソ・スミスクライン)に独占的にライセンス提供し、リレンザとして販売。
- 2000年12月 - 日本でリレンザが発売される[3]。健康保険給付対象外。
- 2001年2月 - 日本で健康保険の給付が適応。
- 2006年2月 - 日本で5歳以上の小児へ適応が承認。
- 2007年1月 - 日本でタミフルと同様にインフルエンザに対する予防投与が認可。
- 2013年2月 - 日本の厚生労働省は、2009年から2012年にリレンザを投与された患者3人にアレルギー性ショックが発生し、そのうちの1人(30代女性、予防投与)が死亡したことを発表[3]。
有効性
英国国立医療技術評価機構(NICE)による2008年のインフルエンザの予防のための診療ガイドラインにおいては、慢性呼吸器疾患などの指定されたリスク群を除いて、季節性インフルエンザの予防のためのザナミビルの使用は推奨されない[4]、治療においては発症から48時間以内といった条件を満たした場合に推奨できる[5]。
しかし2014年には、完全な臨床試験のデータに基づいた分析が公開され、わずかな有益性と有害なリスクの増加を示しているため、ガイドラインは改定されるべきであり、各国は(オセルタミビル:タミフルと共に)備蓄するほどの恩恵があるのかの見直しが求められる、としている[6][1]。
脚注
- ^ a b BMJ and Cochrane (10 April 2014). "Tamiflu & Relenza: how effective are they?" (Press release). Cochrane Collaboration. 2014年4月10日閲覧。、邦訳:BMJ誌(英国医師会雑誌)プレスリリース (PDF)
- ^ 『朝日新聞』2011年2月15日、朝刊23面
- ^ a b “リレンザ ショック症状3人”. 読売新聞 朝刊 (読売新聞社): pp. 38面. (2013年2月28日)
- ^ 英国国立医療技術評価機構 (2008-09). Influenza (prophylaxis) - amantadine, oseltamivir and zanamivir (TA158) (Report). National Institute for Health and Clinical Excellence. pp. 1.3, 1.7. 2014-06-26閲覧。
{{cite report}}:|date=の日付が不正です。 (説明) - ^ 英国国立医療技術評価機構 (2009-03). Influenza - zanamivir, amantadine and oseltamivir (review) (TA168) (Report). National Institute for Health and Clinical Excellence. p. 1.5. 2014-06-26閲覧。
{{cite report}}:|date=の日付が不正です。 (説明) - ^ Jefferson, Tom; Jones, Mark A; Doshi, Peter; Del Mar, Chris B; Hama, Rokuro; Thompson, Matthew J; Spencer, Elizabeth A; Onakpoya, Igho et al. (2014). “Neuraminidase inhibitors for preventing and treating influenza in healthy adults and children”. The Cochrane Database of Systematic Reviews: CD008965. doi:10.1002/14651858.CD008965.pub4. PMID 24718923.
外部リンク
- リレンザ (グラクソ・スミスクライン)
