生体直交化学
生体直交化学(せいたいちょっこうかがく、英語: bioorthogonal chemistry)とは、生体システム内部において、本来の生化学的プロセスを妨げることなく起こり得るあらゆる化学反応を指す用語である[1][2][3]。
解説
[編集]この用語は、2003年にキャロリン・R・ベルトッツィによって造語された[4][5]。生体直交反応の概念により、細胞毒性なしに、生体システムにおいて、グリカン、タンパク質[6]、脂質[7]などの生体分子のリアルタイムでの研究が可能になった。生体直交性の要件を満たす化学ライゲーション戦略は数多く開発されており、アジドとシクロオクチンの間の1,3-双極子付加環化反応(銅フリークリックケミストリーとも呼ばれる)[8]、ニトロンとシクロオクチンの間の1,3-双極子付加環化反応[9]、アルデヒドとケトンからのオキシム/ヒドラゾンの形成[10]、テトラジン・ライゲーション[11]、イソシアニドをベースとしたクリック反応[12]、そして最近では、クアドリシクラン・ライゲーション[13]などが挙げられる。

生体直交化学の使用は、典型的には2つのステップで行われる。第一に、細胞基質は生体直交官能基(以下、ケミカルレポーターと呼ぶ)で修飾され、細胞に導入される。基質には、代謝産物、酵素阻害剤などが含まれる。ケミカルレポーターは、その生物活性を損なわないように、基質の構造を劇的に変化させてはならない。第二に、相補的な官能基を含むプローブを導入し、基質と反応させて標識する。
銅フリークリックケミストリーなどの効果的な生体直交反応が開発されてきたが、新しい反応の開発は、標識のための直交法を生み出し続け、同じ生体システムにおいて複数の標識法を使用できるようにしている。キャロリン・R・ベルトッツィは、クリックケミストリーと生体直交化学の開発により、2022年にノーベル化学賞を受賞した[14]。
語源
[編集]生体直交(英語: bioorthogonal)という言葉は、ギリシャ語のbio-「生きている」とorthogōnios「直角の」に由来する。文字通りには、生体システムに対して直交する反応、すなわち生体システムを乱さない反応を意味する。 これは、bioorthogonalが「生体システムに影響を与えない」という意味で、生体システムに本来存在する化学反応と、人為的に導入された化学反応が互いに干渉せず、独立して進行することを表している。 言い換えれば、これらの反応はあたかも互いに直角に交わるかのように、独立した経路をたどるため、生体システム本来の機能を阻害することなく、目的の反応を進行させることができる。
生体直交性のための要件
[編集]生体直交と見なされるためには、反応は以下のいくつかの要件を満たさなければならない。
- 選択性: 生物学的化合物との副反応を避けるために、反応は内因性官能基間で選択的でなければならない。
- 生物学的不活性: 反応パートナーと結果として生じる結合は、研究対象となる生物の本来の化学的機能を破壊する可能性のあるいかなる反応様式も持ってはならない。
- 化学的不活性: 共有結合は強く、生物学的反応に対して不活性でなければならない。
- 速度論: プローブの代謝とクリアランスの前に共有結合が形成されるように、反応は迅速でなければならない。反応は、細胞プロセス(数分)の時間スケールで高速でなければならず、それほど豊富ではない種の小さなシグナルを減少させる可能性のある反応における競合を防ぐ必要がある。また、迅速な反応は、動的なプロセスを正確に追跡するために必要な、高速な応答を提供する。
- 反応の生体適合性: 反応は非毒性でなければならず、pH、水性環境、温度を考慮した生物学的条件下で機能しなければならない。生体直交化学が生きた動物モデルにまで拡大するにつれて、薬物動態はますます懸念されるようになってきている。
- アクセス可能なエンジニアリング: ケミカルレポーターは、何らかの代謝工学またはタンパク質工学によって生体分子に組み込むことができなければならない。最適には、官能基の1つは非常に小さく、本来の挙動を乱さないようにする。
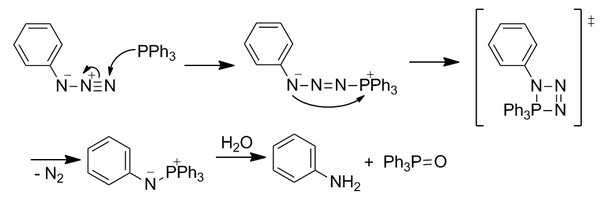
シュタウディンガー・ライゲーション
[編集]シュタウディンガー・ライゲーションは、2000年にベルトッツィ(Bertozzi)グループによって開発された反応であり、アジドとトリアリールホスフィンの古典的なシュタウディンガー反応に基づいている[15]。これは、完全に非生物的な官能基を用いた最初の反応として、生体直交化学の分野を切り開いたが、現在では広く使われてはいない。シュタウディンガー・ライゲーションは、生細胞と生きたマウスの両方で使用されてきた[5]。
生体直交性
[編集]アジドは、ホスフィンなどの軟らかい求核剤を好む、軟らかい求電子剤として作用することができる。これは、ほとんどの生物学的求核剤が、典型的には硬い求核剤であることとは対照的である。反応は、耐水性条件下で選択的に進行し、安定な生成物を生成する。
ホスフィンは、生体システムには全く存在せず、穏やかな還元電位にもかかわらず、ジスルフィド結合を還元しない。アジドは、アジドチミジンなどのFDA承認薬や、架橋剤としての他の用途を通じて、生体適合性があることが示されている。さらに、その小さなサイズは、細胞の代謝経路を通じて生体分子に容易に組み込むことを可能にする。
機構
[編集]古典的なシュタウディンガー反応
[編集]求核性のホスフィンは、求電子性の末端窒素においてアジドを攻撃する。四員環遷移状態を経て、が脱離し、アザ−イリドが形成される。不安定なイリドは加水分解され、ホスフィンオキシドと第一級アミンを形成する。しかし、この反応は、アザ−イリドの共有結合が加水分解によって切断されるため、即座に生体直交性を持つわけではない。
反応は、アザ−イリドを新しい反応経路へと導き、エステルを配置して局所濃度を増加させることによって即時加水分解に打ち勝つために、アリール環の1つのリン原子に対してオルト位にエステル基を含むように修正された。アジドへの最初の求核攻撃は、律速段階である。イリドは、分子内環化によって求電子性エステル捕捉剤と反応し、五員環を形成する。この環は加水分解を受けて安定なアミド結合を形成する。
制限事項
[編集]ホスフィン試薬は、生体システムにおいて徐々に空気酸化を受ける。また、in vitroにおいてはシトクロムP450酵素によって代謝される可能性がある。
反応速度は遅く、二次速度定数は約0.0020 M−1•s−1である。ホスフィンに電子供与基を付加することで求核攻撃速度を向上させようと試みられたが、速度論的な改善は見られたものの、空気酸化の速度も上昇してしまった。
反応速度が遅いため、高濃度のホスフィンを使用する必要があり、これはイメージングアプリケーションにおいて高いバックグラウンドシグナルの原因となる。フルオレセインとルシフェリンを基にした蛍光発生性ホスフィン試薬の開発によって、高いバックグラウンドシグナルの問題に対処しようと試みられてきたが、反応速度そのものは依然として課題として残っている[16]。
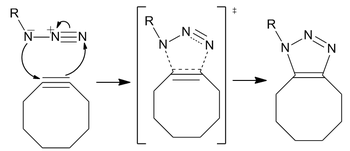
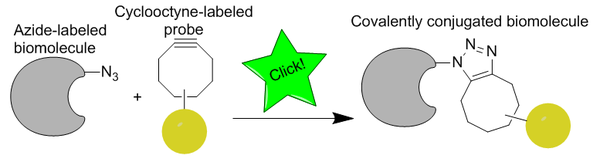
銅フリークリックケミストリー
[編集]銅フリークリックケミストリー(英語: Copper-free click chemistry)は、キャロリン・ベルトッツィによって最初に開発された生体直交反応であり、バリー・シャープレスらによる研究に基づいた、ヒュスゲン環化付加の活性化型である。CuAACとは異なり、銅フリークリックケミストリーは、細胞毒性のある銅触媒を除去することで生体直交性を持つように改変されており、生細胞に毒性を及ぼすことなく反応が迅速に進行する。銅の代わりに、反応は歪み促進型アルキン-アジド環化付加反応 (SPAAC) である。これは、シュタウディンガー・ライゲーションよりも高速な代替手段として開発されたもので、第一世代は60倍以上速く反応する。反応の生体直交性により、銅フリークリック反応は培養細胞、生きたゼブラフィッシュ、マウスに適用することが可能となった。
銅の毒性
[編集]古典的な銅触媒アジド-アルキン環化付加反応は、生体共役のための非常に高速で効果的なクリック反応であるが、Cu(I)イオンの毒性のため、生細胞での使用には適していない。毒性は、銅触媒によって形成される活性酸素種による酸化的損傷によるものである。また、銅錯体が細胞代謝の変化を誘発し、細胞に取り込まれることも分かっている。
in vitroアプリケーションにおいて、生体分子の損傷を防ぎ、除去を促進するためのリガンドの開発がある程度進められてきた。しかし、錯体の異なるリガンド環境は依然として代謝と取り込みに影響を与える可能性があり、細胞機能に望ましくない摂動をもたらすことが分かっている[17]。
生体直交性
[編集]アジド基は非常に小さく(細胞透過性に有利であり、摂動を避ける)、代謝的に安定であり、細胞内に自然に存在しないため、競合する生物学的副反応がないことから、特に生体直交性が高い。アジドは、反応に利用できる最も反応性の高い1,3-双極子ではないが、相対的な副反応の少なさと典型的な合成条件における安定性から好まれている[18]。アルキンはアジドほど小さくはないが、in vivo標識に必要な安定性と直交性を備えている。シクロオクチンは、最も小さな安定したアルキン環であるため、伝統的に標識研究に最もよく用いられるシクロアルキンである。
機構
[編集]反応は、標準的な1,3-双極子付加環化反応、すなわち非同期的協奏的ペリ環状シフトとして進行する。1,3-双極子の両性的な性質は、アジド上の求電子中心または求核中心の同定を不可能にするはずであり、環状電子流の方向は無意味である。[p] しかし、計算によると、窒素間の電子分布により、最も内側の窒素原子が最大の負電荷を帯びることが示されている[19]。
位置選択性
[編集]反応は位置異性体混合物のトリアゾールを生成するが、反応における位置選択性の欠如は、現在のほとんどの用途において大きな懸念事項ではない。より位置特異的で、生体直交性の要件が少ない場合は、特に歪んだシクロオクチンの合成の難しさ(末端アルキンの付加と比較して)を考えると、銅触媒Huisgen環化付加反応が最適である。
脚注
[編集]- ^ Sletten, Ellen M.; Bertozzi, Carolyn R. (2009). “Bioorthogonal Chemistry: Fishing for Selectivity in a Sea of Functionality”. Angewandte Chemie International Edition 48 (38): 6974–98. doi:10.1002/anie.200900942. PMC 2864149. PMID 19714693.
- ^ Prescher, Jennifer A.; Dube, Danielle H.; Bertozzi, Carolyn R. (2004). “Chemical remodelling of cell surfaces in living animals”. Nature 430 (7002): 873–7. Bibcode: 2004Natur.430..873P. doi:10.1038/nature02791. PMID 15318217.
- ^ Prescher, Jennifer A; Bertozzi, Carolyn R (2005). “Chemistry in living systems”. Nature Chemical Biology 1 (1): 13–21. doi:10.1038/nchembio0605-13. PMID 16407987.
- ^ Hang, Howard C.; Yu, Chong; Kato, Darryl L.; Bertozzi, Carolyn R. (2003-12-09). “A metabolic labeling approach toward proteomic analysis of mucin-type O-linked glycosylation” (英語). Proceedings of the National Academy of Sciences 100 (25): 14846–14851. Bibcode: 2003PNAS..10014846H. doi:10.1073/pnas.2335201100. ISSN 0027-8424. PMC 299823. PMID 14657396.
- ^ a b Sletten, Ellen M.; Bertozzi, Carolyn R. (2011). “From Mechanism to Mouse: A Tale of Two Bioorthogonal Reactions”. Accounts of Chemical Research 44 (9): 666–676. doi:10.1021/ar200148z. PMC 3184615. PMID 21838330.
- ^ Plass, Tilman; Milles, Sigrid; Koehler, Christine; Schultz, Carsten; Lemke, Edward A. (2011). “Genetically Encoded Copper-Free Click Chemistry”. Angewandte Chemie International Edition 50 (17): 3878–3881. doi:10.1002/anie.201008178. PMC 3210829. PMID 21433234.
- ^ Neef, Anne B.; Schultz, Carsten (2009). “Selective Fluorescence Labeling of Lipids in Living Cells”. Angewandte Chemie International Edition 48 (8): 1498–500. doi:10.1002/anie.200805507. PMID 19145623.
- ^ Baskin, J. M.; Prescher, J. A.; Laughlin, S. T.; Agard, N. J.; Chang, P. V.; Miller, I. A.; Lo, A.; Codelli, J. A. et al. (2007). “Copper-free click chemistry for dynamic in vivo imaging”. Proceedings of the National Academy of Sciences 104 (43): 16793–7. Bibcode: 2007PNAS..10416793B. doi:10.1073/pnas.0707090104. PMC 2040404. PMID 17942682.
- ^ Ning, Xinghai; Temming, Rinske P.; Dommerholt, Jan; Guo, Jun; Blanco-Ania, Daniel; Debets, Marjoke F.; Wolfert, Margreet A.; Boons, Geert-Jan et al. (2010). “Protein Modification by Strain-Promoted Alkyne-Nitrone Cycloaddition”. Angewandte Chemie International Edition 49 (17): 3065–8. doi:10.1002/anie.201000408. PMC 2871956. PMID 20333639.
- ^ Yarema, K. J.; Mahal, LK; Bruehl, RE; Rodriguez, EC; Bertozzi, CR (1998). “Metabolic Delivery of Ketone Groups to Sialic Acid Residues. Application to Cell Surface Glycoform Engineering”. Journal of Biological Chemistry 273 (47): 31168–79. doi:10.1074/jbc.273.47.31168. PMID 9813021.
- ^ Blackman, Melissa L.; Royzen, Maksim; Fox, Joseph M. (2008). “The Tetrazine Ligation: Fast Bioconjugation based on Inverse-electron-demand Diels-Alder Reactivity”. Journal of the American Chemical Society 130 (41): 13518–9. doi:10.1021/ja8053805. PMC 2653060. PMID 18798613.
- ^ Stöckmann, Henning; Neves, André A.; Stairs, Shaun; Brindle, Kevin M.; Leeper, Finian J. (2011). “Exploring isonitrile-based click chemistry for ligation with biomolecules”. Organic & Biomolecular Chemistry 9 (21): 7303–5. doi:10.1039/C1OB06424J. PMID 21915395.
- ^ Sletten, Ellen M.; Bertozzi, Carolyn R. (2011). “A Bioorthogonal Quadricyclane Ligation”. Journal of the American Chemical Society 133 (44): 17570–3. doi:10.1021/ja2072934. PMC 3206493. PMID 21962173.
- ^ “The Nobel Prize in Chemistry”. The Nobel Prize. 6 October 2022閲覧。
- ^ Saxon, E.; Bertozzi, CR (2000). “Cell Surface Engineering by a Modified Staudinger Reaction”. Science 287 (5460): 2007–10. Bibcode: 2000Sci...287.2007S. doi:10.1126/science.287.5460.2007. PMID 10720325.
- ^ Pamela, Chang.; Prescher, Jennifer A.; Hangauer, Matthew J.; Bertozzi, Carolyn R. (2008). “Imaging Cell Surface Glycans with Bioorthogonal Chemical Reporters”. J Am Chem Soc 129 (27): 8400–8401. doi:10.1021/ja070238o. PMC 2535820. PMID 17579403.
- ^ Kennedy, David C.; McKay, Craig S.; Legault, Marc C. B.; Danielson, Dana C.; Blake, Jessie A.; Pegoraro, Adrian F.; Stolow, Albert; Mester, Zoltan et al. (2011). “Cellular Consequences of Copper Complexes Used to Catalyze Bioorthogonal Click Reactions”. Journal of the American Chemical Society 133 (44): 17993–8001. doi:10.1021/ja2083027. PMID 21970470.
- ^ Huisgen, Rolf. (1976). “1,3-Dipolar cycloadditions. 76. Concerted nature of 1,3-dipolar cycloadditions and the question of diradical intermediates”. The Journal of Organic Chemistry 41 (3): 403–419. doi:10.1021/jo00865a001.
- ^ Gold, Brian; Shevchenko, Nikolay E.; Bonus, Natalie; Dudley, Gregory B.; Alabugin, Igor V. (2011). “Selective Transition State Stabilization via Hyperconjugative and Conjugative Assistance: Stereoelectronic Concept for Copper-Free Click Chemistry”. The Journal of Organic Chemistry 77 (1): 75–89. doi:10.1021/jo201434w. PMID 22077877.