「グルタチオン合成酵素」の版間の差分
img |
Smilesworth (会話 | 投稿記録) en:Glutathione synthetase (22:41, 10 April 2020 UTC) より翻訳して追加・改変 タグ: サイズの大幅な増減 ビジュアルエディター: 中途切替 |
||
| 1行目: | 1行目: | ||
{{infobox protein |
|||
|Name=Glutathione synthetase |
|||
|caption=[[酵母]]のグルタチオン合成酵素の構造。1M0Wから作成<ref name="Gogos_2002">{{cite journal | vauthors = Gogos A, Shapiro L | title = Large conformational changes in the catalytic cycle of glutathione synthase | journal = Structure | volume = 10 | issue = 12 | pages = 1669–76 | date = Dec 2002 | pmid = 12467574 | doi = 10.1016/S0969-2126(02)00906-1 | doi-access = free }}</ref>。 |
|||
|image=Glutathione_synthetase_1M0W.png |
|||
|width= |
|||
|HGNCid=4624 |
|||
|Symbol=GSS |
|||
|AltSymbols= |
|||
|EntrezGene=2937 |
|||
|OMIM=601002 |
|||
|RefSeq=NM_000178 |
|||
|UniProt=P48637 |
|||
|PDB= |
|||
|ECnumber=6.3.2.3 |
|||
|Chromosome=20 |
|||
|Arm=q |
|||
|Band=11.2 |
|||
|LocusSupplementaryData= |
|||
}} |
|||
{{Infobox protein family |
|||
| Symbol = GSH_synthase |
|||
| Name = Eukaryotic glutathione synthase |
|||
| image = PDB 2hgs EBI.jpg |
|||
| width = |
|||
| caption = ヒトのグルタチオン合成酵素 |
|||
| Pfam = PF03199 |
|||
| Pfam_clan = CL0483 |
|||
| InterPro = IPR004887 |
|||
| SMART = |
|||
| PROSITE = |
|||
| MEROPS = |
|||
| SCOP = 2hgs |
|||
| TCDB = |
|||
| OPM family = |
|||
| OPM protein = |
|||
| CAZy = |
|||
| CDD = |
|||
}} |
|||
{{enzyme |
{{enzyme |
||
| Name = |
| Name = glutathione synthase |
||
| EC_number = 6.3.2.3 |
| EC_number = 6.3.2.3 |
||
| CAS_number = 9023-62-5 |
| CAS_number = 9023-62-5 |
||
| 7行目: | 45行目: | ||
| image = 2hgs.jpg |
| image = 2hgs.jpg |
||
| width = 270 |
| width = 270 |
||
| caption = ヒトのグルタチオン合成酵素二量体 |
|||
| caption = |
|||
}} |
}} |
||
{{Infobox protein family |
|||
'''グルタチオン合成酵素'''(Glutathione synthase、{{EC number|6.3.2.3}})は、以下の[[化学反応]]を[[触媒]]する[[酵素]]である。 |
|||
| Symbol = GSH_synth_ATP |
|||
:ATP + γ-L-グルタミル-L-システイン + グリシン<math>\rightleftharpoons</math>ADP + リン酸 + グルタチオン |
|||
| Name = Eukaryotic glutathione synthase, ATP binding domain |
|||
| image = PDB 2hgs EBI.jpg |
|||
| width = |
|||
| caption = ヒトのグルタチオン合成酵素 |
|||
| Pfam = PF03917 |
|||
| Pfam_clan = |
|||
| InterPro = IPR005615 |
|||
| SMART = |
|||
| PROSITE = |
|||
| MEROPS = |
|||
| SCOP = 1m0t |
|||
| TCDB = |
|||
| OPM family = |
|||
| OPM protein = |
|||
| CAZy = |
|||
| CDD = |
|||
}} |
|||
{{Infobox protein family |
|||
| Symbol = GSH-S_N |
|||
| Name = Prokaryotic glutathione synthetase, N-terminal domain |
|||
| image = PDB 1gsh EBI.jpg |
|||
| width = |
|||
| caption = [[大腸菌]]''Escherichia coli''のグルタチオン合成酵素(pH 7.5) |
|||
| Pfam = PF02951 |
|||
| Pfam_clan = |
|||
| InterPro = IPR004215 |
|||
| SMART = |
|||
| PROSITE = |
|||
| MEROPS = |
|||
| SCOP = 1glv |
|||
| TCDB = |
|||
| OPM family = |
|||
| OPM protein = |
|||
| CAZy = |
|||
| CDD = |
|||
}} |
|||
{{Infobox protein family |
|||
| Symbol = GSH-S_ATP |
|||
| Name = Prokaryotic glutathione synthetase, ATP-grasp domain |
|||
| image = PDB 1gsh EBI.jpg |
|||
| width = |
|||
| caption = [[大腸菌]]''Escherichia coli''のグルタチオン合成酵素(pH 7.5) |
|||
| Pfam = PF02955 |
|||
| Pfam_clan = CL0179 |
|||
| InterPro = IPR004218 |
|||
| SMART = |
|||
| PROSITE = |
|||
| MEROPS = |
|||
| SCOP = 1glv |
|||
| TCDB = |
|||
| OPM family = |
|||
| OPM protein = |
|||
| CAZy = |
|||
| CDD = |
|||
}} |
|||
'''グルタチオン合成酵素'''または'''グルタチオンシンテターゼ'''(グルタチオンごうせいこうそ、{{Lang-en-short|glutathione synthetase}}、略称: '''GSS'''、{{EC number|6.3.2.3}})は、[[グルタチオン]](GSH)の生合成経路の2番目の酵素である。[[γ-グルタミルシステイン]]と[[グリシン]]の縮合を触媒し、グルタチオンを形成する<ref name=":0">{{cite journal|year=2005|title=Physiological and pathological aspects of GSH metabolism.|journal=Acta Paediatr|volume=94|issue=2|pages=132–7|doi=10.1080/08035250410025285|pmid=15981742|vauthors=Njålsson R, Norgren S}}</ref>。グルタチオン合成酵素は、抗酸化作用も持つ。細菌、酵母、哺乳類、植物を含む多くの種に存在する<ref name="Li_2003">{{cite journal|date=Aug 2003|title=Glutathione synthetase homologs encode alpha-L-glutamate ligases for methanogenic coenzyme F420 and tetrahydrosarcinapterin biosyntheses|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=100|issue=17|pages=9785–90|doi=10.1073/pnas.1733391100|pmid=12909715|pmc=187843|vauthors=Li H, Xu H, Graham DE, White RH}}</ref>。 |
|||
ヒトでは、GSSの欠陥は[[常染色体劣性遺伝|常染色体劣勢遺伝]]し、重症{{仮リンク|代謝性アシドーシス|en|Metabolic acidosis|label=|preserve=1}}、{{仮リンク|グルタチオン合成酵素欠損症|en|Glutathione synthetase deficiency|label=5-オキソプロリン尿症}}、[[溶血]]の増加、[[中枢神経系]]の機能障害の原因となる<ref name="Njålsson_2005">{{cite journal|date=Sep 2005|title=Glutathione synthetase deficiency|journal=Cellular and Molecular Life Sciences|volume=62|issue=17|pages=1938–45|doi=10.1007/s00018-005-5163-7|pmid=15990954|vauthors=Njålsson R}}</ref>。GSSの欠乏は植物でもヒトでも同様にさまざまな有害症状を引き起こす<ref name="O'Neill 2005">{{cite web|last1=O'Neill|first1=Marla|name-list-format=vanc|title=Glutathione Synthetase Deficiency|url=http://www.omim.org/entry/266130|website=Online Mendelian Inheritance in Man|accessdate=2020-05-17|publisher=}}</ref>。 |
|||
従って、この酵素の基質は[[アデノシン三リン酸|ATP]]と[[γ-グルタミルシステイン]]と[[グリシン]]の3つ、生成物は[[アデノシン二リン酸|ADP]]と[[リン酸]]と[[グルタチオン]]の3つである。 |
|||
[[真核生物]]のGSSは、ホモ二量体型酵素である。基質結合ドメインは[[Αヘリックス|α]]/[[Βシート|β]]/αの3層構造を持つ<ref name="Polekhina_1999">{{cite journal|date=Jun 1999|title=Molecular basis of glutathione synthetase deficiency and a rare gene permutation event|journal=The EMBO Journal|volume=18|issue=12|pages=3204–13|doi=10.1093/emboj/18.12.3204|pmid=10369661|pmc=1171401|vauthors=Polekhina G, Board PG, Gali RR, Rossjohn J, Parker MW}}</ref>。この酵素は、後のグリシンの求核攻撃をエネルギー的に有利に行うため、アシルリン酸中間体を利用して安定化を行う。 |
|||
この酵素は[[リガーゼ]]、特に酸-D-アミノ酸リガーゼ(ペプチドシンターゼ)に分類される。系統名は、'''γ-L-グルタミル-L-システイン:グリシン リガーゼ (ADP形成)'''(gamma-L-glutamyl-L-cysteine:glycine ligase (ADP-forming))である。この酵素は、[[グルタミン酸]]及びグルタチオンの代謝に関与している。少なくとも[[ホスフィン酸]]は[[酵素阻害剤]]である。 |
|||
==構造== |
==構造== |
||
ヒトと酵母のグルタチオン合成酵素はホモ二量体であり、同一な2つのサブユニットが非共有結合によって互いに結合している。一方、大腸菌のグルタチオン合成酵素はホモ四量体である<ref name="Li_2003" />。ATP-graspスーパーファミリーに属する<ref name="Banerjee_2007">{{cite book|last1=Banerjee|first1=Ruma|name-list-format=vanc|title=Redox Biochemistry|date=2007|publisher=Wiley|location=Hoboken, N.J.|isbn=978-0-471-78624-5|edition=|page=16|chapter=Antioxidant Molecules and Redox Factors|chapter-url=https://books.google.com/books?id=ynFUOEgjXYgC&pg=PA16&dq=glutathione+synthetase&hl=en&sa=X&ved=0ahUKEwin4-nBypvLAhUDx2MKHT2iArkQ6AEIXzAJ#v=onepage&q=glutathione%20synthetase&f=false}}</ref>。各サブユニットは互いに[[αヘリックス]]と[[βシート]]の[[水素結合]]を介して相互作用し、2つのドメインから構成される。1つのドメインはATP-graspと呼ばれ[[アデノシン三リン酸|ATP]]との相互作用を促進し<ref name="Fawaz_2011">{{cite journal|date=Dec 2011|title=The ATP-grasp enzymes|journal=Bioorganic Chemistry|volume=39|issue=5-6|pages=185–91|doi=10.1016/j.bioorg.2011.08.004|pmid=21920581|pmc=3243065|vauthors=Fawaz MV, Topper ME, Firestine SM}}</ref>、もう一方はγ-グルタミルシステインの触媒活性部位である。ATP-graspフォールドはATP-graspスーパーファミリー内で保存されており、ATP分子を保持する2つのαヘリックスとβシートによって特徴づけられる<ref name="Fyfe_2010">{{cite journal|date=Apr 2010|title=Structure of Trypanosoma brucei glutathione synthetase: domain and loop alterations in the catalytic cycle of a highly conserved enzyme|journal=Molecular and Biochemical Parasitology|volume=170|issue=2|pages=93–9|doi=10.1016/j.molbiopara.2009.12.011|pmid=20045436|pmc=2845819|vauthors=Fyfe PK, Alphey MS, Hunter WN}}</ref>。活性部位を含むドメインは、興味深い特異性を示す。{{仮リンク|グルタミン酸システインリガーゼ|en|Glutamate–cysteine ligase|label=γ-グルタミルシステイン合成酵素}}とは異なり、グルタチオン合成酵素はγ-グルタミルシステインのグルタミン酸が修飾されたさまざまなアナログを受容するが、システインが修飾されたアナログに対する特異性はずっと高い<ref name="Galperin_1997">{{cite journal|year=1997|title=A diverse superfamily of enzymes with ATP-dependent carboxylate-amine/thiol ligase activity|journal=Protein Science|volume=6|issue=12|pages=2639–43|doi=10.1002/pro.5560061218|pmid=9416615|pmc=2143612|vauthors=Galperin MY, Koonin EV}}</ref>。GSH、[[アデノシン二リン酸|ADP]]、2つの[[マグネシウム]]イオンと[[硫酸イオン]]を結合したグルタチオン合成酵素の結晶構造が解かれている<ref name="Meister_1978">{{cite book|editor-last1=Wendel|editor-first1=Albrecht|editor-last2=Sies|editor-first2=Helmut|last=Meister|first=A.|name-list-format=vanc|title=Functions of Glutathione in Liver and Kidney|date=1978|publisher=Springer Berlin Heidelberg|location=Berlin, Heidelberg|isbn=978-3-642-67132-6|chapter=Current Status of the γ-Glutamyl Cycle|chapter-url=https://books.google.com/books?id=epf6CAAAQBAJ&pg=PA49&lpg=PA49&dq=specificity+of+glutathione+synthetase&source=bl&ots=jUL5dYfIpo&sig=UxkS0hWEbp3CCfJX_CGLq11gX24&hl=en&sa=X&ved=0ahUKEwjrisGm76DLAhVI9GMKHasPD2QQ6AEIQzAF#v=onepage&q=specificity%20of%20glutathione%20synthetase&f=false|page=49}}</ref>。2つのマグネシウムイオンはアシルリン酸中間体を安定化し、ATPの結合を促進し、ATPからのリン酸基の除去を活性化する機能がある。硫酸イオンは、活性部位内でアシルリン酸中間体が形成された際のリン酸基の位置を模していると考えられる<ref name="Polekhina_1999" />。 |
|||
<br /> |
|||
[[File:Key residues that interact with ADP within the active site.png|thumb|upright=1.4|活性部位近傍でATPと相互作用する重要な残基。マグネシウムイオンは黒で示されている<ref name="Polekhina_1999" />。{{PDB3|2HGS}}|代替文=|中央]] |
|||
2007年末時点で、7個の構造が解明されている。[[蛋白質構造データバンク]]のコードは、{{PDB link|1GLV}}、{{PDB link|1GSA}}、{{PDB link|1GSH}}、{{PDB link|1M0T}}、{{PDB link|1M0W}}、{{PDB link|2GLT}}及び{{PDB link|2HGS}}である。 |
2007年末時点で、7個の構造が解明されている。[[蛋白質構造データバンク]]のコードは、{{PDB link|1GLV}}、{{PDB link|1GSA}}、{{PDB link|1GSH}}、{{PDB link|1M0T}}、{{PDB link|1M0W}}、{{PDB link|2GLT}}及び{{PDB link|2HGS}}である。 |
||
==機構== |
|||
グルタチオン合成酵素は、以下の[[化学反応]]を[[触媒]]する[[酵素]]である。 |
|||
:ATP + γ-L-グルタミル-L-システイン + グリシン <math>\rightleftharpoons</math> ADP + リン酸 + グルタチオン |
|||
従って、この酵素の基質はATPとγ-グルタミルシステインとグリシンの3つ、生成物はADPとリン酸とグルタチオンの3つである。 |
|||
この酵素は[[リガーゼ]]、特に酸-D-アミノ酸リガーゼ(ペプチドシンターゼ)に分類される。系統名は、'''γ-L-グルタミル-L-システイン:グリシン リガーゼ (ADP形成)'''(gamma-L-glutamyl-L-cysteine:glycine ligase (ADP-forming))である。この酵素は、[[グルタミン酸]]及びグルタチオンの代謝に関与している。少なくとも[[ホスフィン酸]]塩は[[酵素阻害剤]]であることが知られている。 |
|||
合成酵素と訳される酵素には[[シンテターゼ]]と[[シンターゼ]]があり、シンテターゼは[[ヌクレオシド三リン酸]]のエネルギーを利用するが、シンターゼは利用しない<ref name="Hara_1996">{{cite journal|date=Sep 1996|title=A pseudo-michaelis quaternary complex in the reverse reaction of a ligase: structure of Escherichia coli B glutathione synthetase complexed with ADP, glutathione, and sulfate at 2.0 A resolution|journal=Biochemistry|volume=35|issue=37|pages=11967–74|doi=10.1021/bi9605245|pmid=8810901|vauthors=Hara T, Kato H, Katsube Y, Oda J}}</ref>。グルタチオン合成酵素はシンテターゼであり、ATPによって生成されるエネルギーを利用する。まず、γ-グルタミルシステインのカルボキシル基へATPの無機リン酸が転移してアシルリン酸中間体が形成される。その後、グリシンのアミノ基が求核攻撃に加わり、リン酸基に置き換わってGSHが形成される<ref name="urlsynthase and ligase">{{cite web|url=http://www.chem.qmul.ac.uk/iubmb/newsletter/misc/synthase.html|title=Synthases and Ligases|work=IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN), and Nomenclature Commission of IUB (NC-IUB), Newsletter|date=1984|access-date=2016-03-02|archive-url=https://web.archive.org/web/20121015094308/http://www.chem.qmul.ac.uk/iubmb/newsletter/misc/synthase.html|archive-date=2012-10-15|url-status=dead}}</ref>。産生されたGSHは、[[グルタチオンペルオキシダーゼ]]による[[過酸化水素]]などの[[活性酸素種]]の中和や、[[グルタチオン-S-トランスフェラーゼ|グルタチオン-''S''-トランスフェラーゼ]]による生体異物の無毒化に利用される<ref name="Banerjee_2007" />。 |
|||
[[File:Overall synthesis rxn of GSH.jpg|thumb|upright=2.4|GSHの生合成の反応機構<ref name="Herrera_2007">{{cite journal|date=Jun 2007|title=Reaction mechanism of glutathione synthetase from Arabidopsis thaliana: site-directed mutagenesis of active site residues|journal=The Journal of Biological Chemistry|volume=282|issue=23|pages=17157–65|doi=10.1074/jbc.M700804200|pmid=17452339|vauthors=Herrera K, Cahoon RE, Kumaran S, Jez J|doi-access=free}}</ref>。グルタミン酸とシステインの側鎖は赤と緑で示されている。|代替文=|中央]] |
|||
==機能== |
|||
グルタチオン合成酵素は、さまざまな生物でさまざまな生物学的機能に重要である。[[シロイヌナズナ]]''Arabidopsis thaliana''では、グルタチオン合成酵素のレベルが低いと、[[重金属]]、毒性有機分子、[[酸化ストレス]]などのストレス因子に対する脆弱性が増大する<ref name="Moyer_2010">{{cite journal|date=Mar 2010|title=Glutathione pathway genetic polymorphisms and lung cancer survival after platinum-based chemotherapy|journal=Cancer Epidemiology, Biomarkers & Prevention|volume=19|issue=3|pages=811–21|doi=10.1158/1055-9965.EPI-09-0871|pmid=20200426|pmc=2837367|vauthors=Moyer AM, Sun Z, Batzler AJ, Li L, Schaid DJ, Yang P, Weinshilboum RM}}</ref>。反応産物であるGSH中の[[チオール]]基は、さまざまな生物学的条件で[[酸化剤]]・[[還元剤]]の双方として効率的に機能する。チオールは容易に電子対を受容し酸化されて[[ジスルフィド]]となり、容易に還元されてチオールが再生される。さらに、システインのチオール側鎖は強力な[[求核剤]]として機能し、細胞の損傷を引き起こす酸化剤や[[求電子剤]]と反応する<ref name="Xiang_2001">{{cite journal|date=Jun 2001|title=The biological functions of glutathione revisited in arabidopsis transgenic plants with altered glutathione levels|journal=Plant Physiology|volume=126|issue=2|pages=564–74|doi=10.1104/pp.126.2.564|pmid=11402187|pmc=111149|vauthors=Xiang C, Werner BL, Christensen EM, Oliver DJ}}</ref>。特定の金属との相互作用もチオレート中間体を安定化する<ref name="Conte_2013">{{cite book|title=Oxidative Stress and Redox Regulation|chapter=The Chemistry of Thiol Oxidation and Detection|chapter-url=http://www.scripps.edu/carroll/papers/loconte_bookchapter2012.pdf|doi=10.1007/978-94-007-5787-5_1|first1=Mauro Lo|last1=Conte|first2=Kate S.|last2=Carroll|name-list-format=vanc|date=14 February 2013|pages=1–42}}</ref>。 |
|||
ヒトでもグルタチオン合成酵素は同様に機能する。反応産物であるGSHは恒常性や細胞の維持に関与する経路に関与する。例えば、グルタチオンペルオキシダーゼは、フリーラジカルや過酸化水素などの活性酸素種を還元し、GSHの[[グルタチオンジスルフィド]](GSSG)への酸化を触媒する<ref name="Suzuki_2002">{{cite journal|date=Aug 2002|title=Multiple active intermediates in oxidation reaction catalyzed by synthetic heme-thiolate complex relevant to cytochrome p450|journal=Journal of the American Chemical Society|volume=124|issue=32|pages=9622–8|doi=10.1021/ja0115013|pmid=12167058|vauthors=Suzuki N, Higuchi T, Nagano T}}</ref>。グルタチオン-''S''-トランスフェラーゼは、さまざまな代謝産物、生体異物、求電子剤を{{仮リンク|メルカプツール酸|en|Mercapturic acid|label=}}として排泄して除去するためにGSHを利用する<ref name="Fang_2002">{{cite journal|date=Oct 2002|title=Free radicals, antioxidants, and nutrition|journal=Nutrition|volume=18|issue=10|pages=872–9|doi=10.1016/S0899-9007(02)00916-4|pmid=12361782|vauthors=Fang YZ, Yang S, Wu G}}</ref>。GSSは主に[[肝細胞]]の[[細胞質]]でGSHを産生し、そこから無毒化が行われる[[ミトコンドリア]]へ輸送される<ref name="Ribas 2014">{{cite journal|date=Jul 2014|title=Glutathione and mitochondria|journal=Frontiers in Pharmacology|volume=5|pages=151|doi=10.3389/fphar.2014.00151|pmid=25024695|pmc=4079069|vauthors=Ribas V, García-Ruiz C, Fernández-Checa JC}}</ref>。GSHは[[免疫系]]の活性化にも必須であり、侵入した病原体に対する頑強な防御機構を作り出す<ref name="Fang_2002" />。GSHは[[インフルエンザウイルス]]の感染を防ぐ能力がある<ref name="Townsend_2003">{{cite journal|year=2003|title=The importance of glutathione in human disease|journal=Biomedicine & Pharmacotherapy|volume=57|issue=3-4|pages=145–55|doi=10.1016/S0753-3322(03)00043-X|pmid=12818476|vauthors=Townsend DM, Tew KD, Tapiero H}}</ref><ref name="Cai_2003">{{cite journal|date=Apr 2003|title=Inhibition of influenza infection by glutathione|journal=Free Radical Biology & Medicine|volume=34|issue=7|pages=928–36|doi=10.1016/S0891-5849(03)00023-6|pmid=12654482|vauthors=Cai J, Chen Y, Seth S, Furukawa S, Compans RW, Jones DP}}</ref>。 |
|||
[[File:Gsh mitochondria.jpg|thumb|upright=1.4|グルタチオン(GSH)は肝細胞の細胞質で合成されてミトコンドリアへ輸送され、そこでは、多くの抗酸化因子や解毒酵素の[[補因子]]として機能する<ref name="Ribas 2014" />。|代替文=|中央]] |
|||
==臨床的意義== |
|||
''GSS''遺伝子に変異を有する患者は、常染色体劣性遺伝する疾患である{{仮リンク|グルタチオン合成酵素欠損症|en|Glutathione synthetase deficiency|label=}}を発症する<ref name="Ristoff_2001">{{cite journal|date=Jul 2001|title=Long-term clinical outcome in patients with glutathione synthetase deficiency|journal=The Journal of Pediatrics|volume=139|issue=1|pages=79–84|doi=10.1067/mpd.2001.114480|pmid=11445798|vauthors=Ristoff E, Mayatepek E, Larsson A}}</ref>。患者では変異に応じてさまざまな症状がみられる。軽度の患者では変異が酵素の安定性に影響を与えており、[[溶血性貧血]]がみられる。中程度から重度の患者には触媒部位が機能不全となった酵素が存在し、酵素は解毒反応に関与することができなくなる。代謝性アシドーシス、神経学的障害、病原体感染に対する感受性の増加などの症状がみられる<ref name="Njålsson_2005" />。 |
|||
グルタチオン合成酵素欠損症の患者に対する治療は、一般的に軽度から重度の症状に対処する治療が行われる。代謝性アシドーシスの治療に際しては、重症患者には[[炭酸水素塩]]や、[[ビタミンE]]、[[ビタミンC]]などの抗酸化剤の大量投与が行われる<ref name="Kraut_2010">{{cite journal|date=May 2010|title=Metabolic acidosis: pathophysiology, diagnosis and management|journal=Nature Reviews. Nephrology|volume=6|issue=5|pages=274–85|doi=10.1038/nrneph.2010.33|pmid=20308999|vauthors=Kraut JA, Madias NE}}</ref>。軽度の症例では、[[アスコルビン酸]]と[[N-アセチルシステイン|''N''-アセチルシステイン]]がグルタチオンレベルを増加させ、[[赤血球]]の産生を増加させることが示されている<ref name="Jain_1994">{{cite journal|date=Feb 1994|title=Effect of ascorbate or N-acetylcysteine treatment in a patient with hereditary glutathione synthetase deficiency|journal=The Journal of Pediatrics|volume=124|issue=2|pages=229–33|doi=10.1016/S0022-3476(94)70309-4|pmid=8301428|vauthors=Jain A, Buist NR, Kennaway NG, Powell BR, Auld PA, Mårtensson J}}</ref>。グルタチオン合成酵素欠損症は非常に稀であるため、あまり理解が進んでいないことに留意しておくことは重要である。また、この疾患の症状は連続的なスペクトルとして出現するため、数少ない症例から一般化を行うことはさらに困難である<ref name="Ristoff 2007">{{cite journal|year=2007|title=Inborn errors in the metabolism of glutathione|journal=Orphanet Journal of Rare Diseases|volume=2|issue=|pages=16|doi=10.1186/1750-1172-2-16|pmid=17397529|pmc=1852094|vauthors=Ristoff E, Larsson A}}</ref>。 |
|||
==出典== |
==出典== |
||
{{Reflist|33em}} |
|||
* {{cite journal | author = Law MY and Halliwell B | date = 1986 | title = Purification and properties of glutathione synthetase from (Spinacia oleracea) leaves | journal = Plant Sci. | volume = 43 | pages = 185–191 | doi = 10.1016/0168-9452(86)90016-6 | issue = 3 }} |
|||
* {{cite journal | author = Macnicol PK | date = 1987 | title = Homoglutathione and glutathione synthetases of legume seedlings - partial-purification and substrate-specificity | journal = Plant Sci. | volume = 53 | pages = 229–235 | doi = 10.1016/0168-9452(87)90159-2 | issue = 3 }} |
|||
==関連文献== |
|||
*{{cite journal | vauthors = Law MY, Halliwell B | date = 1986 | title = Purification and properties of glutathione synthetase from (Spinacia oleracea) leaves | journal = Plant Sci. | volume = 43 | pages = 185–191 | doi = 10.1016/0168-9452(86)90016-6 | issue = 3 }} |
|||
*{{cite journal | vauthors = Macnicol PK | date = 1987 | title = Homoglutathione and glutathione synthetases of legume seedlings - partial-purification and substrate-specificity | journal = Plant Sci. | volume = 53 | pages = 229–235 | doi = 10.1016/0168-9452(87)90159-2 | issue = 3 }} |
|||
==関連項目== |
|||
*{{仮リンク|グルタチオン合成酵素欠損症|en|Glutathione synthetase deficiency|label=}} |
|||
*[[グルタチオン]] |
|||
*[[肝臓]] |
|||
==外部リンク== |
|||
*{{MeshName|Glutathione+Synthetase}} |
|||
{{デフォルトソート:くるたちおんこうせいこうそ}} |
{{デフォルトソート:くるたちおんこうせいこうそ}} |
||
2020年5月20日 (水) 15:48時点における版
| Glutathione synthetase | |
|---|---|
 | |
| 識別子 | |
| 略号 | GSS |
| Entrez | 2937 |
| HUGO | 4624 |
| OMIM | 601002 |
| RefSeq | NM_000178 |
| UniProt | P48637 |
| 他のデータ | |
| EC番号 (KEGG) | 6.3.2.3 |
| 遺伝子座 | Chr. 20 q11.2 |
| Eukaryotic glutathione synthase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ヒトのグルタチオン合成酵素 | |||||||||
| 識別子 | |||||||||
| 略号 | GSH_synthase | ||||||||
| Pfam | PF03199 | ||||||||
| Pfam clan | CL0483 | ||||||||
| InterPro | IPR004887 | ||||||||
| SCOP | 2hgs | ||||||||
| SUPERFAMILY | 2hgs | ||||||||
| |||||||||
| glutathione synthase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
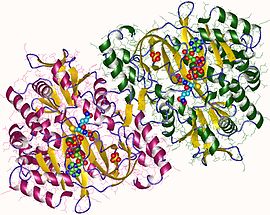 ヒトのグルタチオン合成酵素二量体 | |||||||||
| 識別子 | |||||||||
| EC番号 | 6.3.2.3 | ||||||||
| CAS登録番号 | 9023-62-5 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / QuickGO | ||||||||
| |||||||||
| Eukaryotic glutathione synthase, ATP binding domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 ヒトのグルタチオン合成酵素 | |||||||||
| 識別子 | |||||||||
| 略号 | GSH_synth_ATP | ||||||||
| Pfam | PF03917 | ||||||||
| InterPro | IPR005615 | ||||||||
| SCOP | 1m0t | ||||||||
| SUPERFAMILY | 1m0t | ||||||||
| |||||||||
| Prokaryotic glutathione synthetase, N-terminal domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 大腸菌Escherichia coliのグルタチオン合成酵素(pH 7.5) | |||||||||
| 識別子 | |||||||||
| 略号 | GSH-S_N | ||||||||
| Pfam | PF02951 | ||||||||
| InterPro | IPR004215 | ||||||||
| SCOP | 1glv | ||||||||
| SUPERFAMILY | 1glv | ||||||||
| |||||||||
| Prokaryotic glutathione synthetase, ATP-grasp domain | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 大腸菌Escherichia coliのグルタチオン合成酵素(pH 7.5) | |||||||||
| 識別子 | |||||||||
| 略号 | GSH-S_ATP | ||||||||
| Pfam | PF02955 | ||||||||
| Pfam clan | CL0179 | ||||||||
| InterPro | IPR004218 | ||||||||
| SCOP | 1glv | ||||||||
| SUPERFAMILY | 1glv | ||||||||
| |||||||||
グルタチオン合成酵素またはグルタチオンシンテターゼ(グルタチオンごうせいこうそ、英: glutathione synthetase、略称: GSS、EC 6.3.2.3)は、グルタチオン(GSH)の生合成経路の2番目の酵素である。γ-グルタミルシステインとグリシンの縮合を触媒し、グルタチオンを形成する[2]。グルタチオン合成酵素は、抗酸化作用も持つ。細菌、酵母、哺乳類、植物を含む多くの種に存在する[3]。
ヒトでは、GSSの欠陥は常染色体劣勢遺伝し、重症代謝性アシドーシス、5-オキソプロリン尿症、溶血の増加、中枢神経系の機能障害の原因となる[4]。GSSの欠乏は植物でもヒトでも同様にさまざまな有害症状を引き起こす[5]。
真核生物のGSSは、ホモ二量体型酵素である。基質結合ドメインはα/β/αの3層構造を持つ[6]。この酵素は、後のグリシンの求核攻撃をエネルギー的に有利に行うため、アシルリン酸中間体を利用して安定化を行う。
構造
ヒトと酵母のグルタチオン合成酵素はホモ二量体であり、同一な2つのサブユニットが非共有結合によって互いに結合している。一方、大腸菌のグルタチオン合成酵素はホモ四量体である[3]。ATP-graspスーパーファミリーに属する[7]。各サブユニットは互いにαヘリックスとβシートの水素結合を介して相互作用し、2つのドメインから構成される。1つのドメインはATP-graspと呼ばれATPとの相互作用を促進し[8]、もう一方はγ-グルタミルシステインの触媒活性部位である。ATP-graspフォールドはATP-graspスーパーファミリー内で保存されており、ATP分子を保持する2つのαヘリックスとβシートによって特徴づけられる[9]。活性部位を含むドメインは、興味深い特異性を示す。γ-グルタミルシステイン合成酵素とは異なり、グルタチオン合成酵素はγ-グルタミルシステインのグルタミン酸が修飾されたさまざまなアナログを受容するが、システインが修飾されたアナログに対する特異性はずっと高い[10]。GSH、ADP、2つのマグネシウムイオンと硫酸イオンを結合したグルタチオン合成酵素の結晶構造が解かれている[11]。2つのマグネシウムイオンはアシルリン酸中間体を安定化し、ATPの結合を促進し、ATPからのリン酸基の除去を活性化する機能がある。硫酸イオンは、活性部位内でアシルリン酸中間体が形成された際のリン酸基の位置を模していると考えられる[6]。
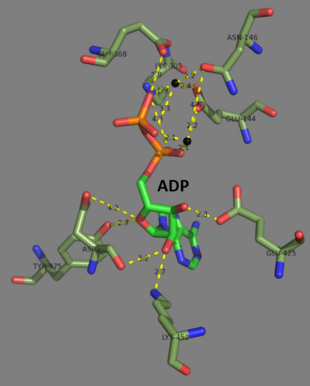
2007年末時点で、7個の構造が解明されている。蛋白質構造データバンクのコードは、1GLV、1GSA、1GSH、1M0T、1M0W、2GLT及び2HGSである。
機構
グルタチオン合成酵素は、以下の化学反応を触媒する酵素である。
- ATP + γ-L-グルタミル-L-システイン + グリシン ADP + リン酸 + グルタチオン
従って、この酵素の基質はATPとγ-グルタミルシステインとグリシンの3つ、生成物はADPとリン酸とグルタチオンの3つである。
この酵素はリガーゼ、特に酸-D-アミノ酸リガーゼ(ペプチドシンターゼ)に分類される。系統名は、γ-L-グルタミル-L-システイン:グリシン リガーゼ (ADP形成)(gamma-L-glutamyl-L-cysteine:glycine ligase (ADP-forming))である。この酵素は、グルタミン酸及びグルタチオンの代謝に関与している。少なくともホスフィン酸塩は酵素阻害剤であることが知られている。
合成酵素と訳される酵素にはシンテターゼとシンターゼがあり、シンテターゼはヌクレオシド三リン酸のエネルギーを利用するが、シンターゼは利用しない[12]。グルタチオン合成酵素はシンテターゼであり、ATPによって生成されるエネルギーを利用する。まず、γ-グルタミルシステインのカルボキシル基へATPの無機リン酸が転移してアシルリン酸中間体が形成される。その後、グリシンのアミノ基が求核攻撃に加わり、リン酸基に置き換わってGSHが形成される[13]。産生されたGSHは、グルタチオンペルオキシダーゼによる過酸化水素などの活性酸素種の中和や、グルタチオン-S-トランスフェラーゼによる生体異物の無毒化に利用される[7]。
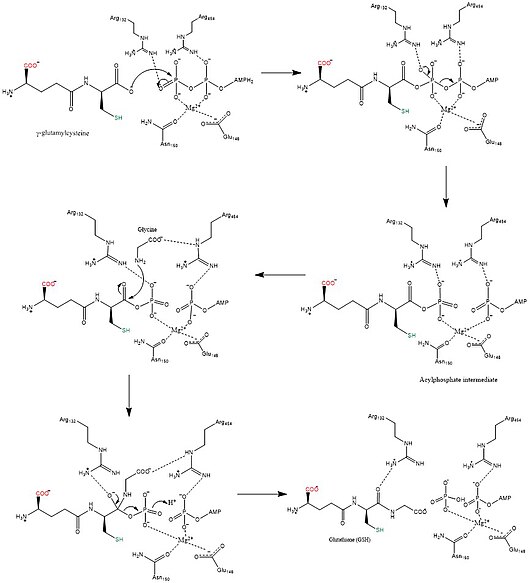
機能
グルタチオン合成酵素は、さまざまな生物でさまざまな生物学的機能に重要である。シロイヌナズナArabidopsis thalianaでは、グルタチオン合成酵素のレベルが低いと、重金属、毒性有機分子、酸化ストレスなどのストレス因子に対する脆弱性が増大する[15]。反応産物であるGSH中のチオール基は、さまざまな生物学的条件で酸化剤・還元剤の双方として効率的に機能する。チオールは容易に電子対を受容し酸化されてジスルフィドとなり、容易に還元されてチオールが再生される。さらに、システインのチオール側鎖は強力な求核剤として機能し、細胞の損傷を引き起こす酸化剤や求電子剤と反応する[16]。特定の金属との相互作用もチオレート中間体を安定化する[17]。
ヒトでもグルタチオン合成酵素は同様に機能する。反応産物であるGSHは恒常性や細胞の維持に関与する経路に関与する。例えば、グルタチオンペルオキシダーゼは、フリーラジカルや過酸化水素などの活性酸素種を還元し、GSHのグルタチオンジスルフィド(GSSG)への酸化を触媒する[18]。グルタチオン-S-トランスフェラーゼは、さまざまな代謝産物、生体異物、求電子剤をメルカプツール酸として排泄して除去するためにGSHを利用する[19]。GSSは主に肝細胞の細胞質でGSHを産生し、そこから無毒化が行われるミトコンドリアへ輸送される[20]。GSHは免疫系の活性化にも必須であり、侵入した病原体に対する頑強な防御機構を作り出す[19]。GSHはインフルエンザウイルスの感染を防ぐ能力がある[21][22]。
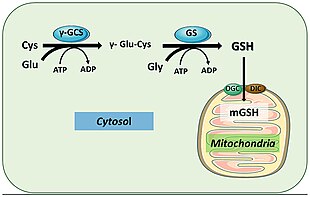
臨床的意義
GSS遺伝子に変異を有する患者は、常染色体劣性遺伝する疾患であるグルタチオン合成酵素欠損症を発症する[23]。患者では変異に応じてさまざまな症状がみられる。軽度の患者では変異が酵素の安定性に影響を与えており、溶血性貧血がみられる。中程度から重度の患者には触媒部位が機能不全となった酵素が存在し、酵素は解毒反応に関与することができなくなる。代謝性アシドーシス、神経学的障害、病原体感染に対する感受性の増加などの症状がみられる[4]。
グルタチオン合成酵素欠損症の患者に対する治療は、一般的に軽度から重度の症状に対処する治療が行われる。代謝性アシドーシスの治療に際しては、重症患者には炭酸水素塩や、ビタミンE、ビタミンCなどの抗酸化剤の大量投与が行われる[24]。軽度の症例では、アスコルビン酸とN-アセチルシステインがグルタチオンレベルを増加させ、赤血球の産生を増加させることが示されている[25]。グルタチオン合成酵素欠損症は非常に稀であるため、あまり理解が進んでいないことに留意しておくことは重要である。また、この疾患の症状は連続的なスペクトルとして出現するため、数少ない症例から一般化を行うことはさらに困難である[26]。
出典
- ^ “Large conformational changes in the catalytic cycle of glutathione synthase”. Structure 10 (12): 1669–76. (Dec 2002). doi:10.1016/S0969-2126(02)00906-1. PMID 12467574.
- ^ “Physiological and pathological aspects of GSH metabolism.”. Acta Paediatr 94 (2): 132–7. (2005). doi:10.1080/08035250410025285. PMID 15981742.
- ^ a b “Glutathione synthetase homologs encode alpha-L-glutamate ligases for methanogenic coenzyme F420 and tetrahydrosarcinapterin biosyntheses”. Proceedings of the National Academy of Sciences of the United States of America 100 (17): 9785–90. (Aug 2003). doi:10.1073/pnas.1733391100. PMC 187843. PMID 12909715.
- ^ a b “Glutathione synthetase deficiency”. Cellular and Molecular Life Sciences 62 (17): 1938–45. (Sep 2005). doi:10.1007/s00018-005-5163-7. PMID 15990954.
- ^ “Glutathione Synthetase Deficiency”. Online Mendelian Inheritance in Man. 2020年5月17日閲覧。
- ^ a b c “Molecular basis of glutathione synthetase deficiency and a rare gene permutation event”. The EMBO Journal 18 (12): 3204–13. (Jun 1999). doi:10.1093/emboj/18.12.3204. PMC 1171401. PMID 10369661.
- ^ a b Banerjee, Ruma (2007). “Antioxidant Molecules and Redox Factors”. Redox Biochemistry. Hoboken, N.J.: Wiley. p. 16. ISBN 978-0-471-78624-5
- ^ “The ATP-grasp enzymes”. Bioorganic Chemistry 39 (5-6): 185–91. (Dec 2011). doi:10.1016/j.bioorg.2011.08.004. PMC 3243065. PMID 21920581.
- ^ “Structure of Trypanosoma brucei glutathione synthetase: domain and loop alterations in the catalytic cycle of a highly conserved enzyme”. Molecular and Biochemical Parasitology 170 (2): 93–9. (Apr 2010). doi:10.1016/j.molbiopara.2009.12.011. PMC 2845819. PMID 20045436.
- ^ “A diverse superfamily of enzymes with ATP-dependent carboxylate-amine/thiol ligase activity”. Protein Science 6 (12): 2639–43. (1997). doi:10.1002/pro.5560061218. PMC 2143612. PMID 9416615.
- ^ Meister, A. (1978). “Current Status of the γ-Glutamyl Cycle”. Functions of Glutathione in Liver and Kidney. Berlin, Heidelberg: Springer Berlin Heidelberg. p. 49. ISBN 978-3-642-67132-6
- ^ “A pseudo-michaelis quaternary complex in the reverse reaction of a ligase: structure of Escherichia coli B glutathione synthetase complexed with ADP, glutathione, and sulfate at 2.0 A resolution”. Biochemistry 35 (37): 11967–74. (Sep 1996). doi:10.1021/bi9605245. PMID 8810901.
- ^ “Synthases and Ligases”. IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN), and Nomenclature Commission of IUB (NC-IUB), Newsletter (1984年). 2012年10月15日時点のオリジナルよりアーカイブ。2016年3月2日閲覧。
- ^ “Reaction mechanism of glutathione synthetase from Arabidopsis thaliana: site-directed mutagenesis of active site residues”. The Journal of Biological Chemistry 282 (23): 17157–65. (Jun 2007). doi:10.1074/jbc.M700804200. PMID 17452339.
- ^ “Glutathione pathway genetic polymorphisms and lung cancer survival after platinum-based chemotherapy”. Cancer Epidemiology, Biomarkers & Prevention 19 (3): 811–21. (Mar 2010). doi:10.1158/1055-9965.EPI-09-0871. PMC 2837367. PMID 20200426.
- ^ “The biological functions of glutathione revisited in arabidopsis transgenic plants with altered glutathione levels”. Plant Physiology 126 (2): 564–74. (Jun 2001). doi:10.1104/pp.126.2.564. PMC 111149. PMID 11402187.
- ^ Conte, Mauro Lo; Carroll, Kate S. (14 February 2013). “The Chemistry of Thiol Oxidation and Detection”. Oxidative Stress and Redox Regulation. pp. 1–42. doi:10.1007/978-94-007-5787-5_1
- ^ “Multiple active intermediates in oxidation reaction catalyzed by synthetic heme-thiolate complex relevant to cytochrome p450”. Journal of the American Chemical Society 124 (32): 9622–8. (Aug 2002). doi:10.1021/ja0115013. PMID 12167058.
- ^ a b “Free radicals, antioxidants, and nutrition”. Nutrition 18 (10): 872–9. (Oct 2002). doi:10.1016/S0899-9007(02)00916-4. PMID 12361782.
- ^ a b “Glutathione and mitochondria”. Frontiers in Pharmacology 5: 151. (Jul 2014). doi:10.3389/fphar.2014.00151. PMC 4079069. PMID 25024695.
- ^ “The importance of glutathione in human disease”. Biomedicine & Pharmacotherapy 57 (3-4): 145–55. (2003). doi:10.1016/S0753-3322(03)00043-X. PMID 12818476.
- ^ “Inhibition of influenza infection by glutathione”. Free Radical Biology & Medicine 34 (7): 928–36. (Apr 2003). doi:10.1016/S0891-5849(03)00023-6. PMID 12654482.
- ^ “Long-term clinical outcome in patients with glutathione synthetase deficiency”. The Journal of Pediatrics 139 (1): 79–84. (Jul 2001). doi:10.1067/mpd.2001.114480. PMID 11445798.
- ^ “Metabolic acidosis: pathophysiology, diagnosis and management”. Nature Reviews. Nephrology 6 (5): 274–85. (May 2010). doi:10.1038/nrneph.2010.33. PMID 20308999.
- ^ “Effect of ascorbate or N-acetylcysteine treatment in a patient with hereditary glutathione synthetase deficiency”. The Journal of Pediatrics 124 (2): 229–33. (Feb 1994). doi:10.1016/S0022-3476(94)70309-4. PMID 8301428.
- ^ “Inborn errors in the metabolism of glutathione”. Orphanet Journal of Rare Diseases 2: 16. (2007). doi:10.1186/1750-1172-2-16. PMC 1852094. PMID 17397529.
関連文献
- “Purification and properties of glutathione synthetase from (Spinacia oleracea) leaves”. Plant Sci. 43 (3): 185–191. (1986). doi:10.1016/0168-9452(86)90016-6.
- “Homoglutathione and glutathione synthetases of legume seedlings - partial-purification and substrate-specificity”. Plant Sci. 53 (3): 229–235. (1987). doi:10.1016/0168-9452(87)90159-2.
関連項目
外部リンク
- Glutathione Synthetase - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)

