「ギ酸」の版間の差分
m styなど |
|||
| 1行目: | 1行目: | ||
{{Chembox |
{{Chembox |
||
| |
| ImageFile1 = formic_acid.svg |
||
| |
| ImageSize1 = 120px |
||
| |
| ImageFile2 = Formic-acid-3D-ball-stick.png |
||
| |
| ImageSize2 = 140px |
||
| IUPACName = メタン酸 |
| IUPACName = メタン酸 methanoic acid (系統名)<br />ギ酸 formic acid (許容慣用名) |
||
| Section1 = {{Chembox Identifiers |
| Section1 = {{Chembox Identifiers |
||
| SMILES = O=CO |
| SMILES = O=CO |
||
| CASNo = |
| CASNo = 64-18-6 |
||
| RTECS = LQ4900000 |
| RTECS = LQ4900000 |
||
}} |
}} |
||
| 16行目: | 16行目: | ||
| Density = 1.2196 g cm<sup>−3</sup> |
| Density = 1.2196 g cm<sup>−3</sup> |
||
| Solubility = 任意に混和 |
| Solubility = 任意に混和 |
||
| BoilingPt = 100.75 ℃ |
| BoilingPt = 100.75 {{℃}} |
||
| MeltingPt = 8.40 ℃ |
| MeltingPt = 8.40 {{℃}} |
||
| Viscosity = 1.57 cP at 26 ℃ |
| Viscosity = 1.57 cP at 26 {{℃}} |
||
| pKa = 3.75 |
| pKa = 3.75 |
||
}} |
}} |
||
| 36行目: | 36行目: | ||
| NFPA-F = 2 |
| NFPA-F = 2 |
||
| NFPA-R = 0 |
| NFPA-R = 0 |
||
| FlashPt = 69 ℃ |
| FlashPt = 69 {{℃}} |
||
| RPhrases = {{R10}}, {{R35}} |
| RPhrases = {{R10}}, {{R35}} |
||
| SPhrases = {{S1/2}}, {{S23}}, {{S26}}, {{S45}} |
| SPhrases = {{S1/2}}, {{S23}}, {{S26}}, {{S45}} |
||
| 47行目: | 47行目: | ||
}} |
}} |
||
'''ギ酸'''(ぎさん、formic acid)は、低級の[[カルボン酸]]の |
'''ギ酸'''(ぎさん、formic acid)は、低級の[[カルボン酸]]の一つ。'''蟻酸'''とも書き表される。[[化学式]]は HCOOH。[[IUPAC命名法]]では'''メタン酸''' (methanoic acid) が系統名である。−CHO基を持つため、[[アルデヒド]]の性質([[還元|還元性]])も示す。工業的に作られており、水溶液が市販されている。加熱すると発火しやすい。 |
||
== 生成方法 == |
== 生成方法 == |
||
| 55行目: | 55行目: | ||
: CH<sub>3</sub>OH + CO → HCOOCH<sub>3</sub> |
: CH<sub>3</sub>OH + CO → HCOOCH<sub>3</sub> |
||
工業的にはこの反応は高圧液相下で行われる。典型的な反応条件は |
工業的にはこの反応は高圧液相下で行われる。典型的な反応条件は 80 {{℃}}、40気圧で[[ナトリウムメトキシド]]を用いるというものである。ギ酸メチルを[[加水分解]]するとギ酸が生成する。 |
||
: HCOOCH<sub>3</sub> + H<sub>2</sub>O → HCOOH + CH<sub>3</sub>OH |
: HCOOCH<sub>3</sub> + H<sub>2</sub>O → HCOOH + CH<sub>3</sub>OH |
||
| 78行目: | 78行目: | ||
ギ酸は水や多くの[[極性溶媒]]、[[炭化水素]]に溶解する。炭化水素に溶解している場合や気体の場合、[[水素結合]]によりカルボン酸の[[二量体]]を形成している。この結合の存在により、気体は[[理想気体]]の性質から大きく外れたものとなる。液体及び固体状態では効率的な水素結合のネットワークを形成している。 |
ギ酸は水や多くの[[極性溶媒]]、[[炭化水素]]に溶解する。炭化水素に溶解している場合や気体の場合、[[水素結合]]によりカルボン酸の[[二量体]]を形成している。この結合の存在により、気体は[[理想気体]]の性質から大きく外れたものとなる。液体及び固体状態では効率的な水素結合のネットワークを形成している。 |
||
ギ酸はカルボン酸であるが、通常の条件下では[[カルボン酸ハロゲン化物|酸塩化物]]や[[カルボン酸無水物|酸無水物]]を形成しないという特徴を持つ。これらを生成させようとした実験のほとんどは一酸化炭素が生成するという結果に終わった。その後− |
ギ酸はカルボン酸であるが、通常の条件下では[[カルボン酸ハロゲン化物|酸塩化物]]や[[カルボン酸無水物|酸無水物]]を形成しないという特徴を持つ。これらを生成させようとした実験のほとんどは一酸化炭素が生成するという結果に終わった。その後 −78 {{℃}} でフッ化ホルミルをギ酸ナトリウムと反応させると酸無水物が、−60 {{℃}} で1-ホルムイミダゾールの[[クロロメタン]]溶液と塩酸を反応させると酸塩化物が生成するという報告がなされた<ref>Cohen, J. B. (1930). ''Practical Organic Chemistry''; MacMillan.</ref>。加熱するとギ酸は一酸化炭素と水に分解する。 |
||
カルボン酸としては独特の性質を持ち、[[アルケン]]と反応する。ギ酸とアルケンが反応すると[[ギ酸エステル]]を生成する。しかし硫酸や[[フッ化水素]]などの酸が存在すると[[コッホ反応]] (Koch reaction) によりギ酸がアルケンに付加し、炭素鎖が伸長したカルボン酸が生成する。 |
カルボン酸としては独特の性質を持ち、[[アルケン]]と反応する。ギ酸とアルケンが反応すると[[ギ酸エステル]]を生成する。しかし硫酸や[[フッ化水素]]などの酸が存在すると[[コッホ反応]] (Koch reaction) によりギ酸がアルケンに付加し、炭素鎖が伸長したカルボン酸が生成する。 |
||
ギ酸水溶液は、一価の脂肪族カルボン酸の中では最も強い酸であることに加えて[[腐食性]]を持ち、皮膚に触れると水泡を生じ、痛みを与える。0.1 mol dm<sup>−3</sup>水溶液中の電離度は0.042である。また100%ギ酸のハメットの[[酸度関数]]は''H''<sub>0</sub> = −2.22であり比較的強い酸性媒体である<ref name=tanaka>田中元治 |
ギ酸水溶液は、一価の脂肪族カルボン酸の中では最も強い酸であることに加えて[[腐食性]]を持ち、皮膚に触れると水泡を生じ、痛みを与える。0.1 mol dm<sup>−3</sup>水溶液中の電離度は0.042である。また100%ギ酸のハメットの[[酸度関数]]は''H''<sub>0</sub> = −2.22であり比較的強い酸性媒体である<ref name=tanaka>田中元治 『基礎化学選書8 酸と塩基』 裳華房、1971年。</ref>。 |
||
: HCOOH(aq) <math> \rightleftarrows\ </math> H<sup>+</sup>(aq) + HCOO<sup>−</sup>(aq) |
: HCOOH (aq) <math> \rightleftarrows\ </math> H<sup>+</sup> (aq) + HCOO<sup>−</sup> (aq) |
||
その酸解離に対する[[熱力学]]的諸量は以下の通りである<ref name=tanaka /><ref name=Parker>D.D. |
その酸解離に対する[[熱力学]]的諸量は以下の通りである<ref name=tanaka /><ref name=Parker>{{cite journal | author = Wagman, D. D.; Evans, W. H.; Parker, V. B.; Schumm, R. H.; Halow, I. | title = The NBS tables of chemical thermodynamics properties. Selected Values for Inorganic and C1 and C2 Organic Substances in SI Units | journal = J. Phys. Chem. Ref. Data | volume = 11 | pages = Suppl. 2 | year = 1982}}</ref>。 |
||
{| class="wikitable" style="text-align: center |
{| class="wikitable" style="text-align: center;" |
||
|- |
|- |
||
! Δ''H''<sup>○</sup> |
|||
!! style="white-space:nowrap"| <math>\mathit{\Delta} H^\circ</math> |
|||
! Δ''G''<sup>○</sup> |
|||
!! style="white-space:nowrap"| <math>\mathit{\Delta} G^\circ</math> |
|||
! Δ''S''<sup>○</sup> |
|||
!! style="white-space:nowrap"| <math>\mathit{\Delta} S^\circ</math> |
|||
! Δ''Cp''<sup>○</sup> |
|||
!! style="white-space:nowrap"| <math>\mathit{\Delta} Cp^\circ</math> |
|||
|- |
|- |
||
| −0.12 kJ mol<sup>−1</sup> |
|||
| 21.4 kJ mol<sup>−1</sup> |
|||
| −72 J mol<sup>−1</sup>K<sup>−1</sup> |
|||
| −172 J mol<sup>−1</sup>K<sup>−1</sup> |
|||
|- |
|- |
||
|} |
|} |
||
また、[[硫酸|濃硫酸]]または[[三酸化硫黄]]を加えて熱すると一酸化炭素を生じる。 |
また、[[硫酸|濃硫酸]]または[[三酸化硫黄]]を加えて熱すると一酸化炭素を生じる。 |
||
: HCOOH → CO + H<sub>2</sub>O |
: HCOOH → CO + H<sub>2</sub>O |
||
: HCOOH + SO<sub>3</sub> → CO + H<sub>2</sub>SO<sub>4</sub> |
: HCOOH + SO<sub>3</sub> → CO + H<sub>2</sub>SO<sub>4</sub> |
||
ギ酸はアルデヒドでもあるため、還元性を持つ。にもかかわらず、[[フェーリング反応]]はほとんど示さない。これは、ギ酸イオンが銅イオンと安定な[[キレート|キレート錯体]]を形成するためで、ギ酸イオンが銅イオンを包み込み、銅イオンが[[酸化銅(I)]]として沈澱するのを妨げるからだと考えられる。 |
ギ酸はアルデヒドでもあるため、還元性を持つ。にもかかわらず、[[フェーリング反応]]はほとんど示さない。これは、ギ酸イオンが銅イオンと安定な[[キレート|キレート錯体]]を形成するためで、ギ酸イオンが銅イオンを包み込み、銅イオンが[[酸化銅(I)]]として沈澱するのを妨げるからだと考えられる。 |
||
同じく還元性に由来する[[銀鏡反応]]は問題なく起こる。 |
同じく還元性に由来する[[銀鏡反応]]は問題なく起こる。 |
||
| 125行目: | 125行目: | ||
有機合成化学では、しばしば[[水素化物イオン]]源として用いられる。[[エシュバイラー・クラーク反応]]や[[ロイカート反応|ロイカート・ヴァラッハ反応]]は良い例である。 |
有機合成化学では、しばしば[[水素化物イオン]]源として用いられる。[[エシュバイラー・クラーク反応]]や[[ロイカート反応|ロイカート・ヴァラッハ反応]]は良い例である。 |
||
研究室内では、硫酸と混合することで一酸化炭素源として用いられる。ホルミル源としても用いられることがあり、トルエン中でメチルアニリンからN-メチルホルムアニリドを生成する反応が例として挙げられる |
研究室内では、硫酸と混合することで一酸化炭素源として用いられる。ホルミル源としても用いられることがあり、トルエン中でメチルアニリンからN-メチルホルムアニリドを生成する反応が例として挙げられる<ref>{{OrgSynth | author = Fieser, L. F.; Jones, J. E. | year =1940 | title = ''N''-Methylformanilide | volume= 20 | pages = 66 | collvol = 3 | collvolpages = 590 | prep = cv3p0590}}</ref>。 |
||
ギ酸を燃料とする[[ギ酸燃料電池]]も開発中である。 |
ギ酸を燃料とする[[ギ酸燃料電池]]も開発中である。 |
||
| 143行目: | 143行目: | ||
== 関連化合物 == |
== 関連化合物 == |
||
=== ギ酸塩 === |
=== ギ酸塩 === |
||
[[Image:Formate.png| |
[[Image:Formate.png|thumb|120px|ギ酸イオン]] |
||
ギ酸の[[電離]]により生成する[[イオン]]を''' |
ギ酸の[[電離]]により生成する[[イオン]]を'''ギ酸イオン''' (formate, HCOO<sup>−</sup>) と呼び、ギ酸イオンを含む塩を[[ギ酸塩]]と呼ぶ。 |
||
ギ酸イオンは多くの金属イオンおよび[[アンモニウム]]と塩を生成するが、[[銀]]塩は室温で不安定である。多くのものはギ酸イオンを含む[[イオン結晶]]であるが、[[ベリリウム]]、[[クロム]](III)および[[鉄]](III)などはギ酸イオンで架橋した金属[[多核錯体]]を形成している<ref name=kagakudaijiten>化学大辞典編集委員会 |
ギ酸イオンは多くの金属イオンおよび[[アンモニウム]]と塩を生成するが、[[銀]]塩は室温で不安定である。多くのものはギ酸イオンを含む[[イオン結晶]]であるが、[[ベリリウム]]、[[クロム]](III)および[[鉄]](III)などはギ酸イオンで架橋した金属[[多核錯体]]を形成している<ref name=kagakudaijiten>化学大辞典編集委員会 『化学大辞典』 共立出版、1993年。</ref>。 |
||
多くのものが水溶性であるが、[[スズ]]塩、[[鉛]]塩および[[ビスマス]]塩などは難溶性である。 |
多くのものが水溶性であるが、[[スズ]]塩、[[鉛]]塩および[[ビスマス]]塩などは難溶性である。 |
||
[[ギ酸ナトリウム]] HCOONa は繊維の染色や印刷の過程などで用いられる。 |
|||
=== ギ酸エステル === |
=== ギ酸エステル === |
||
[[Image:Methyl formate.png|thumb|120px|ギ酸メチル]] |
|||
ギ酸と[[アルコール]]が[[脱水縮合]]した構造を持つ[[エステル]]を'''ギ酸エステル'''と呼び、HCOORの構造を持つ。 |
ギ酸と[[アルコール]]が[[脱水縮合]]した構造を持つ[[エステル]]を'''ギ酸エステル'''と呼び、HCOORの構造を持つ。 |
||
ギ酸エステルには果実の芳香の成分となっているものが存在し、ギ酸エチル HCOOC<sub>2</sub>H<sub>5</sub> は[[桃]]、ギ酸アミル HCOOC<sub>5</sub>H<sub>11</sub> は[[リンゴ]]、ギ酸イソアミル HCOOCH<sub>2</sub>CH<sub>2</sub>CH(CH<sub>3</sub>)<sub>2</sub> は[[梨]]の香りの成分の一つであり、[[香料]]として用いられる<ref name=kagakudaijiten />。 |
ギ酸エステルには果実の芳香の成分となっているものが存在し、ギ酸エチル HCOOC<sub>2</sub>H<sub>5</sub> は[[桃]]、ギ酸アミル HCOOC<sub>5</sub>H<sub>11</sub> は[[リンゴ]]、ギ酸イソアミル HCOOCH<sub>2</sub>CH<sub>2</sub>CH(CH<sub>3</sub>)<sub>2</sub> は[[梨]]の香りの成分の一つであり、[[香料]]として用いられる<ref name=kagakudaijiten />。 |
||
* [[ギ酸メチル]] (HCOOCH<sub>3</sub>) |
|||
[[ギ酸メチル]] HCOOCH<sub>3</sub> はエーテル用芳香を持ち、化成品原料として用いられる。 |
|||
その他、ギ酸誘導体には、[[ニトリル]]として[[シアン化水素]] HCN、[[アミド]]として[[ホルムアミド]] HCONH<sub>2</sub> などが存在する。また[[カルボン酸ハロゲン化物]]としてのギ酸クロライド HCOCl は室温では安定でない。 |
その他、ギ酸誘導体には、[[ニトリル]]として[[シアン化水素]] HCN、[[アミド]]として[[ホルムアミド]] HCONH<sub>2</sub> などが存在する。また[[カルボン酸ハロゲン化物]]としてのギ酸クロライド HCOCl は室温では安定でない。 |
||
2010年9月29日 (水) 16:28時点における版
| ギ酸 | |
|---|---|

| |

| |
メタン酸 methanoic acid (系統名) | |
| 識別情報 | |
| CAS登録番号 | 64-18-6 |
| E番号 | E236 (防腐剤) |
| RTECS番号 | LQ4900000 |
| |
| 特性 | |
| 化学式 | CH2O2 (HCOOH) |
| モル質量 | 46.025 g mol−1 |
| 外観 | 無色の液体 |
| 密度 | 1.2196 g cm−3 |
| 融点 |
8.40 °C |
| 沸点 |
100.75 °C |
| 水への溶解度 | 任意に混和 |
| 酸解離定数 pKa | 3.75 |
| 粘度 | 1.57 cP at 26 °C |
| 構造 | |
| 分子の形 | Planar |
| 双極子モーメント | 1.41 Debye(gas) |
| 熱化学 | |
| 標準生成熱 ΔfH |
−424.72 kJ mol−1 |
| 標準燃焼熱 ΔcH |
−254.62 kJ mol−1 |
| 標準モルエントロピー S |
128.95 J mol−1K−1 |
| 標準定圧モル比熱, Cp |
99.04 J mol−1K−1 |
| 危険性 | |
| 主な危険性 | 腐食性; 刺激性; |
| NFPA 704 | |
| Rフレーズ | R10, R35 |
| Sフレーズ | (S1/2), S23, S26, S45 |
| 引火点 | 69 °C |
| 関連する物質 | |
| 関連するカルボン酸 | 炭酸 酢酸 |
| 関連物質 | ホルムアルデヒド メタノール |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ギ酸(ぎさん、formic acid)は、低級のカルボン酸の一つ。蟻酸とも書き表される。化学式は HCOOH。IUPAC命名法ではメタン酸 (methanoic acid) が系統名である。−CHO基を持つため、アルデヒドの性質(還元性)も示す。工業的に作られており、水溶液が市販されている。加熱すると発火しやすい。
生成方法
酢酸生産時の副生成物としてギ酸が得られるが、それだけでは不足するため他の方法を用いたギ酸の生成も行われている。
メタノールと一酸化炭素を強塩基存在下で反応させると、ギ酸メチルが生成する。
- CH3OH + CO → HCOOCH3
工業的にはこの反応は高圧液相下で行われる。典型的な反応条件は 80 °C、40気圧でナトリウムメトキシドを用いるというものである。ギ酸メチルを加水分解するとギ酸が生成する。
- HCOOCH3 + H2O → HCOOH + CH3OH
しかしながらメチルエステルの加水分解を効率的に進行させるには大過剰の水が必要であるため、他の化合物を経由した加水分解も行われている。ギ酸メチルをアンモニアと反応させホルムアミドを生成後、ホルムアミドを硫酸で加水分解するというものである。
- HCOOCH3 + NH3 → HCONH2 + H2O
- HCONH2 + H2O + ½H2SO4 → HCOOH + ½(NH4)2SO4
この方法では硫酸アンモニウムが副生成物として生成してしまうという問題点がある。このため近年、製造業者はエネルギー効率向上の観点から、ギ酸メチルを直接加水分解した後の大過剰の水からギ酸を取り出す技術を開発している。例としてBASF社の、有機塩基を用いて抽出するという手法が挙げられる。
また高圧下で水酸化ナトリウムに一酸化炭素を反応させ、ギ酸ナトリウムをつくり、これを塩酸で分解しても得られる。これらの反応から一酸化炭素はギ酸の無水物とも見做される。
- NaOH + CO → HCOONa
濃縮したいときは次のようにする。
歴史
15世紀初頭には、錬金術師や自然主義者の一部は、エゾアカヤマアリ類の蟻塚から酸性の蒸気が出ていることを知っていた。1671年、イギリスの博物学者であるジョン・レイ (John Ray) が、大量の死んだアリの蒸留によりギ酸を初めて単離し、「アリの酸 (formic acid)」と命名した。ジョセフ・ルイ・ゲイ=リュサックが、シアン化水素からのギ酸の合成に成功した。シアン化水素はギ酸のニトリルとも見做せる物質である。1855年、フランスのマルセラン・ベルテロが、今日行われている一酸化炭素からの合成を行った。
化学的性質
ギ酸は水や多くの極性溶媒、炭化水素に溶解する。炭化水素に溶解している場合や気体の場合、水素結合によりカルボン酸の二量体を形成している。この結合の存在により、気体は理想気体の性質から大きく外れたものとなる。液体及び固体状態では効率的な水素結合のネットワークを形成している。
ギ酸はカルボン酸であるが、通常の条件下では酸塩化物や酸無水物を形成しないという特徴を持つ。これらを生成させようとした実験のほとんどは一酸化炭素が生成するという結果に終わった。その後 −78 °C でフッ化ホルミルをギ酸ナトリウムと反応させると酸無水物が、−60 °C で1-ホルムイミダゾールのクロロメタン溶液と塩酸を反応させると酸塩化物が生成するという報告がなされた[1]。加熱するとギ酸は一酸化炭素と水に分解する。
カルボン酸としては独特の性質を持ち、アルケンと反応する。ギ酸とアルケンが反応するとギ酸エステルを生成する。しかし硫酸やフッ化水素などの酸が存在するとコッホ反応 (Koch reaction) によりギ酸がアルケンに付加し、炭素鎖が伸長したカルボン酸が生成する。
ギ酸水溶液は、一価の脂肪族カルボン酸の中では最も強い酸であることに加えて腐食性を持ち、皮膚に触れると水泡を生じ、痛みを与える。0.1 mol dm−3水溶液中の電離度は0.042である。また100%ギ酸のハメットの酸度関数はH0 = −2.22であり比較的強い酸性媒体である[2]。
- HCOOH (aq) H+ (aq) + HCOO− (aq)
その酸解離に対する熱力学的諸量は以下の通りである[2][3]。
| ΔH○ | ΔG○ | ΔS○ | ΔCp○ |
|---|---|---|---|
| −0.12 kJ mol−1 | 21.4 kJ mol−1 | −72 J mol−1K−1 | −172 J mol−1K−1 |
また、濃硫酸または三酸化硫黄を加えて熱すると一酸化炭素を生じる。
- HCOOH → CO + H2O
- HCOOH + SO3 → CO + H2SO4
ギ酸はアルデヒドでもあるため、還元性を持つ。にもかかわらず、フェーリング反応はほとんど示さない。これは、ギ酸イオンが銅イオンと安定なキレート錯体を形成するためで、ギ酸イオンが銅イオンを包み込み、銅イオンが酸化銅(I)として沈澱するのを妨げるからだと考えられる。
同じく還元性に由来する銀鏡反応は問題なく起こる。
- CH2O + [O] → HCOOH
生物とギ酸
ギ酸というとアリを思い浮かべる人が多いが、すべてのアリがギ酸を持つわけではない。ハチの仲間であるアリは、ほとんどの種で尾端に毒針を持っており、これで巣の防衛や獲物の攻撃を行う。しかし、ヤマアリ亜科とカタアリ亜科のアリの場合はこの毒針を失っており、水鉄砲のように毒性のある毒液を外敵に吹きかけて巣を防衛したり、獲物を狩ったりする。ヤマアリ亜科の場合にはこの毒液の主成分がギ酸であり、ギ酸の腐食性と浸透性によって外敵の皮膚を損傷し、毒液を体内に浸透させる。北半球の温帯地方、特にその北部で特に繁栄していてヒトの生活圏で個体数も多いヤマアリ属 Formica spp. やケアリ属 Lasius spp. のアリがヤマアリ亜科に属すため、この地域でアリの巣を刺激した時にギ酸による攻撃を受けることが多い。
ギ酸はヤマアリ亜科のアリから防御液を吹きかけられたり、イラクサの棘に刺されたときの刺激の一因となっている(ただし、イラクサの毒作用はヒスタミンとアセチルコリンが主成分とする説が有力になってきている)。
メタノールを誤飲すると失明・死亡するがそれはメタノールの酸化により生じるホルムアルデヒドのせいではなく、それがさらに酸化されて生じるギ酸のアシドーシスであることが判明している。
利用
主な利用法としては家畜用飼料(サイレージ)の防腐剤や抗菌剤といったものが挙げられる。干し草や貯蔵牧草などに噴霧すると腐食を抑え、栄養価を保持するなどの特徴から冬季の牛の飼料などに広く用いられる。養鶏業ではサルモネラ菌除去のため時々飼料に加えられる。
養蜂業ではミツバチヘギイタダニ等のダニ殺虫剤として用いる場合がある。
また繊維工業や皮なめしの場でも用いられることがある。ある種のギ酸エステルは香料となる。
有機合成化学では、しばしば水素化物イオン源として用いられる。エシュバイラー・クラーク反応やロイカート・ヴァラッハ反応は良い例である。
研究室内では、硫酸と混合することで一酸化炭素源として用いられる。ホルミル源としても用いられることがあり、トルエン中でメチルアニリンからN-メチルホルムアニリドを生成する反応が例として挙げられる[4]。
ギ酸を燃料とするギ酸燃料電池も開発中である。
ロジウム単核金属錯体触媒をもちい常温常圧下でギ酸を分解し水素を高効率に取り出すことに成功した。これにより、取扱いに不便な水素貯蔵にかえてギ酸による安全貯蔵、運搬に道が開けたことになる。
危険性
液体のギ酸溶液や蒸気は皮膚や目に対して有害である。特に目に対して回復不能な障害を与えてしまう場合がある。吸入すると肺水腫などの障害を与えることがある。ギ酸の蒸気中には一酸化炭素も含まれていることが多いため、大量のギ酸の蒸気を扱う際には注意しなければならない。
慢性的な暴露により肝臓や腎臓に悪影響を及ぼすと考えられている。またアレルギー源としての可能性も考えられている。
動物実験により変異原性が確認されていたが、変異原性はギ酸のみに見られ、ギ酸ナトリウムなどの塩には見られないことから、変異原性はその低いpHによるものだと考えられている[5]。
法的規制
日本では90%以上の水溶液は毒物及び劇物取締法により劇物に、消防法により危険物第4類に、また安衛法による文書交付対象物質に指定されている。
関連化合物
ギ酸塩

ギ酸の電離により生成するイオンをギ酸イオン (formate, HCOO−) と呼び、ギ酸イオンを含む塩をギ酸塩と呼ぶ。
ギ酸イオンは多くの金属イオンおよびアンモニウムと塩を生成するが、銀塩は室温で不安定である。多くのものはギ酸イオンを含むイオン結晶であるが、ベリリウム、クロム(III)および鉄(III)などはギ酸イオンで架橋した金属多核錯体を形成している[6]。
多くのものが水溶性であるが、スズ塩、鉛塩およびビスマス塩などは難溶性である。
ギ酸ナトリウム HCOONa は繊維の染色や印刷の過程などで用いられる。
ギ酸エステル
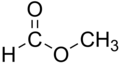
ギ酸とアルコールが脱水縮合した構造を持つエステルをギ酸エステルと呼び、HCOORの構造を持つ。
ギ酸エステルには果実の芳香の成分となっているものが存在し、ギ酸エチル HCOOC2H5 は桃、ギ酸アミル HCOOC5H11 はリンゴ、ギ酸イソアミル HCOOCH2CH2CH(CH3)2 は梨の香りの成分の一つであり、香料として用いられる[6]。
ギ酸メチル HCOOCH3 はエーテル用芳香を持ち、化成品原料として用いられる。
その他、ギ酸誘導体には、ニトリルとしてシアン化水素 HCN、アミドとしてホルムアミド HCONH2 などが存在する。またカルボン酸ハロゲン化物としてのギ酸クロライド HCOCl は室温では安定でない。
参考文献
- ^ Cohen, J. B. (1930). Practical Organic Chemistry; MacMillan.
- ^ a b 田中元治 『基礎化学選書8 酸と塩基』 裳華房、1971年。
- ^ Wagman, D. D.; Evans, W. H.; Parker, V. B.; Schumm, R. H.; Halow, I. (1982). “The NBS tables of chemical thermodynamics properties. Selected Values for Inorganic and C1 and C2 Organic Substances in SI Units”. J. Phys. Chem. Ref. Data 11: Suppl. 2.
- ^ Fieser, L. F.; Jones, J. E. (1940). "N-Methylformanilide". Organic Syntheses (英語). 20: 66.; Collective Volume, vol. 3, p. 590
- ^ High Production Volume (HPV) Challenge Robust Summaries & Test Plans: Formates
- ^ a b 化学大辞典編集委員会 『化学大辞典』 共立出版、1993年。
関連項目
| - | 飽和脂肪酸 | C2: 酢酸 |


