抗体
B細胞は抗原に応じて分化し抗体産生をする。一度分化したB細胞は、大量の抗体を迅速に産生し抗原を除去し、生態を防御する[1]。
抗体が抗原へ結合すると、その抗原と抗体の複合体を好中球やマクロファージといった食細胞が認識・貪食して体内から除去するように働いたり、リンパ球などの免疫細胞が結合して免疫反応を引き起こしたりする。これらの働きを通じ、脊椎動物の感染防御機構において重要な役割を担っている(無脊椎動物は抗体を産生しない)。
構造
[編集]

軽鎖と重鎖
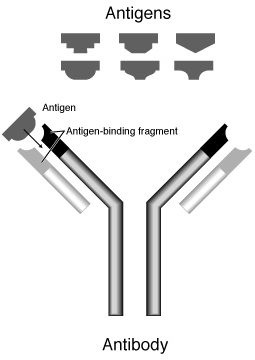
[編集]すべての抗体は基本的には同じ構造を持っており、"Y"字型の4本鎖構造(軽鎖・重鎖の2つのポリペプチド鎖が2本ずつ)を基本構造としている[注釈 1]。軽鎖(またはL鎖)にはλ鎖とκ鎖の2種類があり、すべての免疫グロブリンはこのどちらかを持つが、分子量は約25,000で共通である。重鎖(またはH鎖)には、γ鎖、μ鎖、α鎖、δ鎖、ε鎖の、構造の異なる5種類があり、この重鎖の違いによって免疫グロブリンの種類(アイソタイプと呼ぶ)が変わる。分子量は50,000〜77,000である。この軽鎖と重鎖がジスルフィド結合(SS結合)で結びついてヘテロダイマーを形成し、さらにこのヘテロダイマーが左右2つジスルフィド結合で結合して "Y"字型のヘテロテトラマーを形成する。
2本の軽鎖同士、あるいは2本の重鎖同士は全く同一のポリペプチド鎖である。
Fc領域とFab領域
[編集]"Y"字の下半分の縦棒部分にあたる場所をFc領域 (Fragment, crystallizable) と呼ぶ。左右2つの重鎖からなる。白血球やマクロファージなどの食細胞はこのFc領域と結合できる受容体(Fc受容体)を持っており、このFc受容体を介して抗原と結合した抗体を認識して抗原を貪食する(オプソニン作用)。その他Fc領域は、補体の活性化や抗体依存性細胞傷害作用(英: Antibody Dependent Cellular Cytotoxicity、ADCC)など、免疫反応の媒介となる。このようにFc領域は抗体が抗原に結合した後の反応を惹起する「エフェクター機能」をもつ。免疫グロブリンのエフェクター機能は、免疫グロブリンの種類(アイソタイプ)によって異なる。
"Y"字の上半分の"V"字の部分をFab領域 (Fragment,antigen binding) と呼ぶ。この2つのFab領域の先端の部分で抗原と結合する。2本の軽鎖と2本の重鎖からなる。重鎖のFab領域とFc領域はヒンジ部でつながっている。左右の重鎖はこのヒンジ部がジスルフィド結合している。パパイヤに含まれるタンパク分解酵素パパインはこのヒンジ部を分解して、2つのFabと1つのFc領域に切断する[3]。またタンパク分解酵素のペプシンはヒンジ部のジスルフィド結合のFc側で切断し、大きなFabが2個くっついたF(ab')2を1つと、多数の小さなFc断片を生成する[4]。Fc断片のうち、CH3領域に相当する最も大きな断片はpFc'と呼ばれる。F(ab')2は、ジスルフィド結合部を含むため、Fabよりも構造が大きいため、Fabと区別するため ab' としている。このF(ab')2は抗原に結合するが、Fc領域を持たないためその後の免疫反応を引き起こさない。このことを利用して抗原の標識に用いられる。

(1) Fab領域, (2) Fc領域, (3) 重鎖(N端側から VH、CH1、ヒンジ部、CH2、CH3), (4) 軽鎖(N端側から VL、CL), (5) 抗原結合部位, (6) ヒンジ部
定常領域と可変領域
[編集]Fab領域のうち先端に近い半分は、多様な抗原に結合できるように、アミノ酸配列に多彩な変化がみられる。このFab領域の先端に近い半分を可変領域(V領域)といい、軽鎖の可変領域をVL領域、重鎖の可変領域をVH領域と呼ぶ。V領域以外のFab領域とFc領域は、比較的変化の少ない領域であり、定常領域(C領域)と呼ばれる。軽鎖の定常領域をCL領域と呼び、重鎖の定常領域をCH領域と呼ぶが、CH領域はさらにCH1〜CH3の3つに分けられる。重鎖のFab領域はVH領域とCH1からなり、重鎖のFc領域はCH2とCH3からなる。ヒンジ部はCH1とCH2の間に位置する。
相補性決定領域とフレームワーク領域
[編集]可変領域のうち、直接抗原と接触する領域は特に変化が大きく、この超可変領域を相補性決定領域 (complementarity-determining region: CDR) と呼び、それ以外の比較的変異の少ない部分をフレームワーク領域 (framework region: FR) と呼ぶ。軽鎖と重鎖の可変領域に、それぞれ3つのCDR (CDR1 - CDR3) と、3つのCDRを取り囲む4つのFR (FR1 - FR4) が存在する。
種類
[編集]抗体は定常領域の構造の違いにより、いくつかのクラス(アイソタイプ)に分けられる。多くの哺乳類では、定常領域の構造の違いによりIgG、IgA、IgM、IgD、IgEの5種類のクラスの免疫グロブリンに分類される。それぞれのクラスの免疫グロブリンは大きさや生理活性が異なり、例えばIgAは粘膜分泌型の分子であり、IgEは肥満細胞に結合してアレルギー反応を引き起こす。さらにヒトの場合、IgGにはIgG1〜IgG4の4つのサブクラスが、IgAにはIgA1とIgA2の2つのサブクラスがあり、それぞれ少しずつ構造が異なっている。IgM、IgD、IgEにはサブクラスはない。
また、免疫グロブリンは血中や粘膜への分泌型の他、B細胞の細胞表面に結合した型(膜型)のものがある。
ヒト免疫グロブリンの分類
[編集]
重鎖は定常領域の違いにより、γ鎖、μ鎖、α鎖、δ鎖、ε鎖に分けられ、この違いによりそれぞれIgG、IgM、IgA、IgD、IgEの5種類のクラス(アイソタイプ)の免疫グロブリンが形成される。これらの分泌型の免疫グロブリンの他、B細胞表面に結合したものがある。これは、分泌型免疫グロブリンが細胞表面に接着しているのではなく、細胞膜貫通部分をもったものであり、B細胞受容体 (B cell receptor; BCR) と呼ばれる。BCRは2本の重鎖と2本の軽鎖を持ち、細胞膜貫通部分にIgα/Igβヘテロ二量体を持つ。アイソタイプの違いにより、免疫グロブリンの持つ「エフェクター機能」が異なる。
- IgG
- 免疫グロブリンG(IgG)はヒト免疫グロブリンの70-75%を占め、血漿中に最も多い単量体の抗体である。軽鎖2本と重鎖2本の4本鎖構造をもつ。IgG1、IgG2、IgG4は分子量は約146,000であるが、IgG3はFab領域とFc領域をつなぐヒンジ部が長く、分子量も170,000と大きい。IgG1はIgGの65%程度、IgG2は25%程度、IgG3は7%程度、IgG4は3%程度を占める。血管内外に平均して分布する。
- IgM
- 免疫グロブリンM(IgM)はヒト免疫グロブリンの約10%を占める、基本の4本鎖構造が5つ結合した五量体の抗体である。分子量は970,000。通常血中のみに存在し、感染微生物に対して最初に産生され、初期免疫を司る免疫グロブリンである。分子量が大きいので、マクログロブリンとも呼ばれる。マクロは、「大きい」という意味である。
- IgA
- 免疫グロブリンA(IgA)はヒト免疫グロブリンの10-15%を占める。分子量は160,000。分泌型IgAは2つのIgAが結合した二量体の抗体になっている。IgA1は血清、鼻汁、唾液、母乳中に存在し、腸液にはIgA2が多く存在する。
- IgD
- 免疫グロブリンD(IgD)はヒト免疫グロブリンの1%以下の単量体の抗体である。B細胞表面に存在し、抗体産生の誘導に関与する。
- IgE
- 免疫グロブリンE(IgE)はヒト免疫グロブリンの0.001%以下と極微量しか存在しない単量体の抗体である。IgEが抗原と反応するとヒスタミンの分泌が起きる[5]。寄生虫に対する免疫反応に関与していると考えられるが、寄生虫の稀な先進国においては、特に気管支喘息やアレルギーに大きく関与している。「肥満細胞」とも言われるマスト細胞の表面にあるFCεR受容体にIgEが常駐しているが、ここのIgEにさらに抗原が結合する反応によってマスト細胞が活性化され、ヒスタミンなどの分泌物をマスト細胞から放出する[5]。好塩基球にもIgEが存在している。
その他の生物での分類
[編集]免疫グロブリンは無脊椎動物には見られず、軟骨魚類以降の脊椎動物で見つかっている。それぞれの生物ごとに複数のクラスの免疫グロブリンを持つが、その種類は綱ごとに違いが見られる[6]。IgMのみが脊椎動物のすべてで共通に見られる。
- 軟骨魚類
- IgMの他にIgW、IgW (long)、IgNARと呼ばれるクラスを持つ
- 硬骨魚類
- IgMとIgD、IgT(IgZ)を持つ
- ハイギョ
- IgM, IgW, IgW (long) を持つ
- 爬虫類
- IgMの他、IgYと呼ばれるクラスを持つ[7]
- 両生類(アフリカツメガエル)
- IgMの他、IgXとIgYと呼ばれるクラスを持つ
- 鳥類(ニワトリ)
- IgM、IgA、IgYを持つ
- 哺乳類
- IgM、IgD、IgG、IgA、IgEの5種類を持つ
また、同じ哺乳類でもサブクラスの種類には種ごとに違いが見られる。例えばヒトIgGのサブクラスがIgG1〜IgG4の4種類であるのに対し、マウスIgGではIgG1, IgG2a, IgG2b, IgG3の4種類である。
関連する話題として、軟骨魚類と硬骨魚類はともにクラススイッチを起こさない[7]。生物のうち免疫グロブリン抗体にてクラススイッチを起こすのは、両生類・爬虫類。鳥類・哺乳類である。
両生類と爬虫類に共通してIgYが見られる[7]。哺乳類と鳥類に共通してIgAが見られる[7]。IgEは哺乳類だけに見られる[7]。
働き
[編集]抗体は血液中や体液中に遊離型として存在するか、またはB細胞表面上にB細胞受容体として存在する。特定の抗原と結合する機能が抗体の最も重要な機能である。
抗体はウイルスや細菌などの微生物、あるいは毒素などを抗原として結合するが、抗原と抗体が結合すると、凝集反応(免疫沈降)をおこし、その凝集した抗原抗体複合体は、マクロファージやその他の食細胞が認識し貪食する。その際、抗体はそのFc領域をもってマクロファージ等に認識され貪食されやすくする役割をする(オプソニン作用)。そしてマクロファージに貪食された抗原は、マクロファージ内で分解され、T細胞にペプチド-MHC複合体として提示され、さらなる免疫反応がおこる。また抗体は補体活性化作用を通した免疫反応もおこす。抗体の中には、結合するだけで微生物の感染力を低下させたり、毒性を減少させたりする働きをもつものもある(中和作用)。これらの機構により、抗体は体内に侵入してきた細菌・ウイルスなどの微生物・毒素や、微生物に感染した細胞を認識して体内から排除しようとする。
B細胞表面に存在するBCRは、B細胞の抗原認識受容体として働き、特異的な抗原が結合することで、抗体産生細胞(形質細胞)や体細胞超変異、クラススイッチ組み換え等を経た後の、より抗原に対する親和性の高いBCRをもった抗体産生細胞や記憶B細胞への分化を引き起こす。抗体産生細胞はBCRと同じ抗原特異性、アイソタイプを持つ抗体を産生する。
抗原と抗体の結合
[編集]抗体が抗原と結合する際、抗原の一部分(エピトープ)のみを認識して結合する。抗体はエピトープの立体構造を厳密に認識して結合し、エピトープのアミノ酸配列の違いはもちろんのこと、荷電の差、光学異性体、立体異性体の違いでも結合しなくなる。エピトープと結合する抗体側の部分をパラトープという。エピトープとパラトープの間には、水素結合、静電気力、ファンデルワールス力、疎水結合などの引力がかかり、これらの力により安定して結合する。このエピトープとパラトープの間の結合力のことをアフィニティ affinity という。
ただし、抗体は基本の4本鎖構造においては、抗原と結合する部位は2カ所であるが、IgMは五量体、IgAは二量体を形成するのでさらに多くの抗原認識部位を持っている。また、抗原によってはエピトープを複数もつ。このため抗体によっては、抗原と抗体は1か所で結合したり(1価)、同時に複数か所で認識したりする(多価)。このように抗原と抗体が結合するときの結合力の総和をアビディティ avidity と呼ぶ。多価の結合の際、結合力が相乗的に働くため、アビディティはアフィニティよりも高くなる。
オプソニン作用
[編集]マクロファージや好中球といった食細胞は、もともと細菌や死んだ細胞に結合する能力を持っているが、こういった細菌や死細胞に抗体や補体が結合すると、食細胞がもつ補体受容体やFc受容体を介して結合し、食作用を促進する。これをオプソニン作用という。
補体活性化機能
[編集]抗体は補体の古典経路によって補体を活性化し、抗体の結合した細菌に補体を結合させて細菌の細胞膜を破壊し、溶菌する。またオプソニン作用で食細胞による抗原の食作用を促進させる。IgG1、IgG3、IgMがもつ機能である。IgG2は補体活性化能は低く、IgG4、IgA、IgD、IgEはこの機能をもたない。
中和作用
[編集]細菌やウイルスなどの微生物や、ヘビや虫などの毒素は、自らの構造の一部を細胞表面に結合させて細胞内に侵入し、毒性を示す。細胞に侵入する際に結合させる部分に抗体が結合してしまえば、微生物や毒素は細胞に結合できず、毒性を示せない。このように抗体は、結合することによって微生物の感染力を低下させたり、毒素の毒性を減少させたりすることがある。例えばインフルエンザウイルスは、ウイルス表面のヘマグルチニンを気道上皮細胞のシアル酸残基に結合させて細胞内に侵入するため、ヘマグルチニンに対する抗体はインフルエンザの感染力を低下させる。このことを中和作用という。
免疫グロブリンの多様性
[編集]あらゆる抗原に対応するために、体内では可変領域の異なる重鎖と軽鎖を何百・何千万種類と用意する。このような抗体の多様性をどのようにして作り出しているのかは、長い間不明であった。1897年エールリヒは、もともとさまざまな抗原に対する鋳型を細胞表面にもっている細胞があり、その鋳型が抗原に出会うと、それが刺激となってその抗原に対する抗体を産生すると考えた(側鎖説)[8]が、ラントシュタイナーは、新しく人工合成された化合物に対しても抗体が作用することを示し、この世になかった物質に対する鋳型をもともと細胞が持っていたとは考えにくく、抗体の多様性は側鎖説だけでは説明がつかないと考えた。その後、抗体は抗原に出会うとそれに結合できるように自らの姿を変えることができるという説(鋳型説)や、抗原の刺激により抗体が後天的に作られるという説(指令説)が唱えられたが、1959年エーデルマンが免疫グロブリンの基本構造を解明し[9][10]、また1958年クリックにより、タンパクは遺伝子の情報に基づいて作られることが明らかになる(セントラルドグマ)と、鋳型説・指令説は否定的と考えられた。それに代わってバーネットの提唱したクローン選択説[11](1957年)が受け入れられるようになった。つまり、リンパ球はそれぞれ1種類の抗体しか作ることができず、そのため体内には非常に多くの種類のリンパ球が先天的に用意されている。そして抗原が体内に侵入すると、その抗原と結合できるリンパ球が選ばれて増殖し(クローン)、この抗原に対する抗体を産生する、という説である。この説は種々の実験によって正当性が証明されていったが、クローン選択説もエールリヒの側鎖説と同じように、全く未知の抗原に対応できるような抗体を、遺伝子はどうやって用意できるのか、という点は不明であった。非常に多くの種類の抗体の構造がひとつひとつ全て遺伝子に書き込まれているとは考えにくかった。
1976年利根川らは免疫グロブリンの遺伝子再構成という現象を発見し[12][13]、この抗体の多様性に関する遺伝子レベルの謎に答えを出した。その他、体細胞超変異、遺伝子変換、クラススイッチ組み換えといった現象も抗体の多様性に関与していることが知られている[14]。
V(D)J遺伝子再構成 (gene rearrangement)
[編集]B細胞に分化する前の生殖細胞の遺伝子では、重鎖可変領域 (VH) をコードする遺伝子は、VH遺伝子部分、DH遺伝子部分、JH遺伝子部分の3つに分かれており、この3つの遺伝子部分にそれぞれ、可変領域の遺伝子断片が複数個コードされている。抗体を産生するB細胞の重鎖可変領域の遺伝子は、VH遺伝子部分にコードされているいくつかの遺伝子断片の中から1種類、DH遺伝子部分から1種類、JH遺伝子部分から1種類が選ばれて、それが組み立てられてつくられる。VH遺伝子部分に50の遺伝子断片、DH遺伝子部分に30の遺伝子断片、JH遺伝子部分に6種類の遺伝子断片があるとすると、その組み合わせは50×30×6 = 9000種類となる。
軽鎖可変領域 (VL) をコードする遺伝子は、重鎖よりも少なく、VL遺伝子部分、JL遺伝子部分の2つの部分からなる。同じようにVL遺伝子部分に35の遺伝子断片、JL遺伝子部分に5つの遺伝子断片があるとすると、その組み合わせは35×5 = 175種類となる。そして、9000種類の重鎖と175種類の軽鎖の組み合わせは9000×175 = 150万種類以上となる。このように、重鎖のV、D、J、軽鎖のVとJの遺伝子断片の組み合わせで多様な遺伝子をもつB細胞ができ、それぞれ異なった種類のB細胞がそれぞれ異なった抗体を作ることで多様な抗体がつくられる[12][15]。これをV(D)J遺伝子再構成といい、主にヒトやマウスでみられる。
各細胞につき、遺伝子再構成が起こるのは相同染色体の片方だけであり、再構成がないほうの遺伝子は不活化される。
体細胞超変異 (somatic hypermutation; SHM)
[編集]幹細胞が分化して体のさまざまな細胞に分化していくが、この分化した細胞を体細胞という。幹細胞が体細胞に分化していくときにごく稀に遺伝子に変異が起こることがある(体細胞変異)。B細胞は変異の頻度が極めて高く、1万倍にも及ぶ[16]。これは末梢の成熟したB細胞の中で、T細胞依存性抗原で活性されたB細胞は胚中心を形成し、この微小環境内で免疫グロブリン遺伝子のV領域が、AID(activation-induced cytidine deaminase)により様々な塩基置換を引き起こされるためである。このメカニズムを体細胞超変異といい、ヒトやマウスにおいて抗体の多様性や親和性の成熟に関与している[14]。
遺伝子変換 (gene conversion)
[編集]V(D)J遺伝子再構成を終えた可変領域遺伝子が、V遺伝子上流に存在する偽遺伝子にランダムに置換されて、多様性をつくる。これを遺伝子変換 (gene conversion; GC) といい、主にニワトリでみられる[17][18]。1986年レイノーらにより報告された[19][20]。
クラススイッチ組み換え (class switch recombination; CSR)
[編集]V(D)J遺伝子再構成等の過程を経て生まれたB細胞は、抗原の刺激を受けると成熟化し、増殖する。この際、重鎖定常領域 (CH) をコードする遺伝子にDNA改変が起こり、最初IgMを分泌していたB細胞はIgG等他のクラスの免疫グロブリンを産生する。同じ可変領域を異なる定常領域と組み合わせることにより、さらに多様な抗体を作り出す。このことをクラススイッチ組み換えという[14]。
抗体医薬
[編集]近年、モノクローナル抗体の持つ特異性を利用した医薬品の開発が進んでいる。抗体医薬は標的となる抗原に対して特異的に働くためにこれまでの医薬品よりも副作用を軽減させ、かつ高い治療効果が得られることが期待されている。2008年現在で関節リウマチ治療薬として抗TNF-α抗体であるインフリキシマブや抗IL-6抗体であるトシリズマブ、癌遺伝子HER2に対する抗体であるトラスツズマブなどがすでに臨床において使用されている。
脚注
[編集]注釈
[編集]出典
[編集]- ^ 2.抗体産生のしくみ 科学技術振興機構 2021年7月31日閲覧。
- ^ Hamers-Casterman, C. et al., "Naturally occurring antibodies devoid of light chains", Nature 363, 446−448 (1993). doi:10.1038/363446a0、W.W.ギブズ, 「開発進むナノ抗体医薬」, 日経サイエンス 2006年1月号
- ^ Porter RR. "The hydrolysis of rabbit γ-globulin and antibodies with crystalline papain." Biochemical Journal, 73, 1959, p.p. 119-127. PMID 14434282
- ^ Nisonoff A, Wissler FC, Lipman LN, Woernley DL. "Separation of univalent fragments from the bivalent rabbit antibody molecule by reduction of disulfide bonds." Archives of biochemistry and biophysics, 89, 1960, p.p. 230-44. PMID 14427334
- ^ a b 宮坂昌之ほか『標準免疫学』、医学書院、2016年2月1日 第3版 第2刷、254ページ
- ^ Stavnezer J, Amemiya CT. "Evolution of isotype switching" Semin. Immunol. 16, 2006, p.p. 257-275. PMID 15522624
- ^ a b c d e 河本宏『もっとよくわかる! 免疫学』、2018年5月30日 第8刷、176ページ
- ^ Silverstein AM. "Paul Ehrlich's passion: the origins of his receptor immunology." Cellular Immunology, 194, 1999, p.p. 213-221. PMID 10383824
- ^ Edelman GM. "Journal of American Chemical Society", 81, 1959, p.p. 3155.
- ^ Edelman GM, Poulik MD. "Studies on structural units of the gamma-globulins." Journal of Experimental Medicine, 113, 1961, p.p. 861-884. PMID 13725659
- ^ Burnet FM. "A modification of Jerne's theory of antibody production using the concept of clonal selection." Australian Journal of Science, 20, 1957, p.p. 67-69.
- ^ a b Hozumi N, Tonegawa S. "Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions." Proceedings of National Academy of Science of United States of America, 73, 1976, p.p. 3628-3632. PMID 824647
- ^ Tonegawa S. "Somatic generation of antibody diversity." Nature, 302, 1983, p.p. 575-581. PMID 6300689
- ^ a b c Li Z, Woo CJ, Iglesias-Ussel MD, et al. "The generation of antibody diversity throuth somatic hypermutation and class switch recombination." Gene & Development, 18, 2004, p.p. 1-11. PMID 14724175
- ^ Market E, Papavasiliou FN. "V(D)J recombination and the evolution of the adaptive immune system." PloS Biology, 1, 2003, p.p. 24-27. PMID 14551913
- ^ Rajewsky K, Forster I, Cumano A. "Evolutionary and somatic selection of the antibody repertoire in the mouse." Science, 238, 1987, p.p. 1088-1094. PMID 3317826
- ^ Weill JC, Reynaud CA, Lassila O, Pink JR. "Rearrangement of chicken immunoglobulin genes is not an ongoing process in the embryonic bursa of Fabricius." Proceedings of National Academy of Science of United States of America, 83, 1986, p.p. 3336-3340. PMID 3010290
- ^ Weill JC, Reynaud CA. "Rearrangement/hypermutation/gene conversion: When, where and why?" Immunology Today, 17, 1996, p.p. 92 -97. PMID 8808057
- ^ Reynaud CA, Anquez V, Dahan A, Weill JC. "A single rearrengement event generates most of the chicken immunoglobulin light chain diversity." Cell, 40, 1985, p.p. 283-291. PMID 3917859
- ^ "系統看護学講座 専門基礎① 解剖生理学 人体の構造と機能[1]" 医学書院, p.p. 435.
