免疫グロブリンE
免疫グロブリンE(めんえきグロブリンE、英語: Immunoglobulin E、IgE)とは哺乳類にのみ存在する糖タンパク質であり、免疫グロブリンの一種である。
概要
[編集]1966年、石坂公成はジョンズ・ホプキンズ大学においてブタクサに対してアレルギーをもつ患者の血清からIgEを精製した[1]。また1967年にはウプサラ大学(スウェーデン)のS.G.O JohanssonとHans Bennichも独立してこれを発見した[2]。
IgEの "E" というアルファベットはこの抗体が紅斑 (Erythema) を惹起するということに由来している。IgE分子は2つの重鎖(ε鎖)と2つの軽鎖(κ鎖およびλ鎖)から構成され、2つの抗原結合部位を有している。健常人における血清中のIgE濃度はng/mL単位であり他の種類の免疫グロブリンと比較しても非常に低いが、アレルギー疾患を持つ患者の血清中では濃度が上昇しマスト細胞や好塩基球の細胞内顆粒中に貯蔵される生理活性物質の急速な放出(脱顆粒反応)を誘起する。これらのことからIgEはヒスタミンなどと並んでアレルギー反応において中心的な役割を果たす分子の一つとして数えられる。また、IgE分子の性質として胎盤通過能や補体結合能を有さない。分子量は188 kDa。
構造
[編集]
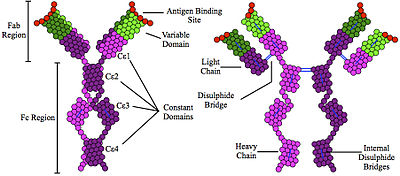
IgEはIgGをはじめとした他のアイソタイプと構造的に類似している。これらの分子は2つの重鎖および軽鎖から構成され、ジスルフィド結合(-S-S-)により結びついてY字型の複合体として存在している。このY字状分子の2箇所の上端部が抗原結合部位(Fab部位)、下端が受容体との結合部位(Fc部位)である。抗体分子一般の構造の詳細については抗体の項を参照の事。IgE重鎖の定常領域(Fcε鎖)は四つのドメインから構成される。これらは可変領域に近い方からCε1-4と呼ばれ、IgE受容体への結合にはCε3ドメインが重要である。
機能
[編集]
マスト細胞表面受容体上のIgEに抗原タンパク質が結合すると、IgEが抗原を架橋するような形になり細胞内顆粒中に貯蔵されているヒスタミンなどの放出が行われる。その結果として炎症反応を促進するが、炎症には急性炎症と慢性炎症が存在し、それぞれ関与するメディエーター・細胞などが異なる。マスト細胞の脱顆粒により放出される物質のうちヒスタミンは血管透過性を亢進させることにより急性炎症を促進する。また、ロイコトリエンやサイトカイン、ケモカイン等の分子は炎症における遅延型反応に関与し、炎症性細胞を動員するなどの役割を果たす。気管支喘息等のアレルギー性疾患の患者では血清中IgE濃度が高値を示し、これらの反応が亢進されている。
寄生虫仮説
[編集]IgEアイソタイプは、好塩基球やマスト細胞と共進化し、(シストソーマのような)蠕虫のような寄生虫に対する防御に用いられるが、細菌感染にも有効である可能性がある[要出典]。 疫学的研究によると、ヒトではマンソン住血吸虫(Schistosoma mansoni)[3]、アメリカ鉤虫(Necator americanus)[4]、線虫[5]に感染するとIgEレベルが上昇する。IgEは肺に付着した鉤虫の除去に有益である可能性が高い[要出典]。
アレルギー性疾患の毒素仮説
[編集]1981年、マージー・プロフェットは、アレルギー反応が毒物から身を守るための最後の防衛手段として進化してきたことを提案した[6]。 当時は物議を醸したものの、新しい研究では、有害な毒素に対する防衛としてのアレルギーの適応的役割に関するプロフェットの考えの一部が支持されている[7]。
2013年には、ミツバチ[8]やラッセルクサリヘビ[8][9]の毒に対する後天的な耐性に、IgE抗体が不可欠な役割を果たしていることが明らかになった。著者らは、「少量のハチ毒が、はるかに大量の致死量に対する免疫をもたらす」とし、「この種の毒特異的でIgE関連の適応免疫反応は、少なくとも進化の観点からは、動物がハチの巣全体に遭遇した場合やヘビに噛まれた場合など、潜在的に毒性のある量の毒から宿主を守るために発達した」と結論づけている[8][10]。ハチ毒の主要アレルゲン(ホスホリパーゼA2)は、IgE抗体の産生を伴うTh2免疫応答を誘導し、「潜在的な致死量のチャレンジに対するマウスの抵抗力を高める」可能性がある[11]。
産生機構
[編集]抗体分子は一般にB細胞から分化した形質細胞によって産生されることが知られている。形質細胞はその細胞表面に発現している抗体分子と同じものを産生することができる。抗原に出会っていないB細胞(ナイーブB細胞)はその表面にIgMあるいはIgDを発現しているものが多い。これらの細胞に対してサイトカインによる刺激が入ると遺伝子の組み換えによる免疫グロブリン分子のクラススイッチが生じる。IgEの産生はTh2細胞などにより産生されるインターロイキン-4 (IL-4) により促進され、インターフェロン-γ刺激によって抑制される。また、活性化したマスト細胞はIL-4およびIL-13の分泌やCD40リガンド (CD40L) の発現によりB細胞を刺激し、IgE定常領域をコードするCε遺伝子の転写を亢進させることによりIgE産生の亢進が行われる。
受容体
[編集]
IgEはFc部位と呼ばれる部位を介して細胞表面のIgE受容体(Fcε受容体)と呼ばれる分子に結合することが知られており、Fcε受容体はマスト細胞、好塩基球、好酸球等の細胞に発現している。Fc受容体に対して抗体が結合し、細胞の細胞内顆粒に蓄えられているヒスタミンなどのメディエーターはFc受容体に抗原が結合することにより誘発され、種々のアレルギー反応に関与している。
IgE受容体にはIgEに対して高親和性を示すFcεRI(Rはreceptor = 受容体、Iはone; 1番目に見つかったの略)と低親和性のFcεRII(CD23)が存在する。これらは細胞膜を貫通して細胞内外にまたがっているが、FcεRI は細胞外領域に免疫グロブリン様ドメインを複数個有しており、免疫グロブリンスーパーファミリーに属する。血中のマスト細胞や好塩基球をはじめとしてランゲルハンス細胞や樹状細胞などの抗原提示細胞、好酸球、単球などの細胞において発現が見られる[12]。FcεRI はα鎖、β鎖および二量体のγ鎖の四量体構造(αβγ2)をとり、計7個の膜貫通ドメインを有する[12]。細胞外ドメインを主としたα鎖はIgEとの結合部位を有しており、βおよびγ鎖の細胞内ドメインはシグナル伝達に関与しておりLynなどのチロシンキナーゼのリン酸化を介して行われる。一方FcεRIIはC型レクチンであり単量体あるいはオリゴマーとして存在している[13]。FcεRII はB細胞において発見され、その他にも単球、活性化T細胞、好酸球、血小板などの細胞表面に発現していることが分かっているがその機能についてはFcεRIと比べて十分に明らかになっていないところが多い。FcεRIIには細胞膜上に存在するmCD23と可溶性受容体として存在するsCD23が存在する。sCD23はB細胞に対する増殖因子として機能し、IgEの合成を促進する[14]。
形質細胞により産生されたIgEがマスト細胞および好塩基球表面のFcεRI に結合することでメディエーターの放出が促進される。抗原提示細胞上のFcεRIあるいはFcεRII にIgEが結合することによりT細胞の活性化が引き起こされるがマスト細胞などによる機構に対してポジティブフィードバックとして働き、IgEへのクラススイッチを亢進するIL-4の産生量が増加することによる。
シグナル伝達
[編集]マスト細胞上のIgE受容体を介したシグナル伝達経路には大きく分けて2つの経路が存在し、細胞膜のラフトに存在する膜結合型アダプター分子であるLATを介する経路と介さない経路に分けられる。
前者の経路は抗原刺激によりFcεRIβ鎖のITAMと呼ばれる領域にチロシンキナーゼであるLynが活性化を受けて結合する。ITAMとはチロシン残基を二つ含みシグナル伝達に関与するモチーフである。引き続いてLyn(リン)がγ鎖のITAMをリン酸化し、その部位にチロシンキナーゼであるSyk(シック)が引き寄せられて結合しリン酸化を受ける。SykはLATのリン酸化を介してさらに下流に存在する低分子Gタンパク質の活性化を起こす経路、ホスホリパーゼC、MAPキナーゼなどを介した種々の経路を活性化させる。これらは最終的に小胞体からのカルシウムイオンの放出や細胞の脱顆粒反応、プロスタグランジン類をはじめとしたエイコサノイドや炎症性サイトカインの産生亢進などを引き起こす。
一方、LATを介さない経路として抗原刺激によりチロシンキナーゼFyn(フィン)がリン酸化され、アダプター分子であるGab2(ギャブ2)を介してPI3キナーゼを活性化することが知られている[15]。
参考文献
[編集]- ^ Ishizaka K, Ishizaka T, Hornbrook MM (1966). "Physico-chemical properties of human reaginic antibody. IV. Presence of a unique immunoglobulin as a carrier of reaginic activity". J. Immunol. 97 (1): 75–85. PMID 4162440。
- ^ Ishizaka, Teruko; Ishizaka, Kimishige; Johansson, S. Gunnar O.; Bennich, Hans (April 1, 1969). “Histamine Release from Human Leukocytes by Anti-λE Antibodies”. Journal of Immunology 102 (4): 884–892 2016年2月29日閲覧。.
- ^ Rihet P, Demeure CE, Bourgois A, Prata A, Dessein AJ (November 1991). "Evidence for an association between human resistance to Schistosoma mansoni and high anti-larval IgE levels". European Journal of Immunology. 21 (11): 2679–86. doi:10.1002/eji.1830211106. PMID 1936116. S2CID 1103861。
- ^ Pritchard DI, Quinnell RJ, Walsh EA (February 1995). "Immunity in humans to Necator americanus: IgE, parasite weight and fecundity". Parasite Immunology. 17 (2): 71–5. doi:10.1111/j.1365-3024.1995.tb00968.x. PMID 7761110. S2CID 41222700。
- ^ “Allergen-specific IgE and IgG4 are markers of resistance and susceptibility in a human intestinal nematode infection”. Microbes and Infection 7 (7–8): 990–6. (June 2005). doi:10.1016/j.micinf.2005.03.036. PMID 15961339.
- ^ Profet M (March 1991). "The function of allergy: immunological defense against toxins". The Quarterly Review of Biology. 66 (1): 23–62. doi:10.1086/417049. PMID 2052671. S2CID 5648170。
- ^ Palm NW, Rosenstein RK, Medzhitov R (April 2012). "Allergic host defences". Nature. 484 (7395): 465–72. Bibcode:2012Natur.484..465P. doi:10.1038/nature11047. PMC 3596087. PMID 22538607。
- ^ a b c Sharlach, Molly (24 October 2013). “Bee sting allergy could be a defense response gone haywire, scientists say”. Stanford Medicine News Center. 20 November 2019閲覧。
- ^ Starkl P, Marichal T, Gaudenzio N, Reber LL, Sibilano R, Tsai M, Galli SJ (January 2016). "IgE antibodies, FcεRIα, and IgE-mediated local anaphylaxis can limit snake venom toxicity". The Journal of Allergy and Clinical Immunology. 137 (1): 246–257.e11. doi:10.1016/j.jaci.2015.08.005. PMC 4715494. PMID 26410782。
- ^ Foley, James A. (25 October 2013). “Severe Allergies to Bee Stings may be Malfunctioning Evolutionary Response”. Nature World News. 2021年8月3日閲覧。
- ^ Tsai M, Starkl P, Marichal T, Galli SJ (October 2015). "Testing the 'toxin hypothesis of allergy': mast cells, IgE, and innate and acquired immune responses to venoms". Current Opinion in Immunology. 36: 80–7. doi:10.1016/j.coi.2015.07.001. PMC 4593748. PMID 26210895。
- ^ a b Kinet JP.(1999)"The high-affinity IgE receptor (Fc epsilon RI): from physiology to pathology."Annu.Rev.Immunol. 17,931-72. PMID 10358778
- ^ Sutton BJ, Gould HJ.(1993)"The human IgE network."Nature. 366,421-8. PMID 8247150
- ^ Sarfati M, Bettler B, Letellier M, Fournier S, Rubio-Trujillo M, Hofstetter H, Delespesse G.(1992)"Native and recombinant soluble CD23 fragments with IgE suppressive activity."Immunology. 76,662-7. PMID 1398755
- ^ Parravicini V, Gadina M, Kovarova M, Odom S, Gonzalez-Espinosa C, Furumoto Y, Saitoh S, Samelson LE, O'Shea JJ, Rivera J.(2002), "Fyn kinase initiates complementary signals required for IgE-dependent mast cell degranulation."Nat.Immunol. 3,741-8. PMID 12089510
出典
[編集]- 谷口克、宮坂昌之 編『標準免疫学 第2版』医学書院 2002年 ISBN 4260104527
- 今堀和友、山川民夫 編集 『生化学辞典 第4版』東京化学同人 2007年 ISBN 9784807906703
- 笹月健彦 監訳『免疫生物学 原書第5版』南江堂 2003年 ISBN 4524235221
外部リンク
[編集]- Immunoglobulin E - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス
