活動電位
活動電位(かつどうでんい、英: action potential)は、なんらかの刺激に応じて細胞膜に生じる一過性の膜電位の変化である。活動電位は、主としてナトリウムイオンやカリウムイオンが、細胞内外の濃度差に従ってイオンチャネルを通じて受動的拡散を起こすことにより、起きるものである。
活動電位は動物の本質的な必要条件であり、素早く組織間・内で情報を伝えることができる。また、動物のみならず、植物にも存在する。活動電位はさまざまな種類の細胞から生み出されるが、最も広範には神経系において神経細胞同士や、神経細胞から筋肉や腺などの他の体組織に情報を伝達するために使われる。
活動電位はすべての細胞で同じわけではなく、同じ種類の細胞でも細胞個体によって性質が異なることがある。例えば、筋肉は神経に次いで活動電位を発する組織として知られるが、中でも心筋活動電位は大抵の細胞間で大きく異なる。この項では神経細胞の軸索の典型的な活動電位について扱う。
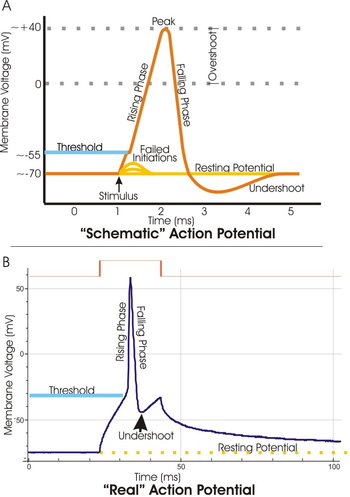
B. 電気ノイズや記録のための電気生理学技術のばらつきにより、実際の活動電位記録は概略図から歪む。
概観
[編集]細胞の内と外の間では、電位差が常に存在している。これは細胞内外でのイオン分布と、これらイオンに対する細胞膜の透過性(特定のイオンの通しやすさ)に由来する。
電荷を持つイオンの分布が細胞内外で異なるため、活性化していない静止状態の細胞では通常、細胞外と比べ細胞内の電位がマイナスとなっている。
活動電位とは、この電位差がなんらかの刺激によって一時的に逆転する現象である。活動電位はスパイクやインパルスともよばれる。また、活動電位に達することを「発火」と称することもある。活動電位の速度と複雑さは細胞の種類により異なるものの、電位逆転の幅はほぼ同じである。
活動電位における負から正への電位の変化に要する時間は短く、数ミリ秒である。どんな細胞の活動電位にも順に脱分極相、再分極相があり、多くの場合過分極相の段階もある。心臓ペースメーカー細胞のような心臓の特化細胞では、中間電圧のプラトー相は下降相に先行し活動電位持続時間を数百ミリ秒延長する。
活動電位は細胞膜上の一ヶ所に留まらず、膜上を進む(伝導)。長距離軸索を進むこともあり、例えば脊髄から脚の筋肉までシグナルを伝える。キリンやクジラのような大型動物においては、距離にして数メートル進む。
活動電位の発生には通常、電位依存性Na+チャネルの存在が不可欠である。この種のNa+チャネルが存在しない細胞や、存在しない細胞上の部位(多くの神経細胞の樹状突起など)においては、活動電位は発生しない。なお、Na+チャネルの代わりに(やはり電位依存性の)Ca2+チャネルを利用して、Ca2+電流による活動電位を発生させる生物もいる。神経以外では、心臓の調律を担っている洞房結節の細胞が挙げられる。
測定法
[編集]活動電位はパッチクランプ法などの電気生理学的手法や、EOSFETs等のニューロチップ、光を使った膜電位イメージングで測定される。軸索上の一点に置いた電極からオシロスコープによって膜電位を記録すると、オシロスコープ上には波周期として活動電位の各段階が現れる。一周期の活動電位は冒頭で示した図のような、歪んだサイン波に似る孤を描く。ある時刻における振幅は活動電位波が膜上のその点に達したかどうか、あるいは通過したかどうか、そうであればどれほど前かに依存する。
静止電位
[編集]
活動電位について知るためには、まず静止膜電位(静止電位ともいう)についておおまかに知る必要がある。
すべての細胞の膜内外に存在する電位差は通常、細胞外と比べ細胞内がマイナスである。この状態を、膜が分極しているという。活動していない状態にある膜の電位差は静止電位と呼ばれ、神経細胞ではおよそ−70mVである(細胞外の電位を0としている)。この電位差が生ずる要因はいくつかあるが、もっとも重要なものは膜間における、イオン輸送と選択的なイオン透過性である。
濃度勾配の形成
[編集]細胞膜上に散らばって存在するNa+ - K+ポンプにより、K+の細胞内への能動輸送とNa+の細胞外への能動輸送が行われる。このポンプは、三つのNa+を細胞外に排出する際、同時に二つのK+を細胞内に取り込む。このことにより、Na+は細胞外に多く内側に少ない、K+は細胞内に多く外側に少ないという陽イオン分布を生じさせる。平衡状態においてこの濃度勾配から計算される平衡電位は、ネルンストの式により、K+は約−90mV、Na+は約+45mVの値をとる。
静止電位の形成
[編集]濃度勾配を維持する要因はNa+ - K+ポンプであるが、静止電位の値を支配している大きな要因は、K+漏洩チャネルである。
Na+とK+は、開いたイオンチャネルを通して電気化学的勾配の影響の下で拡散する。通常、細胞膜においてK+の透過性はNa+の透過性よりも75倍大きい。これはK+漏洩チャネルが常に開いていることに起因する。静止電位が−70mVと、Na+の平衡電位+45mVよりもK+の平衡電位−90mVに近い値をとるのは、この透過性の違いが主な要因である。
静止電位と同様、多くの神経の活動電位はNa+とK+の透過性に依存している。
活動電位の仕組み
[編集]活動電位の大まかな流れは次のようになっている。
静止電位
[編集]静止電位において、いくつかのK+漏洩チャネルは開いている一方、電位依存性Na+チャネルは閉じている。正味の電流は流れていないが、膜間を移動している主なイオンはK+であり、その結果静止電位はK+平衡電位に比較近い値をとる。
刺激
[編集]興奮刺激による膜の局所的な脱分極は、神経細胞の表面の膜にある電位依存性Na+チャネルを開く。その結果Na+は濃度勾配および電気的勾配が推進力となり、細胞内へ流入する。
脱分極
[編集]Na+が流入し膜電位の負電荷が減少するに従い、さらなるNa+チャネルが開き、さらに大きなNa+の流入が引き起こされる。これは正のフィードバックのよい例である。Na+チャネルが多く開くにつれ、Na+による電流はK+漏洩チャネルによる電流に打ち勝ち、膜電位が逆転し内側がプラスとなる。
電位変化はNa+のみの移動によるものと考えるのではなく、Na+とK+の膜間での「透過性の比」の変化によるものと考えるべきである。
この、脱分極とそれにともなうNa+チャネルの開口が周囲に広がっていくことで活動電位の伝導が起こる。
ピーク
[編集]膜電位が+30mV程度になると、Na+チャネルの電位依存性ゲートが閉じ、さらなるNa+の流入を阻害する。これにわずかに遅れて、電位依存性K+チャネルの電位感受性活性化ゲートが開く。
活動電位のどの段階においても、きわめて少しのイオンの移動しか起こらないという認識は重要である。活動電位が生じている間の、細胞内外でのNa+とK+の濃度変化は無視できるほど極めて小さい。
再分極
[編集]電位依存性K+チャネルが開くことで、濃度勾配および電気的勾配が推進力となりK+の流出が始まる。K+が流出することで、膜電位の逆転と再分極が引き起こされる。
過分極
[編集]電位依存性K+チャネルの閉鎖は電位および時間に依存している。このチャネルは膜電位の変化にすぐには応答せず、遅れて応答を返す。そのため、膜が十分再分極した後もK+の流出が続き、一時的に膜電位が通常の静止電位よりもさらに低くなる。この過分極状態はアンダーシュートとも呼ばれる。
この他、Cl-チャネルの開口によりCl-が細胞内に流入することでも過分極を起こす。例として、ベンゾジアゼピン系の睡眠薬や抗不安薬などがある。ベンゾジアゼピン系薬物はγ-アミノ酪酸GABAA受容体-Cl-チャネル複合体のベンゾジアゼピン結合部位に結合しGABAA受容体に対するγ-アミノ酪酸の親和性を高めることで、Cl-チャネルを介したCl-の細胞内流入を促進するため、細胞が過分極を起こし、神経の興奮を抑える。
不応期
[編集]次に、活動電位は不応期と呼ばれる刺激に反応しない期間に移る。不応期はNa+チャネルが不活性化状態となっているために生じる。詳細は後述。
不応期は一方向への活動電位の伝導を保証する。不応期がなければ原理的には活動電位は軸索の両方向へと伝導が可能である。しかし実際には活動電位の伝導方向の後ろは不応期となっているため、活動電位の「逆流」が起こらないようになっている。
閾値
[編集]
活動電位は、興奮刺激による膜の局所的な脱分極が「閾値」を越えたときに引き起こされる。閾値の電位はさまざまだが、一般的には静止電位より15mV以上高い。
活動電位は2つのチャネル(電位依存性Na+チャネルとK+漏洩チャネル)のみをもつ仮想的な細胞によってモデル化できる。活動電位の閾値の由来はI/V カーブ(右図)により理解することが出来る。(図示したI/Vカーブはチャネルが不活性化していない状態で電圧を加えたときの瞬間的な電流を示している)
図において、着目すべき点は矢印にて示されている。
- 緑の矢印は静止電位を示す。仮想細胞系においてはK+の平衡電位(Ek)と一致し、K+チャネルが開口しても電位はEkのままである。
- 黄色の矢印はNa+の平衡電位(ENa)を示す。仮想細胞系においては、ENaはK+チャネルが閉じているときに達しえる最大膜電位である。ENaを越える電圧は人工的に加えて電流を計測している。
- 青の矢印は活動電位のピークが達しえる最大電位である。この電位が事実上の最大膜電位である。K+電流が存在するためENaにはたどり着けない。
- 赤の矢印は活動電位の閾値を示す。この電位以下では電流は外向きであり、細胞は静止電位へと戻ってしまう。この電位を少しでも越えると電流は内向きになり、細胞を脱分極させる。緑の線が最も低い値をとるところが、すべてのNa+チャネルが開く電位である。
活動電位の閾値はよくNa+チャネルが開口する「閾値」と混同される。これは正しくなく、Na+チャネルに明確な「閾値」は存在しない。そうではなく、開口は確率的なものであり、過分極のときでさえ、時折、開口するNa+チャネルがありえる。また、活動電位の閾値はNa+電流がK+電流を上回る電位を指し、Na+電流が有意な大きさとなる電位とは異なる。
神経細胞の脱分極は、生物学的には通常シナプスの樹状突起に起因する。しかし、原理的には活動電位は神経線維のどこからでも生じえる。
回路モデル
[編集]
B. より入念な回路を描くことによって、Na+チャネル(青)、K+チャネル(緑)を含む膜のモデルを示すこともできる。
生体膜における活動電位の伝達の仕組みは、イオンチャネルを持つ細胞膜をRC回路とみなすことでより深く理解できる。この回路において、イオンチャネルは抵抗、絶縁体である脂質膜はコンデンサーとして表される。電圧によって抵抗が変わる電位依存性イオンチャネルは可変抵抗であり、K+漏洩チャネルは通常の抵抗として表現される。膜間におけるNa+とK+の濃度差は電源(電池)とみなせる。また、軸索方向への神経伝達を妨げる要因も抵抗として表現される。
伝導
[編集]
まず、無髄線維における活動電位の伝導について説明する。活動電位は脱分極と電位依存性Na+チャネルの開口を繰り返すことで伝導する。ある区域において脱分極により電位依存性Na+チャネルが開くと、Na+は促進拡散により細胞内へ流入する。流入した陽電荷を持つNa+は静電気的反発によって付近の陽イオンを周りへ押しやり、同時に付近の陰イオンをひきつける。その結果、陽電荷の波、すなわち脱分極の波が生じ、イオン自身の移動を経ることなしに遠くまで伝わることとなる。そして近傍の区域において十分脱分極がおこると、その区域にあるチャネルが開く。この過程が繰り返されることで、活動電位が軸索上を伝導する。
速度
[編集]活動電位は、太さ以外の条件が同じであるとき、より太い軸索上でより速く伝導する。神経伝達を妨げる主な原因は電位差のために細胞内側の膜上に集まった陰イオンであり、直径が大きいと膜から離れた部分、つまりマイナスに帯電していない領域が増えるため、脱分極の波が速く伝わる。
イカは伝導速度の向上のため、直径を太くした巨大軸索 (Giant axon) を持っている。特にアメリカオオアカイカの巨大軸索は直径が1mm以上もある[1]。だがこれらは無髄線維であるため、細い有髄線維と比べて伝達速度はあまり変わらない。
哺乳類においては、自律神経系の交感神経の節後神経は無髄線維である。直径2µmの無髄線維はおよそ1m/sの伝達速度を示す。これに対し、同じ直径を持つ有髄線維はおよそ18m/sの速度をもつ。
跳躍伝導
[編集]有髄線維においては、活動電位が髄鞘 (ミエリン)で絶縁された部分を「飛び越える」、跳躍伝導という現象がある。有髄線維において、髄鞘のまかれていない部分をランヴィエ絞輪と呼ぶ。髄鞘の存在によって、直径を巨大化させずとも伝導速度を速くすることができる。跳躍伝導という名前のためによく誤解されるが、活動電位が「跳躍」すること自体は髄鞘が巻かれていることによる「現象」であり、跳躍伝導が速い原因ではない。
跳躍伝導は、生命が大きく複雑化するという進化の過程において、より遠くにより速く神経伝達を行うために重要な役割を果たした。もし跳躍伝導がなければ、伝導速度を上げるためには軸索の直径を大きくするしかなく、神経系の体の中で占める割合は極めて大きなものとなっていたであろう。
跳躍伝導のメカニズムは、1939年に田崎一二博士により発見された。
- 跳躍伝導のメカニズム
- 伝導を妨げる主な原因は膜上に存在する電荷である。コンデンサーの蓄える電荷は、二枚の板の間の距離を遠くすると減少する。神経系は、細胞に髄鞘を巻くことによって絶縁部分を太くし、膜上に存在する電荷の減少を図っている。
- その結果、髄鞘のある部位における伝導速度は格段に向上する。しかし同時にこの部位では、髄鞘があるために電位依存性チャネルが存在できず、活動電位の再生は妨げられる。よって、髄鞘のまかれていないランヴィエ絞輪においてのみ活動電位が再生される。ランヴィエ絞輪では電位依存性Na+チャネルが豊富に存在するので(無髄線維における密度より4桁ほど多い)、効率的に活動電位を再生することが出来るようになっている。
- 損傷への対応
- 髄鞘の巻かれている部分の長さは跳躍伝導にとって重要である。速い伝導を行うためには、この長さは長ければ長いほど良いが、長すぎると信号の波が減衰しすぎて次のランヴィエ絞輪のチャネルの閾値を越えることが出来なくなる。現実には、髄鞘の巻かれている部分の長さは、信号が最低でも二つ先のランヴィエ絞輪までたどり着けるのに十分な長さをもつ。そのようにして、あるランヴィエ絞輪の部分が損傷などの原因により活動電位が起こせなくなっていたとしても、そのひとつ先のランヴィエ絞輪まで信号を伝えることが出来る。
- 疾患との関わり
- いくつかの病気は跳躍伝導を妨げ、伝導速度を低下させる。これらの病気のうち最もよく知られたものとして、脱髄疾患の一種である多発性硬化症がある。
不応期
[編集]不応期はNa+チャネルが不活性化状態となっているために生じ、便宜上、絶対不応期と相対不応期にわけられる。
絶対不応期はいかに電位が変化しようとも活動電位が発生しない期間をいう。これはほとんどすべてのNa+チャネルが不活性化状態となっているためである。
相対不応期(絶対不応期の次にくる)は、強い刺激を与えれば活動電位の発生がおこる期間をいう。活動電位が発生しづらくなっている原因は二つである。一つ目の原因として、細胞がまだわずかに過分極の状態にあることがあげられる。これは、K+の透過性が静止状態のときと比べ大きなままであるためである。このため、閾値に達するためにより大きな電位変化が必要となる。もう一つの原因は閾値自体の上昇にある。これは、いくつかのNa+チャネルがいまだに不活性であるためである。
よく誤解されるが、Na+/K+ポンプは電位の変化には寄与しない。Na+/K+ポンプは濃度勾配を維持することにより静止電位の維持に寄与する、ということはできるのだが、チャネルと比べるとタイムスケールが長く、電位変化に関わる透過性への影響はチャネルと比べると無視できる程度に小さい。
- 電位依存性Na+チャネル
- 電位依存性Na+チャネルは2つのゲートを持つ。Na+はこの2つのゲートが共に開いて初めて細胞内への流入が可能となる。
- ゲートの一つは細胞膜の電位に反応して開く細胞質外ゲート(電位依存性ゲート)で、膜が脱分極している間は開き続ける。もう一つの細胞質内ゲート(不活性化ゲート)は通常開いているが、電位依存性ゲートが開くとすぐに閉じてしまう。不活性化ゲートが再び開くのは時間依存的であり、確率的なものである。不活性化ゲートが閉じている間はチャネルが不活性化していると呼ばれ、不応期を生じる主な原因となっている。
進化的意図
[編集]この節の加筆が望まれています。 |
植物の活動電位
[編集]この節の加筆が望まれています。 |
脚注
[編集]- ^ Squid As Experimental Animals, p. 102, - Google ブックス
参考文献
[編集]この節の加筆が望まれています。 |
関連項目
[編集]外部リンク
[編集]- 神経細胞とシグナル伝達 (ビジュアル生理学 内の項目)
- Action potential propagation Animation
- Electrochemistry of plant life, from Case Western Reserve University
- Demonstration of ion flow during action potential
- Open-source software to simulate neuronal and cardiac action potentials
- Nernst/Goldman Equation Simulator
- The Nernst Equation and Action Potentials in the Nervous System from www.medicalcomputing.net
- Electrophysiology and The Molecular Basis of Excitability
