テルピネオール
| α-テルピネオール | |
|---|---|
 (S)-(−) 体 | |
| IUPAC名 | p-メンタ-1-エン-8-オール(許容慣用名から誘導) 2-(4-メチルシクロヘキサ-3-エニル)プロパン-2-オール(系統名) |
| 別名 | ターピネオール |
| 分子式 | C10H18O |
| 分子量 | 154.25 |
| CAS登録番号 | [10482-56-1] (S)-(−) 体 [7785-53-7] (R)-(+) 体 [98-55-5] ラセミ体 [8000-41-7] α, β, γ 混合物 |
| 融点 | 31−35 °C |
| 沸点 | 217−218 °C |
| SMILES | CC1=CCC(C(C)(O)C)CC1 |
テルピネオール (terpineol) は天然に存在するモノテルペンアルコールの一種で、カユプテ油 (cajuput oil)、松根油 (pine oil)、プチグレン油 (petitgrain oil) などから得られる[1]。月桂樹、ローズマリー、アニス、マジョラムなどやアキギリ属、ビャクシン属の植物の精油、およびテレビン油の成分でもある。ウコン精油には 500 ppm、ナツメグの種子には 9600 ppm 程度含まれる。
ライラックに似た芳香を持ち、香料や化粧品、石鹸などへの添加物として使われる。
ヒドロキシ基と二重結合の位置が異なる4種類の異性体、α、β、γ、δ-テルピネオールが知られる。普通はこれらの混合物として存在するが、主成分はα-テルピネオールであり、単にテルピネオールといった場合はこれを指す。α-テルピネオールは松根油(pine oil)から単離される。 メンタン骨格上に二重結合とヒドロキシ基をひとつずつ持つ他の位置異性体化合物として、プレゴールとピペリトールが知られる。
-
α-テルピネオール
-
β-テルピネオール
-
γ-テルピネオール
-
δ-テルピネオール
製造[編集]
天然に存在するが、工業的にはより容易に得られるα-ピネンを加水分解することによって製造される。この反応は19世紀から知られている[2]。
ゲラニオールまたはネロールを環化させることによっても得られる。
ラセミ体の製造法として以下の反応が知られる。イソプレンをアクリル酸のメチルエステルとディールス・アルダー反応させ、生成したシクロヘキセン誘導体にグリニャール試薬の一種であるメチルマグネシウムブロミド (CH3MgBr) を作用させるとテルピネオールが得られる[3]。

原料として d-リモネンを用い、(R)-(+)-α-テルピネオールを選択的に合成する方法が報告されている[4]。
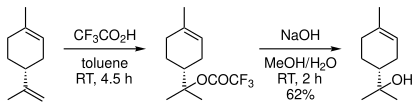
まずリモネンをトリフルオロ酢酸と反応させ、マルコフニコフ型の付加物を得る。生成したトリフルオロ酢酸エステルを水酸化ナトリウムで加水分解すると、テルピネオールを与える。この反応ではβ-テルピネオールとγ-テルピネオールが副生し、α-異性体の選択性は76%である。
関連法規[編集]
参考文献[編集]
- ^ Merck Index, 11th Edition, 9103.
- ^ Bedoukian, P. Z. (1967). "Terpineol" in Perfumery and Flavoring Synthetics. Amsterdam: Elsevier, pp. 328–343.
- ^ Inukai, T.; Kasai, M. (1965). "Diels-Alder reactions of acrylic acid derivatives catalyzed by aluminum chloride." J. Org. Chem. 30: 3567–3569. doi:10.1021/jo01021a508.
- ^ Yuasa, Y.; Yuasa, Y. (2006). "A practical synthesis of d-α-terpineol via Markovnikov addition of d-limonene using trifluoroacetic acid." Org. Process Res. Dev. 10: 1231–1232. doi:10.1021/op068012d.





