「5-メチルシトシン」の版間の差分
編集の要約なし タグ: サイズの大幅な増減 ビジュアルエディター |
|||
| 43行目: | 43行目: | ||
}} |
}} |
||
'''5-メチルシトシン'''(5mC、m5Cなどと略されることが多い)は[[DNA]]塩基の一つである[[シトシン|シトシン(C)]]が[[メチル化]]されたもので、遺伝子[[転写 (生物学)|転写]]の調整に関与している<ref>{{Cite journal|last=Wu|first=Xiaoji|last2=Zhang|first2=Yi|date=09 2017|title=TET-mediated active DNA demethylation: mechanism, function and beyond|url=https://www.ncbi.nlm.nih.gov/pubmed/28555658|journal=Nature Reviews. Genetics|volume=18|issue=9|pages=517–534|doi=10.1038/nrg.2017.33|issn=1471-0064|pmid=28555658}}</ref>。シトシンがメチル化されると、転写過程に変化はないが[[遺伝子発現]]に変化が生ずる。この分野の研究は[[エピジェネティクス]]と呼ばれる。5mCは{{仮リンク|DNAメチルトランスフェラーゼ|en|DNA methyltransferase}}による[[エピジェネティクス|エピジェネティック]]な修飾により生成される。5mCと[[ヌクレオシド]]が組み合わさった状態は[[5-メチルシチジン]]であり、この状態でDNAに組み込まれている。 |
|||
'''5-メチルシトシン'''(5mC)は[[DNA]]塩基の一つである[[シトシン]]が[[メチル化]]されたもので、遺伝子[[転写 (生物学)|転写]]の調整に関与している。 |
|||
シトシンがメチル化されると、転写過程に変化はないが[[遺伝子発現]]に変化が生ずる。(この分野の研究は[[エピジェネティクス]]と呼ばれる。) |
|||
5mCは[[ヌクレオシド]]に取り込まれて5-メチルシチジンとなる。 |
|||
5mCでは |
5mCでは[[メチル基]]は[[六員環]]の、図の6時方向の[[窒素]]原子(NH)から反時計回りに数えて5位の炭素原子に付加される。このメチル基は、シトシンと5mCとを区別する特徴である。 |
||
このメチル基はシトシンと5mCとを区別する特徴である。 |
|||
==発見の経緯== |
==発見の経緯== |
||
1898年、[[結核菌]]から[[細菌]]性[[毒素]]を単離しようとしていた時、新たな核酸が発見され、{{仮リンク|ツベルクリン酸|en|tuberculinic acid}}と命名された<ref>{{cite book |author= Matthews AP |year=2012 |title=[http://books.google.co.in/books/about/Physiological_Chemistry.html?id=809EPAAACAAJ&redir_esc=y Physiological Chemistry] |edition= |publisher= Williams & Wilkins Company/[http://www.amazon.com/Physiological-chemistry-text-book-manual-students/dp/1130145379/ref=sr_1_6?s=books&ie=UTF8&qid=1361261416&sr=1-6 RareBooksClub.com] |pages=167 |isbn=1130145379}} </ref>。 |
1898年、[[結核菌]]から[[細菌]]性[[毒素]]を単離しようとしていた時、新たな核酸が発見され、{{仮リンク|ツベルクリン酸|en|tuberculinic acid}}と命名された<ref>{{cite book |author= Matthews AP |year=2012 |title=[http://books.google.co.in/books/about/Physiological_Chemistry.html?id=809EPAAACAAJ&redir_esc=y Physiological Chemistry] |edition= |publisher= Williams & Wilkins Company/[http://www.amazon.com/Physiological-chemistry-text-book-manual-students/dp/1130145379/ref=sr_1_6?s=books&ie=UTF8&qid=1361261416&sr=1-6 RareBooksClub.com] |pages=167 |isbn=1130145379}} </ref>。この核酸は、[[チミン]]、[[グアニン]]、[[シトシン]]とは異なる、メチル化された塩基を持つ[[ヌクレオチド]]であった。1925年、少量のメチル化シトシンがツベルクリン酸の硫酸[[加水分解]]物として生成された<ref>{{cite journal |author= Johnson TB, Coghill RD |year=1925 |title= The discovery of 5-methyl-cytosine in tuberculinic acid, the nucleic acid of the ''Tubercle bacillus'' |journal= [http://pubs.acs.org/doi/abs/10.1021/ja01688a030 J Am Chem Soc]|volume=47 |issue=11|pages=2838–2844|doi=10.1021/ja01688a030}}</ref><ref>Grosjean H (2009). [http://www.ncbi.nlm.nih.gov/books/NBK6489/#A79016 Nucleic Acids Are Not Boring Long Polymers of Only Four Types of Nucleotides: A Guided Tour]. Landes Bioscience.</ref>。この報告はピクリン酸結晶の光学特性のみに基づいていた上、他の科学者達に再現できなかったので酷評された<ref>{{cite journal |author= Vischer E, Zamenhof S, Chargaff E |year=1949 |title= Microbial nucleic acids: the desoxypentose nucleic acids of avian tubercle bacilli and yeast|journal= J Biol Chem|volume=77 |issue=1|pages=429–438|pmid=18107446}}</ref>。しかし1948年、仔牛[[胸腺]]の[[DNA]]から従来のシトシンや[[ウラシル]]とは異なるメチル化シトシンが[[ペーパークロマトグラフィー]]により単離され、存在が決定的となった<ref>{{cite journal |author= Hotchkiss RD |year=1948|title= The quantitative separation of purines, pyrimidines and nucleosides by paper chromatography|journal=J Biol Chem|volume=175 |issue=1|pages=315–332|pmid=18107446}}</ref>。それから70年後、[[RNA]]分子中に一般に存在することが明らかとなったが、正確な役割は不明であった<ref>{{cite journal |author= Squires JE, Patel HR, Nousch M, Sibbritt T, Humphreys DT, Parker BJ, Suter CM, Preiss T.|year=2012|title= [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3367185/ Widespread occurrence of 5-methylcytosine in human coding and non-coding RNA]|journal=Nucleic Acids Res|volume=40 |issue=11|pages=5023–5033|pmid=22344696|doi=10.1093/nar/gks144}}</ref>。 |
||
この核酸は、[[チミン]]、[[グアニン]]、[[シトシン]]とは違う、メチル化された塩基を持つ[[ヌクレオチド]]であった。 |
|||
1925年、少量のメチル化シトシンがツベルクリン酸の硫酸[[加水分解]]物として生成された<ref>{{cite journal |author= Johnson TB, Coghill RD |year=1925 |title= The discovery of 5-methyl-cytosine in tuberculinic acid, the nucleic acid of the ''Tubercle bacillus'' |journal= [http://pubs.acs.org/doi/abs/10.1021/ja01688a030 J Am Chem Soc]|volume=47 |issue=11|pages=2838–2844|doi=10.1021/ja01688a030}}</ref><ref>Grosjean H (2009). [http://www.ncbi.nlm.nih.gov/books/NBK6489/#A79016 Nucleic Acids Are Not Boring Long Polymers of Only Four Types of Nucleotides: A Guided Tour]. Landes Bioscience.</ref>。 |
|||
この報告はピクリン酸結晶の光学特性のみに基づいていた上、他の科学者達に再現できなかったので酷評された<ref>{{cite journal |author= Vischer E, Zamenhof S, Chargaff E |year=1949 |title= Microbial nucleic acids: the desoxypentose nucleic acids of avian tubercle bacilli and yeast|journal= J Biol Chem|volume=77 |issue=1|pages=429–438|pmid=18107446}}</ref>。 |
|||
しかし1948年、仔牛[[胸腺]]の[[DNA]]から従来のシトシンや[[ウラシル]]とは異なるメチルシトシンが[[ペーパークロマトグラフィー]]により単離され、存在が決定的となった<ref>{{cite journal |author= Hotchkiss RD |year=1948|title= The quantitative separation of purines, pyrimidines and nucleosides by paper chromatography|journal=J Biol Chem|volume=175 |issue=1|pages=315–332|pmid=18107446}}</ref>。 |
|||
それから70年後、[[RNA]]分子中に一般に存在することが明らかとなったが、正確な役割は不明であった<ref>{{cite journal |author= Squires JE, Patel HR, Nousch M, Sibbritt T, Humphreys DT, Parker BJ, Suter CM, Preiss T.|year=2012|title= [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3367185/ Widespread occurrence of 5-methylcytosine in human coding and non-coding RNA]|journal=Nucleic Acids Res|volume=40 |issue=11|pages=5023–5033|pmid=22344696|doi=10.1093/nar/gks144}}</ref>。 |
|||
==''[[In vivo]]''== |
==''[[In vivo]]''== |
||
5mCは{{仮リンク|DNAメチルトランスフェラーゼ|en|DNA methyltransferase}}による[[エピジェネティクス|エピジェネティック]]な修飾により生成される。 |
|||
[[File:Cytosine 5-methylation.png|336px|center]] |
[[File:Cytosine 5-methylation.png|336px|center]] |
||
この物質の機能は生物種により大きく異なる<ref>{{cite journal |author=Colot V, Rossignol JL |title=Eukaryotic DNA methylation as an evolutionary device |journal=Bioessays |volume=21 |issue=5 |pages=402–411 |year=1999 |pmid=10376011 |doi=10.1002/(SICI)1521-1878(199905)21:5<402::AID-BIES7>3.0.CO;2-B}}</ref>。 |
この物質の機能は生物種により大きく異なる<ref>{{cite journal |author=Colot V, Rossignol JL |title=Eukaryotic DNA methylation as an evolutionary device |journal=Bioessays |volume=21 |issue=5 |pages=402–411 |year=1999 |pmid=10376011 |doi=10.1002/(SICI)1521-1878(199905)21:5<402::AID-BIES7>3.0.CO;2-B}}</ref>。 |
||
* 細菌の場合、5mCは様々な場所に存在し、しばしば自身のメチル化感受性 |
* 細菌の場合、5mCはゲノム上の様々な場所に存在し、しばしば自身のDNAをメチル化感受性[[制限酵素]]から保護するマーカーとして機能している。 |
||
* 植物の場合、5mCは |
* 植物の場合、5mCは[[CpG アイランド|CpGサイト]]、CpHpG、ならびにCpHpHの配列に局在している(H = A, C, T)。 |
||
* 真菌および動物の場合 |
* 真菌および動物の場合、5mCは主にCpGジヌクレオチドとして存在する。多くの[[真核生物]]ではCpGサイトのメチル化率はわずかであるが、[[脊椎動物]]の場合は70〜80%のCpG中シトシンがメチル化されている<ref>{{Cite journal|last=Bird|first=A. P.|date=1986 May 15-21|title=CpG-rich islands and the function of DNA methylation|url=https://www.ncbi.nlm.nih.gov/pubmed/2423876|journal=Nature|volume=321|issue=6067|pages=209–213|doi=10.1038/321209a0|issn=0028-0836|pmid=2423876}}</ref>。哺乳類に置いては、ゲノム中の約1%の塩基が5mCである<ref>{{Cite journal|last=Ehrlich|first=M.|last2=Wang|first2=R. Y.|date=1981-06-19|title=5-Methylcytosine in eukaryotic DNA|url=https://www.ncbi.nlm.nih.gov/pubmed/6262918|journal=Science (New York, N.Y.)|volume=212|issue=4501|pages=1350–1357|doi=10.1126/science.6262918|issn=0036-8075|pmid=6262918}}</ref>。 |
||
| ⚫ | シトシンが自発性に[[脱アミノ|脱アミノ化]]すると[[ウラシル]]となり、[[DNA修復|DNA修復酵素]]により除去されるが、一方で5mCが脱アミノ化すると[[チミン]](T)を生じる。この塩基の転換(C→T)は塩基転位型[[突然変異]]を引き起こし得る<ref>{{Cite journal|last=Sassa|author=|first=A|last2=Kanemaru|first2=Y|last3=Kamoshita|first3=N|last4=Honma|first4=M|last5=Yasui|first5=M|year=|date=2016-09-01|title=Mutagenic consequences of cytosine alterations site-specifically embedded in the human genome|url=https://genesenvironment.biomedcentral.com/articles/10.1186/s41021-016-0045-9|journal=Genes and Environment|volume=38|issue=1|page=|language=En|doi=10.1186/s41021-016-0045-9|issn=1880-7062|pmid=27588157|pmc=PMC5007816}}</ref>。加えて、{{仮リンク|APOBEC|en|APOBEC}}ファミリーの酵素によって引き起こされるシトシン及び5mCの脱アミノ化は、細胞内のプロセスや生物種の進化に関与している可能性がある<ref name="Chahwan R, Wontakal SN, and Roa S">{{cite journal| author= Chahwan R., Wontakal S.N., and Roa S.| title=Crosstalk between genetic and epigenetic information through cytosine deamination| journal=Trends in Genetics| volume = 26| pages = 443–448| year = 2010 | doi = 10.1016/j.tig.2010.07.005| pmid = 20800313| issue = 10}}</ref>。一方で、[[5-ヒドロキシメチルシトシン]]の 脱アミノ化の意義や詳細は不明である。 |
||
シトシンが自発性に[[脱アミノ|脱アミノ化]]すると[[ウラシル]]となり、[[DNA修復|DNA修復酵素]]により除去されるが、5mCが脱アミノ化すると[[チミン]]を生じる。 |
|||
| ⚫ | この塩基の転換(C→T)は塩基転位型[[突然変異]]を引き起こ |
||
== ''[[In vitro]]'' == |
== ''[[In vitro]]'' == |
||
[[亜硝酸]]等により5-メチルシトシンから-NH<sub>2</sub>基を除去(脱アミノ化)すると[[チミン]]を生ずる。 |
[[亜硝酸]]等により5-メチルシトシンから-NH<sub>2</sub>基を除去(脱アミノ化)すると[[チミン]]を生ずる。同じ条件下でシトシンが脱アミノ化するとウラシルを生じる。 |
||
同じ条件下でシトシンが脱アミノ化するとウラシルを生じる。 |
|||
[[File:Deamination 5-Methylcytosine to Thymine.svg|300px|thumb|none|5-メチルシトシンからの脱アミノ化に拠るチミンの生成]] |
[[File:Deamination 5-Methylcytosine to Thymine.svg|300px|thumb|none|5-メチルシトシンからの脱アミノ化に拠るチミンの生成]] |
||
シトシンは[[亜硫酸水素ナトリウム|重亜硫酸]]処理で脱アミノ化されるが、5mCは脱アミノ化されない。 |
シトシンは[[亜硫酸水素ナトリウム|重亜硫酸]]処理で脱アミノ化されるが、5mCは脱アミノ化されない。この性質を利用して、{{仮リンク|重亜硫酸塩シークエンス|en|Bisulfite_sequencing}}技術によりゲノム中のシトシンのメチル化パターンを解析することができる<ref>{{cite journal |author=Clark SJ, Harrison J, Paul CL, Frommer M |title=High sensitivity mapping of methylated cytosines |journal=Nucleic Acids Res. |volume=22 |issue=15 |pages=2990–2997 |year=1994 |pmid=8065911 |doi=10.1093/nar/22.15.2990 |pmc=310266}}</ref>。 |
||
この性質は{{仮リンク|重亜硫酸塩シークエンス|en|Bisulfite_sequencing}}技術を用いたシトシンのメチル化パターンの解析に利用される<ref>{{cite journal |author=Clark SJ, Harrison J, Paul CL, Frommer M |title=High sensitivity mapping of methylated cytosines |journal=Nucleic Acids Res. |volume=22 |issue=15 |pages=2990–2997 |year=1994 |pmid=8065911 |doi=10.1093/nar/22.15.2990 |pmc=310266}}</ref>。 |
|||
== DNMTによるメチル化と発現制御 == |
|||
5mCマークは、 [[DNAメチルトランスフェラーゼ]] (DNMT)を介してゲノムDNAに付加される。ヒトゲノム中では、DNMT1、DNMT2、DNMT3A、DNMT3B、およびDNMT3Lの5つのDNMTが知られている。藻類および菌類には、DNMT4、DNMT5、およびDNMT6の3つがさらに存在する<ref>{{Cite journal|last=Ponger|first=Loïc|last2=Li|first2=Wen-Hsiung|date=2005-04-01|title=Evolutionary Diversification of DNA Methyltransferases in Eukaryotic Genomes|url=https://academic.oup.com/mbe/article/22/4/1119/1083517|journal=Molecular Biology and Evolution|volume=22|issue=4|pages=1119–1128|language=en|DOI=10.1093/molbev/msi098|ISSN=0737-4038|PMID=15689527}}</ref>。 |
|||
DNMT1には、複製焦点ターゲティングシーケンス(RFTS)と、5mCマークの追加を触媒するCXXCドメインが含まれている。 RFTSはDNMT1をDNA複製の遺伝子座に導き、DNA複製中の娘鎖上の5mCの維持を支援しますが、CXXCはDNAへのメチル化の''de novo''付加のための[[ジンクフィンガー]]ドメインを含む <ref name=":0">{{Cite journal|last=Lyko|first=Frank|date=February 2018|title=The DNA methyltransferase family: a versatile toolkit for epigenetic regulation|journal=Nature Reviews Genetics|volume=19|issue=2|pages=81–92|language=en|DOI=10.1038/nrg.2017.80|ISSN=1471-0064|PMID=29033456}}</ref>。DNMT1は、多くのヒトの体組織において、支配的なDNAメチルトランスフェラーゼであること知られている<ref name=":1">{{Cite journal|last=Robertson|first=K D|last2=Uzvolgyi|first2=E|last3=Liang|first3=G|last4=Talmadge|first4=C|last5=Sumegi|first5=J|last6=Gonzales|first6=F A|last7=Jones|first7=P A|date=1999-06-01|title=The human DNA methyltransferases (DNMTs) 1, 3a and 3b: coordinate mRNA expression in normal tissues and overexpression in tumors.|journal=Nucleic Acids Research|volume=27|issue=11|pages=2291–2298|DOI=10.1093/nar/27.11.2291|ISSN=0305-1048|PMID=10325416|PMC=148793}}</ref>。 DNMT3AとDNMT3Bは主に''de novo''メチル化を担当し、DNMT1は複製後に5mCマークを維持する役割を持つ<ref name=":3">{{Cite journal|last=Wu|first=Xiaoji|last2=Zhang|first2=Yi|date=2017-05-30|title=TET-mediated active DNA demethylation: mechanism, function and beyond|journal=Nature Reviews Genetics|volume=18|issue=9|pages=517–534|DOI=10.1038/nrg.2017.33|ISSN=1471-0056|PMID=28555658}}</ref>。DNMTは互いに相互作用して、メチル化能力を高めている。たとえば、2つのDNMT3Lは2つのDNMT3Aと複合体を形成してDNAとの相互作用を改善し、メチル化を促進する <ref>{{Cite journal|last=Jia|first=Da|last2=Jurkowska|first2=Renata Z.|last3=Zhang|first3=Xing|last4=Jeltsch|first4=Albert|last5=Cheng|first5=Xiaodong|date=September 2007|title=Structure of Dnmt3a bound to Dnmt3L suggests a model for de novo DNA methylation|journal=Nature|volume=449|issue=7159|pages=248–251|language=en|bibcode=2007Natur.449..248J|DOI=10.1038/nature06146|ISSN=1476-4687|PMID=17713477|PMC=2712830}}</ref>。DNMTの発現の変化は、異常なメチル化をもたらす。過剰発現することでメチル化の増加をもたらし、逆に酵素を破壊するとメチル化のレベルは低下する<ref name=":1" />。 |
|||
[[File:DNMT_reaction_mechanism.tif|リンク=https://en.wikipedia.org/wiki/File:DNMT_reaction_mechanism.tif|代替文=DNMT reaction mechanism|左|サムネイル|595x595ピクセル|Addition of methyl group to cytosine]] |
|||
付加のメカニズムは次のとおりである <ref name=":02">{{Cite journal|last=Lyko|first=Frank|date=February 2018|title=The DNA methyltransferase family: a versatile toolkit for epigenetic regulation|journal=Nature Reviews Genetics|volume=19|issue=2|pages=81–92|language=en|DOI=10.1038/nrg.2017.80|ISSN=1471-0064|PMID=29033456}}</ref> 。 |
|||
# DNMTのPCQモチーフのシステイン残基が、メチル化されるシトシンヌクレオチドの炭素6に求核攻撃を引き起こす。 |
|||
# [[S-アデノシルメチオニン]]は、メチル基を炭素5に供与する。 |
|||
# DNMT酵素の塩基は、炭素5の残留水素を脱プロトン化して、環の炭素5と6の間の二重結合を復元し、5-メチルシトシン塩基対を生成する。 |
|||
<br /> |
|||
== 脱メチル化 == |
|||
シトシンが5mCにメチル化された後、複数のメカニズムを介して元の状態に戻すことができる。 |
|||
受動的なDNA脱メチル化としては、DNMTによるメンテナンスの欠如により、複製を通じて徐々にメチル化シトシンが希釈化される、というものがある。能動的なDNA脱メチル化としては、酸化プロセスにより[[5-ヒドロキシメチルシトシン]] (5hmC)、[[5-ホルミルシトシン]](5fC)、および[[5-カルボキシルシトシン]](5caC)に変換され、後者2つは最終的に[[チミンDNAグルコシラーゼ|チミンDNAグリコシラーゼ]] (TDG)及びシトシンを復元するための塩基除去修復酵素(BER)によってヌクレオシドから切断される<ref name=":32">{{Cite journal|last=Wu|first=Xiaoji|last2=Zhang|first2=Yi|date=2017-05-30|title=TET-mediated active DNA demethylation: mechanism, function and beyond|journal=Nature Reviews Genetics|volume=18|issue=9|pages=517–534|DOI=10.1038/nrg.2017.33|ISSN=1471-0056|PMID=28555658}}</ref>。 TDGをノックアウトした実験では、5hmCにはに統計的に有意な変化を与えず、一方で5fCは2倍の増加をもたらした<ref>{{Cite journal|last=Song|first=Chun-Xiao|last2=Szulwach|first2=Keith E.|last3=Dai|first3=Qing|last4=Fu|first4=Ye|last5=Mao|first5=Shi-Qing|last6=Lin|first6=Li|last7=Street|first7=Craig|last8=Li|first8=Yujing|last9=Poidevin|first9=Mickael|date=2013-04-25|title=Genome-wide profiling of 5-formylcytosine reveals its roles in epigenetic priming|journal=Cell|volume=153|issue=3|pages=678–691|DOI=10.1016/j.cell.2013.04.001|ISSN=1097-4172|PMID=23602153|PMC=3657391}}</ref>。 5mC、5hmC、および5fCへの酸化反応は[[ Tetメチルシトシンジオキシゲナーゼ2|TET]] (Ten-eleven translocation)ファミリージオキシゲナーゼを介して発生する。 この酵素は5mCを優先的に処理し、TET2では5hmCおよび5fC変換の初期反応速度は4.9〜7.6倍遅くなります<ref>{{Cite journal|last=Ito|first=Shinsuke|last2=Shen|first2=Li|last3=Dai|first3=Qing|last4=Wu|first4=Susan C.|last5=Collins|first5=Leonard B.|last6=Swenberg|first6=James A.|last7=He|first7=Chuan|last8=Zhang|first8=Yi|date=2011-09-02|title=Tet Proteins Can Convert 5-Methylcytosine to 5-Formylcytosine and 5-Carboxylcytosine|journal=Science|volume=333|issue=6047|pages=1300–1303|language=en|bibcode=2011Sci...333.1300I|DOI=10.1126/science.1210597|ISSN=0036-8075|PMID=21778364|PMC=3495246}}</ref>。TETには補因子としてFe(II)、基質として酸素および[[α-ケトグルタル酸]] (α-KG)が必要であり、後者の基質は[[イソクエン酸デヒドロゲナーゼ]] (IDH)によってイソクエン酸から生成される<ref>{{Cite journal|last=Lu|first=Xingyu|last2=Zhao|first2=Boxuan Simen|last3=He|first3=Chuan|date=2015-02-12|title=TET Family Proteins: Oxidation Activity, Interacting Molecules, and Functions in Diseases|journal=Chemical Reviews|volume=115|issue=6|pages=2225–2239|DOI=10.1021/cr500470n|ISSN=0009-2665|PMID=25675246|PMC=4784441}}</ref>。 [[悪性腫瘍]](がん)においては、α-KGと競合する[[ 2-ヒドロキシグルタル酸|2-ヒドロキシグルタレート]] (2HG)を生成してTET活性を低下させることで、5mCから5hmCへの変換を低下させている可能性が報告されている<ref>{{Cite journal|last=Xu|first=Wei|last2=Yang|first2=Hui|last3=Liu|first3=Ying|last4=Yang|first4=Ying|last5=Wang|first5=Ping|last6=Kim|first6=Se-Hee|last7=Ito|first7=Shinsuke|last8=Yang|first8=Chen|last9=Wang|first9=Pu|date=2011-01-18|title=Oncometabolite 2-Hydroxyglutarate Is a Competitive Inhibitor of α-Ketoglutarate-Dependent Dioxygenases|journal=Cancer Cell|volume=19|issue=1|pages=17–30|DOI=10.1016/j.ccr.2010.12.014|ISSN=1535-6108|PMID=21251613|PMC=3229304}}</ref>。 |
|||
== ヒトにおける5mCの役割 == |
|||
癌細胞においては、ゲノムDNAは過剰メチル化や低メチル化と呼ばれる状態になることがある<ref name=":22">{{Cite journal|last=Ehrlich|first=Melanie|date=2009-12-01|title=DNA hypomethylation in cancer cells|journal=Epigenomics|volume=1|issue=2|pages=239–259|DOI=10.2217/epi.09.33|ISSN=1750-1911|PMID=20495664|PMC=2873040}}</ref>。過剰メチル化の例としては、遺伝子プロモーターと重複するCpGアイランドが''de novo''メチル化されることで、通常腫瘍の増殖阻害に関連する遺伝子の異常な不活性化を引き起こすものがある<ref>{{Cite journal|last=Jones|first=Peter A.|date=1996-06-01|title=DNA Methylation Errors and Cancer|url=https://cancerres.aacrjournals.org/content/56/11/2463|journal=Cancer Research|volume=56|issue=11|pages=2463–2467|language=en|ISSN=0008-5472|PMID=8653676}}</ref>。 腫瘍では正常組織と比べてDNMT1や、DNMT3A、DNMT3Bの発現レベルが高く、これらは癌の5mCの異常なレベルに関連している<ref name=":12">{{Cite journal|last=Robertson|first=K D|last2=Uzvolgyi|first2=E|last3=Liang|first3=G|last4=Talmadge|first4=C|last5=Sumegi|first5=J|last6=Gonzales|first6=F A|last7=Jones|first7=P A|date=1999-06-01|title=The human DNA methyltransferases (DNMTs) 1, 3a and 3b: coordinate mRNA expression in normal tissues and overexpression in tumors.|journal=Nucleic Acids Research|volume=27|issue=11|pages=2291–2298|DOI=10.1093/nar/27.11.2291|ISSN=0305-1048|PMID=10325416|PMC=148793}}</ref>。 サテライトDNA、Alu配列、および長い散在要素(LINE)を含むゲノムの反復配列は、癌細胞において低メチル化されていることが多く、通常は発現しないはずの遺伝子の発現をもたらすため、その発現レベルは多くの場合で腫瘍進行の重要なマーカーになっている<ref name=":22" />。高メチル化と低メチル化の間には、関連があると推測されている。異常な''de novo'' 5mCメチル化を生成するDNAメチルトランスフェラーゼの過剰活性は、エピジェネティックな修復の一種であるメチル化の除去によって補償される可能性がある。 しかし、メチル化の除去は非効率的であり、ゲノム全体の低メチル化のオーバーシュートをもたらしうるし、またその逆もありえるす。低メチル化領域における遺伝子の過剰発現は、ゲノム全体の高メチル化により抑制される可能性もある<ref name=":22" />。がんの顕著な特徴は、がん細胞とその周囲の微小環境内(腫瘍関連間質)の両方で5mCを変化させる後成的変化を通じて獲得される可能性が高い。 <ref>{{Cite journal|last=Hanahan|first=Douglas|last2=Weinberg|first2=Robert A.|date=2011-03-04|title=Hallmarks of Cancer: The Next Generation|url=https://www.cell.com/cell/abstract/S0092-8674(11)00127-9|journal=Cell|volume=144|issue=5|pages=646–674|language=English|DOI=10.1016/j.cell.2011.02.013|ISSN=0092-8674|PMID=21376230}}</ref> |
|||
== 老化のバイオマーカーとして == |
|||
「Epigenetic age」とは、年齢とゲノムのDNAメチル化レベルとの関係を指す <ref>{{Cite journal|last=Horvath|first=Steve|last2=Raj|first2=Kenneth|date=June 2018|title=DNA methylation-based biomarkers and the epigenetic clock theory of ageing|journal=Nature Reviews Genetics|volume=19|issue=6|pages=371–384|language=en|DOI=10.1038/s41576-018-0004-3|ISSN=1471-0064|PMID=29643443}}</ref>。 「clock CpG」と呼ばれるCpGの特定のセットのDNAメチル化のレベルと、特定の年代で集団的ゲノム全体のメチル化の典型的なレベルを回帰するアルゴリズムを組み合わせることで、後成的年齢予測が可能になる。 若者(0〜20歳)の場合、DNAメチル化の変化は、発達と成長が進むにつれてより速い速度で発生し、高齢になると変化が遅くなり始める。 エピジェネティックな年齢推定値は複数存在する。 Horvathの時計は、353個のCpGのマルチ組織セットを測定します。半分は年齢と正の相関があり、残りの半分はエピジェネティックな年齢を推定するために負の相関がある<ref>{{Cite journal|last=Horvath|first=Steve|date=2013-12-10|title=DNA methylation age of human tissues and cell types|journal=Genome Biology|volume=14|issue=10|pages=3156|DOI=10.1186/gb-2013-14-10-r115|ISSN=1474-760X|PMID=24138928|PMC=4015143}}</ref>。Hannumの時計は、成人の血液サンプルを使用して、71 CpGの直交ベースに基づいて年齢を計算する<ref>{{Cite journal|last=Hannum|first=Gregory|last2=Guinney|first2=Justin|last3=Zhao|first3=Ling|last4=Zhang|first4=Li|last5=Hughes|first5=Guy|last6=Sadda|first6=SriniVas|last7=Klotzle|first7=Brandy|last8=Bibikova|first8=Marina|last9=Fan|first9=Jian-Bing|date=2013-01-24|title=Genome-wide Methylation Profiles Reveal Quantitative Views of Human Aging Rates|journal=Molecular Cell|volume=49|issue=2|pages=359–367|DOI=10.1016/j.molcel.2012.10.016|ISSN=1097-2765|PMID=23177740|PMC=3780611}}</ref>。DNAm PhenoAgeとして知られるLevineの時計は、513 CpGに依存しており、死亡率と寿命を予測する際に他の年齢推定値を上回っていますが、非血液組織にはバイアスを示す<ref>{{Cite journal|last=Levine|first=Morgan E.|last2=Lu|first2=Ake T.|last3=Quach|first3=Austin|last4=Chen|first4=Brian H.|last5=Assimes|first5=Themistocles L.|last6=Bandinelli|first6=Stefania|last7=Hou|first7=Lifang|last8=Baccarelli|first8=Andrea A.|last9=Stewart|first9=James D.|date=2018-04-17|title=An epigenetic biomarker of aging for lifespan and healthspan|journal=Aging (Albany NY)|volume=10|issue=4|pages=573–591|DOI=10.18632/aging.101414|ISSN=1945-4589|PMID=29676998|PMC=5940111}}</ref>。遺伝子ELOVL2の1つのCpGのみのメチル化状態を持つ年齢推定器の報告がある<ref>{{Cite journal|last=Garagnani|first=Paolo|last2=Bacalini|first2=Maria G.|last3=Pirazzini|first3=Chiara|last4=Gori|first4=Davide|last5=Giuliani|first5=Cristina|last6=Mari|first6=Daniela|last7=Blasio|first7=Anna M. Di|last8=Gentilini|first8=Davide|last9=Vitale|first9=Giovanni|date=2012|title=Methylation of ELOVL2 gene as a new epigenetic marker of age|journal=Aging Cell|volume=11|issue=6|pages=1132–1134|language=en|DOI=10.1111/acel.12005|ISSN=1474-9726|PMID=23061750}}</ref>。年齢の推定により、5mCのメチル化マーカーに基づいて個人が影響を受ける可能性のある年齢に関連した状態の予想から寿命を予測できる。 |
|||
==出典== |
==出典== |
||
2020年3月17日 (火) 10:14時点における版
| 5-メチルシトシン | |
|---|---|

| |
4-amino-5-methyl-3H-pyrimidin-2-one | |
| 識別情報 | |
| CAS登録番号 | 554-01-8 |
| PubChem | 65040 |
| ChemSpider | 58551 |
| UNII | 6R795CQT4H |
| KEGG | C02376 |
| MeSH | 5-Methylcytosine |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | C5H7N3O |
| モル質量 | 125.13 g mol−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
5-メチルシトシン(5mC、m5Cなどと略されることが多い)はDNA塩基の一つであるシトシン(C)がメチル化されたもので、遺伝子転写の調整に関与している[1]。シトシンがメチル化されると、転写過程に変化はないが遺伝子発現に変化が生ずる。この分野の研究はエピジェネティクスと呼ばれる。5mCはDNAメチルトランスフェラーゼによるエピジェネティックな修飾により生成される。5mCとヌクレオシドが組み合わさった状態は5-メチルシチジンであり、この状態でDNAに組み込まれている。
5mCではメチル基は六員環の、図の6時方向の窒素原子(NH)から反時計回りに数えて5位の炭素原子に付加される。このメチル基は、シトシンと5mCとを区別する特徴である。
発見の経緯
1898年、結核菌から細菌性毒素を単離しようとしていた時、新たな核酸が発見され、ツベルクリン酸と命名された[2]。この核酸は、チミン、グアニン、シトシンとは異なる、メチル化された塩基を持つヌクレオチドであった。1925年、少量のメチル化シトシンがツベルクリン酸の硫酸加水分解物として生成された[3][4]。この報告はピクリン酸結晶の光学特性のみに基づいていた上、他の科学者達に再現できなかったので酷評された[5]。しかし1948年、仔牛胸腺のDNAから従来のシトシンやウラシルとは異なるメチル化シトシンがペーパークロマトグラフィーにより単離され、存在が決定的となった[6]。それから70年後、RNA分子中に一般に存在することが明らかとなったが、正確な役割は不明であった[7]。
In vivo
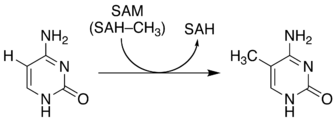
この物質の機能は生物種により大きく異なる[8]。
- 細菌の場合、5mCはゲノム上の様々な場所に存在し、しばしば自身のDNAをメチル化感受性制限酵素から保護するマーカーとして機能している。
- 植物の場合、5mCはCpGサイト、CpHpG、ならびにCpHpHの配列に局在している(H = A, C, T)。
- 真菌および動物の場合、5mCは主にCpGジヌクレオチドとして存在する。多くの真核生物ではCpGサイトのメチル化率はわずかであるが、脊椎動物の場合は70〜80%のCpG中シトシンがメチル化されている[9]。哺乳類に置いては、ゲノム中の約1%の塩基が5mCである[10]。
シトシンが自発性に脱アミノ化するとウラシルとなり、DNA修復酵素により除去されるが、一方で5mCが脱アミノ化するとチミン(T)を生じる。この塩基の転換(C→T)は塩基転位型突然変異を引き起こし得る[11]。加えて、APOBECファミリーの酵素によって引き起こされるシトシン及び5mCの脱アミノ化は、細胞内のプロセスや生物種の進化に関与している可能性がある[12]。一方で、5-ヒドロキシメチルシトシンの 脱アミノ化の意義や詳細は不明である。
In vitro
亜硝酸等により5-メチルシトシンから-NH2基を除去(脱アミノ化)するとチミンを生ずる。同じ条件下でシトシンが脱アミノ化するとウラシルを生じる。

シトシンは重亜硫酸処理で脱アミノ化されるが、5mCは脱アミノ化されない。この性質を利用して、重亜硫酸塩シークエンス技術によりゲノム中のシトシンのメチル化パターンを解析することができる[13]。
DNMTによるメチル化と発現制御
5mCマークは、 DNAメチルトランスフェラーゼ (DNMT)を介してゲノムDNAに付加される。ヒトゲノム中では、DNMT1、DNMT2、DNMT3A、DNMT3B、およびDNMT3Lの5つのDNMTが知られている。藻類および菌類には、DNMT4、DNMT5、およびDNMT6の3つがさらに存在する[14]。
DNMT1には、複製焦点ターゲティングシーケンス(RFTS)と、5mCマークの追加を触媒するCXXCドメインが含まれている。 RFTSはDNMT1をDNA複製の遺伝子座に導き、DNA複製中の娘鎖上の5mCの維持を支援しますが、CXXCはDNAへのメチル化のde novo付加のためのジンクフィンガードメインを含む [15]。DNMT1は、多くのヒトの体組織において、支配的なDNAメチルトランスフェラーゼであること知られている[16]。 DNMT3AとDNMT3Bは主にde novoメチル化を担当し、DNMT1は複製後に5mCマークを維持する役割を持つ[17]。DNMTは互いに相互作用して、メチル化能力を高めている。たとえば、2つのDNMT3Lは2つのDNMT3Aと複合体を形成してDNAとの相互作用を改善し、メチル化を促進する [18]。DNMTの発現の変化は、異常なメチル化をもたらす。過剰発現することでメチル化の増加をもたらし、逆に酵素を破壊するとメチル化のレベルは低下する[16]。

付加のメカニズムは次のとおりである [19] 。
- DNMTのPCQモチーフのシステイン残基が、メチル化されるシトシンヌクレオチドの炭素6に求核攻撃を引き起こす。
- S-アデノシルメチオニンは、メチル基を炭素5に供与する。
- DNMT酵素の塩基は、炭素5の残留水素を脱プロトン化して、環の炭素5と6の間の二重結合を復元し、5-メチルシトシン塩基対を生成する。
脱メチル化
シトシンが5mCにメチル化された後、複数のメカニズムを介して元の状態に戻すことができる。
受動的なDNA脱メチル化としては、DNMTによるメンテナンスの欠如により、複製を通じて徐々にメチル化シトシンが希釈化される、というものがある。能動的なDNA脱メチル化としては、酸化プロセスにより5-ヒドロキシメチルシトシン (5hmC)、5-ホルミルシトシン(5fC)、および5-カルボキシルシトシン(5caC)に変換され、後者2つは最終的にチミンDNAグリコシラーゼ (TDG)及びシトシンを復元するための塩基除去修復酵素(BER)によってヌクレオシドから切断される[20]。 TDGをノックアウトした実験では、5hmCにはに統計的に有意な変化を与えず、一方で5fCは2倍の増加をもたらした[21]。 5mC、5hmC、および5fCへの酸化反応はTET (Ten-eleven translocation)ファミリージオキシゲナーゼを介して発生する。 この酵素は5mCを優先的に処理し、TET2では5hmCおよび5fC変換の初期反応速度は4.9〜7.6倍遅くなります[22]。TETには補因子としてFe(II)、基質として酸素およびα-ケトグルタル酸 (α-KG)が必要であり、後者の基質はイソクエン酸デヒドロゲナーゼ (IDH)によってイソクエン酸から生成される[23]。 悪性腫瘍(がん)においては、α-KGと競合する2-ヒドロキシグルタレート (2HG)を生成してTET活性を低下させることで、5mCから5hmCへの変換を低下させている可能性が報告されている[24]。
ヒトにおける5mCの役割
癌細胞においては、ゲノムDNAは過剰メチル化や低メチル化と呼ばれる状態になることがある[25]。過剰メチル化の例としては、遺伝子プロモーターと重複するCpGアイランドがde novoメチル化されることで、通常腫瘍の増殖阻害に関連する遺伝子の異常な不活性化を引き起こすものがある[26]。 腫瘍では正常組織と比べてDNMT1や、DNMT3A、DNMT3Bの発現レベルが高く、これらは癌の5mCの異常なレベルに関連している[27]。 サテライトDNA、Alu配列、および長い散在要素(LINE)を含むゲノムの反復配列は、癌細胞において低メチル化されていることが多く、通常は発現しないはずの遺伝子の発現をもたらすため、その発現レベルは多くの場合で腫瘍進行の重要なマーカーになっている[25]。高メチル化と低メチル化の間には、関連があると推測されている。異常なde novo 5mCメチル化を生成するDNAメチルトランスフェラーゼの過剰活性は、エピジェネティックな修復の一種であるメチル化の除去によって補償される可能性がある。 しかし、メチル化の除去は非効率的であり、ゲノム全体の低メチル化のオーバーシュートをもたらしうるし、またその逆もありえるす。低メチル化領域における遺伝子の過剰発現は、ゲノム全体の高メチル化により抑制される可能性もある[25]。がんの顕著な特徴は、がん細胞とその周囲の微小環境内(腫瘍関連間質)の両方で5mCを変化させる後成的変化を通じて獲得される可能性が高い。 [28]
老化のバイオマーカーとして
「Epigenetic age」とは、年齢とゲノムのDNAメチル化レベルとの関係を指す [29]。 「clock CpG」と呼ばれるCpGの特定のセットのDNAメチル化のレベルと、特定の年代で集団的ゲノム全体のメチル化の典型的なレベルを回帰するアルゴリズムを組み合わせることで、後成的年齢予測が可能になる。 若者(0〜20歳)の場合、DNAメチル化の変化は、発達と成長が進むにつれてより速い速度で発生し、高齢になると変化が遅くなり始める。 エピジェネティックな年齢推定値は複数存在する。 Horvathの時計は、353個のCpGのマルチ組織セットを測定します。半分は年齢と正の相関があり、残りの半分はエピジェネティックな年齢を推定するために負の相関がある[30]。Hannumの時計は、成人の血液サンプルを使用して、71 CpGの直交ベースに基づいて年齢を計算する[31]。DNAm PhenoAgeとして知られるLevineの時計は、513 CpGに依存しており、死亡率と寿命を予測する際に他の年齢推定値を上回っていますが、非血液組織にはバイアスを示す[32]。遺伝子ELOVL2の1つのCpGのみのメチル化状態を持つ年齢推定器の報告がある[33]。年齢の推定により、5mCのメチル化マーカーに基づいて個人が影響を受ける可能性のある年齢に関連した状態の予想から寿命を予測できる。
出典
- ^ Wu, Xiaoji; Zhang, Yi (09 2017). “TET-mediated active DNA demethylation: mechanism, function and beyond”. Nature Reviews. Genetics 18 (9): 517–534. doi:10.1038/nrg.2017.33. ISSN 1471-0064. PMID 28555658.
- ^ Matthews AP (2012). Physiological Chemistry. Williams & Wilkins Company/RareBooksClub.com. pp. 167. ISBN 1130145379
- ^ Johnson TB, Coghill RD (1925). “The discovery of 5-methyl-cytosine in tuberculinic acid, the nucleic acid of the Tubercle bacillus”. J Am Chem Soc 47 (11): 2838–2844. doi:10.1021/ja01688a030.
- ^ Grosjean H (2009). Nucleic Acids Are Not Boring Long Polymers of Only Four Types of Nucleotides: A Guided Tour. Landes Bioscience.
- ^ Vischer E, Zamenhof S, Chargaff E (1949). “Microbial nucleic acids: the desoxypentose nucleic acids of avian tubercle bacilli and yeast”. J Biol Chem 77 (1): 429–438. PMID 18107446.
- ^ Hotchkiss RD (1948). “The quantitative separation of purines, pyrimidines and nucleosides by paper chromatography”. J Biol Chem 175 (1): 315–332. PMID 18107446.
- ^ Squires JE, Patel HR, Nousch M, Sibbritt T, Humphreys DT, Parker BJ, Suter CM, Preiss T. (2012). “Widespread occurrence of 5-methylcytosine in human coding and non-coding RNA”. Nucleic Acids Res 40 (11): 5023–5033. doi:10.1093/nar/gks144. PMID 22344696.
- ^ Colot V, Rossignol JL (1999). “Eukaryotic DNA methylation as an evolutionary device”. Bioessays 21 (5): 402–411. doi:10.1002/(SICI)1521-1878(199905)21:5<402::AID-BIES7>3.0.CO;2-B. PMID 10376011.
- ^ Bird, A. P. (1986 May 15-21). “CpG-rich islands and the function of DNA methylation”. Nature 321 (6067): 209–213. doi:10.1038/321209a0. ISSN 0028-0836. PMID 2423876.
- ^ Ehrlich, M.; Wang, R. Y. (1981-06-19). “5-Methylcytosine in eukaryotic DNA”. Science (New York, N.Y.) 212 (4501): 1350–1357. doi:10.1126/science.6262918. ISSN 0036-8075. PMID 6262918.
- ^ Sassa, A; Kanemaru, Y; Kamoshita, N; Honma, M; Yasui, M (2016-09-01). “Mutagenic consequences of cytosine alterations site-specifically embedded in the human genome” (英語). Genes and Environment 38 (1). doi:10.1186/s41021-016-0045-9. ISSN 1880-7062. PMC PMC5007816. PMID 27588157.
- ^ Chahwan R., Wontakal S.N., and Roa S. (2010). “Crosstalk between genetic and epigenetic information through cytosine deamination”. Trends in Genetics 26 (10): 443–448. doi:10.1016/j.tig.2010.07.005. PMID 20800313.
- ^ Clark SJ, Harrison J, Paul CL, Frommer M (1994). “High sensitivity mapping of methylated cytosines”. Nucleic Acids Res. 22 (15): 2990–2997. doi:10.1093/nar/22.15.2990. PMC 310266. PMID 8065911.
- ^ Ponger, Loïc; Li, Wen-Hsiung (2005-04-01). “Evolutionary Diversification of DNA Methyltransferases in Eukaryotic Genomes” (英語). Molecular Biology and Evolution 22 (4): 1119–1128. doi:10.1093/molbev/msi098. ISSN 0737-4038. PMID 15689527.
- ^ Lyko, Frank (February 2018). “The DNA methyltransferase family: a versatile toolkit for epigenetic regulation” (英語). Nature Reviews Genetics 19 (2): 81–92. doi:10.1038/nrg.2017.80. ISSN 1471-0064. PMID 29033456.
- ^ a b Robertson, K D; Uzvolgyi, E; Liang, G; Talmadge, C; Sumegi, J; Gonzales, F A; Jones, P A (1999-06-01). “The human DNA methyltransferases (DNMTs) 1, 3a and 3b: coordinate mRNA expression in normal tissues and overexpression in tumors.”. Nucleic Acids Research 27 (11): 2291–2298. doi:10.1093/nar/27.11.2291. ISSN 0305-1048. PMC 148793. PMID 10325416.
- ^ Wu, Xiaoji; Zhang, Yi (2017-05-30). “TET-mediated active DNA demethylation: mechanism, function and beyond”. Nature Reviews Genetics 18 (9): 517–534. doi:10.1038/nrg.2017.33. ISSN 1471-0056. PMID 28555658.
- ^ Jia, Da; Jurkowska, Renata Z.; Zhang, Xing; Jeltsch, Albert; Cheng, Xiaodong (September 2007). “Structure of Dnmt3a bound to Dnmt3L suggests a model for de novo DNA methylation” (英語). Nature 449 (7159): 248–251. Bibcode: 2007Natur.449..248J. doi:10.1038/nature06146. ISSN 1476-4687. PMC 2712830. PMID 17713477.
- ^ Lyko, Frank (February 2018). “The DNA methyltransferase family: a versatile toolkit for epigenetic regulation” (英語). Nature Reviews Genetics 19 (2): 81–92. doi:10.1038/nrg.2017.80. ISSN 1471-0064. PMID 29033456.
- ^ Wu, Xiaoji; Zhang, Yi (2017-05-30). “TET-mediated active DNA demethylation: mechanism, function and beyond”. Nature Reviews Genetics 18 (9): 517–534. doi:10.1038/nrg.2017.33. ISSN 1471-0056. PMID 28555658.
- ^ Song, Chun-Xiao; Szulwach, Keith E.; Dai, Qing; Fu, Ye; Mao, Shi-Qing; Lin, Li; Street, Craig; Li, Yujing et al. (2013-04-25). “Genome-wide profiling of 5-formylcytosine reveals its roles in epigenetic priming”. Cell 153 (3): 678–691. doi:10.1016/j.cell.2013.04.001. ISSN 1097-4172. PMC 3657391. PMID 23602153.
- ^ Ito, Shinsuke; Shen, Li; Dai, Qing; Wu, Susan C.; Collins, Leonard B.; Swenberg, James A.; He, Chuan; Zhang, Yi (2011-09-02). “Tet Proteins Can Convert 5-Methylcytosine to 5-Formylcytosine and 5-Carboxylcytosine” (英語). Science 333 (6047): 1300–1303. Bibcode: 2011Sci...333.1300I. doi:10.1126/science.1210597. ISSN 0036-8075. PMC 3495246. PMID 21778364.
- ^ Lu, Xingyu; Zhao, Boxuan Simen; He, Chuan (2015-02-12). “TET Family Proteins: Oxidation Activity, Interacting Molecules, and Functions in Diseases”. Chemical Reviews 115 (6): 2225–2239. doi:10.1021/cr500470n. ISSN 0009-2665. PMC 4784441. PMID 25675246.
- ^ Xu, Wei; Yang, Hui; Liu, Ying; Yang, Ying; Wang, Ping; Kim, Se-Hee; Ito, Shinsuke; Yang, Chen et al. (2011-01-18). “Oncometabolite 2-Hydroxyglutarate Is a Competitive Inhibitor of α-Ketoglutarate-Dependent Dioxygenases”. Cancer Cell 19 (1): 17–30. doi:10.1016/j.ccr.2010.12.014. ISSN 1535-6108. PMC 3229304. PMID 21251613.
- ^ a b c Ehrlich, Melanie (2009-12-01). “DNA hypomethylation in cancer cells”. Epigenomics 1 (2): 239–259. doi:10.2217/epi.09.33. ISSN 1750-1911. PMC 2873040. PMID 20495664.
- ^ Jones, Peter A. (1996-06-01). “DNA Methylation Errors and Cancer” (英語). Cancer Research 56 (11): 2463–2467. ISSN 0008-5472. PMID 8653676.
- ^ Robertson, K D; Uzvolgyi, E; Liang, G; Talmadge, C; Sumegi, J; Gonzales, F A; Jones, P A (1999-06-01). “The human DNA methyltransferases (DNMTs) 1, 3a and 3b: coordinate mRNA expression in normal tissues and overexpression in tumors.”. Nucleic Acids Research 27 (11): 2291–2298. doi:10.1093/nar/27.11.2291. ISSN 0305-1048. PMC 148793. PMID 10325416.
- ^ Hanahan, Douglas; Weinberg, Robert A. (2011-03-04). “Hallmarks of Cancer: The Next Generation” (English). Cell 144 (5): 646–674. doi:10.1016/j.cell.2011.02.013. ISSN 0092-8674. PMID 21376230.
- ^ Horvath, Steve; Raj, Kenneth (June 2018). “DNA methylation-based biomarkers and the epigenetic clock theory of ageing” (英語). Nature Reviews Genetics 19 (6): 371–384. doi:10.1038/s41576-018-0004-3. ISSN 1471-0064. PMID 29643443.
- ^ Horvath, Steve (2013-12-10). “DNA methylation age of human tissues and cell types”. Genome Biology 14 (10): 3156. doi:10.1186/gb-2013-14-10-r115. ISSN 1474-760X. PMC 4015143. PMID 24138928.
- ^ Hannum, Gregory; Guinney, Justin; Zhao, Ling; Zhang, Li; Hughes, Guy; Sadda, SriniVas; Klotzle, Brandy; Bibikova, Marina et al. (2013-01-24). “Genome-wide Methylation Profiles Reveal Quantitative Views of Human Aging Rates”. Molecular Cell 49 (2): 359–367. doi:10.1016/j.molcel.2012.10.016. ISSN 1097-2765. PMC 3780611. PMID 23177740.
- ^ Levine, Morgan E.; Lu, Ake T.; Quach, Austin; Chen, Brian H.; Assimes, Themistocles L.; Bandinelli, Stefania; Hou, Lifang; Baccarelli, Andrea A. et al. (2018-04-17). “An epigenetic biomarker of aging for lifespan and healthspan”. Aging (Albany NY) 10 (4): 573–591. doi:10.18632/aging.101414. ISSN 1945-4589. PMC 5940111. PMID 29676998.
- ^ Garagnani, Paolo; Bacalini, Maria G.; Pirazzini, Chiara; Gori, Davide; Giuliani, Cristina; Mari, Daniela; Blasio, Anna M. Di; Gentilini, Davide et al. (2012). “Methylation of ELOVL2 gene as a new epigenetic marker of age” (英語). Aging Cell 11 (6): 1132–1134. doi:10.1111/acel.12005. ISSN 1474-9726. PMID 23061750.
参考文献
- Griffiths, Anthony J. F. (1999). An Introduction to genetic analysis. San Francisco: W.H. Freeman. Chapter 15: Gene Mutation. ISBN 0-7167-3520-2 (available online at the United States National Center for Biotechnology Information)
