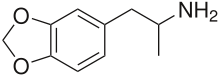
3,4-メチレンジオキシアンフェタミン
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 法的規制 |
|
| 投与経路 | 経口、舌下、噴霧、静脈 |
| 薬物動態データ | |
| 代謝 | 肝臓 (CYP) |
| 排泄 | 腎臓 |
| 識別 | |
| CAS番号 |
4764-17-4 |
| ATCコード | None |
| PubChem | CID: 1614 |
| DrugBank |
DB01509 |
| ChemSpider |
1555 |
| UNII |
XJZ28FJ27W |
| KEGG |
D12715 |
| ChEMBL |
CHEMBL6731 |
| 化学的データ | |
| 化学式 | C10H13NO2 |
| 分子量 | 179.22 g/mol |
| |
3,4-メチレンジオキシアンフェタミン(3,4-Methylenedioxyamphetamine, MDA)は、アンフェタミン系のエンパーソゲン(共感薬)、精神刺激薬、幻覚剤の一種で、主にレクリエーショナルドラッグとして用いられる。薬理学的には、MDAは、セロトニン・ノルアドレナリン・ドーパミン放出薬(SNDRA)として働く。ほとんどの国で規制薬物であり所持や販売は違法である。
MDAは、ほかのアンフェタミン系の薬物と比べ、レクリエーショナルドラッグとしてはあまり人気がない。しかしメチレンジオキシメタンフェタミン (MDMA) の肝臓でのN-脱アルキル化生成物[1]、一次代謝物であるため広く用いられている[2]。また違法に製造されたMDMAに混入していることもよくある[3][4]。
利用[編集]
医療[編集]
MDAには承認された医療用途はない。
娯楽[編集]
違法ではあるが、MDAは気分や共感性を高めるため、娯楽的にラブドラッグとして用いられている[5]。レクリエーショナルドラッグとしての用量は、100–160 mgと言われている[6]。
副作用[編集]
MDAは、セロトニン作動性神経毒作用を持ち[7][8]、MDAの代謝で活性化されると考えられている[1]。さらに、MDAはグリア細胞の応答を活性化するが、使用後には収まる[7]。
過剰摂取[編集]
急性毒性の症状には、興奮、発汗、血圧や心拍の上昇、体温の急激な上昇、痙攣があり、死に至ることもある。死に至る場合は、通常は心毒性とそれに続く脳内出血(脳卒中)の結果である[9]。
薬理学[編集]
薬力学[編集]
MDAは、セロトニン、ノルアドレナリン、ドーパミンの輸送体、小胞モノアミン輸送体の基質となり、TAAR1のアゴニストである[10]。これらの理由により、セロトニン、ノルアドレナリン、ドーパミンの再取り込み阻害剤、放出剤として作用する(つまりSNDRAである[11])。また、5-HT2A[12]、5-HT2B[13]及び5-HT2C[14]セロトニン受容体のアゴニストとして作用し、α2A-、α2B-及びα2C-アドレナリン受容体、5-HT1A、5-HT7セロトニン受容体との親和性を示す[15]。
MDAの(S)-光学異性体は、(R)-光学異性体よりも精神刺激薬としての作用が強く、3つのモノアミン輸送体により高い親和性を持つ。
MDAの主観的、行動的な影響については、エンパーソゲン作用にはセロトニン放出、精神刺激作用にはドーパミン及びノルアドレナリン放出、多幸感(報酬系と嗜癖)にはドーパミン放出、幻覚作用には5-HT2A受容体のアゴニスト作用が直接影響していると考えられている[要出典医学]。
薬物動態学[編集]
薬物の作用時間は、約6–8時間と報告されている[6]。
化学[編集]
MDAは、置換メチレンジオキシ基を持つフェネチルアミン、またアンフェタミン誘導体である。他のフェネチルアミンやアンフェタミンとの関連では、β-フェネチルアミンの3,4-メチレンジオキシ, α-メチル誘導体、アンフェタミンの3,4-メチレンジオキシ誘導体、MDMAのN-デメチル誘導体である。
シノニム[編集]
3,4-メチレンジオキシアンフェタミンという名前に加え、以下のようなシノニムがある。
- α-メチル-3,4-メチレンジオキシ-β-フェニルエチルアミン
- 1-(3,4-メチレンジオキシフェニル)-2-プロパンアミン
- 1-(1,3-ベンゾジオキソール-5-イル)-2-プロパンアミン
合成[編集]
MDAは通常、サフロールやピペロナールのような精油から合成される。これらの前駆体からの一般的な合成経路は、以下のようなものがある。
- サフロールのアルケン基をハロゲン含有鉱酸で還元し、その後アミンアルキル化する[16][17]。
- サフロールをワッカー酸化で3,4-メチレンジオキシフェニルプロパン-2-オン(MDP2P)とし、その後、還元的アミノ化またはオキシムの還元を行う[17][18][19]。
- ピペロナールとニトロエタンでヘンリー反応を起こし、その後ニトロ基の還元を行う[17][20][21][22][23]。
- J. Elksらによってヘリオトロピンのダルツェン縮合も行われている[24]。これによってMDP2Pが生じ、ロイカート反応に供する。
体液からの検出[編集]
MDAは、使用検出のために血漿や尿中濃度の測定、中毒の診断、また交通違反やその他の犯罪、突然死等の法医学的検査が行われる。薬物乱用の検査には、髪の毛、唾液、汗を検体として用いるものがある。市販のアンフェタミンイムノアッセイは、MDAやその他のMDMAの主要代謝物にもかなり反応するが、クロマトグラフィーにより容易に区別でき、個別に測定することができる。MDMAのみを摂取した人の血液や尿中のMDAの濃度は、一般的に、親化合物の10%以下である[25][26][27]。
誘導体[編集]
MDAは、β-アドレナリン受容体のアゴニストであるプロトキロールの核構造の一部から構成されている。
歴史[編集]
MDAは、1910年にカール・マンニッヒとW. Jacobsohnにより初めて合成された[19]。1930年7月にゴードン・アレスが初めて摂取してその生理的効果を発見し、後にSmith, Kline & Frenchにライセンスした[28]。1939年に動物実験が初めて行われ、1941年から、パーキンソン病の治療を目的とした治験が始まった。1949年から1957年まで、Smith, Kline & Frenchにより、抗うつ薬及び食欲抑制薬の研究のために500人以上にMDAが投与された。アメリカ合衆国陸軍は、自白薬や無力化ガスの開発中、EA-1298というコードネームでこの薬品の実験も行った。1953年1月、テニス選手のハロルド・ブラウアー[29]は、MKウルトラ計画の一環で、知識も同意もないまま450 mgのMDAを静脈注射された後、死亡した。1958年にH. D. Brownが鎮咳去痰薬として、1960年にSmith, Kline & Frenchが精神安定剤として、1961年に"Amphedoxamine"の商標名で食欲抑制薬として、特許が取得された。1963–1964年頃には、レクリエーショナルドラッグとして用いられ始めた。当時は実験用薬品として安価で容易に入手可能で、クラウディオ・ナランホやリチャード・イェンセン等の研究者は、心理療法の分野でMDAを研究した[30][31]。
社会と文化[編集]

名前[編集]
医薬品として開発されていた時には、テナンフェタミン(tenamfetamine)という国際一般名が与えられていた。
法規制[編集]
オーストラリア[編集]
オーストラリアでは、医薬品 ・毒物の統一管理基準のスケジュール9の禁止物質とされている[32]。スケジュール9の物質は「乱用の可能性のある物質。医療、科学研究、分析、教育、訓練等のため、コモンウェルスまたは州等の当局の承認を受けた場合を除き、製造、所持、販売、使用は法律で禁止される」物質である[32]。
アメリカ合衆国[編集]
アメリカ合衆国では、規制物質法のスケジュールIで規制される物質である。
研究[編集]
2010年には、健康なボランティアを用いて、MDAが神秘的な体験を呼び起こし、視覚を変化させる能力が研究された。この研究で、MDAは「神秘的な体験と視覚を研究するための潜在的なツールである」と結論付けられた[6]。
2019年の研究では、二重盲検法を用いてMDAとMDMAを健康な被験者に投与した。共感性や興奮作用を含み、MDMAと多くの共通する特徴があることが判明したが、より長く続き、複雑なイメージ、共感覚、霊的な体験などサイケデリック効果がより強かった。[33]
出典[編集]
- ^ a b de la Torre, R; Farre, M; Roset, Pn; Pizzaro, N; Abanades, S; Segura, M; Segura, M; Cami, J (2004). “Human pharmacology of MDMA: pharmacokinetics, metabolism, and disposition.”. Therapeutic Drug Monitoring 26 (2): 137-144. doi:10.1097/00007691-200404000-00009. PMID 15228154.
- ^ Crean, R. D.; Davis, S. A.; Von Huben, S. N.; Lay, C. C.; Katner, S. N.; Taffe, M. A. (2006-10-13). “Effects of (±)3,4-methylenedioxymethamphetamine, (±)3,4-methylenedioxyamphetamine and methamphetamine on temperature and activity in rhesus macaques”. Neuroscience 142 (2): 515-525. doi:10.1016/j.neuroscience.2006.06.033. PMC 1853374. PMID 16876329.
- ^ EcstasyData.org. “EcstasyData.org: Test Result Statistics: Substances by Year”. www.ecstasydata.org. 2017年6月27日閲覧。
- ^ “Trans European Drug Information” (英語). idpc.net. 2017年6月27日閲覧。
- ^ “Synthesis and pharmacological examination of benzofuran, indan, and tetralin analogues of 3,4-(methylenedioxy)amphetamine”. Journal of Medicinal Chemistry 36 (23): 3700-3706. (1993). doi:10.1021/jm00075a027. PMID 8246240.
- ^ a b c Baggott, MJ; Siegrist, JD; Galloway, GP; Robertson, LC; Coyle, JR; Mendelson, JE (2010). “Investigating the Mechanisms of Hallucinogen-Induced Visions Using 3,4-Methylenedioxeamphetamine (MDA): A Randomized Controlled Trial in Humans”. PLOS ONE 5 (12): e14074. doi:10.1371/journal.pone.0014074. PMC 2996283. PMID 21152030.
- ^ a b Herndon, Joseph M.; Cholanians, Aram B.; Lau, Serrine S.; Monks, Terrence J. (March 2014). “Glial Cell Response to 3,4-(±)-Methylenedioxymethamphetamine and Its Metabolites”. Toxicological Sciences 138 (1): 130-138. doi:10.1093/toxsci/kft275. ISSN 1096-6080. PMC 3930364. PMID 24299738.
- ^ Kalant, Harold (2001-10-02). “The pharmacology and toxicology of "ecstasy" (MDMA) and related drugs”. CMAJ: Canadian Medical Association Journal 165 (7): 917-928. ISSN 0820-3946. PMC 81503. PMID 11599334.
- ^ Diaz, Jaime. How Drugs Influence Behavior. Englewood Cliffs: Prentice Hall, 1996.
- ^ “Trace amine-associated receptor 1 is a stereoselective binding site for compounds in the amphetamine class”. Bioorg. Med. Chem. 19 (23): 7044-8. (December 2011). doi:10.1016/j.bmc.2011.10.007. PMC 3236098. PMID 22037049.
- ^ “Therapeutic potential of monoamine transporter substrates”. Curr Top Med Chem 6 (17): 1845-59. (2006). doi:10.2174/156802606778249766. PMID 17017961.
- ^ Giuseppe Di Giovanni; Vincenzo Di Matteo; Ennio Esposito (2008). Serotonin-dopamine Interaction: Experimental Evidence and Therapeutic Relevance. Elsevier. pp. 294-. ISBN 978-0-444-53235-0
- ^ Rothman, Richard B; Baumann, Michael H (2009). “Serotonergic drugs and valvular heart disease”. Expert Opinion on Drug Safety 8 (3): 317-329. doi:10.1517/14740330902931524. ISSN 1474-0338. PMC 2695569. PMID 19505264.
- ^ “Effect of the R(-) and S(+) isomers of MDA and MDMA on phosphatidyl inositol turnover in cultured cells expressing 5-HT2A or 5-HT2C receptors”. Neurosci. Lett. 177 (1-2): 111-5. (1994). doi:10.1016/0304-3940(94)90057-4. PMID 7824160.
- ^ Manzoni, Olivier Jacques; Ray, Thomas S. (2010). “Psychedelics and the Human Receptorome”. PLoS ONE 5 (2): e9019. doi:10.1371/journal.pone.0009019. ISSN 1932-6203. PMC 2814854. PMID 20126400.
- ^ Muszynski, I.E. (1961). “Production of some amphetamine derivatives”. Acta Poloniae Pharmaceutica 18: 471-478. PMID 14477621.
- ^ a b c Shulgin, Alexander; Manning, Tania; Daley, Paul (2011). The Shulgin Index, Volume One: Psychedelic Phenethylamines and Related Compounds (1st ed.). Berkeley, CA: Transform Press. p. 165. ISBN 9780963009630
- ^ Noggle, FT Jr; DeRuiter, J.; Long, MJ. (1986). “Spectrophotometric and liquid chromatographic identification of 3,4-methylenedioxyphenylisopropylamine and its N-methyl and N-ethyl homologs”. Journal Association of Official Analytical Chemists 69 (4): 681-686. PMID 2875058.
- ^ a b Mannich, C.; Jacobsohn, W.; Mannich, Hr. C. (1910). “Uber Oxyphenyl-alkylamine und Dioxyphenyl-alkylamine”. Berichte der Deutschen Chemischen Gesellschaft 41 (1): 189-197. doi:10.1002/cber.19100430126.
- ^ Ho, Beng-Thong; McIsaac, William M.; An, Rong; Tansey, L. Wayne; Walker, Kenneth E.; Englert Jr., Leo F.; Noel, Michael B. (1970). “Analogs of a-methylphenethylamine”. Journal of Medicinal Chemistry 13 (1): 26-30. doi:10.1021/jm00295a007. PMID 5412110.
- ^ Butterick, John R.; Unrau, A. M. (1974). “Reduction of β-nitrostyrene with sodium bis-(2-methoxyethoxy)-aluminium dihydride. A convenient route to substituted phenylisopropylamines”. Journal of the Chemical Society, Chemical Communications 8 (8): 307-308. doi:10.1039/C39740000307.
- ^ 大下敏隆、安藤皓章「幻覚作用発現物質であるフェネチルアミン誘導体の合成」『衛生化学』第38巻第6号、日本薬学会、1992年、571-580頁、2014年6月20日閲覧。
- ^ Shulgin, Alexander; Shulgin, Ann (1991). PiHKAL: A Chemical Love Story. Lafayette, CA: Transform Press. ISBN 9780963009609
- ^ Elks, J.; Hey, D. H. (1943). “7. β-3 : 4-Methylenedioxyphenylisopropylamine”. J. Chem. Soc. 0: 15-16. doi:10.1039/JR9430000015. ISSN 0368-1769.
- ^ Kolbrich EA, Goodwin RS, Gorelick DA, Hayes RJ, Stein EA, Huestis MA. Plasma pharmacokinetics of 3,4-methyl
enedioxy methamphetamine after controlled oral administration to young adults. Ther. Drug Monit. 30: 320-332, 2008. - ^ “Disposition of MDMA and metabolites in human sweat following controlled MDMA administration”. Clinical Chemistry 55 (3): 454-62. (2009). doi:10.1373/clinchem.2008.117093. PMC 2669283. PMID 19168553.
- ^ R. Baselt, Disposition of Toxic Drugs and Chemicals in Man, 9th edition, Biomedical Publications, Seal Beach, California, 2011, pp. 1078-1080.
- ^ “The First MDA trip and the measurement of 'mystical experience' after MDA, LSD, and Psilocybin”. Psychedelic research (2008年7月18日). 2012年7月13日時点のオリジナルよりアーカイブ。2020年12月7日閲覧。
- ^ The History Channel documented details of his death here https://www.youtube.com/watch?v=ySw-0uY4CUA See minute 2:38 onward.
- ^ Naranjo, C.; Shulgin, A. T.; Sargent, T. (1967). “Evaluation of 3, 4-methylenedioxeamphetamine (MDA) as an adjunct to psychotherapy”. Pharmacology 17 (4): 359-364. doi:10.1159/000137100.
- ^ Yensen, R.; Di Leo, F. B.; Rhead, J. C.; Richards, W. A.; Soskin, R. A.; Turek, B.; Kurland, A. A. (1976). “MDA-assisted psychotherapy with neurotic outpatients: a pilot study”. The Journal of Nervous and Mental Disease 163 (4): 233-245. doi:10.1097/00005053-197610000-00002. PMID 972325.
- ^ a b Poisons Standard (October 2015) comlaw.gov.au
- ^ “Effects of the Psychedelic Amphetamine MDA (3,4-Methylenedioxyamphetamine) in Healthy Volunteers”. Journal of Psychoactive Drugs 51 (2): 108–117. (2019-03-15). doi:10.1080/02791072.2019.1593560. PMID 30967099.
