「第1族元素」の版間の差分
Luckas-bot (会話 | 投稿記録) m r2.7.1) (ロボットによる 追加: an:Metal alcalín |
水素化物、酸化物ハロゲン化物の節を化合物節の下にまとめ、水酸化物節を加筆、その他多少の加筆 |
||
| (同じ利用者による、間の3版が非表示) | |||
| 45行目: | 45行目: | ||
{| class="wikitable" |
{| class="wikitable" |
||
! !! [[水素]]<br />'''<sub>1</sub>H''' !! [[リチウム]]<br />'''<sub>3</sub>Li''' !! [[ナトリウム]]<br />'''<sub>11</sub>Na''' !! [[カリウム]]<br />'''<sub>19</sub>K''' !! [[ルビジウム]]<br />'''<sub>37</sub>Rb''' !! [[セシウム]]<br />'''<sub>55</sub>Cs''' |
! !! [[水素]]<br />'''<sub>1</sub>H''' !! [[リチウム]]<br />'''<sub>3</sub>Li''' !! [[ナトリウム]]<br />'''<sub>11</sub>Na''' !! [[カリウム]]<br />'''<sub>19</sub>K''' !! [[ルビジウム]]<br />'''<sub>37</sub>Rb''' !! [[セシウム]]<br />'''<sub>55</sub>Cs''' !! [[フランシウム]]<br />'''<sub>87</sub>Fr''' |
||
|- |
|- |
||
|[[電子配置]] || 1s<sup>1</sup> || <nowiki>[He]</nowiki>2s<sup>1</sup> || <nowiki>[Ne]</nowiki>3s<sup>1</sup> || <nowiki>[Ar]</nowiki>4s<sup>1</sup> || <nowiki>[Kr]</nowiki>5s<sup>1</sup> || <nowiki>[Xe]</nowiki>6s<sup>1</sup> |
|[[電子配置]] || 1s<sup>1</sup> || <nowiki>[He]</nowiki>2s<sup>1</sup> || <nowiki>[Ne]</nowiki>3s<sup>1</sup> || <nowiki>[Ar]</nowiki>4s<sup>1</sup> || <nowiki>[Kr]</nowiki>5s<sup>1</sup> || <nowiki>[Xe]</nowiki>6s<sup>1</sup> || <nowiki>[Rn]</nowiki>7s<sup>1</sup> |
||
|- |
|- |
||
|第1イオン化エネルギー<br />(kJ·mol<sup>−1</sup>) || 1312 || 513.3 || 495.8 || 418.8 || 403.0 || 375.7 |
|第1イオン化エネルギー<br />(kJ·mol<sup>−1</sup>) || 1312 || 513.3 || 495.8 || 418.8 || 403.0 || 375.7 || 392.8 |
||
|- |
|- |
||
|電子付加エンタルピー<br />(kJ·mol<sup>−1</sup>) || − || − || − || − || 46.88 || 45.51 |
|電子付加エンタルピー<br />(kJ·mol<sup>−1</sup>) || − || − || − || − || 46.88 || 45.51 || − |
||
|- |
|- |
||
|電子親和力<br />(kJ·mol<sup>−1</sup>) || 72.77 || 59.63 || 52.87 || − || − || − |
|電子親和力<br />(kJ·mol<sup>−1</sup>) || 72.77 || 59.63 || 52.87 || − || − || − || − |
||
|- |
|- |
||
|電気陰性度<br />(Allred−Rochow) || 2.20 || 0.97 || 1.01 || 0.91 || 0.89 || 0.86 |
|電気陰性度<br />(Allred−Rochow) || 2.20 || 0.97 || 1.01 || 0.91 || 0.89 || 0.86 || − |
||
|- |
|- |
||
|イオン半径<br />(pm, M<sup>+</sup>) || −4 (2配位) || 73 (4配位)<br /> 90 (6配位) || 113 (4配位)<br /> 116 (6配位) || 152 (6配位)<br /> 165 (8配位) || 166 (6配位)<br /> 175 (8配位) || 181 (6配位)<br /> 202 (12配位) |
|イオン半径<br />(pm, M<sup>+</sup>) || −4 (2配位) || 73 (4配位)<br /> 90 (6配位) || 113 (4配位)<br /> 116 (6配位) || 152 (6配位)<br /> 165 (8配位) || 166 (6配位)<br /> 175 (8配位) || 181 (6配位)<br /> 202 (12配位) || − |
||
|- |
|- |
||
|共有結合半径<br />(pm) || 37 || 134 || 154 || 196 || 211 || 225 |
|共有結合半径<br />(pm) || 37 || 134 || 154 || 196 || 211 || 225 || 260 |
||
|- |
|- |
||
|van der Waals半径<br />(pm) || 120 || 182 || 227 || 275 || 244 || |
|van der Waals半径<br />(pm) || 120 || 182 || 227 || 275 || 244 || 343 || 348 |
||
|- |
|- |
||
|融点<br />(K) || 14.025 || 453.69 || 370.87 || 336.53 || 312.46 || 301.59 |
|融点<br />(K) || 14.025 || 453.69 || 370.87 || 336.53 || 312.46 || 301.59 || 300 |
||
|- |
|- |
||
|沸点<br />(K) || 20.268 || 1615 || 1156 || 1032 || 961 || 944 |
|沸点<br />(K) || 20.268 || 1615 || 1156 || 1032 || 961 || 944 || 950 |
||
|- |
|- |
||
|還元電位 ''E''<sup>0</sup> (V, M<sup>+</sup>/M) || 0 || −3.040 || −2.713 || −2.929 || −2.924 || −2.923 |
|還元電位 ''E''<sup>0</sup> (V, M<sup>+</sup>/M) || 0 || −3.040 || −2.713 || −2.929 || −2.924 || −2.923 || − |
||
|} |
|} |
||
| 75行目: | 75行目: | ||
==単体金属== |
==単体金属== |
||
[[Image:Alkalimetalle.jpg|thumb|320px|アルカリ金属単体のサンプル]] |
[[Image:Alkalimetalle.jpg|thumb|320px|アルカリ金属単体のサンプル]] |
||
アルカリ金属は、比較的融点も低く、比較的軟らかく軽い[[金属]]である。Li、Na、Kは比重が1以下で水に浮く。いずれも反応性は高く、周期表の周期が大きくなるほど、結晶エネルギー(解離エンタルピー)が低減するため、激しく反応する傾向が見られる。 |
アルカリ金属は、比較的融点も低く、比較的軟らかく軽い[[金属]]である。Li、Na、Kは比重が1以下で水に浮く。いずれも反応性は高く、周期表の周期が大きくなるほど、結晶エネルギー(解離エンタルピー)が低減するため、激しく反応する傾向が見られる。リチウムおよびナトリウムの単体金属を得るためには、これらの[[酸化還元電位]]がいずれも非常に低い(つまり非常に還元されやすい)ことを利用して溶融塩を電気分解することで生産される<ref>[[#千谷1959|千谷 (1959)]] 73-75頁。</ref>。カリウム、ルビジウム、セシウムは低融点かつ気化しやすいため単純な電気分解による生産には適しておらず、カリウムは溶融させた塩化カリウムをナトリウム蒸気と反応させることで作られ、ルビジウムおよびセシウムはそれぞれの水酸化物を金属マグネシウムや金属カルシウムによって還元させることで得られる<ref name=CW252/><ref>[[#千谷1959|千谷 (1959)]] 74、75頁。</ref>。代表的な工業生産法には、溶融した[[塩化ナトリウム]]に[[融点降下]]剤として[[塩化カルシウム]]を加え、それを電気分解することで金属ナトリウムを得る[[ダウンズ法]]がある<ref>{{Citation| last = JAKES CLOYD DOWNS| title = ELECTROLYTIC PROCESS AND CELL, Patent 1501756| accessdate = 2011-6-2| date = 1924-07-15| url = http://www.freepatentsonline.com/1501756.pdf}}</ref>。このアルカリ金属元素の強い還元性は他にも、有機化学の分野における[[バーチ還元]] (Bürch reduction) などに利用される。 |
||
いずれのアルカリ金属元素単体も水、あるいは空気中の酸素と反応する為に、それらを避けるために[[鉱油|ミネラルオイル]]の中に保存される。オイルを拭って放置すると自然発火することもあるので取り扱いは考慮する必要がある([[危険物#第3類|危険物3類]])。 |
いずれのアルカリ金属元素単体も水、あるいは空気中の酸素と反応する為に、それらを避けるために[[鉱油|ミネラルオイル]]の中に保存される。オイルを拭って放置すると自然発火することもあるので取り扱いは考慮する必要がある([[危険物#第3類|危険物3類]])。アルカリ金属の反応性の高さは原子量の大きいものほど高い傾向があるが、窒素との反応に関しては例外的にリチウムのみが直接的な反応によって[[窒化リチウム]] (Li<sub>3</sub>N)を生成する<ref name=CW250/>。 |
||
アルカリ金属元素は、いずれも[[炎色反応]]を示す。 |
アルカリ金属元素は、いずれも[[炎色反応]]を示す<ref>[[#千谷1959|千谷 (1959)]] 82頁。</ref>。 |
||
{| class="wikitable" style="text-align:center;" |
{| class="wikitable" style="text-align:center;" |
||
| 90行目: | 90行目: | ||
[[セシウム]]のみは励起に必要な高温を得るために、酸水素炎で観察する必要がある。 |
[[セシウム]]のみは励起に必要な高温を得るために、酸水素炎で観察する必要がある。 |
||
アルカリ金属の中でも[[リチウム]]は特異的である。たとえばリチウムのみが熱時に単体窒素 N<sub>2</sub> と直接反応して、リチウム窒化物を生成する。 |
|||
また、[[フランシウム]]は[[放射性同位体|放射性元素]]で天然からは産出されないが、核反応により少量合成されアルカリ金属としての物性を持つことが確認されている。 |
また、[[フランシウム]]は[[放射性同位体|放射性元素]]で天然からは産出されないが、核反応により少量合成されアルカリ金属としての物性を持つことが確認されている。 |
||
| 98行目: | 98行目: | ||
そして、アルカリ金属イオンは[[ハロゲン]]イオンなど種々の[[アニオン]]と水溶性の[[塩 (化学)|塩]]を作る。これは、アルカリ金属イオンが強く水和することの寄与が大きい。これらのアルカリ金属塩の溶解性はアルカリ金属イオンの挙動に強く影響される。例えば、[[クラウンエーテル]]や[[クリプタンド]]などはアルカリ金属イオンと包摂化合物を形成し、塩は有機溶媒に可溶となることが知られている。 |
そして、アルカリ金属イオンは[[ハロゲン]]イオンなど種々の[[アニオン]]と水溶性の[[塩 (化学)|塩]]を作る。これは、アルカリ金属イオンが強く水和することの寄与が大きい。これらのアルカリ金属塩の溶解性はアルカリ金属イオンの挙動に強く影響される。例えば、[[クラウンエーテル]]や[[クリプタンド]]などはアルカリ金属イオンと包摂化合物を形成し、塩は有機溶媒に可溶となることが知られている。 |
||
アルカリ金属の単体は低温においてはいずれも[[体心立方格子]]の等軸晶系の結晶であるが、常温においてはカリウム、ルビジウム、セシウムは正方晶系の結晶となる<ref>[[#千谷1959|千谷 (1959)]] 83、84頁。</ref>。 |
|||
また、アルカリ金属元素の単体はいずれも[[酸化還元電位]]が非常に低く、強い還元性を有する。このアルカリ金属元素の性質は、他の金属の塩化物から単体へと還元するときに利用されたり、有機化学の分野では[[バーチ還元]] (Bürch reduction) に利用される。 |
|||
[[仕事関数]]が小さいという特長を活かして[[カミオカンデ]]で使用された[[光電子増倍管]]の光電面に蒸着されている。 |
[[仕事関数]]が小さいという特長を活かして[[カミオカンデ]]で使用された[[光電子増倍管]]の光電面に蒸着されている。 |
||
== |
== 化合物 == |
||
=== 水素化物 === |
|||
アルカリ金属は一般式 MH で表されるような1価の[[水素化物]]を形成する。これらの水素化物はイオン型水素化物であり、[[水素#ヒドリド|ヒドリド]]供与体として、[[塩基]]や[[還元剤]]として利用される。 |
|||
乾燥条件下においてアルカリ金属を水素気流下で加熱することによって、アルカリ金属は一般式 MH で表されるような1価の[[水素化物]]を形成するが、これらは[[水素化リチウム]]を除き不安定であり<ref>[[#千谷1959|千谷 (1959)]] 81、87頁。</ref>、[[加水分解]]を受けて元の水素化物に対応する水酸化物と水素に分解する<ref name=belllott290>[[#ベルロット1968|ベル、ロット (1968)]] 290頁。</ref>。これらの水素化物は塩化ナトリウム型構造を取るイオン型水素化物であり<ref name=belllott290/>、[[水素#ヒドリド|ヒドリド]]供与体として、[[塩基]]や[[還元剤]]として利用される。また、[[水素化ホウ素ナトリウム]]や[[水素化アルミニウムリチウム]]などの三元化合物も形成される<ref name=belllott290/>。 |
|||
== 酸化物 == |
=== 酸化物 === |
||
アルカリ金属は一般式 M<sub>2</sub>O で表される[[酸化物]]を形成する。空気中の[[酸素]]と直接反応するためアルカリ金属単体の切断面は、直後には金属光沢を示すものの、速やかに酸化物など(一部は水酸化物)に覆われて光沢を失う。 |
アルカリ金属は、一般式 M<sub>2</sub>O で表される[[酸化物]]を形成する。空気中の[[酸素]]と直接反応するためアルカリ金属単体の切断面は、直後には金属光沢を示すものの、速やかに酸化物など(一部は水酸化物)に覆われて光沢を失う。 |
||
また、空気中で燃焼させるとリチウムでは主に酸化物を生成するが、主にナトリウムでは一般式 M<sub>2</sub>O<sub>2</sub> であらわされる[[無機過酸化物|金属過酸化物]]を形成し、カリウム以上の周期の元素の場合は一般式 MO<sub>2</sub> で表される[[超酸化物|金属超酸化物]]を形成することも知られている。 |
また、空気中で燃焼させるとリチウムでは主に酸化物を生成するが、主にナトリウムでは一般式 M<sub>2</sub>O<sub>2</sub> であらわされる[[無機過酸化物|金属過酸化物]]を形成し、カリウム以上の周期の元素の場合は一般式 MO<sub>2</sub> で表される[[超酸化物|金属超酸化物]]を形成することも知られている。これは、イオン半径の大きな陽イオンほど、格子エネルギー効果によって対となる大きな陰イオンを安定化させることができ、不安定な過酸化物イオンや超酸化物イオンとでも安定な化合物が形成できるためである<ref name=CW255>[[#CW1987|コットン、ウィルキンソン (1987)]] 255頁。</ref>。[[過酸化リチウム]]を形成するためには過酸化水素と反応させる必要があり<ref>[[#千谷1959|千谷 (1959)]] 90頁。</ref>、[[超酸化ナトリウム]]を形成するためには高温高圧の条件が必要となる<ref name=belllott291>[[#ベルロット1968|ベル、ロット (1968)]] 291頁。</ref>。アルカリ金属元素の超酸化物は全て[[常磁性体]]であり、歪んだ塩化ナトリウム型構造を取る<ref name=belllott291/>。また、アルカリ金属の[[水酸化物]]と[[オゾン]]との反応によって[[オゾン化物]]が形成される<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 496頁。</ref>。このオゾン化物の安定性もまた、対となる陽イオンのイオン半径の大きさに比例する<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 497頁。</ref>。 |
||
酸化物は発熱を伴い水と激しく反応して水酸化物を生成し、過酸化物は激しく加水分解して[[過酸化水素]]あるいは酸素を発生 |
アルカリ金属は[[電気陰性度]]が低く電気的に非常に陽性であるため、酸化物は発熱を伴い水と激しく反応して水酸化物を生成し、過酸化物は激しく加水分解して[[過酸化水素]]あるいは酸素を発生させ、超酸化物も水溶液中では次第に分解して酸素を発生する<ref name=CW255/>。 |
||
アルカリ金属に限定しない酸化物の一般的性質については、[[酸素]]・[[酸化物]]それぞれの項目を参照のこと。 |
アルカリ金属に限定しない酸化物の一般的性質については、[[酸素]]・[[酸化物]]それぞれの項目を参照のこと。 |
||
== |
=== 水酸化物 === |
||
アルカリ金属は、一般式MOHで表される[[水酸化物]]を形成する。低融点な無色の結晶であり、融点付近の350{{℃}}から400{{℃}}で昇華する<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 256頁。</ref>。[[水酸化リチウム]]を除いて全て[[潮解性]]を有し、水やアルコールには発熱しながら容易に溶解する<ref name=chitani9394>[[#千谷1959|千谷 (1959)]] 93、94頁。</ref>。アルカリ金属の水酸化物の水溶液では、アルカリ金属イオンと水酸化物イオンにほぼ完全に電離しているため非常に強い塩基性を示す<ref name=chitani93>[[#千谷1959|千谷 (1959)]] 93頁。</ref>。気体状態においては(MOH)<sub>2</sub>で表される[[二量体]]を形成し、気体状態における塩基性の強さはアルカリ金属の原子量が大きくなるほど塩基性が強くなるが、溶液中における塩基性の強さは[[溶媒効果]]などの影響を受けるためこの限りではない<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 256頁。</ref>。また非常に強い腐食性を有し、溶融状態においては[[白金]]すらも侵食する<ref name=chitani9394/>。空気中の[[二酸化炭素]]を吸収して[[炭酸塩]]を形成しやすく<ref>[[#櫻井鈴木中尾2003|櫻井、鈴木、中尾(2005)]] 25頁。</ref>、市販の水酸化物はわずかに炭酸塩を含んでいる。例えば、[[日本工業規格]]において[[試薬]]の水酸化ナトリウムや水酸化カリウムでは炭酸塩の含量が1.0 %以下でなければならないと規定されている<ref>日本工業規格 JIS K 8576, JIS K 8574 [http://www.jisc.go.jp/app/JPS/JPSO0020.html 日本工業規格JIS検索]</ref>。 |
|||
| ⚫ | 一般に、アルカリ金属の[[ハロゲン]]化物は常温で固体であり、[[フッ化リチウム]] (LiF) |
||
アルカリ金属の水酸化物は、工業的には対応するアルカリ金属の塩化物の[[電気分解]]や、アルカリ金属の炭酸塩または硫酸塩とアルカリ土類金属の水酸化物とを[[複分解]]させることによって得られる<ref>[[#千谷1959|千谷 (1959)]] 93頁。</ref>。ナトリウムおよびカリウムでは前者の電解法が、ルビジウムおよびセシウムでは後者の複分解法が主に用いられている<ref>[[#千谷1959|千谷 (1959)]] 94頁。</ref>。アルカリ金属の水酸化物の中でも[[水酸化ナトリウム]]は安価なアルカリ源他様々な用途に用いられる工業的に非常に重要な物質であり、日本において2010年度で年間902,178トンもの量が消費されている<ref>{{citation|url=http://www.meti.go.jp/statistics/tyo/seidou/result/ichiran/02_kagaku.html|title=化学工業統計 2010年度年報|publisher=経済産業省|accessdate=2011-6-2}}</ref>。 |
|||
=== ハロゲン化物 === |
|||
| ⚫ | 一般に、アルカリ金属の[[ハロゲン]]化物は常温で固体であり、[[フッ化リチウム]] (LiF、溶解度は水100gに対して0.27g(18{{℃}}))<ref name=chitani102/>や[[フッ化ナトリウム]] (NaF、溶解度は水100gに対して4g(0{{℃}}))<ref>[[#千谷1959|千谷 (1959)]] 103頁。</ref>などの例外はあるものの、ほぼ全て水溶性が高い塩である。上記で述べられているように、塩の水溶性に大きく関与する要因として、アルカリ金属イオンの水和で得られるエネルギーとイオン結晶格子の切断にともない失われるエネルギーとの収支の損得が挙げられる(記事 [[溶液]]・[[溶解]] に詳しい)。フッ化リチウムの水溶性が低い(25 ℃ にて、0.13 g/100 mL)ことについては、フッ化物イオン (F<sup>−</sup>) もリチウムイオン (Li<sup>+</sup>) も[[イオン半径]]が同程度に小さいためにフッ化リチウムの結晶格子は小さく強い結合から成る一方、フッ化リチウムの結晶が溶解してイオンが水和を受ける際の水和エネルギーは大きいものの[[格子エネルギー]]を打ち消す程ではない事による<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 257頁。</ref>。 |
||
{| class="wikitable" style="float:left; text-align:center;" |
{| class="wikitable" style="float:left; text-align:center;" |
||
| 130行目: | 136行目: | ||
{{-}} |
{{-}} |
||
アルカリ金属のハロゲン化物の水溶液の [[水素イオン指数|pH]] は中性に近いことが多いが、フッ化物やヨウ化物の中には微弱な塩基性を示すものがある(例:飽和 NaF 水溶液で、pH 7.4)。これは[[フッ化水素]]が弱酸でありフッ化物イオンが僅かに[[加水分解]]すること、また[[ヨウ化水素]]は[[強酸]]であるものの、[[ヨウ化物]]イオンが酸化されやすく極一部が[[次亜ヨウ素酸]]塩などに変化していることによる。 |
アルカリ金属のハロゲン化物の水溶液の [[水素イオン指数|pH]] は中性に近いことが多いが、フッ化物やヨウ化物の中には微弱な塩基性を示すものがある(例:飽和 NaF 水溶液で、pH 7.4)。これは[[フッ化水素]]が弱酸でありフッ化物イオンが僅かに[[加水分解]]すること、また[[ヨウ化水素]]は[[強酸]]であるものの、[[ヨウ化物]]イオンが酸化されやすく極一部が[[次亜ヨウ素酸]]塩などに変化していることによる。アルカリ金属のハロゲン化物の熱的な安定性は、アルカリ金属側の原子番号が大きいほど安定であり、またハロゲン側の原子番号が小さいほど安定である<ref>[[#ベルロット1968|ベル、ロット (1968)]] 292頁。</ref>。 |
||
一連のハロゲン化物の中で、地球上に最も広く存在するものが[[塩化ナトリウム]] (NaCl) である。 |
一連のハロゲン化物の中で、地球上に最も広く存在するものが[[塩化ナトリウム]] (NaCl) である。 |
||
==== 構造 ==== |
|||
[[File:Action potential ion sizes.svg|thumb|right|200px|アルカリ金属イオンと塩素イオンのイオン半径]] |
|||
アルカリ金属元素のハロゲン化物はいずれも単純な[[立方晶|等軸晶系]]を取る<ref>[[#千谷1959|千谷 (1959)]] 100頁。</ref>。リチウム、ナトリウム、カリウムおよびルビジウムのハロゲン化物は通常6配位の「塩化ナトリウム型構造」と呼ばれる最密充填構造である[[面心立方格子]]を取り、フッ化セシウム以外のハロゲン化セシウムは8配位の「塩化セシウム型構造」と呼ばれる最密充填構造ではない[[体心立方格子]]を取る<ref>[[#千谷1959|千谷 (1959)]] 101-102頁。</ref>。しかし、[[塩化ルビジウム]]は低温では塩化セシウム型構造を優先的に形成することが知られており<ref name="Pyper">{{cite journal |author=Pyper, N.C.; Kirkland, A. I.; Harding, J. H. |title=Cohesion and polymorphism in solid rubidium chloride |journal=Journal of Physics: Condensed Matter |volume=18 |pages=683–702 |year=2006 |url=http://www.iop.org/EJ/abstract/0953-8984/18/2/023 |doi=10.1088/0953-8984/18/2/023 }}</ref>、また[[塩化セシウム]]は445{{℃}}で塩化ナトリウム型構造へと[[相転移]]する<ref name=chitani102>[[#千谷1959|千谷 (1959)]] 102頁。</ref>。このようなハロゲン化物の構造の違いはアルカリ金属元素とハロゲン化物イオンのイオン半径比によるものであり、イオン半径比 (r<sup>+</sup>/r<sup>-</sup>)0.72を境に構造の変化が起こる<ref name=basic132>[[#櫻井鈴木中尾2003|櫻井、鈴木、中尾(2005)]] 132頁。</ref>。これは、イオン結晶が配位数の多さおよび陽イオンと陰イオン同士の充填率の高さによって安定化する性質に由来しており、[[剛体|剛体球]]近似による理論計算から、陽イオンと陰イオンのイオン半径比が小さい(陽イオンのイオン半径が小さい)と少ない配位数で密に詰まる方が安定であり、陽イオンと陰イオンのイオン半径比が大きい(陽イオンのイオン半径が大きい)と多い配位数で最密充填を取らない方が安定となるためである<ref>[[#CW1987|コットン、ウィルキンソン (1987)]] 14-15頁。</ref>。 |
|||
== 合金 == |
|||
アルカリ金属は[[水銀]]と反応して[[アマルガム]]を形成する<ref name=CW253>[[#CW1987|コットン、ウィルキンソン (1987)]] 253頁。</ref>。ナトリウムのアマルガムは、高純度な水酸化ナトリウムを製造するための水銀法とよばれる手法において用いられる<ref>[[#足立岩倉馬場2004|足立、岩倉、馬場 (2004)]] 31頁。</ref>。また、ナトリウムアマルガム電極として、通常の電極を用いることができないアルカリ金属の電極反応などにも利用される<ref>[[#小出2003|小出 (2003)]] 136頁。</ref>。ナトリウムアマルガムは、ナトリウムの割合を増やせば固体、減らせば液体となる性質があり強力な還元剤としても用いられる<ref name=CW253/>。 |
|||
リチウム以外のアルカリ金属元素は、溶融させることでそれぞれ任意の割合で混合して合金を与えるが、リチウムはナトリウムとは380{{℃}}以上の条件で合金を作ることができるものの、それ以外のアルカリ金属元素とは合金を作ることができない<ref name=CW250>[[#CW1987|コットン、ウィルキンソン (1987)]] 250頁。</ref>。アルカリ金属同士の合金で重要なものは[[ナトリウムカリウム合金]]であり、カリウム含有率77.2 %のもので融点が-12.3{{℃}}と常温で液体な低融点合金である<ref name=CW252>[[#CW1987|コットン、ウィルキンソン (1987)]] 252頁。</ref>。その高い比熱によって核反応における熱媒体としての利用が検討されていたが、より安全な溶融ナトリウムへと移りこの用途では現在用いられていない<ref name=CW252/>。 |
|||
==註・出典== |
==註・出典== |
||
{{脚注ヘルプ}} |
{{脚注ヘルプ}} |
||
{{Reflist}} |
{{Reflist}} |
||
== 参考文献 == |
|||
* {{Cite book|和書|author=F.A. コットン, G. ウィルキンソン|others=中原 勝儼|title=コットン・ウィルキンソン無機化学(上)|publisher=培風館|year=1987|edition=原書第4版|isbn=4563041920|ref=CW1987}} |
|||
* {{Cite book|和書|author=足立吟也、岩倉千秋、馬場 章夫|year=2004|title=新しい工業化学-環境との調和をめざして|ref=足立岩倉馬場2004|isbn=4759809554}} |
|||
* {{Cite book|和書|author=小出直之|year=2003|title=ビギナーズ化学|publisher=化学同人|ref=小出2003|isbn=4759808779}} |
|||
* {{Cite book|和書|author=櫻井武、鈴木晋一郎、中尾安男|year=2003|title=ベーシック無機化学|publisher=化学同人|ref=櫻井鈴木中尾2003|isbn=4759809031}} |
|||
* {{Cite book|和書|author=千谷利三|year=1959|title=新版 無機化学(上巻)|publisher=産業図書|ref=千谷1959}} |
|||
* {{Cite book|和書|author=C.F.ベル、K.A.K.ロット|other=奥野久輝ほか|year=1968|edition=第2版|title=ベル・ロット無機化学-その現代的理解のために|publisher=東京化学同人|ref=ベルロット1968}} |
|||
== 関連項目 == |
== 関連項目 == |
||
2011年6月2日 (木) 16:29時点における版
| ← 1族 → | |
| 周期 | |
| 1 | 1 H |
| 2 | 3 Li |
| 3 | 11 Na |
| 4 | 19 K |
| 5 | 37 Rb |
| 6 | 55 Cs |
| 7 | 87 Fr |
第1族元素(だいいちぞくげんそ)とは、周期表において第1族に属する元素。水素・リチウム・ナトリウム・カリウム・ルビジウム・セシウム・フランシウムがこれに該当する。このうち、水素を除いた元素についてはアルカリ金属 (alkali metals) といい、単体では最外殻s軌道電子が自由電子として振舞うため金属的な性質を示す。
周期表の一番左側に位置する元素群で、価電子は最外殻のs軌道にある電子である。s軌道は1電子のみが占有する。
アルカリ金属
第1族元素の中において、元素の持つ化学的性質の共通部分について与えられた名称がアルカリ金属である。言い換えると周期表の族は電子構造の共通性に着目した区分であるため(他の元素族でも同様であるが)同じ族の元素であっても完全な共通性が存在するわけではない。典型元素の単体においては周期が小さいほど共有結合性が強く、周期が大きいほど金属結合性が強い。この典型元素の性質は第1族元素においては水素のみが共有結合性を示し他は金属結合性を示すといったあらわれ方をしている[1]。
第1族元素に属する元素の多くが化学的性質に基づく分類である「アルカリ金属」に属する為、第1族元素をアルカリ金属と言い換えることはかなり歴史的にも古くからおこなわれてきた。その為、広義には第1族元素とアルカリ金属とは同等とみなされることが多い。しかし、分類の着目点が電子構造の違いか代表的な化学的共通性質かという違いがあるため、厳密には第1族元素の区分とアルカリ金属の区分とは合致しない。とは言え水素とアルカリ金属とで共通の化学的性質や物理的性質が存在し、全く別の集団であるということでもない。
性質
第1族元素がアルカリ金属と呼ばれるようにリチウム、ナトリウム、カリウム、ルビジウム、セシウムは性質が非常に似通っている。一方水素はアルカリ金属元素とは性質が著しく異なる。
両者の違いは電子配置の閉殻構造の有無に起因する。アルカリ金属元素の場合、一価の陽イオンが生成すると閉殻構造の寄与により非常に安定化する。一方、水素の陽イオンであるプロトンはむき出しの正電荷である為、電子を核から引き放なす為のイオン化エネルギーが非常に大きく、閉殻構造が無いため安定化の寄与が存在しない。このs電子の振る舞いの違いが水素では共有化合物としての性質を与え、アルカリ金属元素には金属としての性質を与えている。
| 水素 1H |
リチウム 3Li |
ナトリウム 11Na |
カリウム 19K |
ルビジウム 37Rb |
セシウム 55Cs |
フランシウム 87Fr | |
|---|---|---|---|---|---|---|---|
| 電子配置 | 1s1 | [He]2s1 | [Ne]3s1 | [Ar]4s1 | [Kr]5s1 | [Xe]6s1 | [Rn]7s1 |
| 第1イオン化エネルギー (kJ·mol−1) |
1312 | 513.3 | 495.8 | 418.8 | 403.0 | 375.7 | 392.8 |
| 電子付加エンタルピー (kJ·mol−1) |
− | − | − | − | 46.88 | 45.51 | − |
| 電子親和力 (kJ·mol−1) |
72.77 | 59.63 | 52.87 | − | − | − | − |
| 電気陰性度 (Allred−Rochow) |
2.20 | 0.97 | 1.01 | 0.91 | 0.89 | 0.86 | − |
| イオン半径 (pm, M+) |
−4 (2配位) | 73 (4配位) 90 (6配位) |
113 (4配位) 116 (6配位) |
152 (6配位) 165 (8配位) |
166 (6配位) 175 (8配位) |
181 (6配位) 202 (12配位) |
− |
| 共有結合半径 (pm) |
37 | 134 | 154 | 196 | 211 | 225 | 260 |
| van der Waals半径 (pm) |
120 | 182 | 227 | 275 | 244 | 343 | 348 |
| 融点 (K) |
14.025 | 453.69 | 370.87 | 336.53 | 312.46 | 301.59 | 300 |
| 沸点 (K) |
20.268 | 1615 | 1156 | 1032 | 961 | 944 | 950 |
| 還元電位 E0 (V, M+/M) | 0 | −3.040 | −2.713 | −2.929 | −2.924 | −2.923 | − |
以下では、主にアルカリ金属の性質について述べる。水素の性質については、記事 水素 で詳しく述べる。
単体金属

アルカリ金属は、比較的融点も低く、比較的軟らかく軽い金属である。Li、Na、Kは比重が1以下で水に浮く。いずれも反応性は高く、周期表の周期が大きくなるほど、結晶エネルギー(解離エンタルピー)が低減するため、激しく反応する傾向が見られる。リチウムおよびナトリウムの単体金属を得るためには、これらの酸化還元電位がいずれも非常に低い(つまり非常に還元されやすい)ことを利用して溶融塩を電気分解することで生産される[2]。カリウム、ルビジウム、セシウムは低融点かつ気化しやすいため単純な電気分解による生産には適しておらず、カリウムは溶融させた塩化カリウムをナトリウム蒸気と反応させることで作られ、ルビジウムおよびセシウムはそれぞれの水酸化物を金属マグネシウムや金属カルシウムによって還元させることで得られる[3][4]。代表的な工業生産法には、溶融した塩化ナトリウムに融点降下剤として塩化カルシウムを加え、それを電気分解することで金属ナトリウムを得るダウンズ法がある[5]。このアルカリ金属元素の強い還元性は他にも、有機化学の分野におけるバーチ還元 (Bürch reduction) などに利用される。
いずれのアルカリ金属元素単体も水、あるいは空気中の酸素と反応する為に、それらを避けるためにミネラルオイルの中に保存される。オイルを拭って放置すると自然発火することもあるので取り扱いは考慮する必要がある(危険物3類)。アルカリ金属の反応性の高さは原子量の大きいものほど高い傾向があるが、窒素との反応に関しては例外的にリチウムのみが直接的な反応によって窒化リチウム (Li3N)を生成する[6]。
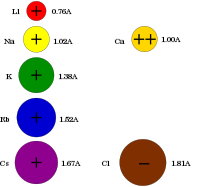
| リチウム | ナトリウム | カリウム | ルビジウム | セシウム | フランシウム |
|---|---|---|---|---|---|
| 深紅色 | 黄色 | 紫色 | 深赤色 | 青紫色 | 未確認 |
セシウムのみは励起に必要な高温を得るために、酸水素炎で観察する必要がある。
また、フランシウムは放射性元素で天然からは産出されないが、核反応により少量合成されアルカリ金属としての物性を持つことが確認されている。
水やアルコールなどプロトン溶媒とは水素ガスを発して反応し、生成する水酸化物や金属アルコキシドなどは強塩基として利用される。
そして、アルカリ金属イオンはハロゲンイオンなど種々のアニオンと水溶性の塩を作る。これは、アルカリ金属イオンが強く水和することの寄与が大きい。これらのアルカリ金属塩の溶解性はアルカリ金属イオンの挙動に強く影響される。例えば、クラウンエーテルやクリプタンドなどはアルカリ金属イオンと包摂化合物を形成し、塩は有機溶媒に可溶となることが知られている。
アルカリ金属の単体は低温においてはいずれも体心立方格子の等軸晶系の結晶であるが、常温においてはカリウム、ルビジウム、セシウムは正方晶系の結晶となる[8]。
仕事関数が小さいという特長を活かしてカミオカンデで使用された光電子増倍管の光電面に蒸着されている。
化合物
水素化物
乾燥条件下においてアルカリ金属を水素気流下で加熱することによって、アルカリ金属は一般式 MH で表されるような1価の水素化物を形成するが、これらは水素化リチウムを除き不安定であり[9]、加水分解を受けて元の水素化物に対応する水酸化物と水素に分解する[10]。これらの水素化物は塩化ナトリウム型構造を取るイオン型水素化物であり[10]、ヒドリド供与体として、塩基や還元剤として利用される。また、水素化ホウ素ナトリウムや水素化アルミニウムリチウムなどの三元化合物も形成される[10]。
酸化物
アルカリ金属は、一般式 M2O で表される酸化物を形成する。空気中の酸素と直接反応するためアルカリ金属単体の切断面は、直後には金属光沢を示すものの、速やかに酸化物など(一部は水酸化物)に覆われて光沢を失う。
また、空気中で燃焼させるとリチウムでは主に酸化物を生成するが、主にナトリウムでは一般式 M2O2 であらわされる金属過酸化物を形成し、カリウム以上の周期の元素の場合は一般式 MO2 で表される金属超酸化物を形成することも知られている。これは、イオン半径の大きな陽イオンほど、格子エネルギー効果によって対となる大きな陰イオンを安定化させることができ、不安定な過酸化物イオンや超酸化物イオンとでも安定な化合物が形成できるためである[11]。過酸化リチウムを形成するためには過酸化水素と反応させる必要があり[12]、超酸化ナトリウムを形成するためには高温高圧の条件が必要となる[13]。アルカリ金属元素の超酸化物は全て常磁性体であり、歪んだ塩化ナトリウム型構造を取る[13]。また、アルカリ金属の水酸化物とオゾンとの反応によってオゾン化物が形成される[14]。このオゾン化物の安定性もまた、対となる陽イオンのイオン半径の大きさに比例する[15]。
アルカリ金属は電気陰性度が低く電気的に非常に陽性であるため、酸化物は発熱を伴い水と激しく反応して水酸化物を生成し、過酸化物は激しく加水分解して過酸化水素あるいは酸素を発生させ、超酸化物も水溶液中では次第に分解して酸素を発生する[11]。
アルカリ金属に限定しない酸化物の一般的性質については、酸素・酸化物それぞれの項目を参照のこと。
水酸化物
アルカリ金属は、一般式MOHで表される水酸化物を形成する。低融点な無色の結晶であり、融点付近の350°Cから400°Cで昇華する[16]。水酸化リチウムを除いて全て潮解性を有し、水やアルコールには発熱しながら容易に溶解する[17]。アルカリ金属の水酸化物の水溶液では、アルカリ金属イオンと水酸化物イオンにほぼ完全に電離しているため非常に強い塩基性を示す[18]。気体状態においては(MOH)2で表される二量体を形成し、気体状態における塩基性の強さはアルカリ金属の原子量が大きくなるほど塩基性が強くなるが、溶液中における塩基性の強さは溶媒効果などの影響を受けるためこの限りではない[19]。また非常に強い腐食性を有し、溶融状態においては白金すらも侵食する[17]。空気中の二酸化炭素を吸収して炭酸塩を形成しやすく[20]、市販の水酸化物はわずかに炭酸塩を含んでいる。例えば、日本工業規格において試薬の水酸化ナトリウムや水酸化カリウムでは炭酸塩の含量が1.0 %以下でなければならないと規定されている[21]。
アルカリ金属の水酸化物は、工業的には対応するアルカリ金属の塩化物の電気分解や、アルカリ金属の炭酸塩または硫酸塩とアルカリ土類金属の水酸化物とを複分解させることによって得られる[22]。ナトリウムおよびカリウムでは前者の電解法が、ルビジウムおよびセシウムでは後者の複分解法が主に用いられている[23]。アルカリ金属の水酸化物の中でも水酸化ナトリウムは安価なアルカリ源他様々な用途に用いられる工業的に非常に重要な物質であり、日本において2010年度で年間902,178トンもの量が消費されている[24]。
ハロゲン化物
一般に、アルカリ金属のハロゲン化物は常温で固体であり、フッ化リチウム (LiF、溶解度は水100gに対して0.27g(18°C))[25]やフッ化ナトリウム (NaF、溶解度は水100gに対して4g(0°C))[26]などの例外はあるものの、ほぼ全て水溶性が高い塩である。上記で述べられているように、塩の水溶性に大きく関与する要因として、アルカリ金属イオンの水和で得られるエネルギーとイオン結晶格子の切断にともない失われるエネルギーとの収支の損得が挙げられる(記事 溶液・溶解 に詳しい)。フッ化リチウムの水溶性が低い(25 ℃ にて、0.13 g/100 mL)ことについては、フッ化物イオン (F−) もリチウムイオン (Li+) もイオン半径が同程度に小さいためにフッ化リチウムの結晶格子は小さく強い結合から成る一方、フッ化リチウムの結晶が溶解してイオンが水和を受ける際の水和エネルギーは大きいものの格子エネルギーを打ち消す程ではない事による[27]。
| 物質 | 格子エネルギー |
水和エンタルピー変化 |
溶解エンタルピー変化 |
溶解エントロピー変化 |
溶解ギブス自由エネルギー変化 |
|---|---|---|---|---|---|
| フッ化リチウム | 1046.4 kJ mol−1 | −1041.5 kJ mol−1 | 4.8 kJ mol−1 | −36.1 J mol−1K−1 | 15.6 kJ mol−1 |
アルカリ金属のハロゲン化物の水溶液の pH は中性に近いことが多いが、フッ化物やヨウ化物の中には微弱な塩基性を示すものがある(例:飽和 NaF 水溶液で、pH 7.4)。これはフッ化水素が弱酸でありフッ化物イオンが僅かに加水分解すること、またヨウ化水素は強酸であるものの、ヨウ化物イオンが酸化されやすく極一部が次亜ヨウ素酸塩などに変化していることによる。アルカリ金属のハロゲン化物の熱的な安定性は、アルカリ金属側の原子番号が大きいほど安定であり、またハロゲン側の原子番号が小さいほど安定である[28]。
一連のハロゲン化物の中で、地球上に最も広く存在するものが塩化ナトリウム (NaCl) である。
構造
アルカリ金属元素のハロゲン化物はいずれも単純な等軸晶系を取る[29]。リチウム、ナトリウム、カリウムおよびルビジウムのハロゲン化物は通常6配位の「塩化ナトリウム型構造」と呼ばれる最密充填構造である面心立方格子を取り、フッ化セシウム以外のハロゲン化セシウムは8配位の「塩化セシウム型構造」と呼ばれる最密充填構造ではない体心立方格子を取る[30]。しかし、塩化ルビジウムは低温では塩化セシウム型構造を優先的に形成することが知られており[31]、また塩化セシウムは445°Cで塩化ナトリウム型構造へと相転移する[25]。このようなハロゲン化物の構造の違いはアルカリ金属元素とハロゲン化物イオンのイオン半径比によるものであり、イオン半径比 (r+/r-)0.72を境に構造の変化が起こる[32]。これは、イオン結晶が配位数の多さおよび陽イオンと陰イオン同士の充填率の高さによって安定化する性質に由来しており、剛体球近似による理論計算から、陽イオンと陰イオンのイオン半径比が小さい(陽イオンのイオン半径が小さい)と少ない配位数で密に詰まる方が安定であり、陽イオンと陰イオンのイオン半径比が大きい(陽イオンのイオン半径が大きい)と多い配位数で最密充填を取らない方が安定となるためである[33]。
合金
アルカリ金属は水銀と反応してアマルガムを形成する[34]。ナトリウムのアマルガムは、高純度な水酸化ナトリウムを製造するための水銀法とよばれる手法において用いられる[35]。また、ナトリウムアマルガム電極として、通常の電極を用いることができないアルカリ金属の電極反応などにも利用される[36]。ナトリウムアマルガムは、ナトリウムの割合を増やせば固体、減らせば液体となる性質があり強力な還元剤としても用いられる[34]。
リチウム以外のアルカリ金属元素は、溶融させることでそれぞれ任意の割合で混合して合金を与えるが、リチウムはナトリウムとは380°C以上の条件で合金を作ることができるものの、それ以外のアルカリ金属元素とは合金を作ることができない[6]。アルカリ金属同士の合金で重要なものはナトリウムカリウム合金であり、カリウム含有率77.2 %のもので融点が-12.3°Cと常温で液体な低融点合金である[3]。その高い比熱によって核反応における熱媒体としての利用が検討されていたが、より安全な溶融ナトリウムへと移りこの用途では現在用いられていない[3]。
註・出典
- ^ 水素も「超高圧下では高温でも固体となり、金属的な物性を示す」と理論的には示されているように、金属であるか非金属であるかは、元素の性質だけでなく物質の構造にも依存する。
- ^ 千谷 (1959) 73-75頁。
- ^ a b c コットン、ウィルキンソン (1987) 252頁。
- ^ 千谷 (1959) 74、75頁。
- ^ JAKES CLOYD DOWNS (1924-07-15), ELECTROLYTIC PROCESS AND CELL, Patent 1501756 2011年6月2日閲覧。
- ^ a b コットン、ウィルキンソン (1987) 250頁。
- ^ 千谷 (1959) 82頁。
- ^ 千谷 (1959) 83、84頁。
- ^ 千谷 (1959) 81、87頁。
- ^ a b c ベル、ロット (1968) 290頁。
- ^ a b コットン、ウィルキンソン (1987) 255頁。
- ^ 千谷 (1959) 90頁。
- ^ a b ベル、ロット (1968) 291頁。
- ^ コットン、ウィルキンソン (1987) 496頁。
- ^ コットン、ウィルキンソン (1987) 497頁。
- ^ コットン、ウィルキンソン (1987) 256頁。
- ^ a b 千谷 (1959) 93、94頁。
- ^ 千谷 (1959) 93頁。
- ^ コットン、ウィルキンソン (1987) 256頁。
- ^ 櫻井、鈴木、中尾(2005) 25頁。
- ^ 日本工業規格 JIS K 8576, JIS K 8574 日本工業規格JIS検索
- ^ 千谷 (1959) 93頁。
- ^ 千谷 (1959) 94頁。
- ^ 化学工業統計 2010年度年報, 経済産業省 2011年6月2日閲覧。
- ^ a b 千谷 (1959) 102頁。
- ^ 千谷 (1959) 103頁。
- ^ コットン、ウィルキンソン (1987) 257頁。
- ^ ベル、ロット (1968) 292頁。
- ^ 千谷 (1959) 100頁。
- ^ 千谷 (1959) 101-102頁。
- ^ Pyper, N.C.; Kirkland, A. I.; Harding, J. H. (2006). “Cohesion and polymorphism in solid rubidium chloride”. Journal of Physics: Condensed Matter 18: 683–702. doi:10.1088/0953-8984/18/2/023.
- ^ 櫻井、鈴木、中尾(2005) 132頁。
- ^ コットン、ウィルキンソン (1987) 14-15頁。
- ^ a b コットン、ウィルキンソン (1987) 253頁。
- ^ 足立、岩倉、馬場 (2004) 31頁。
- ^ 小出 (2003) 136頁。
参考文献
- F.A. コットン, G. ウィルキンソン『コットン・ウィルキンソン無機化学(上)』中原 勝儼(原書第4版)、培風館、1987年。ISBN 4563041920。
- 足立吟也、岩倉千秋、馬場 章夫『新しい工業化学-環境との調和をめざして』2004年。ISBN 4759809554。
- 小出直之『ビギナーズ化学』化学同人、2003年。ISBN 4759808779。
- 櫻井武、鈴木晋一郎、中尾安男『ベーシック無機化学』化学同人、2003年。ISBN 4759809031。
- 千谷利三『新版 無機化学(上巻)』産業図書、1959年。
- C.F.ベル、K.A.K.ロット『ベル・ロット無機化学-その現代的理解のために』(第2版)東京化学同人、1968年。





