幹細胞治療
幹細胞治療(かんさいぼうちりょう、英: Stem-cell therapy)は、幹細胞を使用し、疾患を治療または予防することである。
幹細胞治療で、最も一般的なのは、骨髄移植であり、それには臍帯血を使う場合もある。様々な起源の幹細胞を生み出し、糖尿病、心臓病、神経変性疾患などに、幹細胞治療を適用する研究が進められている。
幹細胞治療の開発において胚性幹細胞(ES細胞)を単離して培養することや、体細胞核移植を用いて幹細胞を作製すること、およびiPS細胞を作製することが論議を呼んできた。この論争は、中絶に関しての扱いや、ヒトのクローンに関連することが多い。さらに、治療に用いる保存臍帯血の取引も物議をかもしてきた。
医療用途
[編集]30年以上にわたり、骨髄移植は、白血病やリンパ腫を治療するために使用されてきた。 これは、唯一、広く行われている幹細胞治療である[1][2][3]。化学療法中に、ほとんどの増殖細胞は殺されるが、化学療法は白血病細胞やがん細胞と、骨髄内の造血幹細胞を区別せず殺してしまう。骨髄移植つまり、幹細胞移植がなされるのは造血幹細胞が死滅してしまうという一般的な化学療法の副作用の改善のためである。化学療法で失われた造血幹細胞を置換するために、ドナーの健康な骨髄が移植される。移植された骨髄からできた免疫細胞は、宿主の細胞を殺す免疫応答をおこすが、これはしばしば過剰になり、骨髄移植の最も深刻な副作用である移植片対宿主病を起こす[4]。
Prochymalと呼ばれるもう1つの幹細胞治療は、ステロイドが効果がない小児における急性の移植片対宿主病のため、2012年にカナダで条件付きで承認された[5]。これは、成人ドナーの骨髄に由来する間葉系幹細胞(MSC)を使った、同種間の幹細胞治療である。MSCは骨髄から精製され、培養され、パッケージングされ、単一のドナー由来で、最大10,000回の用量が得られる。投与されるまで凍結保存される[6]。
臍帯血に由来する造血幹細胞は、血液および免疫疾患の治療を目的とした5つの医療製品がアメリカ食品医薬品局(FDA)により承認された[7]。
2015年には欧州医薬品局(European Medicines Agency)により、幹細胞を含む治療法であるHoloclarが欧州連合での使用が認可された。 眼の火傷により、角膜周辺の輪の部分の幹細胞が欠乏する場合があり、Holoclarはその場合に使用される[8]。
研究
[編集]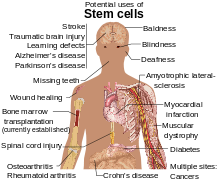
幹細胞は様々な目的で研究されている。 幹細胞から分泌される分子やエキソソームもまた、創薬のために研究されている[9]。
神経変性
[編集]パーキンソン病、筋萎縮性側索硬化症、アルツハイマー病などのような脳変性のモデル動物における幹細胞の効果について研究が行われている[10][11][12]。多発性硬化症に関する予備的な研究もなされている[13][14]。
健康な成人の脳は、自己の細胞数を維持するために増殖を続けるか前駆細胞となる神経幹細胞を含む。 健康な実験動物の成体では前駆細胞が脳内へ移動し、主に嗅覚のニューロン集団を維持するように機能する。神経障害の成体ラットを用いた実験モデルにおいて、内在性の神経幹細胞の薬理学的な活性化により、神経の保護や、行動の回復が亢進することが報告されている[15][16][17]。
脳脊髄損傷
[編集]脳卒中および外傷性脳損傷は、脳内の神経細胞と希突起膠細胞の喪失を特徴とする細胞死をもたらす。幹細胞を脳卒中患者の脳に注入する、小規模の臨床試験が、2013年にスコットランドで進行中である[18]。
脊髄損傷患者においても幹細胞の使用が、臨床的および動物学的に研究されている[19][20][21]。
心臓
[編集]先駆的研究[22] の中には、矛盾が特定され、信用されていないものもある[23]。成体の心筋梗塞[24] ならびに心筋梗塞からではない心不全[25] において、幹細胞療法が安全かつ効果的であると報告されているいくつかの臨床試験の中で、強力な効果が報告されているのは少数のみである。最初の動物実験では顕著な治療効果が示されたが[26][27]、後のヒトへの臨床試験での治療効果は、統計的に有意ではあるがほんの少しだった[28][29]。この矛盾の原因としては、患者の年齢[30]、治療のタイミング[31]、患者が過去に心筋梗塞に何度かなっていたことなどがあげられる[32]。これらの障害は、治療の有効性を高める追加の治療[33] によって、または方法を最適化することによって克服することができるかもしれないが、これらもまた議論の余地がある。
現在の研究は、細胞調達技術、細胞型、細胞投与のタイミングおよび手順、およびパラメータによって結果が大きく異なり、比較を行うことは非常に困難である。したがって、比較する研究が現在必要とされている。
心筋梗塞の治療のための幹細胞療法は、通常、自己の骨髄の幹細胞を使用するが、脂肪由来の幹細胞のような他のタイプの成人幹細胞も使用することができる[34]。
回復のメカニズムとしては、次のようなステップが考えられる。:
- 心筋細胞の発生
- 損傷した心臓組織を再充填するための新しい血管の成長の刺激
- 成長因子の分泌
- 他のメカニズムによる支援
成体の骨髄細胞を心筋細胞に分化させることは可能である。
ヒトのES細胞に由来する心筋細胞の、モルモットへの組み込みの、最初の成功は、2012年8月に報告された。モルモットに人為的に心臓発作を起こした後、細胞治療を処置し、その4週間後に、心臓の収縮力が測定された。細胞は既存の細胞と同期して収縮した。今後の研究は、壊死した組織の周りに細胞をより強く生着させる方法に焦点があてられている。ES細胞由来または成人の骨髄幹細胞からの治療が効果的であるかどうかはまだ分かっていない[35]。
2013年には、自家骨髄幹細胞がヒトの患者の心室機能に及ぼす有益な効果についての先駆的な報告に、矛盾が含まれていることが判明した。全体として、その間に病院の研究室で処理された幹細胞の数よりも多くの患者が幹細胞を摂取していると発表されていた[36][37]。
幹細胞療法の最も有望な利点の1つは、心臓損傷後の心不全発症の根底にある組織喪失を回復させる心臓組織再生の可能性である[38][39]。
血球形成
[編集]完全に成熟したヒト赤血球は、赤血球の前駆体である造血幹細胞(HSC)から培養することで得られる。このプロセスでは、HSCを間質細胞と一緒に培養し、赤血球増殖の自然な部位である骨髄の状態を模倣する環境をつくり出す。成長因子であるエリスロポエチンが添加され、幹細胞から最終的に赤血球へ分化させる[40]。この技術のさらなる研究は、遺伝子治療、輸血、および局所薬に利益をもたらすはずである。
失われた歯
[編集]2004年に、キングズ・カレッジ・ロンドンの科学者は、マウスで完全な歯を育てる方法を発見し[41]、生物工学的に歯を実験室で生育させることができた。歯の再生技術を使い、ヒトの患者に、生きた歯を生やすことができるようになると自信をもっている研究者もいる。
理論上の話だが、患者から採取した幹細胞を実験室で歯茎にし、あごに埋め込み、新しい歯が3週間以上かかって育つことが期待されている[42]。人間が元の大人の歯を成長させたときと同じ過程を経るとかんがえれば、それは顎の骨と融合し、神経と血管に接続するよう促す化学物質を放出するだろう。しかし、治療で、幹細胞によって、歯を置換するためには、多くの課題が残っている。研究はさまざまな分野で進行中である[43][44][45]。
うずまき管の毛細胞の再生
[編集]Heller氏は、ES細胞を用いてうずまき管の有毛細胞を再増殖させることに成功したと報告している[46]。
失明と視覚障害
[編集]2003年以来、研究者は視力回復のために角膜幹細胞を損傷した眼に移植することに成功している。そのとき角膜への移植へ使用されたのは、網膜細胞のシートで、中絶された胎児から採取された。これらのシートが損傷した角膜上に移植されると、幹細胞は新たな修復を刺激し、最終的に視力を回復させた[47]。2005年6月、イギリスのサセックスのクイーンビクトリア病院の研究者が同じ技術を使って40人の患者の視力を回復させた。 Sheraz Dayaが率いるこのグループは、患者、親戚、または死体から得た成人幹細胞を使用した。更なる試験が進行中である[48]。
すい臓のβ細胞(ベータ細胞)胞
[編集]糖尿病患者は、すい臓内のインスリン産生β細胞の機能を失う[49]。研究室で、胚性幹細胞をβ細胞に変えることができた。理論的には、β細胞が正常に移植されると、糖尿病患者の機能不全は改善されるだろう[50]。
移植
[編集]ヒト胚性幹細胞は、細胞培養で増殖させ、刺激して、患者に移植することができるインスリン産生細胞を形成することができる。
しかし、臨床的な成功は、以下の手順の開発に大きく依存する:
- 移植された細胞は増殖する
- 移植された細胞は、部位特異的に分化する。
- 移植された細胞は、レシピエントにおいて生存する(移植拒絶の予防)。
- 移植された細胞は、標的組織内に組み込まれる。
- 移植された細胞は宿主に組み込まれ、機能を回復する。
整形外科
[編集]整形外科治療における臨床事例の報告がされている。今日まで、筋骨格系の治療に関する文献の焦点は、間葉系の幹細胞のようである。 Centenoたちは、ヒトを対象にした臨床試験で、軟骨および半月板体積の増加のMRIの証拠を発表している[51][52]。多数の被験者を含む試験の結果はまだ公表されていない。しかし、3-4年の期間に227人の患者群で実施された研究では、間葉細胞移植は、安全性があり、合併症も少ないと公表された[53]。
また、Wakitani氏は、軟骨欠損を治療するため、5人の患者の膝へ、間葉系幹細胞を外科的移植し、発表した[54]。
創傷の治癒
[編集]幹細胞はまた、ヒト組織の増殖を刺激するために使用することができる。成人では、傷ついた組織は、瘢痕組織で置き換えられる。瘢痕組織は、コラーゲン構造がきれいでなく、毛包もなく、血管構造も不規則である。一方、傷ついた胎児組織の場合、傷ついた組織は、幹細胞の活性によって正常組織に置換される。 成体で組織再生を目指す方法としては、成体の幹細胞を「種」として、ベットとしての組織を「土壌」として植え込み、それを創傷の組織に一緒に埋め込み、幹細胞の分化を刺激すればよいのではと、考えられている。この方法は、成人の瘢痕組織の形成よりも、胎児の創傷治癒により類似した再生応答を誘発する[55]。研究者は、再生に役立つ「土壌」組織について、さまざまな側面を依然として調査している。
不妊症
[編集]細胞分裂がとめられたブタ卵巣線維芽細胞(POF)と一緒に、ヒト胚性幹細胞を一緒に培養すると、生殖細胞(卵母細胞および精子の前駆細胞)でのみ発現する遺伝子が発現された[56]。
ヒト胚性幹細胞から、精子のような細胞を形成するように刺激できるが、損傷している可能性がある。マウスでその精子様の細胞を使って受精させたところ、発生初期で育たなくなる確率が高かった[57][58]。しかし、無精子症の治療に役立つようになるかもしれない。
HIV/AIDS
[編集]HIVウイルスの感染によりヘルパーT細胞(CD4+T細胞)が破壊され、免疫系が機能しなくなる。ヘルパーT細胞(CD4+細胞)へのウイルスの侵入は、細胞ケモカイン受容体との相互作用によって媒介され、最も一般的なものはCCR5およびCXCR4である。その後のウイルス複製は細胞の遺伝子発現プロセスを必要とするため、活性化されたCD4+細胞は、HIV感染の主要標的である[59]。最近、科学者は、HIV-1/AIDSを治療するための代替アプローチとして、遺伝子を改変した(HIV-1耐性の)造血幹細胞および前駆細胞(GM-HSPC)を移植し、免疫系をHIV耐性にするため、研究してきた[60]。
臨床試験
[編集]GRNOPC1
[編集]2009年1月23日、米国食品医薬品局(FDA)は、ヒトに対する胚性幹細胞に基づく治療の最初の臨床試験の開始について、Geron Corporationに認可を与えた。 試験では、急性脊髄損傷を有する患者に対して、ES細胞由来の希突起膠細胞前駆細胞であるGRNOPC1を評価した。 この試験は、2011年11月に中止され、同社は「現在の資本不足および不確実な経済環境」としている。2013年にバイオ・再生医療企業BioTime(NYSE MKT:BTX)は、Geronの幹細胞を取得し、臨床試験の再開を目指している[61][62]。
凍結保存された間葉系間質細胞(MSC)
[編集]科学者らは、解凍後数時間以内に輸血したMSCは、細胞増殖の対数期(新鮮)にあるMSCと比較して機能の低下または有効性の低下を示す可能性があることを報告しているため、凍結保存されたMSCは、 これらが臨床試験または実験的療法のために投与される前にin vitro培養における細胞増殖の段階を繰り返すことにより、MSCの再培養は、凍結および解凍中に細胞が受ける衝撃から回復するのに役立つ。 新鮮なMSCを使用した臨床試験と比較して、凍結直後の凍結保存製品を使用したMSCに関する様々な臨床試験は失敗している[63]。
獣医学
[編集]ウマ、イヌおよびネコに現在行われている研究は、獣医学における幹細胞治療の開発に有益であり、心筋梗塞、卒中、腱および靭帯損傷、変形性関節症、骨軟骨症および筋ジストロフィーのような広範な傷害および疾患を標的とすることができ、動物でも人間でも同様な疾患がある[64][65][66][67]。細胞ベースの治療法の調査は一般に人間の医学的ニーズを反映しているが、競走馬の特定の傷害は、頻度と重症度が高いため、再生医療のアプローチの最前線として獣医学が置かれてもいる。人間の病気とよく似ているため、臨床のモデルとすることができる[68][69][70]。
再生治療モデルの開発
[編集]幹細胞は、次の5つのメカニズムで治療に寄与する。1)抗炎症効果の提供、2)損傷組織への移動、および組織増殖に必要な内皮前駆細胞などの他の細胞をよびよせる、3)組織リモデリングの支援4)アポトーシスの阻害、および5)骨、軟骨、腱および靭帯組織への分化[71][72]。
損傷領域への血液供給をさらに増やし、結果として組織再生を促進するために、豊富な血漿から栄養素が供給される。 いくつかの幹細胞集団の有効性は、扱い方に影響され、例えば、骨を再生するために、幹細胞は、機能骨の生成に必要なミネラルを産生する足場に導入されることが多い。幹細胞は、免疫原性が低いことも示されている[73][74]。
それらの表面上に見出されるMHC分子の数が比較的少ないためである。加えて、それらは、免疫応答を変化させ、新しい組織の寛容を促進するケモカインを分泌することが見出されている。これにより、拒絶反応による排除を減らし、同種異系の移植治療を行うことが可能になる[75]。
幹細胞の供給源
[編集]組織再生の手段としての幹細胞療法の獣医学的適用は、骨、軟骨、靱帯および腱に影響を及ぼす損傷または欠陥について、動物を治療するために、成体からの 間葉系幹細胞 の使用から、研究がはじまった[76][77][78]。治療に使用される幹細胞には2つの主要な種類がある:同種の遺伝的に異なるドナー由来の同種異系幹細胞[79][80] 、および、様々な治療に使用する前に患者から得られた自己間葉系幹細胞である[81]。第3のカテゴリーは異種幹細胞で、異なる種に由来する幹細胞で、特にヒト治療のための研究目的で使用される。再生医療を目的とするほとんどの幹細胞は、一般に、患者の骨髄または脂肪から単離される組織である。間葉系幹細胞は、骨、軟骨、腱および靭帯ならびに筋肉、神経および他の前駆組織を構成する細胞に分化することができ、これらの組織に影響を与える疾患の治療において研究されている[82]。
損傷組織の治療のためには、移植する幹細胞が多数必要である。したがって、例えば、骨髄吸引液に由来する幹細胞は、数百万個の細胞へ増やすために特別な実験室で培養される。 脂肪由来組織もまた、使用前に培養するが、その方法は、骨髄由来細胞の培養方法ほど汎用性はない[83]。損傷組織の治療のためには、移植する幹細胞が多数必要である。したがって、例えば、骨髄吸引液に由来する幹細胞は、数百万個の細胞へ増やすために特別な実験室で培養される。 脂肪由来組織もまた、使用前に培養するが、その方法は、骨髄由来細胞の培養方法ほど汎用性はない[84][85]。骨髄由来の幹細胞は骨、軟骨、靭帯および腱の修復に好ましいと考えられているが、脂肪由来の幹細胞も採取する技術が容易であり、脂肪組織にある細胞の微小環境が自己移植のために好ましいと考える研究者もいる。
間葉系幹細胞の新しい供給源が研究されており、皮膚および真皮に存在する幹細胞は、動物に最小限のリスクで容易に採取できるため興味深い[86]。造血幹細胞はまた、血流中を移動しており、他の間葉系幹細胞と同等の分化能力をもっており、非侵襲的に採取できることも、確認されている[87]。
不要な胚性の間葉系幹細胞の使用に関心が高まっている。ほかの動物の臍帯、卵黄嚢および胎盤に見られる幹細胞の分化能力を調べるための研究が進行中である。これらの幹細胞は、内胚葉および外胚葉の組織をより容易に形成する能力をもち、それらの成体の幹細胞よりもより多くの分化能をもつと考えられている。
幹細胞と組織修復
[編集]幹細胞は、治癒能力をもち、皮膚創傷の治療への応用も関心を集めている。糖尿病患者や化学療法を受けている患者のような治癒能力の低い患者にとって重要な関心事である。ある試験では、臍帯から幹細胞を単離し、これらの細胞を創傷に直接注射した。1週間で、創傷の完全な再上皮化が起こり、対照の創傷では、わずかな再上皮化と比較された。これによりは、表皮組織の修復における間葉系幹細胞の能力が示された[88]。
ウマの軟口蓋欠損は、胚形成中の正中線で胚が完全に閉鎖しないことによって引き起こされる。これらは、軟口蓋全体を眼で見ることができないために見落とされ、悪化してしまう。これにより、治療としての外科的介入の成功率が低くなっていると考えられている。その結果、ウマはしばしば安楽死させなければならない。最近では、間葉系幹細胞の使用が従来の治療法に加えられている。外科医が口蓋を縫合した後、自己間葉細胞を軟口蓋に注入する。幹細胞は、特に古い組織との境界に沿って、治癒組織に組み込まれることが見出された。存在する炎症細胞の数も大幅に減少し、治癒過程を助けると考えられている[89]。
幹細胞と整形外科の修復
[編集]靭帯損傷、腱損傷、変形性関節症、骨軟骨症および軟骨下骨嚢胞の自己幹細胞に基づく治療は、2003年から米国で、そして2006年から英国でウマを治療するために獣医師の練習に商業的に利用されている。イヌの腱損傷、靭帯損傷および骨関節炎のための自己幹細胞ベースの治療は、2005年以来、米国の獣医師が利用してきた。3,000頭を超えるウマやイヌが、自己由来の脂肪由来幹細胞で治療されている。 これらの治療法の有効性は、股関節および肘の変形性関節症および腱損傷を伴うウマの二重盲検臨床試験で示されている[90][91]。
腱の修復
[編集]競走馬は、特に腱と靭帯の傷害を受けやすい。従来の治療法は、ウマを十分に機能するように戻すことは、非常に難しかった。従来の治療法による自然治癒では、線維性瘢痕組織が形成され、柔軟性と関節運動が制限される。伝統的な治療は、多くのウマが完全な活動に戻れず、傷ついた腱が硬いため、再傷害の発生率も高い。骨髄および脂肪由来幹細胞の両方の導入は、自然な機械的刺激とともに腱組織の再生を促進した。自然な動きが、自然な位置合わせとしてはたらき、新しい繊維と腱細胞との整列を促進した。幹細胞治療は、より多くのウマを復帰させ、3年にわたる調査で再傷害率を大幅に低下させた。
ES細胞の使用も腱修復に適用されている。ES細胞は、損傷した腱のすべての領域に到達する、良好な移動能力をもち、腱においてより良好な生存率を有することが示された。全体の修復の質も高く、腱の構造とコラーゲンが形成されていた。 3か月の実験期間中にも腫瘍形成は見られなかった。胚性幹細胞の使用に伴う長期的な有効性とリスクを検討するためには、長期的な研究を行う必要がある。小動物でも同様の結果が見られた。
関節の修理
[編集]変形性関節症は、動物およびヒトの両方の関節痛の主な原因である。 ウマやイヌでは、最も頻繁におこる関節炎である。軟骨の自然治癒は非常に限定的であり、現在の薬物療法では治癒できず、症状を軽減するだけであるようだ。間葉系幹細胞および他の種類の細胞は、長期治療のために、研究されている。
脂肪由来の間葉系細胞は、非侵襲的に採取できるためもっともよく使われている。最近、直接関節に、間葉系幹細胞を注入し、成功が多数あった。これは、簡単に臨床使用されるために、最近開発された、非侵襲的な技術である。 この治療を受けたイヌは、関節の柔軟性が高く、痛みも少なかった[92]。
骨への損傷の修復
[編集]骨は、骨折などがおこると、独特の治癒の過程を経る。重度の外傷や骨癌などの切除など、不規則な形の損傷は、そのままにしておくと、不適切な治癒を起こしやすい。天然成分および人工成分からなる足場に、間葉系幹細胞を播種し、骨の欠損部に配置すると、足場を配置してから4週間以内に、新たに形成された骨が古い骨と一体化し始め、32週間以内に完全な結合がなされる[93]。
骨折の治療のために幹細胞の治療を行うためには、さらなる研究が必要である。幹細胞は変性骨疾患の治療に使用されている。レッグ・カルヴェ・ペルテス病のイヌへの治療は通常は、変性が進行した後に、大腿骨頭を除去する。最近、間葉系幹細胞を、大腿骨の頭部に直接注射し、骨の再生だけでなく痛みの軽減にも成功している。
幹細胞と筋肉の修復
[編集]幹細胞は、イヌの心筋梗塞後の心臓の症状を改善するために使用されてきた。脂肪細胞および骨髄由来の幹細胞を取り出し、心臓の細胞に誘導してから、心臓に注入した。心臓は、幹細胞が適用されてから4週間後に、収縮性が改善され、損傷領域が減少することが見出された[94]。
幹細胞は、多孔質物質で作られたパッチに「まかれ」、心不全における組織再生を誘発するために使用される。組織が再生され、パッチが心臓組織によく組み込まれた。これは、部分的には、血管新生の改善および炎症の減少に起因すると考えられる。心筋細胞は間葉系幹細胞から産生されたが、収縮性はなかった。他の治療法の例では、収縮性の心臓組織の作製に成功を収めている[95]。
幹細胞と神経系修復
[編集]脊髄損傷は、獣医病院に持ち込まれる最も一般的な外傷の1つである。 脊髄損傷は、外傷後に2つの方法で起こる:一次的な機械的損傷、および外傷の数日後における炎症および瘢痕形成のような二次的過程で起こる。二次的な損傷応答に関与する細胞は、瘢痕形成を促進し、細胞再生を阻害する因子を分泌する。神経細胞に誘導された間葉系幹細胞を、多孔性の足場で育て、その後、損傷部位に移植された。細胞および足場は、瘢痕形成細胞によって分泌されるものに対抗する因子を分泌し、神経再生を促進した。 8週間後、幹細胞で処置したイヌは、従来の療法で処置したイヌよりも大幅に改善した。幹細胞で治療したイヌは、従来の治療法を受けているイヌには見られなかった自分の重みを時々支えることができた[96][97][98]。
末梢神経を修復して再生する臨床試験の治療法もある。末梢神経は損傷を受ける可能性がより高いが、損傷の影響は脊髄損傷の場合と同様に広範囲には及ばない。治療は切断された神経を修復するために現在臨床試験中であり、初期段階での成功を収めている。幹細胞は、神経運命に誘導され、切断された神経に注入された。4週間たたずに、以前に損傷を受けた幹細胞および完全に形成された神経束の再生が観察された。
幹細胞はまた、眼科での治療のための臨床段階にある。造血幹細胞は、いくつかのウマの異なる発生原因の角膜潰瘍を治療するために使用されてきた。これらの潰瘍は、従来の治療法では改善できなかったが、幹細胞治療に迅速に応答した。幹細胞はまた、網膜剥離によるウマの一方の眼で視力を回復させ、ウマを日常活動に戻すことを可能にした。
現在の研究領域
[編集]実験室での幹細胞
[編集]分化を誘導し、機能をもった成体組織を無期限に培養することができるため、薬物研究の新たな機会をつくり出している。研究者は、分化した細胞株を成長させ、生体内での研究を行う前に、培養細胞で起こり得る相互作用を調べるために、各細胞型で新薬を試験することができる。これは、種に特異的な相互作用があるかもしれないので、動物を使っての薬物の開発において重要である。ヒトの培養した組織で影響を調べることで、動物試験段階の前に通常は知られていない洞察が得られるため、これらの細胞株を研究に利用できるようにすることで、動物実験のための動物の使用を減らすことができると期待されている。
誘導多能性幹細胞(iPS細胞)の出現にともない、絶滅のおそれのある動物に使用されるための治療法が探究されている。限られた胚や卵を収穫する必要はなく、間葉系幹細胞は卵などよりも非侵襲的に簡単に取得でき、動物への影響を大幅に減らすことができます。これにより、限られた卵を生殖目的にのみ使用することが可能になる。
幹細胞と自然保護
[編集]幹細胞は保存活動に使用するために探索されている。精子幹細胞をラットから採取し、マウス宿主に入れ、生存可能な子孫を産生する能力を有する完全に成熟した精子を作製した。現在、ドナー精子幹細胞の導入に適した宿主を見つけるための研究が進められている。この技術を、自然保護に使用可能になるなら、性成熟に達する前に死亡してしまう個体の精子を得たりもできるだろう。絶滅危惧種の遺伝的な多様性の保存に役立つだろう[99]。
今後の臨床利用
[編集]ヒトおよび、動物でも、肝疾患の治療のための幹細胞の使用は、かなり関心が集まっている。肝臓には自然再生力があるが、肝疾患によっては再生できない。間葉系幹細胞(MSC)のいくつかから肝細胞は分化誘導できるようであるが、現在は臨床的に適用されていない。 間葉系幹細胞は現在、糖尿病の有望な治療法として、すい臓系統に分化した幹細胞を作製する大きな努力がなされているが、まだ誘導する方法はみつかっていない。
間葉系幹細胞は、異種幹細胞治療が拒絶されず、自己幹細胞と比較して治癒能力に差異を示さなかった様々な動物の実験を経て、移植片対宿主病および移植片への拒絶反応の有望な治療法として現在臨床試験中である。
これは、再生獣医学において、治療のために、様々な既製の同種幹細胞をつくり出すためにさらに研究されている。 幹細胞の低免疫原性が、アレルギーや自己免疫疾患などの免疫系が過剰に活動する疾患の、治療に役立つ可能性を探る臨床試験が進行中である。
運動選手にとって特に顕著にみられる骨、関節および結合組織の傷害の治療として、日帰りの外来患者IRBプログラムの一部として、患者自身の骨髄または脂肪由来の成人幹細胞を使って治療する、近年、FDA認可の米国に本拠を置く幹細胞診療所が出てきた。この米国のヒト成人幹細胞療法の出現については、Rudderham氏によって2012年の「Adult Stem Cell US Therapy」という記事で議論されている[100]。
これらの治療の長期的な影響は、医学への貢献以外でも検討する必要がある。獣医薬の大幅な改善は、ペットや家畜が長生きすることを可能にしました。しかしこれは、ペットの傷害および慢性疾患の増加に寄与している。 幹細胞治療は、特にウマの整形外科的問題の治療の改善が大きいが、再傷害率の低下とともにより速い速度で正常な活動状態に戻ることを可能にする。
胚性幹細胞(ES細胞)についての論争
[編集]ヒトのES細胞の使用に関する議論がある。 新しいES細胞の株をつくるためには、ヒトの胚を壊して、ばらばらにした細胞を培養することでES細胞はつくられるが、その技術が主に議論のまとになっている。 研究でのヒトES細胞の使用に対する反対は、しばしば哲学的、道徳的、または宗教的異論に基づいている[101]。ヒト胚の破壊を伴わない他の幹細胞があり、そのような研究には、成体幹細胞、羊水幹細胞、および誘導多能性幹細胞(iPS細胞)がある。
世界中
[編集]中国
[編集]幹細胞の研究と治療は中華人民共和国でも行われている。 中華人民共和国保健省は、西欧諸国で承認されていない病気に対しても、幹細胞療法を許可している。 西側の国々は、これらの試行と手続きについて、国際的な文書化の基準を満たす試みが失敗し、中国を調査している[102]。
中東
[編集]2008年以来、多くの大学、センター、医師が多様な方法を試してきた[103]。
メキシコ
[編集]メキシコでは、幹細胞治療は臨床レベルで実施されている。国際保健局の許可(COFEPRIS)が必要である。
韓国
[編集]2005年、韓国の科学者は、レシピエントに合わせて幹細胞を作り出したと報告した。 11の新しい幹細胞株のそれぞれは、体細胞核移植(SCNT)技術を用いて開発された。得られた細胞は、レシピエントの遺伝物質と一致すると考えられ、従って、拒絶反応が最小であると考えられる[104]。
タイ
[編集]2013年現在、タイは造血幹細胞移植を臨床段階としており、Kampon Sriwatanakulは、2013年10月に20人の患者の臨床試験を開始した。10人の患者は2型糖尿病の幹細胞療法を受け、残りの10人は肺気腫の幹細胞療法を受けた。 Chotinantakulの研究は、恒常性および免疫応答における造血系機能のための造血細胞およびそれらの役割に関する研究である[105]。
その他の国
[編集]その他、幹細胞研究がおこなわれているのは:ブラジル、キプロス、ドイツ、イタリア、イスラエル、日本、パキスタン、フィリピン、ロシア、スイス、トルコ、英国、インド、その他多数。
脚注
[編集]- ^ Ian Murnaghan for Explore Stem Cells.
- ^ Bone Marrow Transplantation and Peripheral Blood Stem Cell Transplantation In National Cancer Institute Fact Sheet web site.
- ^ “Twenty years of unrelated donor hematopoietic cell transplantation for adult recipients facilitated by the National Marrow Donor Program”. Biology of Blood and Marrow Transplantation 14 (9 Suppl): 8–15. (2008). doi:10.1016/j.bbmt.2008.06.006. PMID 18721775.
- ^ “New Insight for the Diagnosis of Gastrointestinal Acute Graft-versus-Host Disease”. Mediators Inflamm 2014: 701013. (2014). doi:10.1155/2014/701013. PMID 24733964.
- ^ “Prochymal – First Stem Cell Drug Approved”. (22 May 2012)
- ^ “A Stem-Cell-Based Drug Gets Approval in Canada”. (17 May 2012)
- ^ Rosemann A (Dec 2014). “Why regenerative stem cell medicine progresses slower than expected”. J Cell Biochem 115 (12): 2073–6. doi:10.1002/jcb.24894. PMID 25079695.
- ^ European Medicines Agency. “First stem-cell therapy recommended for approval in EU”. 12 December 2014閲覧。
- ^ Maguire, G (12 May 2016). “Therapeutics from Adult Stem Cells and the Hype Curve.”. ACS Medicinal Chemistry Letters 7 (5): 441–3. doi:10.1021/acsmedchemlett.6b00125. PMID 27190588.
- ^ Cell Basics: What are the potential uses of human stem cells and the obstacles that must be overcome before these potential uses will be realized?
- ^ Neural Stem Cells May Rescue Memory In Advanced Alzheimer's, Mouse Study Suggests
- ^ Vastag B (April 2001). “Stem cells step closer to the clinic: paralysis partially reversed in rats with ALS-like disease”. JAMA 285 (13): 1691–3. doi:10.1001/jama.285.13.1691. PMID 11277806.
- ^ Rebeiro P, Moore J. The role of autologous haemopoietic stem cell transplantation in the treatment of autoimmune disorders.
- ^ “Results Reported from Case Studies of Stem Cell Transplantation in People with Relapsing and Progressive MS”. National MS Society (January 20, 2015). 2017年4月22日閲覧。
- ^ “Notch signalling regulates stem cell numbers in vitro and in vivo”. Nature 442 (7104): 823–6. (August 2006). doi:10.1038/nature04940. PMID 16799564.
- ^ “Targeting neural precursors in the adult brain rescues injured dopamine neurons”. Proc. Natl. Acad. Sci. U.S.A. 106 (32): 13570–5. (August 2009). doi:10.1073/pnas.0905125106. PMC 2714762. PMID 19628689.
- ^ “Signaling pathways controlling neural stem cells slow progressive brain disease”. Cold Spring Harb. Symp. Quant. Biol. 73: 403–10. (2008). doi:10.1101/sqb.2008.73.018. PMID 19022746.
- ^ Ghosh, Pallab (27 May 2013 ) Stroke patients see signs of recovery in stem cell trial BBC News health, Retrieved 27 May 2013
- ^ “A 37-year-old spinal cord-injured female patient, transplanted of multipotent stem cells from human UC blood, with improved sensory perception and mobility, both functionally and morphologically: a case study”. Cytotherapy 7 (4): 368–73. (2005). doi:10.1080/14653240500238160. PMID 16162459.
- ^ Team co-headed by researchers at Chosun University, Seoul National University and the Seoul Cord Blood Bank Archived 2007年5月1日, at the Wayback Machine. (SCB) Umbilical cord cells 'allow paralysed woman to walk' By Roger Highfield, Science Editor.
- ^ “Human neural stem cells differentiate and promote locomotor recovery in spinal cord-injured mice”. Proc. Natl. Acad. Sci. U.S.A. 102 (39): 14069–74. (September 2005). doi:10.1073/pnas.0507063102. PMC 1216836. PMID 16172374.
- ^ Strauer, Bodo (September 2011). “10 years of intracoronary and intramyocardial bone marrow stem cell therapy of the heart: from the methodological origin to clinical practice”. J Am Coll Cardiol 58 (11): 1095–1104. doi:10.1016/j.jacc.2011.06.016. PMID 21884944.
- ^ Francis, DP (26 June 2013). “Autologous bone marrow-derived stem cell therapy in heart disease: Discrepancies and contradictions”. International Journal of Cardiology 168 (4): 3381–403. doi:10.1016/j.ijcard.2013.04.152. PMID 23830344 21 July 2013閲覧。.
- ^ Strauer, BE (July 2010). “The acute and long-term effects of intracoronary Stem cell Transplantation in 191 patients with chronic heARt failure: the STAR-heart study”. European journal of heart failure 12 (7): 721–9. doi:10.1093/eurjhf/hfq095. PMID 20576835.
- ^ “Hmane autologe Stammzelltransplantation zur Myokardregeneration bei dilatativer Kardiomyopathie (NYHA Stadium II bis III)”. Austrian Journal of Cardiology 15 (1): 23–30. (2008).
- ^ “Bone marrow cells regenerate infarcted myocardium”. Nature 410 (6829): 701–5. (2001). doi:10.1038/35070587. PMID 11287958.
- ^ Kocher A. A.. “Neovascularization of ischemic myocardium by human bone-marrow-derived angioblasts prevents cardiomyocyte apoptosis, reduces remodeling and improves cardiac function”. Nature Medicine 7: 430–436. doi:10.1038/86498.
- ^ Kuswardhani R. A.; Soejitno A. (2011). “Bone marrow-derived stem cells as an adjunctive treatment for acute myocardial infarction: a systematic review and meta-analysis”. Acta medica Indonesiana 43 (3): 168–177. PMID 21979282.
- ^ “The stuttering progress of cell therapy for heart disease”. Clinical pharmacology and therapeutics 90 (4): 532–541. (2011). doi:10.1038/clpt.2011.175. PMID 21900888.
- ^ “Age-dependent availability and functionality of bone marrow stem cells in an experimental model of acute and chronic myocardial infarction”. Cell transplantation 20: 407–419. doi:10.3727/096368909X519283.
- ^ “Timing of bone marrow cell therapy is more important than repeated injections after myocardial infarction”. Cardiovascular Pathology 20: 204–212. doi:10.1016/j.carpath.2010.06.007.
- ^ Wang X.. “Donor myocardial infarction impairs the therapeutic potential of bone marrow cells by an interleukin-1-mediated inflammatory response”. Science Translational Medicine 3: 100ra90. doi:10.1126/scitranslmed.3002814.
- ^ “Interleukin-10 deficiency impairs bone marrow-derived endothelial progenitor cell survival and function in ischemic myocardium”. Circ. Res. 109 (11): 1280–9. (2011). doi:10.1161/CIRCRESAHA.111.248369. PMC 3235675. PMID 21959218.
- ^ “Functional Assessment of Adipose Stem Cells for Xenotransplantation Using Myocardial Infarction Immunocompetent Models: Comparison with Bone Marrow Stem Cells”. Cell Biochemistry and Biophysics 67: 263–273. doi:10.1007/s12013-011-9323-0.
- ^ Guinea pig hearts beat with human cells : Nature News & Comment
- ^ Francis, Darrel P (Oct 2013). Autologous bone marrow-derived stem cell therapy in heart disease: Discrepancies and contradictions. 168. Elsevier. pp. 3381–403. doi:10.1016/j.ijcard.2013.04.152. PMID 23830344 6 July 2013閲覧。.
- ^ “A minefield of contradictions”. Suddeutsche Zeitung. 6 July 2013閲覧。
- ^ Haider, HKh (June 2005). “Bone marrow stem cell transplantation for cardiac repair.”. American Journal of Physiology. Heart and Circulatory Physiology 288 (6): H2557-67. doi:10.1152/ajpheart.01215.2004. PMID 15897328.
- ^ “Towards regenerative therapy for cardiac disease”. The Lancet 379 (9819): 933–942. (2012). doi:10.1016/s0140-6736(12)60075-0.
- ^ “Ex vivo generation of fully mature human red blood cells from hematopoietic stem cells”. Nat. Biotechnol. 23 (1): 69–74. (January 2005). doi:10.1038/nbt1047. PMID 15619619.
- ^ “Technology”. London 24 May 2010閲覧。
- ^ “Scientists Grow Teeth Using Stem Cells”. 31 July 2014閲覧。
- ^ “Stem cells and tooth tissue engineering”. Cell Tissue Res. 331 (1): 359–72. (January 2008). doi:10.1007/s00441-007-0467-6. PMID 17938970.
- ^ “Stem cell-based biological tooth repair and regeneration”. Trends Cell Biol. 20: 715–22. (2010). doi:10.1016/j.tcb.2010.09.012. PMC 3000521. PMID 21035344.
- ^ “Specialized stem cell niche enables repetitive renewal of alligator teeth”. Proceedings of the National Academy of Sciences of the United States of America 110 (22): E2009–E2018. (2013). doi:10.1073/pnas.1213202110. PMC 3670376. PMID 23671090.
- ^ Gene therapy is first deafness 'cure' – health – 14 February 2005 – New Scientist
- ^ Fetal tissue restores lost sight MedicalNewsToday.
- ^ BBC NEWS | England | Southern Counties | Stem cells used to restore vision
- ^ “Adverse Effect of High Glucose Concentration on Stem Cell Therap”. Int J Hematol Oncol Stem Cell Res 7 (3): 34–40. (2013). PMC 3913149. PMID 24505533.
- ^ Goldstein, Ron (2007). Embryonic stem cell research is necessary to find a diabetes cure. Greenhaven Press. p. 44
- ^ “Regeneration of meniscus cartilage in a knee treated with percutaneously implanted autologous mesenchymal stem cells”. Med. Hypotheses 71 (6): 900–8. (December 2008). doi:10.1016/j.mehy.2008.06.042. PMID 18786777.
- ^ “Increased knee cartilage volume in degenerative joint disease using percutaneously implanted, autologous mesenchymal stem cells”. Pain Physician 11 (3): 343–53. (2008). PMID 18523506. オリジナルの2009年4月4日時点におけるアーカイブ。.
- ^ “Safety and complications reporting on the re-implantation of culture-expanded mesenchymal stem cells using autologous platelet lysate technique”. Curr Stem Cell Res Ther 5 (1): 81–93. (March 2010). doi:10.2174/157488810790442796. PMID 19951252.
- ^ “Repair of articular cartilage defects in the patello-femoral joint with autologous bone marrow mesenchymal cell transplantation: three case reports involving nine defects in five knees”. J Tissue Eng Regen Med 1 (1): 74–9. (2007). doi:10.1002/term.8. PMID 18038395.
- ^ “Progress and potential for regenerative medicine”. Annu. Rev. Med 58 (1): 299–312. (2007). doi:10.1146/annurev.med.58.082405.095329. PMID 17076602.
- ^ “Comparative evaluation of different in vitro systems that stimulate germ cell differentiation in human embryonic stem cells”. Fertil. Steril. 93 (3): 986–94. (December 2008). doi:10.1016/j.fertnstert.2008.10.030. PMID 19064262.
- ^ Ledford H (7 July 2009). “Sperm-like cells made from human embryonic stem cells”. Nature News. doi:10.1038/news.2009.646.
- ^ White, YAR (2012). “Oocyte formation by mitotically active germ cells purified from ovaries of reproductive-age women”. Nature Medicine 18 (3): 413–421. doi:10.1038/nm.2669. PMC 3296965. PMID 22366948.
- ^ Allers, Kristinia (14 July 2014). “Evidence for the cure of HIV infection by CCR5Δ32/Δ32 stem cell transplantation”. Blood 117 (10): 2791–2799. doi:10.1182/blood-2010-09-309591. PMID 21148083.
- ^ DiGiusto, David (22 November 2013). “Development of Hematopoietic Stem Cell Based Gene Therapy for HIV-1 Infection: Considerations for Proof of Concept Studies and Translation to Standard Medical Practice”. Viruses 2013 (5): 2898–2919. doi:10.3390/v5112898.
- ^ “Stem cells – where are we now?”. (27 January 2012)
- ^ “BioTime acquires stem cell assets from Geron, raises $10 million”. (7 January 2013)
- ^ Francois M et al., Cytotherapy.2012;14:147–152
- ^ “Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rats”. Stroke 32 (4): 1005–11. (April 2001). doi:10.1161/01.STR.32.4.1005. PMID 11283404.
- ^ “Transplantation of Progenitor Cells and Regeneration Enhancement in Acute Myocardial Infarction (TOPCARE-AMI)”. Circulation 106 (24): 3009–17. (December 2002). doi:10.1161/01.CIR.0000043246.74879.CD. PMID 12473544.
- ^ “Stem cell therapy in a caprine model of osteoarthritis”. Arthritis Rheum. 48 (12): 3464–74. (December 2003). doi:10.1002/art.11365. PMID 14673997.
- ^ “Mesoangioblast stem cells ameliorate muscle function in dystrophic dogs”. Nature 444 (7119): 574–9. (November 2006). doi:10.1038/nature05282. PMID 17108972.
- ^ “Mesenchymal stem cell therapy in equine musculoskeletal disease: scientific fact or clinical fiction?”. Equine Vet. J. 39 (2): 172–80. (March 2007). doi:10.2746/042516407X180868. PMID 17378447.
- ^ “Embryonic stem cells in companion animals (horses, dogs and cats): present status and future prospects”. Reprod. Fertil. Dev. 19 (6): 740–7. (2007). doi:10.1071/RD07039. PMID 17714628.
- ^ “Stem cell therapy for joint problems using the horse as a clinically relevant animal model”. Expert Opin Biol Ther 7 (11): 1621–6. (November 2007). doi:10.1517/14712598.7.11.1621. PMID 17961087.
- ^ “Stem cells in veterinary medicine—attempts at regenerating equine tendon after injury”. Trends Biotechnol. 25 (9): 409–16. (September 2007). doi:10.1016/j.tibtech.2007.07.009. PMID 17692415.
- ^ “Chondrogenesis, osteogenesis and adipogenesis of canine mesenchymal stem cells: a biochemical, morphological and ultrastructural study”. Histochem. Cell Biol. 128 (6): 507–20. (December 2007). doi:10.1007/s00418-007-0337-z. PMID 17922135.
- ^ “Autogenous injectable bone for regeneration with mesenchymal stem cells and platelet-rich plasma: tissue-engineered bone regeneration”. Tissue Eng. 10 (5–6): 955–64. (2004). doi:10.1089/1076327041348284. PMID 15265313.
- ^ “The leading edge of stem cell therapeutics”. Annu. Rev. Med. 58 (1): 313–28. (2007). doi:10.1146/annurev.med.58.070605.115252. PMID 17100553.
- ^ “Stem cell-based tissue engineering in veterinary orthopaedics”. Cell Tissue Res. 347 (3): 677–688. (2012). doi:10.1007/s00441-011-1316-1. PMID 22287044.
- ^ “Use of mesenchymal stem cells in a collagen matrix for Achilles tendon repair”. J. Orthop. Res. 16 (4): 406–13. (July 1998). doi:10.1002/jor.1100160403. PMID 9747780.
- ^ “Autologous mesenchymal stem cell-mediated repair of tendon”. Tissue Eng. 5 (3): 267–77. (June 1999). doi:10.1089/ten.1999.5.267. PMID 10434073.
- ^ “The effect of implants loaded with autologous mesenchymal stem cells on the healing of canine segmental bone defects”. J Bone Joint Surg Am 80 (7): 985–96. (July 1998). PMID 9698003.
- ^ Zachos TA, Smith TJ (September 2008).
- ^ “Mesenchymal stem cells and bone regeneration”. Vet Surg 35 (3): 232–42. (April 2006). doi:10.1111/j.1532-950X.2006.00142.x. PMID 16635002.
- ^ Kane, Ed (May 2008).
- ^ “Stem cells and veterinary medicine: tools to understand diseases and enable tissue regeneration and drug discovery”. Vet. J. 191 (1): 19–27. (2012). doi:10.1016/j.tvjl.2011.08.007. PMID 21958722.
- ^ “Cell-based therapy in the repair of osteochondral defects: a novel use for adipose tissue”. Tissue Eng. 9 (4): 733–44. (August 2003). doi:10.1089/107632703768247412. PMID 13678450.
- ^ “Fat tissue: an underappreciated source of stem cells for biotechnology”. Trends Biotechnol. 24 (4): 150–4. (April 2006). doi:10.1016/j.tibtech.2006.01.010. PMID 16488036.
- ^ “Adipose tissue-derived stromal cells as a novel option for regenerative cell therapy”. J. Atheroscler. Thromb. 13 (2): 77–81. (April 2006). doi:10.5551/jat.13.77. PMID 16733294.
- ^ “Peripheral nerve regeneration using autologous porcine skin-derived mesenchymal stem cells”. J Tissue Eng Regen Med 6 (2): 113–24. (2012). doi:10.1002/term.404. PMID 21337707.
- ^ “Blood derived stem cells: an ameliorative therapy in veterinary ophthalmology”. J. Cell. Physiol. 227 (3): 1250–6. (2012). doi:10.1002/jcp.22953. PMID 21792938.
- ^ “Effects of transplanted mesenchymal stem cells isolated from Wharton's jelly of caprine umbilical cord on cutaneous wound healing; histopathological evaluation”. Vet. Res. Commun. 35 (4): 211–22. (2011). doi:10.1007/s11259-011-9464-z. PMID 21340694.
- ^ “Successful engraftment of cultured autologous mesenchymal stem cells in a surgically repaired soft palate defect in an adult horse”. The Canadian Journal of Veterinary Research 70 (2): 143–147. (2006). PMC 1410720. PMID 16639947.
- ^ “Effect of intraarticular injection of autologous adipose-derived mesenchymal stem and regenerative cells on clinical signs of chronic osteoarthritis of the elbow joint in dogs”. Vet. Ther. 9 (3): 192–200. (2008). PMID 19003780.
- ^ “Effect of adipose-derived nucleated cell fractions on tendon repair in horses with collagenase-induced tendinitis”. Am. J. Vet. Res. 69 (7): 928–37. (July 2008). doi:10.2460/ajvr.69.7.928. PMID 18593247.
- ^ “Production of canine mesenchymal stem cells from adipose tissue and their application in dogs with chronic osteoarthritis of the humeroradial joints”. Cell Biol. Int. 36 (2): 189–94. (2012). doi:10.1042/CBI20110304. PMID 21936851.
- ^ Basic Science and Clinical Application of Stem Cells in Veterinary Medicine. (2010). pp. 219–263. doi:10.1007/10_2010_66.
- ^ “Homing of adipose-derived stem cells to radiofrequency catheter ablated canine atrium and differentiation into cardiomyocyte-like cells”. Int. J. Cardiol. 146 (3): 371–8. (2011). doi:10.1016/j.ijcard.2009.07.016. PMID 19683815.
- ^ “Tissue regeneration observed in a basic fibroblast growth factor–loaded porous acellular bovine pericardium populated with mesenchymal stem cells”. The Journal of Thoracic and Cardiovascular Surgery 134 (1): 65–73.e4. (2007). doi:10.1016/j.jtcvs.2007.02.019. ISSN 0022-5223.
- ^ Sung Su Park (2012). “Functional recovery after spinal cord injury in dogs treated with a combination of Matrigel and neural-induced adipose-derived mesenchymal Stem cells”. Cytotherapy 14 (5): 584–597. doi:10.3109/14653249.2012.658913. PMID 22348702.
- ^ “Functional recovery and neural differentiation after transplantation of allogenic adipose-derived stem cells in a canine model of acute spinal cord injury”. J. Vet. Sci. 10 (4): 273–84. (2009). doi:10.4142/jvs.2009.10.4.273. PMC 2807262. PMID 19934591.
- ^ “Safety of Autologous Bone Marrow Stromal Cell Transplantation in Dogs with Acute Spinal Cord Injury”. Veterinary Surgery 41 (4): 437–442. (2012). doi:10.1111/j.1532-950X.2011.00959.x. ISSN 0161-3499.
- ^ “Germ cell transplantation for the propagation of companion animals, non-domestic and endangered species”. Reproduction, Fertility, and Development 19: 732–739. (2007). doi:10.1071/RD07036.
- ^ Health, Wellness, Nutrition and Anti-Aging Integrative Medicine Experts & Information – Superior Raw Super Food Supplements – Online Wellness Community
- ^ Mlsna, Lucas J. (2010). “Stem Cell Based Treatments and Novel Considerations for Conscience Clause Legislation”. Indiana Health Law Review (Indiana University Robert H. McKinney School of Law) 8 (2): 471–496.
- ^ “Cellular transplants in China: observational study from the largest human experiment in chronic spinal cord injury”. Neurorehabil Neural Repair 20 (1): 5–13. (2006). doi:10.1177/1545968305284675. PMC 4169140. PMID 16467274.
- ^ http://www.regentime.com
- ^ “Stem cells tailored to patients”. (20 May 2005) 24 May 2010閲覧。
- ^ “Hematopoietic stem cell development, niches, and signaling pathways”. Bone Marrow Research 2012: 12–16. (June 2012). doi:10.1155/2012/270425. PMC 3413998. PMID 22900188.
