tert-ブチルチオール
| tert-ブチルチオール tert-Butylthiol | |
|---|---|

| |

| |
2-Methylpropane-2-thiol | |
別称 tert-ブチルメルカプタン 2-メチル-2-プロパンチオール | |
| 識別情報 | |
| 略称 | TBM t-BuSH |
| CAS登録番号 | 75-66-1 |
| PubChem | 6387 |
| ChemSpider | 6147 |
| UNII | 489PW92WIV |
| |
| |
| 特性 | |
| 化学式 | C4H10S |
| モル質量 | 90.19 g mol−1 |
| 外観 | 無色透明の液体 |
| 匂い | 刺激臭[1] |
| 嗅覚閾値 | 0.000029ppm[3] |
| 密度 | 0.8 g/mL |
| 融点 |
-1℃[2] |
| 沸点 |
64℃[2] |
| 水への溶解度 | 水に微溶、アルコール・エーテル、液化硫化水素に易溶[1] |
| 危険性 | |
| 引火点 | -26℃[1] |
| 発火点 | 253℃[1] |
| 爆発限界 | 1.3 - 8.7 %[1] |
| 半数致死量 LD50 | 4,729 mg/kg(ラット、経口)[1] |
| 関連する物質 | |
| 関連するチオール | 1-ブタンチオール 2-ブタンチオール 1-プロパンチオール 2-プロパンチオール エタンチオール |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
tert-ブチルチオールは、化学式(CH3)3CSHで表される有機硫黄化合物の一つである。2-メチルプロパン-2-チオール、2-メチル-2-プロパンチオール、tert-ブチルメルカプタンなどの別名がある。都市ガスの着臭剤の原料として使われる[4]
生成[編集]
1890年に、レナード・ドビンが硫化亜鉛とtert-ブチルクロリドを反応させることにより初めて製造に成功した[5]。1932年には、下記のようにグリニャール試薬t-BuMgClと硫黄を反応させたのちに加水分解することにより製造する方法が発見された[6]。
- t-BuMgCl + S → t-BuSMgCl
- t-BuSMgCl + H2O → t-BuSH + Mg(OH)Cl
工業的には、イソブチレンと硫化水素をシリカアルミナ触媒上で反応させることにより生産される[7]。
調理したジャガイモにごく微量が含まれるとする文献もあるが[8]、tert-ブチル基を持つ化合物が天然物に含まれることは極めて稀であることから、他の文献はこれに懐疑的である。
反応[編集]
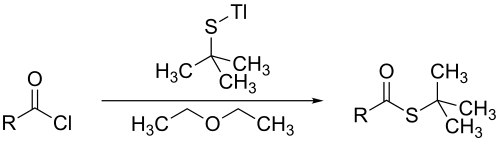
下図のように金属アルコキシドおよび塩化アシルと反応して、チオールエステルを形成する[9]。
上記の反応では、タリウム(I)エトキシドがタリウム(I) t-ブチルチオレートに変換され、ジエチルエーテルの存在下で塩化アシルと反応し、対応する tert-ブチルチオエステルを生成する[9]。他のチオエステルと同様に、加水分解により tert-ブチルチオールとなる[10]。
2-メチルプロパン-2-チオラートリチウムは、ヘキサメチルリン酸トリアミド(HMPA)などの非プロトン溶媒中で、tert-ブチルチオールを水素化リチウムで処理することにより調製することができる。得られたチオラート塩は有用な脱メチル化試薬となる。例えば、7-メチルグアノシンで処理すると、グアノシンが得られる。tRNAに含まれる他のN-メチル化ヌクレオシドは、この試薬では脱メチル化されない[11]。
錯体[編集]
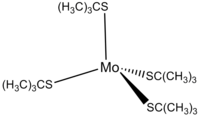
tert-ブチルチオールから得られるアニオンは、様々な金属と錯体を形成する。一例に、テトラキス(tert-ブチルチオレート)モリブデン(IV)、Mo(t-BuS)4がある。この錯体は、MoCl4をt-BuSLiで処理することにより調製される[12]。
- MoCl4 + 4 t-BuSLi → Mo(t-BuS)4 + 4 LiCl
Mo(t-BuS)4は暗赤色の反磁性錯体で、空気と湿気に敏感である。中心のモリブデンが4つの硫黄原子に囲まれた、歪んだ四面体形分子構造をしており、全体として分子対称性はD2である[12]。
安全性[編集]
引火点は-26℃で、日本の消防法では危険物第4類第一石油類に該当する[1]。嗅覚閾値は0.000029ppmと、極めて強い臭気を持つ物質であり、取り扱いには注意を要する[3]。
利用[編集]
ジメチルスルフィド、メチルエチルスルフィド、テトラヒドロチオフェン、または2-プロパンチオール、1-ブタンチオール、2-ブタンチオールなどとブレンドして、ガス燃料の着臭剤として使用される。tert-ブチルチオールの融点は-1℃[2]ほどで、プロパンの沸点-42℃より高い。プロパンガスに使用した場合には気液平衡により蒸気中の臭気物質の混合量が減少するため、天然ガスにのみ使用される。
香料として欧州食品安全機関のリスト(FL-no: 12.174)に掲載されていたが、どのフレーバーに使用されたかは明記されていない。このリストからは削除されている[13]。
脚注[編集]
- ^ a b c d e f g “tert-ブチルメルカプタン”. 厚生労働省職場のあんぜんサイト (2018年3月16日). 2022年11月6日閲覧。
- ^ a b c “製品コードM0405 tert-ブチルメルカプタン”. 東京化成工業 (2022年3月20日). 2022年11月6日閲覧。
- ^ a b 三点比較式臭袋法による嗅覚閾値 (PDF) 永田好男ら調べ
- ^ “tert-butyl mercaptan”. thegoodscentscompany.com. 2022年11月6日閲覧。
- ^ Dobbin, Leonard (1890). “On tertiary Butyl Mercaptan”. Journal of the Chemical Society, Transactions 57: 639–643. doi:10.1039/ct8905700639.
- ^ Rheinboldt, Heinrich; Mott, Friedrich; Motzkus, Erwin; A. D. McMaster; B. M. Mattson; S. T. Michel (1932). “Tertiäres Butylmercaptan”. Journal für Praktische Chemie 134 (9–12): 257–281. doi:10.1002/prac.19321340901.
- ^ Schulze, W.A.; Lyon, J.P. & Short, G.H. (1948). “Synthesis of Tertiary Alkyl Mercaptans”. Industrial and Engineering Chemistry (American Chemical Society) 40 (12): 2308–2313. doi:10.1021/ie50468a019.
- ^ Gumbmann, M. R.; Burr, H. K. (1964). “Food Flavors and Odors, Volatile Sulfur Compounds in Potatoes”. Journal of Agricultural and Food Chemistry 12 (5): 404–408. doi:10.1021/jf60135a004.
- ^ a b Spessard, Gary O.; Chan, Wan Kit; Masamune, S. (1990). “Preparation of thiol esters: s-tert-butyl cyclohexanecarbothioate and s-tert-butyl 3α,7α,12α-trihydroxy-5β-cholane-24-thioate”. Organic Syntheses 7: 87. doi:10.1002/0471264180.os061.28. ISBN 0471264229.
- ^ “2-propanethiol, 2-methyl-”. National Institute of Standards and Technology. 2022年11月9日閲覧。
- ^ Ho, Tse-Lok; Fieser, Mary; Fieser, Louis (2006). “Lithium 2-methylpropane-2-thiolate”. Fieser and Fieser's Reagents for Organic Synthesis. doi:10.1002/9780471264194.fos06530. ISBN 0471264199.
- ^ a b Otsuka, Sei; Kamata, Masato; Hirotsu, Ken; Higuchi, Taiichi (1981). “A Novel Molybdenum Thiolato Compound, Tetrakis(tert-butylthiolato)molybdenum(IV). Preparation and Crystal and Molecular Structure”. Journal of the American Chemical Society 103 (11): 3011–3014. doi:10.1021/ja00401a017.
- ^ “Scientific Opinion on Flavouring Group Evaluation 8, Revision 3 (FGE.08Rev3): Aliphatic and alicyclic mono-, di-, tri-, and polysulphides with or without additional oxygenated functional groups from chemical groups 20 and 30”. EFSA. 2013年4月15日閲覧。