「顆粒球マクロファージコロニー刺激因子」の版間の差分
m編集の要約なし |
m Utataneko がページ「GM-CSF」を「顆粒球マクロファージコロニー刺激因子」に、リダイレクトを残して移動しました: 正式名で。 |
||
| (同じ利用者による、間の2版が非表示) | |||
| 1行目: | 1行目: | ||
{{Infobox_gene}} |
|||
| ⚫ | |||
{{Infobox protein family |
|||
[[File: 1csg.jpg|thumb|Granulocyte macrophage colony-stimulating factor, Human (PDB: [https://www.rcsb.org/structure/1csg 1CSG]).]] |
|||
| Symbol = GM_CSF |
|||
'''GM-CSF'''(''Granulocyte Macrophage colony-stimulating Factor'':'''顆粒球マクロファージコロニー刺激因子''')は、多能性[[造血幹細胞]]に[[分化]]を促す[[サイトカイン]]の一種<ref>{{Cite journal|last=Root|first=R. K.|last2=Dale|first2=D. C.|date=March 1999|title=Granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor: comparisons and potential for use in the treatment of infections in nonneutropenic patients|url=https://www.ncbi.nlm.nih.gov/pubmed/10081506|journal=The Journal of Infectious Diseases|volume=179 Suppl 2|pages=S342–352|doi=10.1086/513857|issn=0022-1899|pmid=10081506}}</ref>。 |
|||
| Name = Granulocyte-macrophage colony-stimulating factor |
|||
| image = PDB 1csg EBI.jpg |
|||
| width = |
|||
| caption = three-dimensional structure of [[recombinant DNA|recombinant]] human granulocyte-macrophage colony-stimulating factor (rhGM_CSF) |
|||
| Pfam = PF01109 |
|||
| Pfam_clan = CL0053 |
|||
| InterPro = IPR000773 |
|||
| SMART = |
|||
| PROSITE = PDOC00584 |
|||
| MEROPS = |
|||
| SCOP = 2gmf |
|||
| TCDB = |
|||
| OPM family = |
|||
| OPM protein = |
|||
| CAZy = |
|||
| CDD = |
|||
}} |
|||
{{Drugbox |
|||
| Verifiedfields = changed |
|||
| verifiedrevid = 476997210 |
|||
| IUPAC_name = Human granulocyte macrophage colony stimulating factor |
|||
| image = GMCSF_Crystal_Structure.rsh.png |
|||
<!-- Clinical data --> |
|||
| tradename = |
|||
<!-- Identifiers --> |
|||
| CAS_number_Ref = {{cascite|correct|??}} |
|||
| CAS_number = 83869-56-1 |
|||
| ATC_prefix = L03 |
|||
| ATC_suffix = AA09 |
|||
| DrugBank_Ref = {{drugbankcite|changed|drugbank}} |
|||
| DrugBank = DB00020 |
|||
| ChemSpiderID_Ref = {{chemspidercite|changed|chemspider}} |
|||
| ChemSpiderID = none |
|||
<!-- Chemical data --> |
|||
| C=639 | H=1006 | N=168 | O=196 | S=8 |
|||
}} |
|||
'''顆粒球マクロファージコロニー刺激因子'''(granulocyte-macrophage colony-stimulating factor;'''GM-CSF''')または'''コロニー刺激因子2'''(colony stimulating factor 2;'''CSF2''')は、[[マクロファージ]]、[[T細胞]]、[[肥満細胞]]、[[ナチュラルキラー細胞]]、[[内皮細胞]]、[[線維芽細胞]]などから分泌される単量体の糖タンパク質であり、[[サイトカイン]]として機能する。 |
|||
IL([[インターロイキン]])-3,5などと協力し、多能性造血幹細胞を骨髄系前駆細胞(CFU-GEMM)に分化させ、これを前期赤芽球系前駆細胞(BFU-E)、[[顆粒球]]単球コロニー形成細胞(CFU-GM)、好酸球コロニー形成細胞(CFU-Eo)、好塩基球コロニー形成細胞(CFU-Ba)らに分化させる。更に、CFU-GMを[[好中球]]と[[単球]]に、CFU-Eoを[[好酸球]]に分化させる働きを持つ。(CFU-BaはIL-3,5により[[好塩基球]]に誘導される) |
|||
好中球の増殖と成熟を特異的に促進する[[顆粒球コロニー刺激因子]]とは異なり、GM-CSFはより多くの種類の細胞に作用する<ref name="pmid10081506">{{cite journal | vauthors = Root RK, Dale DC | title = Granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor: comparisons and potential for use in the treatment of infections in nonneutropenic patients | journal = The Journal of Infectious Diseases | volume = 179 Suppl 2 | issue = Suppl 2 | pages = S342-52 | date = March 1999 | pmid = 10081506 | doi = 10.1086/513857 | doi-access = free }}</ref>。 |
|||
Th細胞等が産生していることがわかっている。 |
|||
この様に主に細胞性[[免疫]]の主役である[[白血球]](顆粒球、単球)の分化誘導作用をもつ為、免疫賦活や[[骨髄]]刺激に用いられる事もある<ref>{{Cite journal|last=Armitage|first=J. O.|date=1998-12-15|title=Emerging applications of recombinant human granulocyte-macrophage colony-stimulating factor|url=https://www.ncbi.nlm.nih.gov/pubmed/9845514|journal=Blood|volume=92|issue=12|pages=4491–4508|issn=0006-4971|pmid=9845514}}</ref>。Th細胞等が産生している事が知られている。 |
|||
天然由来GM-CSFの[[アナログ (化学)|類縁物質]]医薬品は{{仮リンク|サルグラモスチム|en|Sargramostim}}や{{仮リンク|モルグラモスチム|en|Molgramostim}}と呼ばれている。 |
|||
== 機能 == |
|||
GM-CSFは、[[サイトカイン]]として機能する単量体の糖タンパク質であり、[[白血球]]の[[成長因子]]である<ref name="pmid24264600">{{cite journal | vauthors = Francisco-Cruz A, Aguilar-Santelises M, Ramos-Espinosa O, Mata-Espinosa D, Marquina-Castillo B, Barrios-Payan J, Hernandez-Pando R | title = Granulocyte-macrophage colony-stimulating factor: not just another haematopoietic growth factor | journal = Medical Oncology | volume = 31 | issue = 1 | pages = 774 | date = January 2014 | pmid = 24264600 | doi = 10.1007/s12032-013-0774-6 | s2cid = 24452892 }}</ref>。GM-CSFは、IL([[インターロイキン]])-3,5などと協力し、[[多能性造血幹細胞]]を[[骨髄系前駆細胞]](CFU-GEMM)に分化させ、これを[[前期赤芽球系前駆細胞]] (BFU-E)、[[顆粒球単球コロニー形成細胞]] (CFU-GM)、[[好酸球コロニー形成細胞]] (CFU-Eo)、[[好塩基球コロニー形成細胞]] (CFU-Ba) 等に分化させる。更に、CFU-GMを[[好中球]]と[[単球]]に、CFU-Eoを[[好酸球]]に分化させる働きを持つ。(CFU-BaはIL-3,5により[[好塩基球]]に誘導される。)[[単球]]は循環系を出て組織内に移動し、[[マクロファージ]]や[[樹状細胞]]に成熟する。このように、GM-CSFは免疫・炎症カスケードの一部であり、少数のマクロファージを活性化する事で、[[感染症]]との戦いに不可欠なマクロファージの数を急速に増加させる事が出来る。 |
|||
GM-CSFは、免疫系の成熟細胞にも作用する。例えば、好中球の移動を促進したり、細胞表面に発現している受容体を変化させる等の作用がある<ref>{{cite journal | vauthors = Gasson JC | title = Molecular physiology of granulocyte-macrophage colony-stimulating factor | journal = Blood | volume = 77 | issue = 6 | pages = 1131–45 | date = March 1991 | pmid = 2001448 | doi = 10.1182/blood.V77.6.1131.1131 | doi-access = free }}</ref>。 |
|||
GM-CSFは、シグナル伝達および転写の活性化因子である[[STAT5]]を介してシグナルを伝達する<ref name="pmid23042651">{{cite journal | vauthors = Voehringer D | title = Basophil modulation by cytokine instruction | journal = European Journal of Immunology | volume = 42 | issue = 10 | pages = 2544–50 | date = October 2012 | pmid = 23042651 | doi = 10.1002/eji.201142318 }}</ref>。マクロファージでは、[[STAT3]]を介してシグナルを送る事も示されている。このサイトカインはマクロファージを活性化し、[[真菌]]の生存を阻害する。GM-CSFは、細胞内の遊離亜鉛を減少させ、[[活性酸素]]の産生を増加させ、真菌の亜鉛飢餓と毒性を引き起こす<ref name="pmid24138881">{{cite journal | vauthors = Subramanian Vignesh K, Landero Figueroa JA, Porollo A, Caruso JA, Deepe GS | title = Granulocyte macrophage-colony stimulating factor induced Zn sequestration enhances macrophage superoxide and limits intracellular pathogen survival | journal = Immunity | volume = 39 | issue = 4 | pages = 697–710 | date = October 2013 | pmid = 24138881 | pmc = 3841917 | doi = 10.1016/j.immuni.2013.09.006 }}</ref>。この様に、GM-CSFは、免疫系の発達を促し、感染症に対する防御を促進する。 |
|||
また、GM-CSFは、生殖器官で産生される{{仮リンク|エンブリオカイン|en|Embryokine}}として機能する事で、胚の発生にも一役買っている<ref name="pmid24954585">{{cite journal | vauthors = Hansen PJ, Dobbs KB, Denicol AC | title = Programming of the preimplantation embryo by the embryokine colony stimulating factor 2 | journal = Animal Reproduction Science | volume = 149 | issue = 1-2 | pages = 59–66 | date = September 2014 | pmid = 24954585 | doi = 10.1016/j.anireprosci.2014.05.017 }}</ref>。 |
|||
== 遺伝学 == |
|||
ヒトの遺伝子は、[[染色体]]領域5q31の2型[[ヘルパーT細胞|ヘルパーT]]関連サイトカイン[[遺伝子クラスター]]内の{{仮リンク|インターロイキン-3|en|Interleukin 3}}遺伝子に近接して配置されており、[[5q-症候群]]や[[急性骨髄性白血病]]の中間部欠失と関連する事が知られている。GM-CSFとIL-3は[[インスレーター (遺伝学)|隔離]]要素で分離されている為、独立して制御されている<ref name="pmid19158269">{{cite journal | vauthors = Bowers SR, Mirabella F, Calero-Nieto FJ, Valeaux S, Hadjur S, Baxter EW, Merkenschlager M, Cockerill PN | display-authors = 6 | title = A conserved insulator that recruits CTCF and cohesin exists between the closely related but divergently regulated interleukin-3 and granulocyte-macrophage colony-stimulating factor genes | journal = Molecular and Cellular Biology | volume = 29 | issue = 7 | pages = 1682–93 | date = April 2009 | pmid = 19158269 | pmc = 2655614 | doi = 10.1128/MCB.01411-08 }}</ref>。その他、[[インターロイキン-4]]、[[インターロイキン-5|5]]、{{仮リンク|インターロイキン-13|en|Interleukin 13|label=13}}をコードする遺伝子も含まれている<ref>{{cite web|title=Entrez Gene: CSF2 colony stimulating factor 2 (granulocyte-macrophage)|url=https://www.ncbi.nlm.nih.gov/sites/entrez?Db=gene&Cmd=ShowDetailView&TermToSearch=1437|accessdate=2021-12-08}}</ref>。 |
|||
== 糖鎖付加 == |
|||
ヒト顆粒球マクロファージコロニー刺激因子は、成熟型ではグリコシル化(糖鎖付加)されている。 |
|||
== 臨床的意義 == |
|||
GM-CSFは[[関節リウマチ]]の関節で高濃度に検出されるので、[[生物学的標的]]としてのGM-CSFを遮断する事による炎症や損傷の軽減が期待されている<ref name="pmid23448220">{{cite journal|date=March 2013|title=Treating multiple sclerosis with monoclonal antibodies: a 2013 update|journal=Expert Review of Neurotherapeutics|volume=13|issue=3|pages=313–35|doi=10.1586/ern.13.17|pmid=23448220|vauthors=Deiß A, Brecht I, Haarmann A, Buttmann M|s2cid=169334}}</ref>。GM-CSFを阻害する薬剤({{仮リンク|オチリマブ|en|Otilimab}}等)が開発されている。 |
|||
重症患者において、GM-CSFは免疫抑制状態に対する薬剤として試行されており、[[単球]]<ref>{{cite journal|date=October 2009|title=Granulocyte-macrophage colony-stimulating factor to reverse sepsis-associated immunosuppression: a double-blind, randomized, placebo-controlled multicenter trial|journal=American Journal of Respiratory and Critical Care Medicine|volume=180|issue=7|pages=640–8|doi=10.1164/rccm.200903-0363OC|pmid=19590022|vauthors=Meisel C, Schefold JC, Pschowski R, Baumann T, Hetzger K, Gregor J, Weber-Carstens S, Hasper D, Keh D, Zuckermann H, Reinke P, Volk HD|display-authors=6}}</ref>および[[好中球]]<ref>{{cite journal|date=October 2018|title=Randomised controlled trial of GM-CSF in critically ill patients with impaired neutrophil phagocytosis|journal=Thorax|volume=73|issue=10|pages=918–925|doi=10.1136/thoraxjnl-2017-211323|pmid=30064991|pmc=6166597|vauthors=Pinder EM, Rostron AJ, Hellyer TP, Ruchaud-Sparagano MH, Scott J, Macfarlane JG, Wiscombe S, Widdrington JD, Roy AI, Linnett VC, Baudouin SV, Wright SE, Chadwick T, Fouweather T, Juss JK, Chilvers ER, Bowett SA, Parker J, McAuley DF, Conway Morris A, Simpson AJ|display-authors=6}}</ref>の機能を回復させる事が期待されているが、患者の転帰への影響は現在の処不明であり、大規模な研究が待たれる。 |
|||
GM-CSFは、単球や[[マクロファージ]]を刺激して、{{仮リンク|CCL17|en|CCL17}}などの炎症性サイトカインを産生する<ref name="pmid33150139" />。GM-CSFの上昇は、[[炎症性関節炎]]、[[変形性関節症]]、[[大腸炎]]、[[気管支喘息|喘息]]、[[肥満]]、[[新型コロナウイルス感染症 (2019年)|COVID-19]]等の炎症に寄与する事が示されている<ref name="pmid33150139" /><ref name="Thwaites">{{cite journal|date=March 2021|title=Inflammatory profiles across the spectrum of disease reveal a distinct role for GM-CSF in severe COVID-19|journal=Science Immunology|volume=6|issue=57|pages=eabg9873|doi=10.1126/sciimmunol.abg9873|pmid=33692097|vauthors=Thwaites RS, Sanchez Sevilla Uruchurtu A, Siggins MK, Liew F, Russell CD, Moore SC, Fairfield C, Carter E, Abrams S, Short CE, Thaventhiran T, Bergstrom E, Gardener Z, Ascough S, Chiu C, Docherty AB, Hunt D, Crow YJ, Solomon T, Taylor GP, Turtle L, Harrison EM, Dunning J, Semple MG, Baillie JK, Openshaw PJ|display-authors=6|doi-access=free}}</ref><ref>{{cite journal|date=February 2021|title=Clonal expansion and activation of tissue-resident memory-like Th17 cells expressing GM-CSF in the lungs of severe COVID-19 patients|journal=Science Immunology|volume=6|issue=56|doi=10.1126/sciimmunol.abf6692|pmid=33622974|vauthors=Zhao Y, Kilian C, Turner JE, Bosurgi L, Roedl K, Bartsch P, Gnirck AC, Cortesi F, Schultheiß C, Hellmig M, Enk LU, Hausmann F, Borchers A, Wong MN, Paust HJ, Siracusa F, Scheibel N, Herrmann M, Rosati E, Bacher P, Kylies D, Jarczak D, Lütgehetmann M, Pfefferle S, Steurer S, Zur-Wiesch JS, Puelles VG, Sperhake JP, Addo MM, Lohse AW, Binder M, Huber S, Huber TB, Kluge S, Bonn S, Panzer U, Gagliani N, Krebs CF|display-authors=6|doi-access=free}}</ref>。 |
|||
== 医薬品開発 == |
|||
GM-CSFが最初にクローン化されたのは1985年の事で、その後直ぐに組換えDNA技術を用いて3種類の医薬品候補が作られた。{{仮リンク|モルグラモスチム|en|Molgramostim}}<ref>{{cite web|title=Molgramostim|url=https://adisinsight.springer.com/drugs/800004167|publisher=AdisInsight|access-date=3 April 2018|language=en}}</ref>は[[大腸菌]]で作られ、グリコシル化されていない。{{仮リンク|サルグラモスチム|en|Sargramostim}}<ref name="back">{{cite journal|last1=Staff|title=Back to the Future: Original Liquid Leukine® Coming Soon|journal=Oncology Business Review|date=May 2008|url=https://obroncology.com/documents/OBR_may08_LEUKINE.pdf|access-date=2016-08-29|archive-url=https://web.archive.org/web/20160825034301/https://obroncology.com/documents/OBR_may08_LEUKINE.pdf|archive-date=2016-08-25|url-status=dead}}</ref>は酵母で作られ、23位にプロリンの代わりにロイシンがあり、多少グリコシル化されている。[[レグラモスチム]]<ref>{{cite journal | vauthors = Hussein AM, Ross M, Vredenburgh J, Meisenberg B, Hars V, Gilbert C, Petros WP, Coniglio D, Kurtzberg J, Rubin P | display-authors = 6 | title = Effects of granulocyte-macrophage colony stimulating factor produced in Chinese hamster ovary cells (regramostim), Escherichia coli (molgramostim) and yeast (sargramostim) on priming peripheral blood progenitor cells for use with autologous bone marrow after high-dose chemotherapy | journal = European Journal of Haematology | volume = 55 | issue = 5 | pages = 348–56 | date = November 1995 | pmid = 7493686 | doi = 10.1111/j.1600-0609.1995.tb00713.x | s2cid = 25424116 }}</ref>は[[チャイニーズハムスター卵巣細胞]](CHO)で作られ、サルグラモスチムよりもグリコシル化されている。グリコシル化の量は、身体と薬剤とがどのように相互作用するかに影響する<ref>{{cite journal | vauthors = Armitage JO | title = Emerging applications of recombinant human granulocyte-macrophage colony-stimulating factor | journal = Blood | volume = 92 | issue = 12 | pages = 4491–508 | date = December 1998 | pmid = 9845514 | doi = 10.1182/blood.V92.12.4491 | url = http://www.bloodjournal.org/content/bloodjournal/92/12/4491.full.pdf?sso-checked=true }}</ref>。 |
|||
{{仮リンク|タリモジン ラヘルパレプベク|en|talimogene laherparepvec}}は、2015年10月に米国FDAから<ref>{{cite web |url=https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/imlygic-talimogene-laherparepvec |title=IMLYGIC (talimogene laherparepvec) |author= U.S. Food & Drug Administration |publisher=fda.gov |access-date=17 December 2019}}</ref>、2015年12月にEMAから、腫瘍溶解性ウイルス療法として承認された。この{{仮リンク|腫瘍溶解性ヘルペスウイルス|en|Oncolytic herpes virus}}は、腫瘍細胞の機構を利用してヒトGM-CSFを発現するように遺伝子工学的に設計されている<ref>{{cite journal | vauthors = Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N, Chesney J, Delman KA, Spitler LE, Puzanov I, Agarwala SS, Milhem M, Cranmer L, Curti B, Lewis K, Ross M, Guthrie T, Linette GP, Daniels GA, Harrington K, Middleton MR, Miller WH, Zager JS, Ye Y, Yao B, Li A, Doleman S, VanderWalde A, Gansert J, Coffin RS | display-authors = 6 | title = Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma | journal = Journal of Clinical Oncology | volume = 33 | issue = 25 | pages = 2780–8 | date = September 2015 | pmid = 26014293 | doi = 10.1200/JCO.2014.58.3377 }}</ref>。 |
|||
==臨床試験== |
|||
GM-CSFに対する[[モノクローナル抗体]]は、[[関節リウマチ]]、[[強直性脊椎炎]]、[[新型コロナウイルス感染症 (2019年)|COVID-19]]などに対する臨床試験で治療薬として使用されている<ref name="pmid33150139">{{cite journal | vauthors = Lee KM, Achuthan AA, Hamilton JA | title = GM-CSF: A Promising Target in Inflammation and Autoimmunity | journal = ImmunoTargets and Therapy | volume = 9 | pages = 225–240 | year = 2020 | pmid = 33150139 | pmc = 7605919 | doi = 10.2147/ITT.S262566 }}</ref>。 |
|||
== 関連項目 == |
|||
* [[マクロファージコロニー刺激因子]](M-CSF) |
|||
* [[顆粒球コロニー刺激因子]](G-CSF) |
|||
* {{仮リンク|顆粒球マクロファージ前駆細胞|en|CFU-GM}}(CFU-GM) |
|||
* {{仮リンク|顆粒球マクロファージコロニー刺激因子受容体|en|Granulocyte-macrophage colony-stimulating factor receptor}} |
|||
*{{仮リンク|サルグラモスチム|en|Sargramostim}} |
|||
*{{仮リンク|モルグラモスチム|en|Molgramostim}} |
|||
== 脚注 == |
== 脚注 == |
||
{{reflist}} |
{{reflist}} |
||
== 外部リンク == |
|||
* [http://www.gm-csf.com/ Official gentaur web site] |
|||
* [http://www.leukine.com/ Official Leukine web site] |
|||
* {{MeshName|Granulocyte-Macrophage+Colony-Stimulating+Factor}} |
|||
| ⚫ | |||
[[Category:成長因子|GMCSF]] |
[[Category:成長因子|GMCSF]] |
||
2021年12月7日 (火) 09:58時点における最新版
| Granulocyte-macrophage colony-stimulating factor | |||||||||
|---|---|---|---|---|---|---|---|---|---|
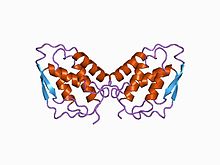 three-dimensional structure of recombinant human granulocyte-macrophage colony-stimulating factor (rhGM_CSF) | |||||||||
| 識別子 | |||||||||
| 略号 | GM_CSF | ||||||||
| Pfam | PF01109 | ||||||||
| Pfam clan | CL0053 | ||||||||
| InterPro | IPR000773 | ||||||||
| PROSITE | PDOC00584 | ||||||||
| SCOP | 2gmf | ||||||||
| SUPERFAMILY | 2gmf | ||||||||
| |||||||||
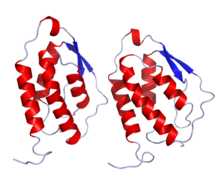 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 識別 | |
| CAS番号 |
83869-56-1 |
| ATCコード | L03AA09 (WHO) |
| DrugBank |
DB00020 |
| ChemSpider |
none |
| 化学的データ | |
| 化学式 | C639H1006N168O196S8 |
| 分子量 | 14,434.54 g·mol−1 |
顆粒球マクロファージコロニー刺激因子(granulocyte-macrophage colony-stimulating factor;GM-CSF)またはコロニー刺激因子2(colony stimulating factor 2;CSF2)は、マクロファージ、T細胞、肥満細胞、ナチュラルキラー細胞、内皮細胞、線維芽細胞などから分泌される単量体の糖タンパク質であり、サイトカインとして機能する。
好中球の増殖と成熟を特異的に促進する顆粒球コロニー刺激因子とは異なり、GM-CSFはより多くの種類の細胞に作用する[5]。
この様に主に細胞性免疫の主役である白血球(顆粒球、単球)の分化誘導作用をもつ為、免疫賦活や骨髄刺激に用いられる事もある[6]。Th細胞等が産生している事が知られている。
天然由来GM-CSFの類縁物質医薬品はサルグラモスチムやモルグラモスチムと呼ばれている。
機能[編集]
GM-CSFは、サイトカインとして機能する単量体の糖タンパク質であり、白血球の成長因子である[7]。GM-CSFは、IL(インターロイキン)-3,5などと協力し、多能性造血幹細胞を骨髄系前駆細胞(CFU-GEMM)に分化させ、これを前期赤芽球系前駆細胞 (BFU-E)、顆粒球単球コロニー形成細胞 (CFU-GM)、好酸球コロニー形成細胞 (CFU-Eo)、好塩基球コロニー形成細胞 (CFU-Ba) 等に分化させる。更に、CFU-GMを好中球と単球に、CFU-Eoを好酸球に分化させる働きを持つ。(CFU-BaはIL-3,5により好塩基球に誘導される。)単球は循環系を出て組織内に移動し、マクロファージや樹状細胞に成熟する。このように、GM-CSFは免疫・炎症カスケードの一部であり、少数のマクロファージを活性化する事で、感染症との戦いに不可欠なマクロファージの数を急速に増加させる事が出来る。
GM-CSFは、免疫系の成熟細胞にも作用する。例えば、好中球の移動を促進したり、細胞表面に発現している受容体を変化させる等の作用がある[8]。
GM-CSFは、シグナル伝達および転写の活性化因子であるSTAT5を介してシグナルを伝達する[9]。マクロファージでは、STAT3を介してシグナルを送る事も示されている。このサイトカインはマクロファージを活性化し、真菌の生存を阻害する。GM-CSFは、細胞内の遊離亜鉛を減少させ、活性酸素の産生を増加させ、真菌の亜鉛飢餓と毒性を引き起こす[10]。この様に、GM-CSFは、免疫系の発達を促し、感染症に対する防御を促進する。
また、GM-CSFは、生殖器官で産生されるエンブリオカインとして機能する事で、胚の発生にも一役買っている[11]。
遺伝学[編集]
ヒトの遺伝子は、染色体領域5q31の2型ヘルパーT関連サイトカイン遺伝子クラスター内のインターロイキン-3遺伝子に近接して配置されており、5q-症候群や急性骨髄性白血病の中間部欠失と関連する事が知られている。GM-CSFとIL-3は隔離要素で分離されている為、独立して制御されている[12]。その他、インターロイキン-4、5、13をコードする遺伝子も含まれている[13]。
糖鎖付加[編集]
ヒト顆粒球マクロファージコロニー刺激因子は、成熟型ではグリコシル化(糖鎖付加)されている。
臨床的意義[編集]
GM-CSFは関節リウマチの関節で高濃度に検出されるので、生物学的標的としてのGM-CSFを遮断する事による炎症や損傷の軽減が期待されている[14]。GM-CSFを阻害する薬剤(オチリマブ等)が開発されている。
重症患者において、GM-CSFは免疫抑制状態に対する薬剤として試行されており、単球[15]および好中球[16]の機能を回復させる事が期待されているが、患者の転帰への影響は現在の処不明であり、大規模な研究が待たれる。
GM-CSFは、単球やマクロファージを刺激して、CCL17などの炎症性サイトカインを産生する[17]。GM-CSFの上昇は、炎症性関節炎、変形性関節症、大腸炎、喘息、肥満、COVID-19等の炎症に寄与する事が示されている[17][18][19]。
医薬品開発[編集]
GM-CSFが最初にクローン化されたのは1985年の事で、その後直ぐに組換えDNA技術を用いて3種類の医薬品候補が作られた。モルグラモスチム[20]は大腸菌で作られ、グリコシル化されていない。サルグラモスチム[21]は酵母で作られ、23位にプロリンの代わりにロイシンがあり、多少グリコシル化されている。レグラモスチム[22]はチャイニーズハムスター卵巣細胞(CHO)で作られ、サルグラモスチムよりもグリコシル化されている。グリコシル化の量は、身体と薬剤とがどのように相互作用するかに影響する[23]。
タリモジン ラヘルパレプベクは、2015年10月に米国FDAから[24]、2015年12月にEMAから、腫瘍溶解性ウイルス療法として承認された。この腫瘍溶解性ヘルペスウイルスは、腫瘍細胞の機構を利用してヒトGM-CSFを発現するように遺伝子工学的に設計されている[25]。
臨床試験[編集]
GM-CSFに対するモノクローナル抗体は、関節リウマチ、強直性脊椎炎、COVID-19などに対する臨床試験で治療薬として使用されている[17]。
関連項目[編集]
- マクロファージコロニー刺激因子(M-CSF)
- 顆粒球コロニー刺激因子(G-CSF)
脚注[編集]
- ^ a b c GRCh38: Ensembl release 89: ENSG00000164400 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000018916 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Granulocyte colony-stimulating factor and granulocyte-macrophage colony-stimulating factor: comparisons and potential for use in the treatment of infections in nonneutropenic patients”. The Journal of Infectious Diseases 179 Suppl 2 (Suppl 2): S342-52. (March 1999). doi:10.1086/513857. PMID 10081506.
- ^ Armitage, J. O. (1998-12-15). “Emerging applications of recombinant human granulocyte-macrophage colony-stimulating factor”. Blood 92 (12): 4491–4508. ISSN 0006-4971. PMID 9845514.
- ^ “Granulocyte-macrophage colony-stimulating factor: not just another haematopoietic growth factor”. Medical Oncology 31 (1): 774. (January 2014). doi:10.1007/s12032-013-0774-6. PMID 24264600.
- ^ “Molecular physiology of granulocyte-macrophage colony-stimulating factor”. Blood 77 (6): 1131–45. (March 1991). doi:10.1182/blood.V77.6.1131.1131. PMID 2001448.
- ^ “Basophil modulation by cytokine instruction”. European Journal of Immunology 42 (10): 2544–50. (October 2012). doi:10.1002/eji.201142318. PMID 23042651.
- ^ “Granulocyte macrophage-colony stimulating factor induced Zn sequestration enhances macrophage superoxide and limits intracellular pathogen survival”. Immunity 39 (4): 697–710. (October 2013). doi:10.1016/j.immuni.2013.09.006. PMC 3841917. PMID 24138881.
- ^ “Programming of the preimplantation embryo by the embryokine colony stimulating factor 2”. Animal Reproduction Science 149 (1-2): 59–66. (September 2014). doi:10.1016/j.anireprosci.2014.05.017. PMID 24954585.
- ^ “A conserved insulator that recruits CTCF and cohesin exists between the closely related but divergently regulated interleukin-3 and granulocyte-macrophage colony-stimulating factor genes”. Molecular and Cellular Biology 29 (7): 1682–93. (April 2009). doi:10.1128/MCB.01411-08. PMC 2655614. PMID 19158269.
- ^ “Entrez Gene: CSF2 colony stimulating factor 2 (granulocyte-macrophage)”. 2021年12月8日閲覧。
- ^ “Treating multiple sclerosis with monoclonal antibodies: a 2013 update”. Expert Review of Neurotherapeutics 13 (3): 313–35. (March 2013). doi:10.1586/ern.13.17. PMID 23448220.
- ^ “Granulocyte-macrophage colony-stimulating factor to reverse sepsis-associated immunosuppression: a double-blind, randomized, placebo-controlled multicenter trial”. American Journal of Respiratory and Critical Care Medicine 180 (7): 640–8. (October 2009). doi:10.1164/rccm.200903-0363OC. PMID 19590022.
- ^ “Randomised controlled trial of GM-CSF in critically ill patients with impaired neutrophil phagocytosis”. Thorax 73 (10): 918–925. (October 2018). doi:10.1136/thoraxjnl-2017-211323. PMC 6166597. PMID 30064991.
- ^ a b c “GM-CSF: A Promising Target in Inflammation and Autoimmunity”. ImmunoTargets and Therapy 9: 225–240. (2020). doi:10.2147/ITT.S262566. PMC 7605919. PMID 33150139.
- ^ “Inflammatory profiles across the spectrum of disease reveal a distinct role for GM-CSF in severe COVID-19”. Science Immunology 6 (57): eabg9873. (March 2021). doi:10.1126/sciimmunol.abg9873. PMID 33692097.
- ^ “Clonal expansion and activation of tissue-resident memory-like Th17 cells expressing GM-CSF in the lungs of severe COVID-19 patients”. Science Immunology 6 (56). (February 2021). doi:10.1126/sciimmunol.abf6692. PMID 33622974.
- ^ “Molgramostim” (英語). AdisInsight. 2018年4月3日閲覧。
- ^ Staff (May 2008). “Back to the Future: Original Liquid Leukine® Coming Soon”. Oncology Business Review. オリジナルの2016-08-25時点におけるアーカイブ。 2016年8月29日閲覧。.
- ^ “Effects of granulocyte-macrophage colony stimulating factor produced in Chinese hamster ovary cells (regramostim), Escherichia coli (molgramostim) and yeast (sargramostim) on priming peripheral blood progenitor cells for use with autologous bone marrow after high-dose chemotherapy”. European Journal of Haematology 55 (5): 348–56. (November 1995). doi:10.1111/j.1600-0609.1995.tb00713.x. PMID 7493686.
- ^ “Emerging applications of recombinant human granulocyte-macrophage colony-stimulating factor”. Blood 92 (12): 4491–508. (December 1998). doi:10.1182/blood.V92.12.4491. PMID 9845514.
- ^ U.S. Food & Drug Administration. “IMLYGIC (talimogene laherparepvec)”. fda.gov. 2019年12月17日閲覧。
- ^ “Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma”. Journal of Clinical Oncology 33 (25): 2780–8. (September 2015). doi:10.1200/JCO.2014.58.3377. PMID 26014293.
外部リンク[編集]
- Official gentaur web site
- Official Leukine web site
- Granulocyte-Macrophage Colony-Stimulating Factor - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
- Overview of all the structural information available in the PDB for UniProt: P04141 (Granulocyte-macrophage colony-stimulating factor) at the PDBe-KB.