テトラメチル尿素
| テトラメチル尿素 | |
|---|---|
| |
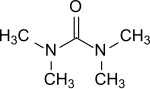
テトラメチル尿素 | |
別称 1,1,3,3-テトラメチル尿素 *TMU | |
| 識別情報 | |
| CAS登録番号 | 632-22-4 |
| PubChem | 12437 |
| ChemSpider | 11930 |
| UNII | 2O1EJ64031 |
| EC番号 | 211-173-9 |
| ChEBI | |
| ChEMBL | CHEMBL11949 |
| |
| |
| 特性 | |
| 化学式 | C5H12N2O |
| モル質量 | 116.16 g mol−1 |
| 外観 | Colorless liquid |
| 密度 | 0.968 g/mL |
| 融点 |
-1.2 °C, 272 K, 30 °F |
| 沸点 |
176.5 °C, 450 K, 350 °F |
| 危険性 | |
| GHSピクトグラム |  
|
| GHSシグナルワード | 危険(DANGER) |
| Hフレーズ | H302, H360, H361 |
| Pフレーズ | P201, P202, P264, P270, P281, P301+312, P308+313, P330, P405, P501 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
テトラメチル尿素は、有機化合物用の非プロトン性極性溶媒であり、特に芳香族化合物や例えばグリニャール試薬に用いられる。
急性毒性は中程度である。しかし、いくつかの動物種に対しては胎児毒性、催奇性があることが判明しているため[1]、適切な安全予防策の下で使用すべきである。
製造
[編集]テトラメチル尿素の合成および特性は、1963年のArthur Lüttringhausにより包括的に記述されている[2]。著者らが好む合成方法は、炭酸ジフェニル(ポリカーボネートの製造に用いる)をもとにして、これを圧力がま中でガス状のジメチルアミンと反応させると収率74%で得られる。

テトラメチル尿素は、ジメチルカルバモイルクロリドと無水炭酸ナトリウムの反応で96.5%の収率で生成する[3]。
さらに、ジメチルカルバモイルクロリドは過剰なジメチルアミンと反応してテトラメチル尿素を生成する。生成物が汚染され強烈なにおいがしても、酸化カルシウムを添加してその後に分留することで精製することができる[4]。
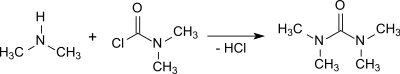
例えば50%水酸化ナトリウム水溶液の存在下でジメチルアミンとホスゲンを反応させ、続いて1,2-ジクロロエタンで抽出するとテトラメチル尿素が収率95%で得られる[5]。

ジメチルカルバモイルクロリドもしくはホスゲンとの反応は非常に発熱性があり、得られるジメチルアミン塩酸塩を取り除くのはいくらかの手間が必要である。
また、トリス(ジメチルアミノ)メタンの熱分解[6]もしくはクロロトリフルオロエテンとジメチルアミン[7]から得ることのできる非常に電子が豊富なアルケン[8]及び強力な還元剤であるテトラキス(ジメチルアミノ)エチレン(TDAE)の酸化中にもテトラメチル尿素は形成される。

TDAEは1,2-ジオキセタンに対する(2+2)環状付加反応において酸素と反応し、1,2-ジオキセタンは電子励起されたテトラメチル尿素に分解する。これは基底状態に戻り、放出最大515nmで緑色の光を出す[9][10]。

特性
[編集]水や多くの有機溶媒と混和し、軽い芳香族臭のする無色透明の液体である[11]。170度を超えてもテトラメチル尿素が液体であることは、尿素にとっては異常なことである。
用途
[編集]テトラメチル尿素は、酢酸などの酸、ピリジンなどの塩基と混和し、ε-カプトラクタムや安息香酸などの有機物に対する優れた溶媒となるなど様々な有機化合物と混和し、硝酸銀やヨウ化ナトリウムなど一部の無機塩も溶かす[12][13]。溶媒特性が独特であるため、発がん性ヘキサメチルリン酸トリアミド(HMPT)の代替物としてしばしば用いられる[14]。
ポリ(m-フェニレンイソフタルアミド)(Nomex®)などのアラミドに対して、芳香族二酸塩化物(例えばイソフタル酸)および芳香族ジアミン(1,3-ジアミノベンゼン(m-フェニレンジアミン)など)を重合するための反応溶媒として適している[15][16]。
テトラメチル尿素中の4-アミノ安息香酸クロライド塩酸塩の重合は、ポリ(p-ベンズアミド)(PPB)の等方性粘性溶液を呈し、これは直接繊維に紡ぐことができる[17]。

テトラメチル尿素-LiCl混合物中では、安定な等方溶液を最大14%のPPBポリマー濃度まで得ることができる[18]。
テトラメチル尿素は、セルロースエステルを溶解し、ポリカーボネート、ポリ塩化ビニル、脂肪族ポリアミドのような他のポリマーを通常は昇温状態で膨張させる。
強力なヒンダード非求核グアニジン塩基はテトラメチル尿素はから簡単に手に入り[19][20]、これはアルキル化されていない縮合アミジン塩基DBNやDBUとは対照的である。

2,3,4,6-テトラ-O-アセチル-α-D-グルコピラノシルブロミド(アセトブロモグルコース)からグリコシドを構築するKoenigs-Knorr反応の変更点は、トリフルオロメタンスルホン酸銀(TfOAg)を用いたS. Hanessian及びプロトン受容体テトラメチル尿素から生じたものである[21]。この過程の変更は、単純化された過程制御、高いアノマー純度、高い収率の生成物を特徴とする。反応をアセトブロモグルコースと銀トリフレート/テトラメチル尿素を用いて室温で行う場合、テトラメチル尿素は塩基としてではなくグルコシルと反応し、良質で単離可能なウロニウムトリフレートを56%の収率で形成する[22]。

脚注
[編集]- ^ The MAK Collection for Occupational Health and Safety (2012) (German), Tetramethylharnstoff [MAK Value Documentation in German language, 1979, Documentations and Methods], Weinheim: Wiley-VCH, doi:10.1002/3527600418.mb63222d0007
- ^ A. Lüttringhaus; H.-W. Dirksen (1963), “Tetramethylharnstoff als Lösungsmittel und Reaktionspartner” (German), Angew. Chem. 75 (22): pp. 1059–1068, doi:10.1002/ange.19630752204
- ^ J.K. Lawson Jr.; J.A.T. Croom (1963), “Dimethylamides from alkali carboxylates and dimethylcarbamoyl chloride” (German), J. Org. Chem. 28 (1): pp. 232–235, doi:10.1021/jo1036a513
- ^ US 3597478, "Preparation of tetramethylurea"
- ^ US 3681457, "Method of making tetramethylurea"
- ^ H. Weingarten; W.A. White (1966), “Synthesis of Tetrakis(dimethylamino)ethylene” (German), J. Org. Chem. 31 (10): pp. 3427–3428, doi:10.1021/jo01348a520
- ^ US 3293299, "Process for making tetrakis(dimethylamino)ethylene"
- ^ H. Bock; H. Borrmann; Z. Havlas; H. Oberhammer; K. Ruppert; A. Simon (1991), “Tetrakis(dimethylamino)ethen: Ein extrem elektronenreiches Molekül mit ungewöhnlicher Struktur sowohl im Festkörper als auch in der Gasphase” (German), Angew. Chem. 103 (12): pp. 1733–1735, doi:10.1002/ange.19911031246
- ^ H.E. Winberg; J.R. Downing; D.D. Coffman (1965), “The chemiluminescence of tetrakis(dimethylamino)ethylene” (German), J. Am. Chem. Soc. 87 (9): pp. 2054–2055, doi:10.1021/ja01087a039
- ^ “Chemilumineszenz von TDAE” (German). illumina-chemie.de (2014年8月8日). 2016年8月22日閲覧。
- ^ R.M. Giuliano (2004), (German)e-EROS Encyclopedia of Reagents for Organic Synthesis, doi:10.1002/047084289X.rn00399
- ^ B.J. Barker; J.A. Caruso (1976) (German), The Chemistry of Nonaqueous Solvents, IV. Solution Phenomena and Aprotic Solvents, New York: Academic Press, pp. 110–127, ISBN 0-12-433804-6
- ^ B.J. Barker; J. Rosenfarb; J.A. Caruso (1979), “Harnstoffe als Lösungsmittel in der chemischen Forschung” (German), Angew. Chem. 91 (7): pp. 560–564, doi:10.1002/ange.19790910707
- ^ A.J. Chalk (1970), “The use of sodium hydride as a reducing agent in nitrogen-containing solvents I. The reduction of chlorosilanes in Hexaalkylphosphoric triamides and tetraalkylureas” (German), J. Organomet. Chem. 21 (1): pp. 95–101, doi:10.1016/S0022-328X(00)90598-9
- ^ G. Odian (2004) (German), Principles of Polymerization, 4th Edition, Hoboken, NJ: Wiley-Interscience, pp. 100, ISBN 0-471-27400-3
- ^ H.G. Rodgers; R.A. Gaudiana; W.C. Hollinsed; P.S. Kalyanaraman; J.S. Manello; C. McGovern; R.A. Minns; R. Sahatjian (1985), “Highly amorphous, birefringent, para-linked aromatic polyamides” (German), Macromolecules 18 (6): pp. 1058–1068, doi:10.1021/ma00148a003
- ^ J. Preston (1978), A. Blumstein, ed. (in German), Synthesis and Properties of Rodlike Condensation Polymers, in Liquid Crystalline Order in Polymers, New York: Academic Press, pp. 141–166,
- ^ S.L. Kwolek; P.W. Morgan; J.R. Schaefgen; L.W. Gulrich (1977), "Synthesis, Anisotropic Solutions, and Fibers of Poly(1,4-benzamide)" (in German), Macromolecules 10 (6): pp. 1390–1396, doi:10.1021/ma60060a041S.L. Kwolek; P.W. Morgan; J.R. Schaefgen; L.W. Gulrich (1977), “Synthesis, Anisotropic Solutions, and Fibers of Poly(1,4-benzamide)” (German), Macromolecules 10 (6): pp. 1390–1396, doi:10.1021/ma60060a041
- ^ Organic Syntheses (英語). doi:10.15227/orgsyn.074.0101。
{{cite journal}}:|title=は必須です。 (説明) - ^ D.H.R. Barton; J.D. Elliott; S.D. Géro (1981), "The synthesis and properties of a series of strong but hindered organic bases" (in German), J. Chem. Soc., Chem. Commun.: pp. 1136–1137, doi:10.1039/C39810001136D.H.R. Barton; J.D. Elliott; S.D. Géro (1981), “The synthesis and properties of a series of strong but hindered organic bases” (German), J. Chem. Soc., Chem. Commun.: pp. 1136–1137, doi:10.1039/C39810001136
- ^ S. Hanessian; J. Banoub (1977), "Chemistry of the glycosidic linkage. An efficient synthesis of 1,2-trans-disaccharides" (in German), Carbohydr. Res. 53: pp. C13–C16, doi:10.1016/S0008-6215(00)85468-3S. Hanessian; J. Banoub (1977), “Chemistry of the glycosidic linkage. An efficient synthesis of 1,2-trans-disaccharides” (German), Carbohydr. Res. 53: pp. C13–C16, doi:10.1016/S0008-6215(00)85468-3
- ^ K. Bock; J. Fernández-Bolanos Guzmán; S. Refn (1992), "Synthesis and properties of 1,1,3,3-tetramethyl-2-(2,3,4,6-tetra-O-acetyl-α-D-glucopyranosyl)uronium triflate" (in German), Carbohydr. Res. 232: pp. 353–357, doi:10.1016/0008-6215(92)80067-BK. Bock; J. Fernández-Bolanos Guzmán; S. Refn (1992), “Synthesis and properties of 1,1,3,3-tetramethyl-2-(2,3,4,6-tetra-O-acetyl-α-D-glucopyranosyl)uronium triflate” (German), Carbohydr. Res. 232: pp. 353–357, doi:10.1016/0008-6215(92)80067-B
