有機ホウ素化合物の反応
有機ホウ素化合物の反応はホウ素原子に結合している求核性の高い官能基が求電子的な炭素を攻撃することで起こる。α,β-不飽和ホウ酸塩やα位に脱離基を持ったホウ酸塩は分子内1,2-シフトによって有機基がホウ素から求電子性の高いα位炭素に移動しやすい。有機ボラン化合物を酸化やプロトノリシスすることでアルコールやカルボニル化合物、アルケン、ハロゲン化物などが合成できる[1]。
概要[編集]
有機ボラン(一般式R3B)や、有機ホウ素イオン(一般式R4B−で表され、R3BにR−が付加して得られる)は炭素-ホウ素結合をもち、その結合は炭素に分極している。したがって、炭素はホウ素に求核的に結合しており[2]、ホウ素イオンでは有機基(R)のうちの一つが分子内で求電子的な炭素に結合する。この反応は分子内で起こることが多く、その場合求核性の高い有機基が1,2-転位してホウ素に結合した求電子性の高い炭素に結合する[3]。生じたボランは酸化または加水分解され、目的物へと変化する。下の図に反応の例を示した。
(1)

アルケンおよびアルキンのヒドロホウ素化はボランの合成に有用な反応である。しかしボラン(BH3)ないしその等価体を使った場合、酸化および加水分解しても元のオレフィンの33%しか変換されず、多くがホウ素を含む副生成物となる。量論量の9-BBNをヒドロホウ素化試薬として用いることでこの問題を解決できる[4]。
反応機構と立体化学[編集]
一般的な反応機構[編集]
ボラン類は単独では求核性が低いためアルキル基を求電子中心に移動させることができない。しかし求核剤による攻撃を受けて生成したホウ酸塩は求核性が高い[3]。求核剤のα位に不飽和な官能基や脱離基が結合していた場合、アルキル基の一つがホウ素に結合し、アルキル基の負電荷を安定化する能力が高ければ求電子性の高いα炭素への転位が起こる。アルキル基の負電荷安定化能は以下のような順になっている
アルキニル > アリール ≈ アルケニル > 1級アルキル > 2級アルキル > 3級アルキル[5]。転位反応の際は転位元となる炭素では元の立体化学が保持される[6]が、 転位先の炭素では立体化学が反転する(転位先の炭素がsp3混成だった場合)[7]。ビス(ノルボルニル)ボランおよび9-BBNはヒドロホウ素化におけるダミー官能基として用いられる。ヒドロホウ素化したオレフィンから得られるアルキル基のみが求核剤として活性を持つ。
(2)

α-ハロエノラートは有機ホウ素化合物が関わる反応において幅広く用いられる求核剤である。ホウ素に求核攻撃して生成するケトボロン酸塩は転位して中性のエノールボランになる。これを加水分解することでカルボニル基を持った化合物が得られる[8]。反応中間体のエノールボランは求電子剤でクエンチされる。
(3)

アルキニルボランはアルキンへの攻撃と転位が同時に起こるため、ケトン・オレフィンいずれにも変換できる有用な中間体である。生成するアルケニルボランでは求電子剤と転位基がトランスの位置に結合する。この中間体の加水分解によりオレフィンが生成し[9]、ケト-エノール互変異性により酸化されるとケトンになる[10]。
(4)

基質適用範囲と制限[編集]
有機ホウ素化合物を用いた有機合成反応における基質適用範囲(スコープ)は非常に広い。有機ホウ素化合物の反応ではアルコールやカルボニル化合物、ハロゲン化物、過酸化物、アミンなど様々な化合物を合成することができる。ここではアルコール、カルボニル化合物、ハロゲン化物の合成について述べる。
有機ホウ素化合物を用いたアルコールの合成はカルボニル基への求核基の転位や有機ボランの酸化によってなされる。有機ボランと一酸化炭素、水素化物を反応させると一級アルコールが得られる[11]。
(5)

2つの異なる置換基を持つ3級アルコールは酸の存在下、アルキニルホウ酸塩に2回転位反応をさせることで合成できる[10]。1当量の酸を反応させ、続いて酸化または加水分解を行うことでそれぞれケトン、オレフィンが得られる(反応機構と立体化学のセクションを参照のこと)。.
(6)

ホウ酸塩のアシル化はカルボン酸ハロゲン化物の存在下で進行する。ここでは、ホウ酸塩はトリ(シクロペンチル)ボランとフェニルリチウムから合成される。3つのシクロペンチル基がダミーの官能基となり、転位反応が阻害される[12]。
(7)
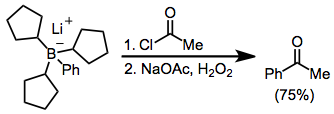
トリアルキルボランをα-ハロエノラートと反応させると官能基を導入したケトンが生成する[8]。転位が立体特異的に進行する(転位基の立体化学を保持しつつ、転位先のα炭素では反転する)ため、この反応はエナンチオ特異的なα-アルキルもしくはα-アリールケトンの合成に用いることができる[13]。
(8)
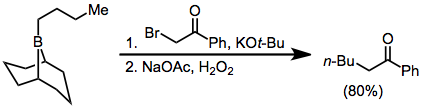
α-ハロエステルエノラートもボランに付加し、α位が官能基化された生成物を与える。しかし収率が若干落ちる[14]。この反応においてはジアゾエステルやジアゾケトンも外部塩基の必要ない基質として用いられることがある[15]。α,α’-ジハロエノラートはボランと反応し、α-ハロカルボニル化合物を与える。これはさらにα位に官能基を導入できる化合物である[16]。
(9)

ハロゲン化物は有機ボランを水酸化物またはアルコキシドで活性化してからX2と反応させることで合成できる。過剰の塩基を用いることで3つのアルキル基のうち2つがハロゲン化できるが、ジシアミルボランでヒドロホウ素化するとヒドロホウ素化したオレフィンのみを選択的にハロゲン化できる as the hydroborating reagent permits the selective halogenation of only the hydroborated olefin.[17]
(10)
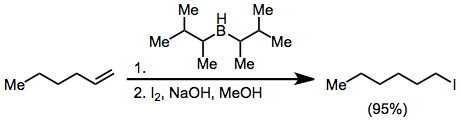
アルケニルボランを臭素やヨウ素と反応させると有機基の一つがホウ素に結合する転位反応が起きる。アルキニル基は選択的に転位し、酢酸ナトリウムと過酸化水素で処理することでエンインが得られる[18]。
(11)

反応条件[編集]
一般的な反応条件[編集]
多くの有機ボランは空気に不安定で、揮発性有機ボランは空気中では引火性がある。従って、これらの試薬は不活性ガスの雰囲気下で反応させなければならない。有機ボランは水を加えただけでは反応停止しないため、過酸化水素によって酸化することでクエンチ(反応停止)するのがよい。水素化ホウ素は過酸化水素を使う前に水か、水溶性の酸でクエンチできる。有機ボランは一般的にはアルケンやアルキンのヒドロホウ素化で得られる[19]。
反応の進行にはホウ素源の選択が重要である。9-BBNは様々な反応において、反応に関与しないダミーな官能基として働く。また9-BBNをヒドロホウ素化試薬として用いることでオレフィンを完全にヒドロホウ素化することができる。THFが有機ホウ素化合物の反応の溶媒となることが多いが、クロロボランはTHFと安定な錯体を作る[20]。この場合ジエチルエーテルなど極性の低い溶媒が用いられる。
実験手法[編集]
(12)

よく乾燥させた50mLナスフラスコにマグネチックスターラーの攪拌子を入れ、セプタムで蓋をして内部を窒素置換する。フラスコを−25°Cに冷却し、1.89 g (10 mmol)のp-クロロフェニルジクロロボランを10 mLのテトラヒドロフランに溶かす。この溶液を一滴ずつ、1.25 g (11 mmol)のジアゾ酢酸エチルを10 mLのテトラヒドロフランに溶かした溶液に入れる。(3-5分間に1mL)これは窒素の発生を穏やかにするためである(約1.5時間かけて反応させる)。この温度で水5 mLとメタノール5 mLを加える。最後に冷却バスを取り除き、飽和炭酸ナトリウム水溶液75 mLで反応停止(クエンチ)してから50mLのエーテルで3回抽出する。無水MgSO4で乾燥させ、濃縮すると’’p'’-クロロフェニル酢酸エチルを収量1.80 g (収率91%)で得る。この化合物の沸点は106–107°C、(3.5 mm);融点は31–32°C、1H NMRのδは1.34, 3.59, 4.12, 7.21, 7.29である[21]。
脚注[編集]
- ^ Negishi, E.-i.; Idacavage, M. J. Org. React. 1985, 33, 1. doi:10.1002/0471264180.or033.01
- ^ Allred, A. L.; Rochow, E. G. J. Inorg. Nucl. Chem. 1958, 5, 264.
- ^ a b Negishi, E.-i. Journal of Organometallic Chemistry 1976, 108, 281.
- ^ Jacob, III, P.; Brown, H. C. ‘’J. Org. Chem. 1977, 42, 579.
- ^ Miyaura, M.; Sasaki, N.; Itoh, M.; Suzuki, A. ‘’Tetrahedron Lett. 1977, 173.
- ^ Zweifel, G. in Aspects of Mechanism and Organometallic Chemistry, J. H. Bewster, Ed., Plenum, 1978, p. 229.
- ^ Midland, M. M.; Zolopa, A. R.; Halterman, R. L. ‘’J. Am. Chem. Soc. 1979, 101, 248.
- ^ a b Brown, H. C.; Rogi, M. M.; Nambu, H.; Rathke, M. W. J. Am. Chem. Soc. 1969, 91, 2147.
- ^ Corey, E. J.; Ravindranathan, T. J. Am. Chem. Soc. 1972, 94, 4013.
- ^ a b Midland, M. M.; Brown, H. C. J. Org. Chem. 1975, 40, 2845.
- ^ Rathke, M. W.; Brown, H. C. J. Am. Chem. Soc. 1967, 89, 2740.
- ^ Negishi, E.-i.; Abramovitch, A.; Merrill, R. E. Chem. Commun. 1975, 138.
- ^ Nesmeyanov, A. N.; Sokolik, R. A. The Organic Compounds of Boron, Aluminium, Gallium, Indium, and Thallium, North-Holland, Amsterdam, 1967.
- ^ Brown, H. C.; Rogic, M. M.; Rathke, M. W.; Kabalka, G. W. J. Am. Chem. Soc. 1968, 90, 818.
- ^ Hooz, J.; Gunn, D. M. ‘’J. Am. Chem. Soc. 1969, 91, 6195.
- ^ Pasto, D. J.; Wojtkowski, P. W. J. Org. Chem. 1971, 36, 1790.
- ^ Brown, H. C.; Rathke, M. W.; Rogic, M. M. J. Am. Chem. Soc. 1968, 90, 5038.
- ^ Negishi, E.-i.; Lew, G.; Yoshida, T. Chem. Commun. 1973, 874.
- ^ Zweifel, G.; Brown, H. C. Org. React. 1963, 13, 1.
- ^ Brown, H. C.; Midland, M. M; Levy, A. B. J. Am. Chem. Soc. 1973, 95, 2394.
- ^ Hooz, J.; Bridson, J. N.; Calzada, J. G.; Brown, H. C; Midland, M. M.; Levy, A. B. ‘’J. Org. Chem. 1973, 38, 2574.
