五フッ化臭素
| 五フッ化臭素 Bromine pentafluoride | |
|---|---|

| |
| |

| |
Bromine pentafloride | |
| 識別情報 | |
| CAS登録番号 | 7789-30-2 |
| PubChem | 24606 |
| |
| |
| 特性 | |
| 化学式 | BrF5 |
| モル質量 | 174.894 g mol−1 |
| 外観 | 淡黄色ないし無色の発煙性液体 |
| 密度 | 2.466 g/cm3 |
| 融点 |
−61.30 ℃ |
| 沸点 |
40.25 ℃ |
| 水への溶解度 | 激しく反応する |
| 構造 | |
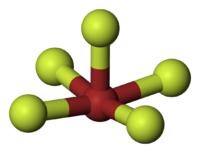
| 分子の形 | 四角錐形 |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS |
| NFPA 704 | |
| R/Sフレーズ | R2 R23 R24 R25 |
| 引火点 | 不燃性 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
五フッ化臭素(ごフッかしゅうそ、英: bromine pentafluoride)は化学式 BrF5 の、臭素とフッ素によるハロゲン間化合物の液体。強力なフッ素化剤であり、ウランのフッ素化剤やロケット燃料の酸化剤、酸素の同位体の分析、固体ケイ酸塩のレーザーアブレーションに用いられる[1]。
合成[編集]
150℃以上で、臭素に大量のフッ素を反応させることにより量産できる。
少量の製造では下記のように臭化カリウムとフッ素から合成される。この方法では三フッ化臭素や不純物の発生をほぼ完全に抑えることができる[2]
反応[編集]
水と爆発的に反応する。
強力なフッ素化作用を持ち、常温でウラン化合物と反応して六フッ化ウランを生じる。
安全性[編集]
自身は不燃性であるが酸化性を持つため、日本の消防法では第6類危険物に分類される。460度以上に加熱すると分解し、フッ素や臭素を生じる。水や有機化合物と爆発的に反応し、フッ化水素などを生じる。水素を含む化合物などと反応し、火災や爆発のおそれがある。皮膚や眼に対し強い刺激性があり、蒸気を吸入した場合には肺気腫や肺水腫などの重篤な呼吸器障害を起こす。半数致死濃度(LC50)は 96 ppm(ラット、3.7時間)。長期的には血液、歯、骨などに障害をもたらす[3]。
脚注[編集]
- ^ Clayton, Robert N; Mayeda, Toshiko K (1963). “The use of bromine pentafluoride in the extraction of oxygen from oxides and silicates for isotopic analysis”. Geochimica et Cosmochimica Acta 27 (1): 43–52. doi:10.1016/0016-7037(63)90071-1. ISSN 00167037.
- ^ Hyde, Gene A.; Boudakian, Max M. (1968). “Synthesis routes to chlorine and bromine pentafluorides”. Inorganic Chemistry 7 (12): 2648–2649. doi:10.1021/ic50070a039. ISSN 0020-1669.
- ^ 製品安全データシート(安全衛生情報センター)
関連項目[編集]
外部リンク[編集]
| ハロゲン間化合物 | |||||
|---|---|---|---|---|---|
| フッ素 | 塩素 | 臭素 | ヨウ素 | アスタチン | |
| フッ素 | F2 | ||||
| 塩素 | ClF ClF3 ClF5 | Cl2 | |||
| 臭素 | BrF BrF3 BrF5 | BrCl BrCl3 | Br2 | ||
| ヨウ素 | IF IF3 IF5 IF7 | ICl I2Cl6 | IBr IBr3 | I2 | |
| アスタチン | AtCl | AtBr | AtI | At2? | |




