上皮間葉転換

上皮間葉転換(じょうひかんようてんかん、英: Epithelial-Mesenchymal Transformation)または上皮間葉移行(Epithelial-Mesenchymal Transition)、略称EMTは、上皮細胞がその細胞極性や周囲細胞との細胞接着機能を失い、遊走、浸潤能を得ることで間葉系様の細胞へと変化する過程である。上皮間葉転換は中胚葉形成や神経管形成などを含むさまざまな発生過程に重要な役割を果たしている。また、創傷治癒や組織の線維化、がんの浸潤、転移などにおいて出現していると考えられている。
はじめに[編集]
上皮間葉転換は当初、胚形成における特徴として捉えられていた[1]。上皮間葉転換およびその逆過程である間葉上皮転換は胚の発育および、その他多くの胎生期の事象(原腸陥入、神経堤形成、心臓弁形成、口蓋形成、筋形成など)において、さまざまな組織や器官の形成、成長、分化に対し非常に重要な役割を果たしている[2]。上皮細胞、間葉細胞は、機能と同様、形態も異なっている。上皮細胞は、密着結合、ギャップ結合、接着結合などの細胞接着分子によりお互いの細胞が接着している。これにより、細胞極性やアクチン骨格の極性を保っている。また、底部では基底膜により固定されている。一方、間葉系細胞においては、そのような極性はなく、紡錘状の形態をとり、部分的な点のみで細胞同士の相互作用を行う[3]。上皮細胞がEカドヘリンを高発現している一方、間葉系細胞はNカドヘリン、ビメンチンやフィブロネクチンを発現している。上皮間葉転換は細胞に形態および質的な大きな変化を呼び起こす。生物学的な背景より、上皮間葉転換は3つのタイプに分類できる[4]。
上皮間葉転換誘導因子[編集]
Eカドヘリンの消失は上皮間葉転換において不可欠な事象と考えられている。Eカドヘリンを抑制することができる多くの転写因子をEMT-TF(上皮間葉転換誘導転写因子)と捉えることができる。SNAI1/Snail1、SNAI2/Snail2(Slug)、ZEB1、ZEB2、E47、KLF8 (Kruppel-like factor 8) などはEカドヘリンのプロモーター領域へ結合し、その転写を抑制することができる。一方、TwistやGoosecoid、E2.2 (TCF4)、ホメオボックス転写因子であるSIX1やFOXC2 (fork-head box protein C) などのタンパク質はEカドヘリンを間接的に抑制する[5][6]。SNAILおよびZEBはプロモーター領域におけるE-Boxコンセンサス配列に結合する。一方、KLF8はGT-Boxを介してプロモーター領域に結合する。これらの上皮間葉転換誘導転写因子は、直接的にEカドヘリンを抑制するだけではなく、クローディンや接着斑などを含む他の接着タンパク質の転写を抑制し上皮間葉転換を促進する。一方、GRHL2 (grainyhead-like protein 2 homologue)、やETS関連転写因子であるELF3、ELF5などの転写因子は上皮間葉転換の過程で減少する。なお、これらの転写因子が間葉系細胞において過剰発現した際は間葉上皮転換が惹起される[7][8]。がんの発育・進展における上皮間葉転換は、正常な組織の発育、成長プログラムを模しているため(成長を正方向へと促進するため)、多くの上皮間葉転換誘導転写因子は浸潤、転移の促進因子へとなる。
いくつかのシグナル伝達経路(TGF-β、FGF、EGF、HGF、Wnt/β-カテニン、Notchシグナリングなど)や、低酸素刺激は上皮間葉転換を誘導する。特に、RAS/MAPKシグナル伝達経路は、SnailやSlugを活性化することが示されている。Slugはデスモソームの分解や、細胞の広がり、細胞-細胞境界の部分的解離など、上皮間葉転換の過程において必要な、最初の段階の引き金となる。一方で、Slugは二次的な段階(細胞運動の誘導、サイトケラチンの抑制、ビメンチンの発現誘導など)の引き金となるわけではない[9][10]。SlugとSnailは上皮形態の適切な発育に必要な転写因子p63アイソフォームの発現を制御していることが知られている[11]。p63アイソフォームの異常発現は、細胞接着を減少させ、がん細胞の浸潤能を亢進させる。p63因子は上皮間葉転換の阻害に関わっており、p63アイソフォームの減少は上皮がんにおける発育、伸展に重要であると考えられている[12]。これらの多くは、サイトケラチン発現を調節していることがわかっている[13]。最近、PI3キナーゼ/AKTシグナルが上皮間葉転換において中心的役割を果たしているのではないかとの考えが急浮上している。同じく、ヘッジホッグシグナル伝達経路や、NF-κB (nuclear factor-kappaB)、ATF2 (Activating Transcription Factor 2) などが、上皮間葉転換に関連していると考えられている[14][15][16]。
Wntシグナル経路は原腸陥入や心臓弁の形成、およびがんにおいて上皮間葉転換を制御している[17]。肺がん細胞においてWntシグナル経路を活性化すると、上皮間葉転換を引き起こすSnailが誘導され、間葉系マーカーであるビメンチンが上昇する。また、Wnt/βカテニン経路は臨床医学において肺がん患者の予後不良と相関している。同様に、心臓弁形成や、口蓋形成、がんなどにおいてTGF-βはSnailやZEBの発現を誘導する。肺がんの骨転移病変はTGF-βシグナルを活性化させることで、さらなる転移の形成に寄与する[18]。一方で、がん抑制遺伝子としてよく知られているp53は、ZEBやSnailなどのタンパク質産生を阻害する様々なマイクロRNA(miR-200、miR-34など)の発現を誘導することにより、上皮間葉転換を抑制している[19]。
発生、創傷治癒における上皮間葉転換[編集]
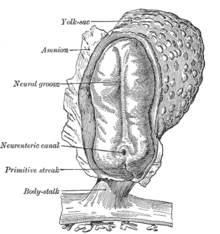
胚形成における最初の段階の後、胚の着床と胎盤形成に上皮間葉転換は関わっている。栄養外胚葉細胞は適切な胎盤の配置および子宮内膜への浸潤を容易にするために上皮間葉転換を行う。これにより、胚への栄養とガス交換が可能となる。胚形成後の原腸陥入において、上皮間葉転換は、細胞が胚の特定の部位(有羊膜類における原始線条やショウジョウバエにおける腹面溝など)へと移動することを可能とする。これらの組織における細胞はEカドヘリンを発現し、細胞極性を持っている[20]。原腸陥入は急速な過程であるため、EカドヘリンはTwistとSnailによって転写レベルで抑制され、p38関連タンパク質にてタンパク質レベルで抑制されている。原始線条は陥入により内中胚葉を形成し、再び上皮間葉転換を起こして内胚葉と中胚葉に分離する。原始線条由来の間葉系細胞はまた、間葉上皮転換によって(体節と同じような)脊索などの多くの上皮系の中胚葉由来器官の形成に関与している。ナメクジウオは上皮神経管と背側体節を形成するが、原始線条の上皮間葉転換能は有していない。高等脊椎動物において、原始線条外に由来している間葉は体節から前方へと移動するとともに、神経管間葉を伴い心原性中胚葉の形成に寄与する。
脊椎動物において、上皮細胞と間葉細胞は基本的な組織の表現形質である。胚発生において移動可能な神経堤細胞は神経外胚葉の上皮細胞を含む上皮間葉転換によって形成される。結果としてこれらの細胞は神経ヒダから分離し移動能を獲得することで、胚の様々な部位に広がっていき、多くの他の細胞へと分化していく。また、頭部や顔面を形成する結合組織を形作る頭蓋顔面堤系間葉細胞は上皮間葉転換による神経管上皮によって形成される[21]。細胞外マトリックス外における脊椎形成において上皮間葉転換が起きる。これは、神経管を取り囲む線維芽細胞や骨芽細胞によりなされる。これら細胞の大部分の由来は原条と同様、硬節や体節の間葉細胞である。間葉細胞の形態は胚のなかの特定の標的へと移動することを可能とし、それらの細胞は移動先で他の細胞へと分化、変形または(さらに)それらを誘導する[21][22]。
創傷治癒においては、傷が閉じていく際に、創傷部付近のケラチノサイトが上皮間葉転換、上皮化や間葉上皮転換を引き起こす。移動先端のSnail2の発現は、このような状況に影響を与え、その過剰発現は創傷治癒を促進する。同様に、各月経周期において、卵巣表面の上皮細胞は排卵後の創傷治癒期間において上皮間葉転換を起こしている[23]。
がんの浸潤、転移における上皮間葉転換[編集]
転移の開始には浸潤が必要であり、これは上皮間葉転換により引き起こされる。原発腫瘍におけるがん細胞は、Eカドヘリンの減少や基底膜の崩壊により、細胞接着を喪失するとともに浸潤能を増強し、脈管侵襲を介し全身の血流へと浸潤する。その後、循環腫瘍細胞 (Circulating tumor cell: CTC) が全身の血流から脱出し、微小転移巣を形成した時、これら循環腫瘍細胞は間葉上皮転換を起こして、転移部での増殖を開始する。つまり、上皮間葉転換および間葉上皮転換は浸潤-転移のカスケードにおいて、その開始と終了を担っているのである[24]。また、上皮間葉転換はがん遺伝子によって引き起こされる成熟前老化に対する抵抗性をもたらす。ZEB1と同様、Twist1やTwist2はヒトの細胞やマウスの胚性線維芽細胞の老化を防いでいる。同じく、TGF-βはがんの進行期における浸潤能と、免疫の監視からの回避をもたらす。TGF-βが活性化Rasを発現した哺乳類の上皮細胞に作用した時、上皮間葉転換が引き起こされ、アポトーシスは阻害される[25]。また、薬剤耐性が上皮間葉転換を引き起こすことが示されている。上皮間葉転換のマーカーは卵巣がん上皮細胞培養細胞のパクリタキセル抵抗性と関連していることが知られている。同じように、Snailはp53により誘導されるアポトーシスを阻害することで、パクリタキセルやアドリアマイシン、放射線治療に抵抗性をもたらす[26]。さらに、がん化や線維化に関連している炎症は、最近、炎症誘導性の上皮間葉転換を介したがんの進行と関連していることが示されている。つまり、上皮間葉転換は、細胞を移動可能な形質へと変換するだけではなく、様々な免疫抑制や薬剤耐性、アポトーシスからの回避、および宿主と腫瘍の異常反応を引き起こしているのである。
最近の研究では、上皮間葉転換を起こしている細胞は、幹細胞様の機能を獲得し、これによりがん幹細胞を生じることが示唆されている。ヒト上皮細胞にRasの活性化を導入すると、CD44high/CD24lowを示す不死化した細胞集団が上皮間葉転換の誘導を伴い増加する。これは、幹細胞様の機能をもったがん細胞と同様の変化である[27]。ZEB1もまた、幹細胞様の機能を付与することができ、上皮間葉転換と幹細胞らしさの関係を強くする。上皮間葉転換によりもたらされるこの機能は、浸潤能と増殖・腫瘍化能の増大という2点で患者に不利益をもたらす[28]。
上皮間葉転換によるランゲルハンス島細胞からの内分泌前駆細胞の生成[編集]
がん幹細胞の発生と同様、上皮間葉転換によってヒトランゲルハンス島細胞から内分泌前駆細胞を発生し得ることが証明されている[29]。当初、hIPCs(ヒト膵島由来前駆細胞、human islet-derived progenitor cells)がより良い前駆細胞と考えられていた。なぜなら、hIPCの分化細胞であるβ細胞は、インスリンのプロモーター領域の活性化と定義されているエピジェネティックな特徴を受け継いでいるからである[30]。しかし後に、インビトロの実験において標識されたβ細胞は間葉様の形質へと脱分化することができるが、増殖でできないという報告がなされたため、議論となった[31][32][33]。
これらのヒトランゲルハンス島細胞における実験は、細胞系譜解析が行われていなかった。このため、不可逆的に標識されたマウスのβ細胞からのこれらの知見は、ヒトランゲルハンス島細胞にも同様であろうと考えられた。標識されたβ細胞に2つのレンチウイルスを使用した遺伝子細胞系譜解析が行われた。その結果、インビトロにおいて成人ヒトβ細胞は上皮間葉転換を起こし、増殖していることが証明された[34][35]。また、これらの知見は胎児のインスリン産生細胞においても確認され、ランゲルハンス島細胞に由来する間葉細胞は膵島様細胞の集団を形成するために上皮間葉転換の逆過程である間葉上皮転換を起こすことができることが判明した[36]。
つまり、上皮間葉転換によるインスリン産生細胞由来の前駆細胞産生や、がん細胞における上皮間葉転換によるがん幹細胞の生成という概念は、糖尿病患者に対するインスリン産生細胞の補充や、がん患者に対する上皮間葉転換の分子標的治療薬による治療を可能としてくれるかもしれない。
脚注[編集]
- ^ Kong D, Li Y, Wang Z, Sarkar FH (2011). “Cancer Stem Cells and Epithelial-to-Mesenchymal Transition (EMT)-Phenotypic Cells: Are They Cousins or Twins?”. Cancers (Basel) 3 (1): 716–729. doi:10.3390/cancers30100716. PMID 21643534.
- ^ Thiery JP, Acloque H, Huang YJR, Nieto MA (2009). “Epithelial-Mesenchymal Transitions in Development and Disease”. Cell 139 (5): 871–890. doi:10.1016/j.cell.2009.11.007. PMID 19945376.
- ^ Thiery JP, Sleeman JP (2006). “Complex networks orchestrate epithelial-mesenchymal transitions”. Nat. Rev. Mol. Cell Biol. 7: 131–142. doi:10.1038/nrm1835. PMID 16493418.
- ^ Kalluri R, Weinberg RA (2009). “The basics of epithelial-mesenchymal transition”. J. Clin. Invest. 119 (6): 1420–1428. doi:10.1172/JCI39104. PMC 2689101. PMID 19487818.
- ^ Peinado H, Olmeda D, Cano A (2007). “Snail, Zeb and bHLH factors in tumour progression: an alliance against the epithelial phenotype?”. Nat. Rev. Cancer 7 (6): 415–428. doi:10.1038/nrc2131. PMID 17508028.
- ^ Yang J, Weinberg RA (2008). “Epithelial-mesenchymal transition: at the crossroads of development and tumor metastasis”. Dev. Cell 14: 818–829. doi:10.1016/j.devcel.2008.05.009. PMID 18539112.
- ^ De Craene B, Berx G (2013). “Regulatory networks defining EMT during cancer initiation and progression”. Nat. Rev. Cancer 13: 97–110. doi:10.1038/nrc3447. PMID 23344542.
- ^ Chakrabarti R, Hwang J, Andres Blanco M, Wei Y, Lukačišin M, Romano RA, Smalley K, Liu S, Yang Q, Ibrahim T, Mercatali L, Amadori D, Haffty BG, Sinha S, Kang Y (2012). “Elf5 inhibits the epithelial-mesenchymal transition in mammary gland development and breast cancer metastasis by transcriptionally repressing Snail2”. Nat. Cell Biol. 14 (11): 1212–1222. doi:10.1038/ncb2607. PMC 3500637. PMID 23086238.
- ^ Savagner P, Yamada KM, Thiery JP (1997). “The zinc-finger protein slug causes desmosome dissociation, an initial and necessary step for growth factor-induced epithelial–mesenchymal transition”. J. Cell Biol. 137 (6): 1403–1419. doi:10.1083/jcb.137.6.1403. PMC 2132541. PMID 9182671.
- ^ Boyer B, Tucker GC, Vallés AM, Franke WW, Thiery JP (1989). “Rearrangements of desmosomal and cytoskeletal proteins during the transition from epithelial to fibroblastoid organization in cultured rat bladder carcinoma cells”. J. Cell Biol. 109 (4 Pt 1): 1495–1509. doi:10.1083/jcb.109.4.1495. PMC 2115780. PMID 2677020.
- ^ Herfs M, Hubert P, Suarez-Carmona M, Reschner A, Saussez S, Berx G, Savagner P, Boniver J, Delvenne P (2010). “Regulation of p63 isoforms by snail and slug transcription factors in human squamous cell carcinoma”. Am. J. Pathol. 176 (4): 1941–1949. doi:10.2353/ajpath.2010.090804. PMID 20150431.
- ^ Lindsay J, McDade SS, Pickard A, McCloskey KD, McCance DJ (2011). “Role of ΔNp63γ in epithelial to mesenchymal transition”. J. Biol. Chem. 286 (5): 3915–3924. doi:10.1074/jbc.M110.162511. PMC 3030392. PMID 21127042.
- ^ Boldrup L, Coates PJ, Gu X, Nylander K (2007). “ΔNp63 isoforms regulate CD44 and keratins 4, 6, 14 and 19 in squamous cell carcinoma of head and neck”. J. Pathol. 213 (4): 384–391. doi:10.1002/path.2237. PMID 17935121.
- ^ Vlahopoulos SA, Logotheti S, Mikas D, Giarika A, Gorgoulis V, Zoumpourlis V (2008). “The role of ATF-2 in oncogenesis”. BioEssays 30 (4): 314–327. doi:10.1002/bies.20734. PMID 18348191.
- ^ Huber MA, Beug H, Wirth T (2004). “Epithelial-mesenchymal transition: NF-κB takes center stage”. Cell Cycle 3 (12): 1477–1480. doi:10.4161/cc.3.12.1280. PMID 15539952.
- ^ Katoh Y, Katoh M (2008). “Hedgehog signaling, epithelial-to-mesenchymal transition and miRNA”. Int. J. Mol. Med. 22 (3): 271–275. doi:10.3892/ijmm_00000019. PMID 18698484.
- ^ Micalizzi Ds, Farabaugh SM, Ford HL (2010). “Epithelial-Mesenchymal Transition in Cancer: Parallels between Normal Development and Tumor Progression”. J. Mammary Gland Biol. Neoplasia 15: 117–134. doi:10.1007s/10911-010-9178-9. PMC 2886089. PMID 20490631.
- ^ Kang Y, He W, Tulley S, Gupta GP, Serganova I, Chen CR, Manova-Todorova K, Blasberg R, Gerald WL, Massagué J (2005). “Breast cancer bone metastasis mediated by the Smad tumor suppressor pathway”. Proc. Natl. Acad. Sci. U. S. A. 102 (39): 13909–13914. doi:10.1073/pnas.0506517102. PMC 1236573. PMID 16172383.
- ^ Chang C, Chao C, Xia W, Yang J, Xiong Y, Li C, Yu W, Rehman SK, Hsu JL, Lee H, Liu M, Chen C, Yu D, Hung M (2011). “p53 regulates epithelial-mesenchymal transition (EMT) and stem cell properties through modulating miRNAs”. Nat. Cell Biol. 13 (3): 317–323. doi:10.1038/ncb2173. PMC 3075845. PMID 21336307.
- ^ Lim R, Thiery JP (2012). “Epithelial-mesenchymal transitions: insights from development”. Development 139: 3471–3486. doi:10.1242/dev.071209. PMID 22949611.
- ^ a b Hay ED (2005). “The mesenchymal cell, its role in the embryo, and the remarkable signaling mechanisms that create it”. Dev. Dyn. 233 (3): 706–720. doi:10.1002/dvdy.20345. PMID 15937929.
- ^ Kerosuo L, Bronner-Fraser M (2012). “What is bad in cancer is good in the embryo: Importance of EMT in neural crest development”. Semin. Cell Dev. Biol. 23 (3): 320–332. doi:10.1016/j.semcdb.2012.03.010. PMC 3345076. PMID 22430756.
- ^ Ahmed N, Maines-Bandiera S, Quinn MA, Unger WG, Dedhar S, Auersperg N (2006). “Molecular pathways regulating EGF-induced epithelio-mesenchymal transition in human ovarian surface epithelium”. Am. J. Physiol. Cell Physiol. 290 (6): C1532–C1542. doi:10.1152/ajpcell.00478.2005. PMID 16394028.
- ^ Chaffer CL, Weinberg RA (2011). “A perspective on cancer cell metastasis”. Science 331: 1559–1564. doi:10.1126/science.1203543. PMID 21436443.
- ^ Massague J (2008). “TGFβ in cancer”. Cell 134: 215–229. doi:10.1016/j.cell.2008.07.001. PMC 3512574. PMID 18662538.
- ^ Kajiyama H, Shibata K, Terauchi M, Yamashita M, Ino K, Nawa A, Kikkawa F (2007). “Chemoresistance to paclitaxel induces epithelial-mesenchymal transition and enhances metastatic potential for epithelial ovarian carcinoma cells”. Int. J. Oncol. 31: 277–283. doi:10.3892/ijo.31.2.277. PMID 17611683.
- ^ Mani SA, Guo W, Liao MJ, Eaton NE, Ayyanan A, Zhou AY, Brooks M, Reinhard F, Zhang1, Shipitsin M, Campbell LL, Polyak K, Brisken C, Yang J, Weinberg RA (2008). “The Epithelial-Mesenchymal Transition Generates Cells with Properties of Stem Cells”. Cell 133 (4): 704–715. doi:10.1016/j.cell.2008.03.027. PMID 20150431.
- ^ Singh A, Settleman J (2010). “EMT, cancer stem cells and drug resistance: an emerging axis of evil in the war on cancer”. Oncogene 29: 4741–4751. doi:10.1038/onc.2010.215.
- ^ Gershengorn MC, Hardikar AA, Wei C et al. (2004). “Epithelial-to-mesenchymal transition generates proliferative human islet precursor cells”. Science 306: 2261–2264. doi:10.1126/science.1101968. PMID 15564314.
- ^ Gershengorn MC, Geras-Raaka E, Hardikar AA et al. (2005). “Are better islet cell precursors generated by epithelial-to-mesenchymal transition?”. Cell Cycle 4: 380–382. doi:10.4161/cc.4.3.1538. PMID 15711124.
- ^ Atouf F, Park CH, Pechhold K et al. (2007). “No evidence for mouse pancreatic beta-cell epithelial-mesenchymal transition in vitro”. Diabetes 56: 699–702. doi:10.2337/db06-1446. PMID 17327438.
- ^ Chase LG, Ulloa-Montoya F, Kidder BL et al. (2007). “Islet-derived fibroblast-like cells are not derived via epithelial-mesenchymal transition from Pdx-1 or insulin-positive cells”. Diabetes 56: 3–7. doi:10.2337/db06-1165. PMID 17110468.
- ^ Morton RA, Geras-Raaka E, Wilson LM et al. (2007). “Endocrine precursor cells from mouse islets are not generated by epithelial-to-mesenchymal transition of mature beta cells”. Mol. Cell Endocrinol. 270: 87–93. doi:10.1016/j.mce.2007.02.005. PMC 1987709. PMID 17363142.
- ^ Russ HA, Bar Y, Ravassard P et al. (2008). “In vitro proliferation of cells derived from adult human beta-cells revealed by cell-lineage tracing”. Diabetes 57: 1575–1583. doi:10.2337/db07-1283. PMID 18316362.
- ^ Russ HA, Ravassard P, Kerr-Conte J et al. (2009). “Epithelial-mesenchymal transition in cells expanded in vitro from lineage-traced adult human pancreatic beta cells”. PLoS ONE 4: e6417. doi:10.1371/journal.pone.0006417. PMC 2712769. PMID 19641613.
- ^ Joglekar MV, Joglekar VM, Joglekar SV et al. (2009). “Human fetal pancreatic insulin-producing cells proliferate in vitro”. J. Endocrinol. 201: 27–36. doi:10.1677/JOE-08-0497. PMID 19171567.
