「カルボニル還元」の版間の差分
| 70行目: | 70行目: | ||
== 立体選択性 == |
== 立体選択性 == |
||
{{Main|Asymmetric catalytic reduction}} |
{{Main|{{仮リンク|不斉触媒反応|en|Asymmetric catalytic reduction}}}} |
||
=== ジアステレオ選択的還元 === |
=== ジアステレオ選択的還元 === |
||
シクロヘキサノンの還元においては、ヒドリド源が[[シクロヘキサンの立体配座|アキシャル]]位を攻撃してエカトリアル位にヒドロキシ基がつくか、エカトリアル位を攻撃してアキシャル位にヒドロキシ基が結合したアルコールができる。アキシャル位への攻撃(赤で示した)ではヒドリドが[[ひずみ (化学)|1,3-ジアキシャル相互作用]]による反発を受ける。一方エカトリアル位の攻撃ではヒドリドは相互作用を受けることがないが、新しくできたアルコールが基質と水素原子が[[反応中間体]]が{{仮リンク|アルカンの立体化学|en|Alkane stereochemistry|label=ねじれひずみ}}を受ける(アキシャル位にヒドロキシ基が結合したアルコールの[[ニューマン投影法]]で下に示した)。 |
|||
In the reduction of cyclohexanones, the hydride source can attack [[Axial bond|axially]] to produce an equatorial alcohol, or [[Equatorial bond|equatorially]] to produce an axial alcohol. In axial attack (shown in red), the hydride encounters [[Strain (chemistry)|1,3-diaxial strain]]. In equatorial attack (shown in blue), the hydride avoids the 1,3-diaxial interaction, but the substrate undergoes unfavorable [[Strain (chemistry)|torsional strain]] when the newly formed alcohol and added hydrogen atom eclipse each other in the reaction intermediate (as shown in the Newman projection for the axial alcohol). |
|||
[[ |
[[ファイル:Axial vs equatorial.png|centre|frameless|316x316px]] |
||
Large reducing agents, such as LiBH(Me<sub>2</sub>CHCHMe)<sub>3</sub>, are hindered by the 1,3-axial interactions and therefore attack equatorially.<ref name=":0"/> Small reducing agents, such as NaBH<sub>4</sub>, preferentially attack axially in order to avoid the eclipsing interactions, because the 1,3-diaxial interaction for small molecules is minimal; stereoelectronic reasons have also been cited for small reducing agents' axial preference.<ref>{{Cite journal|title = Theoretical evidence in support of the Anh?Eisenstein electronic model in controlling ?-facial stereoselectivity in nucleophilic additions to carbonyl compounds|url = http://xlink.rsc.org/?DOI=c39900000456|journal = Journal of the Chemical Society, Chemical Communications|volume = 0|issue = 6|doi = 10.1039/c39900000456|first = Stephen S.|last = Wong|first2 = Michael N.|last2 = Paddon-Row|pages=456–458|date = January 1990}}</ref> Making the substrate bulkier (and increasing 1,3-axial interactions), however, decreases the prevalence of axial attacks, even for small hydride donors.<ref>{{Cite journal|title = Lithium trisiamylborohydride. A new sterically hindered reagent for the reduction of cyclic ketones with exceptional stereoselectivity|journal = Journal of the American Chemical Society|date = 1976-05-01|issn = 0002-7863|pages = 3383–3384|volume = 98|issue = 11|doi = 10.1021/ja00427a061|first = S.|last = Krishnamurthy|first2 = Herbert C.|last2 = Brown}}</ref> |
Large reducing agents, such as LiBH(Me<sub>2</sub>CHCHMe)<sub>3</sub>, are hindered by the 1,3-axial interactions and therefore attack equatorially.<ref name=":0"/> Small reducing agents, such as NaBH<sub>4</sub>, preferentially attack axially in order to avoid the eclipsing interactions, because the 1,3-diaxial interaction for small molecules is minimal; stereoelectronic reasons have also been cited for small reducing agents' axial preference.<ref>{{Cite journal|title = Theoretical evidence in support of the Anh?Eisenstein electronic model in controlling ?-facial stereoselectivity in nucleophilic additions to carbonyl compounds|url = http://xlink.rsc.org/?DOI=c39900000456|journal = Journal of the Chemical Society, Chemical Communications|volume = 0|issue = 6|doi = 10.1039/c39900000456|first = Stephen S.|last = Wong|first2 = Michael N.|last2 = Paddon-Row|pages=456–458|date = January 1990}}</ref> Making the substrate bulkier (and increasing 1,3-axial interactions), however, decreases the prevalence of axial attacks, even for small hydride donors.<ref>{{Cite journal|title = Lithium trisiamylborohydride. A new sterically hindered reagent for the reduction of cyclic ketones with exceptional stereoselectivity|journal = Journal of the American Chemical Society|date = 1976-05-01|issn = 0002-7863|pages = 3383–3384|volume = 98|issue = 11|doi = 10.1021/ja00427a061|first = S.|last = Krishnamurthy|first2 = Herbert C.|last2 = Brown}}</ref> |
||
2019年4月24日 (水) 01:22時点における版
この項目「カルボニル還元」は途中まで翻訳されたものです。(原文:en:Carbonyl reduction) 翻訳作業に協力して下さる方を求めています。ノートページや履歴、翻訳のガイドラインも参照してください。要約欄への翻訳情報の記入をお忘れなく。(2019年4月) |

有機化学におけるカルボニル還元(英: carbonyl reduction)はカルボニル化合物を還元剤によって有機反応である。
典型的なカルボニル化合物としてケトン、アルデヒド、カルボン酸、エステルや酸ハロゲン化物などがある。カルボン酸やエステル、酸ハロゲン化物は還元剤の強さによってアルデヒドや第一級アルコールに還元される。アルデヒドやケトンはそれぞれ第一級、第二級アルコールに還元される。脱酸素化ではアルコールがさらに還元され、酸素が取り除かれてアルキル基になる。
ホウ素やアルミニウムをベースとした金属水素化物は還元剤としてよく用いられる。接触水素化もカルボニル還元のために重要な反応である。水素化物が知られるようになる前は、金属ナトリウムとアルコールの混合物を使う[1][2]ブーボー・ブラン還元によってエステルの還元が行われていた[3][4][5]。
カルボン酸とその誘導体、ケトン、アルデヒド、アルコール
ヒドリド還元
反応機構
金属水素化物による還元の反応機構はヒドリド(水素化物)がカルボニルの炭素に求核付加反応しているというものである。いくつかの場合、Li+などアルカリ金属のカチオンがカルボニル基の酸素に配位することでカルボニル基の求電子性を高めることで活性化する。
カルボン酸誘導体の還元では、水素化アルミニウムイオンによる還元のあと脱離反応によってアルデヒドが得られる(その後もう一度還元反応が起こり、アルコールまで還元される場合もある)

水素化アルミニウムイオンによるアルデヒドやケトンの還元では反応物がアルコキシドに変換される。還元反応が終了したあと、アルコキシドがプロトン化され、アルコールが得られる。

カルボニル基の反応性の傾向

ケトンは立体効果が大きくアルキル基が電子を供与して、C=Oの部分正電荷を安定化するのでアルデヒドより反応性が低い[6]。ゆえに、アルデヒドはケトンより還元されやすく、穏やかな条件・弱い還元剤でも還元される。カルボン酸とエステルは酸素原子が2つ存在するため、孤立電子対からの負電荷の流入により正電荷がさらに安定化される。酸ハロゲン化物はハロゲンの電子供与性が低いので、もっとも不安定である[7]。
酸ハロゲン化物、ケトン、アルデヒドは還元されやすい化合物だが、カルボン酸やエステルを還元するには強い還元剤が必要である。
金属水素化の反応性
金属ヒドリドを用いる場合、還元剤の強さは4つのファクターによって決まる。1つは対イオンがカルボニル基の酸素に配位することでどれだけ活性化されるかである。リチウムはナトリウムより小さく求電子性が高いので、カルボニルにより強く配位する[8]。Mg、Al、Znなど+2以上の電荷を取れるカチオンもNa+より強くカルボニル基を活性化する[9]。
2つめは中心金属が還元剤の強さに与える影響である。アルミニウムはホウ素より大きいのでヒドリドとの結合はホウ素より弱い。このため求核攻撃をしやすく、ボロンヒドリドより還元力が強い[10]。3番目のファクターとして置換ヒドリドにおける立体効果がある。置換基のあるヒドリドはそうでない金属ヒドリドに比べ求核性が低い。例えばトリ酢酸水素化ホウ素ナトリウム(NaBH(OAc)3)はケトンとは反応しないのでアルデヒドの選択的還元に使われる[11]。
4つめは基質が還元剤に与える影響である。アセトキシ基は立体障害と電子吸引性のためトリ酢酸水素化ホウ素ナトリウム(NaBH(OAc)3)の還元を阻害する。シアノ基も還元剤に対して立体障害が大きいが、水素化トリエチルホウ素リチウムなど電子供与基を持った還元剤を使うことで、望まない転位反応が起こることを避けることができる。
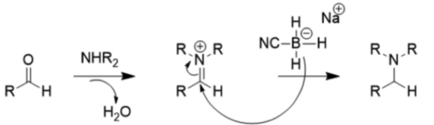
この基質効果により、NaBH3CNは通常のpH(>4)で還元作用が著しく低くなる。そのためこの化合物を使って還元的アミノ化を行う場合、下のように反応させるのが望ましい。
比較的弱い還元剤としてケトンをアルコールに還元する際は水素化ホウ素ナトリウムが一般的に用いられる。これはLAHなどは官能基許容性が低く、ニトロ基やニトリル、エステルなど様々な官能基を還元してしまうからである。またLAHと違いエタノールや水を溶媒として用いることができる点も特長である[12]。LAHやDIBAL-H、L-セレクトリド、ジボラン、ジアゼンや水素化アルミニウムなどの強い還元剤はアルデヒドとケトンの両方を還元することができるが、活性が高いため毒性も高い[13]。しかし、カルボン酸やエステルをアルコールに還元する場合はこれらの強い還元剤が必要となる。
下の表はどのカルボニル官能基がどの還元剤で還元されるかを示している。ただしいくつかの試薬は反応条件に依存する。

カルボン酸誘導体からアルデヒドへの還元
金属ヒドリドを利用したカルボニル還元
カルボン酸誘導体からアルデヒドを合成するのは非常に難しい。NaBH4などの弱い還元剤では還元反応がエステルやカルボン酸など比較的安定な化合物は還元されず、LiAlH4のような強い還元剤ではアルコールまで還元されるからである[14]。
酸塩化物はアルデヒドやケトンに比べれば不安定であるため、立体障害の大きなヒドリド供与体の存在下でアルデヒドを合成する際に比較的弱い還元剤と反応させると、アルデヒドが得られる。この還元剤としてはDIBAL-Hがよく用いられる。しかし、DIBAL-Hも全てのカルボニル基を還元することができるので、アルデヒドで還元を止める場合1当量の還元剤を低温で反応させる必要がある[15]。LiAl(OtBu)3(LiAlH4とtBuOHから合成される)も同様の機構で、還元をアルデヒドで止めることができる[16]。
Alternative methods
The traditional method of forming aldehydes without reducing to alcohols - by using hindered hydrides and reactive carbonyls - is limited by its narrow substrate scope and great dependence on reaction conditions. One workaround to avoid this method is to reduce the carboxylic acid derivative all the way down to an alcohol, then oxidize the alcohol back to an aldehyde. Other alternatives include forming a thioester or a Weinreb amide, then reducing the new species to an aldehyde through the Fukuyama reduction or Weinreb reaction respectively, or using catalytic hydrogenation as in the Rosenmund reaction.

In the Fukuyama reduction, a carboxylic acid is first converted to a thioester through addition of a thiol (with a mechanism similar to esterification).[17] The thioester is then reduced to an aldehyde by a silyl hydride with a palladium catalyst.
In the Weinreb reaction, an acyl chloride is first converted to the Weinreb amide, then treated with an organometallic reagent to form a ketone, or lithium aluminum hydride to form an aldehyde:[18]

The Weinreb amide is reduced via a stable chelate, rather than the electrophilic carbonyl that is formed through metal hydride reductions; the chelate is therefore only reduced once, as illustrated below:

The Rosenmund reaction reduces acyl chlorides to aldehydes using hydrogen gas with a catalyst of palladium on barium sulfate, whose small surface area prevents over-reduction.[19] For more reactive substrates, the catalyst must be further hindered with a poison, often one containing sulfur.
アルデヒド、ケトンとアルケン

アルデヒドとケトンはアルコールだけでなくアルカンまで還元することもできる。この変換反応には強酸性下で起こるクレメンセン還元や強塩基性下で起こるウォルフ・キシュナー還元およびその派生などが含まれる。例えばカリオリティの開発した反応では、トシルヒドラゾンとヒドリド供与体を利用することで、塩基を使わず穏和な条件下で反応を進めることができる[20]。マイアズによって報告された反応では、置換ヒドラジンをビス(tert-ブチルジメチルシリル)-ヒドラジンと室温下の穏和な条件で反応させ、速くかつ高収率で還元できる[21]。
1.2C4-reductionα,β-unsaturated carbonyls

In α,β-reduction (also called conjugate reduction), the substrate is an α,β-unsaturated carbonyl, an enone or enal.
When these substrates are reduced, 1,2-reduction - which produces an allyl alcohol - is in competition with the 1,4-reduction - which forms the saturated ketone or aldehyde. The following NaBH4 reduction of an enone shows two possible products: the first from 1,4-reduction and the second from 1,2-reduction.[12]

The more sterically hindered the enone substrate, the more likely 1,2 reduction becomes.[12] Additionally, to selectively form the alcohol and avoid the 1,4 product, the Luche reaction uses the smaller molecule Ce(BH4)3 (derived from NaBH4 and CeCl3 combined in situ) as the hydride source.[22]
The hydride source Zn(BH4)2 also shows 1,2 selectivity, as well as greater diastereoselectivity; it does so by coordinating not only to the carbonyl oxygen but also to adjacent atoms:[23]

立体選択性
ジアステレオ選択的還元
シクロヘキサノンの還元においては、ヒドリド源がアキシャル位を攻撃してエカトリアル位にヒドロキシ基がつくか、エカトリアル位を攻撃してアキシャル位にヒドロキシ基が結合したアルコールができる。アキシャル位への攻撃(赤で示した)ではヒドリドが1,3-ジアキシャル相互作用による反発を受ける。一方エカトリアル位の攻撃ではヒドリドは相互作用を受けることがないが、新しくできたアルコールが基質と水素原子が反応中間体がねじれひずみを受ける(アキシャル位にヒドロキシ基が結合したアルコールのニューマン投影法で下に示した)。

Large reducing agents, such as LiBH(Me2CHCHMe)3, are hindered by the 1,3-axial interactions and therefore attack equatorially.[12] Small reducing agents, such as NaBH4, preferentially attack axially in order to avoid the eclipsing interactions, because the 1,3-diaxial interaction for small molecules is minimal; stereoelectronic reasons have also been cited for small reducing agents' axial preference.[24] Making the substrate bulkier (and increasing 1,3-axial interactions), however, decreases the prevalence of axial attacks, even for small hydride donors.[25]
不斉還元
プロキラルなケトンが還元されると、生じる第2級アルコールには不斉中心が生じる。この立体制御を行う触媒がある。
不斉合成におけるカルボニル還元の例として野依不斉水素化反応(β-ケトエステルをルテニウム/BINAP錯体を触媒として還元する)やコーリー・バクシ・柴田還元 (BH3、プロリンの誘導体であるキラル触媒を利用)などがある
脚注
- ^ Moffett, Robert Bruce (1953). "2-(1-Pyrrolidyl)propanol". Organic Syntheses (英語). 33: 82. doi:10.15227/orgsyn.033.0082。; Collective Volume, vol. 4, p. 834
- ^ "Isoxazole Annelation Reaction: 1-Methyl-4,4a,5,6,7,8-hexahydronaphthalen-2(3H)-one". Organic Syntheses (英語). 53: 70. 1973. doi:10.15227/orgsyn.053.0070。
{{cite journal}}:|given1=を指定する場合、|surname1=も指定してください。 (説明); Collective Volume, vol. 6, p. 781 - ^ ルイ・ブーボー; Blanc, Gustave Louis (1903). “Préparation des alcools primaires au moyen des acides correspondants [Preparation of primary alcohols by means of the corresponding acids]” (French). Compt. Rend. 136: 1676–1678.
- ^ ルイ・ブーボー; Blanc, Gustave Louis (1903). “Préparation des alcools primaires au moyen des acides correspondants [Preparation of primary alcohols by means of the corresponding acids]” (French). Compt. Rend. 137: 60–62.
- ^ ルイ・ブーボー; Blanc, Gustave Louis (1904). “Transformation des acides monobasiques saturés dans les alcools primaires correspondants [Transforming saturated monobasic acids into the corresponding primary alcohols]” (French). Bull. Soc. Chim. Fr. 31: 666–672.
- ^ Roche, Alex. “Ketones and Aldehydes”. ラトガース大学. 2015年12月1日閲覧。
- ^ Clayden, Jonathan (2012). Organic Chemistry. OUP Oxford. pp. 200. ISBN 978-0199270293
- ^ König, Burkhard (2009年). “Reduction Reactions”. Modern Methods in Organic Synthesis. Institut für Organische Chemie, Uni Regensburg. 2015年12月1日閲覧。
- ^ Cox, Liam (2007年). “Nucleophilic Addition Reactions of Aldehydes and Ketones”. University of Birmingham. 2015年12月1日閲覧。
- ^ Sweeting, Linda M. (2001年). “Reducing Agents”. タウソン大学. 2015年12月1日閲覧。
- ^ Gribble, Gordon W.; Ferguson, Duncan C. (January 1975). “Reactions of sodium borohydride in acidic media. Selective reduction of aldehydes with sodium triacetoxyborohydride”. Journal of the Chemical Society, Chemical Communications 0 (13): 535–536. doi:10.1039/C39750000535 2015年12月2日閲覧。.
- ^ a b c d Banfi, Luca; Narisano, Enrica; Riva, Renata (2001-01-01). Sodium Borohydride. John Wiley & Sons, Ltd. doi:10.1002/047084289x.rs052. ISBN 9780470842898
- ^ Chaikin, Saul W.; Brown, Weldon G. (1949-01-01). “Reduction of Aldehydes, Ketones and Acid Chlorides by Sodium Borohydride”. Journal of the American Chemical Society 71 (1): 122–125. doi:10.1021/ja01169a033. ISSN 0002-7863.
- ^ Gaylord, Norman G. (1957-08-01). “Reduction with complex metal hydrides”. Journal of Chemical Education 34 (8): 367. Bibcode: 1957JChEd..34..367G. doi:10.1021/ed034p367.
- ^ Zakharkin, L.I.; Khorlina, I.M. (1962). “Reduction of esters of carboxylic acids into aldehydes with diisobutylaluminium hydride”. Tetrahedron Letters 3 (14): 619–620. doi:10.1016/s0040-4039(00)70918-x.
- ^ Cortes, Sergio (2010年). “Using Hydrogen as a Nucleophile in Hydride Reductions”. Dr. Sergio Cortes' Organic Chemistry Page. University of Texas at Dallas. 2015年12月1日閲覧。
- ^ Fukuyama, Tohru; Lin, Shao Cheng; Li, Leping (1990-09-01). “Facile reduction of ethyl thiol esters to aldehydes: application to a total synthesis of (+)-neothramycin A methyl ether”. Journal of the American Chemical Society 112 (19): 7050–7051. doi:10.1021/ja00175a043. ISSN 0002-7863.
- ^ Nahm, Steven; Weinreb, Steven M. (1981). “N-methoxy-n-methylamides as effective acylating agents”. Tetrahedron Letters 22 (39): 3815–3818. doi:10.1016/s0040-4039(01)91316-4.
- ^ Mosettig, Erich; Mozingo, Ralph (2004-01-01). The Rosenmund Reduction of Acid Chlorides to Aldehydes. John Wiley & Sons, Inc.. doi:10.1002/0471264180.or004.07. ISBN 9780471264187
- ^ Caglioti, L.; Magi, M. (1963-01-01). “The reaction of tosylhydrazones with lithium aluminium hydride”. Tetrahedron 19 (7): 1127–1131. doi:10.1016/S0040-4020(01)98571-0.
- ^ Furrow, Michael E.; Myers, Andrew G. (2004-05-01). “Practical Procedures for the Preparation of N-tert-Butyldimethylsilylhydrazones and Their Use in Modified Wolff−Kishner Reductions and in the Synthesis of Vinyl Halides and gem-Dihalides”. Journal of the American Chemical Society 126 (17): 5436–5445. doi:10.1021/ja049694s. ISSN 0002-7863. PMID 15113215.
- ^ Strategic Applications of Named Reactions in Organic Synthesis (Paperback) by Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4
- ^ Greeves, Nick (2015年). “Diastereoselective Ketone Reduction”. ChemTube3D. University of Liverpool. 2015年12月1日閲覧。
- ^ Wong, Stephen S.; Paddon-Row, Michael N. (January 1990). “Theoretical evidence in support of the Anh?Eisenstein electronic model in controlling ?-facial stereoselectivity in nucleophilic additions to carbonyl compounds”. Journal of the Chemical Society, Chemical Communications 0 (6): 456–458. doi:10.1039/c39900000456.
- ^ Krishnamurthy, S.; Brown, Herbert C. (1976-05-01). “Lithium trisiamylborohydride. A new sterically hindered reagent for the reduction of cyclic ketones with exceptional stereoselectivity”. Journal of the American Chemical Society 98 (11): 3383–3384. doi:10.1021/ja00427a061. ISSN 0002-7863.
