カテリシジン
| cathelicidin | |||||||
|---|---|---|---|---|---|---|---|
| 識別子 | |||||||
| 記号 | cathelicidins | ||||||
| 外部ID | GeneCards: [1] | ||||||
| オルソログ | |||||||
| 種 | ヒト | マウス | |||||
| Entrez |
|
| |||||
| Ensembl |
|
| |||||
| UniProt |
|
| |||||
| RefSeq (mRNA) |
|
| |||||
| RefSeq (タンパク質) |
|
| |||||
| 場所 (UCSC) | n/a | n/a | |||||
| PubMed検索 | n/a | n/a | |||||
| ウィキデータ | |||||||
| |||||||
カテリシジンまたはカセリサイディン(cathelicidin, cathelicidin antimicrobial peptide, CAMP)は、ヒトではCAMP遺伝子にコードされる抗菌ペプチドである[1]。活性型はLL-37と呼ばれる。ヒトでは、CAMP遺伝子はペプチド前駆体であるCAP-18(18 kDa)をコードしており、プロテイナーゼ3による細胞外での切断などのプロセシングを受け、活性型であるLL-37となる[1][2][3]。
カテリシジンファミリーのメンバーは約30種類が知られており、LL-37はヒトにみられる唯一のカテリシジンである[4]。カテリシジンは好中球やマクロファージの分泌顆粒に貯蔵され、白血球による活性化後に放出される[5]。カテリシジンは両親媒性分子と呼ばれる、二重の性質を併せ持った分子である。すなわち、分子の一方の端は水分子に親和性があり、脂肪やタンパク質に反発する。もう一方の端は脂肪やタンパク質に親和性があり、水分子に反発する。こうした性質のため、このファミリーのメンバーは病原体に対し、細胞膜の崩壊、損傷、穿孔といった反応を示すこととなる。
カテリシジンは哺乳類において、侵入細菌の感染に対する自然免疫に重要な役割を果たしている[6]。カテリシジンはディフェンシンなどとともに、抗菌ペプチドに分類される。ディフェンシン類は共通した構造的特徴を有するのに対し、カテリシジン関連ペプチドはきわめて多様である[6]。カテリシジンファミリーは、cathelinドメインと呼ばれる高度に保存された領域と、きわめて多様なカテリシジンペプチドドメインによって特徴づけられる[6]。
カテリシジンは、有袋類を含む、多くの哺乳類から単離されている[7]。カテリシジンは主に好中球、単球、マスト細胞、樹状細胞、マクロファージにおいて[8]、細菌、ウイルス、真菌、寄生虫による活性化、または活性型ビタミンDであるビタミンD3によって誘導される[9]。上皮細胞やケラチノサイトなど、他の一部の細胞にも存在することが知られている[10]。
名称
[編集]カテリシジン(cathelicidin)という名称は、特徴的なcathelin様ドメインが存在することから1995年に命名された[11]。Cathelin自体は1989年に命名されたもので、カテプシンLインヒビター(cathepsin L inhibitor)に由来する[12]。
抗微生物活性の機序
[編集]カテリシジンの作用機序は、他の抗菌ペプチドと同様、標的生物の細胞膜構造の破壊(損傷や穿孔)を伴う[5]。
マクロファージにおいて、カテリシジンはファゴソームに取り込まれた微生物の脂質とタンパク質からなる膜をリソソームとの融合後に迅速に破壊する。そのため、細菌のバイオフィルムの形成を阻害する役割を果たす[13]。
その他の活性
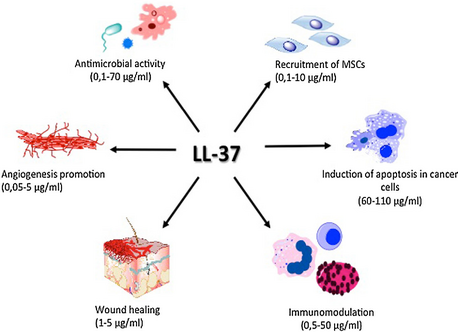
[編集]LL-37は細胞増殖や遊走の活性化に関与し、創傷閉鎖過程に寄与している[14]。こうした機構の全てが、組織の恒常性や再生過程に必須の役割を果たしている。また、FPRL1[15]、P2X7、EGFR[16]、IGF1R[17]といったさまざまな受容体に対してアゴニストとして作用する。さらに、LL-37は血管新生を誘導し[18]、アポトーシスを調節する[19]。
特徴
[編集]カテリシジンは12–80アミノ酸から構成され、さまざまな構造をとる[20]。大部分のカテリシジンは23–37アミノ酸残基からなり、両親媒性のαヘリックスへとフォールディングする。さらに、1つもしくは2つのジスルフィド結合によって安定化されたβヘアピン構造を持つ小さな分子(12–18残基)である場合もある。より大きなサイズ(39–80残基)のものも存在し、こうしたものはプロリンの反復モチーフを持ち、伸長したポリプロリン型構造を形成する[6]。
1995年Gudmundssonらによって、あるORFのC末端の39残基から抗微生物活性を有するペプチド(FALL-39と命名された)が形成されることが推定された[21]。その1年後、実際にはFALL-39よりも2アミノ酸だけ短い、現在LL-37と呼ばれているペプチドが活性を有することが明らかにされた[22]。
カテリシジンファミリーは、シスタチンファミリーのシステインプロテアーゼインヒビターとアミノ酸配列の相同性を示す[23]。しかしながら、プロテアーゼ阻害に重要であると考えられているアミノ酸残基は通常失われている。
オルソログ
[編集]カテリシジンファミリーのペプチドは、ヒト、サル、マウス、ラット、ウサギ、モルモット、パンダ、ブタ、ウシ、カエル、ヒツジ、ヤギ、ニワトリ、ウマ、ワラビーで見つかっている[24]。有袋類でのカテリシジン様ペプチドの発見には、ヒトLL37/hCAP-18に対する抗体が用いられた[25]。これまでに哺乳類では約30種類のメンバーが記載されているが、ヒトで見つかっているのはLL-37のみである[5]。現在同定されているカテリシジンには次のようなものがある。
- ヒト: hCAP-18(切断されてLL-37となる)
- アカゲザル: RL-37
- マウス:CRAMP-1/2 (Cathelicidin-related Antimicrobial Peptide)[26]
- ラット: rCRAMP
- ウサギ: CAP-18
- モルモット: CAP-11
- ブタ: PR-39, Prophenin, PMAP-23,36,37
- ウシ: BMAP-27,28,34 (Bovine Myeloid Antimicrobial Peptides); Bac5, Bac7
- カエル: cathelicidin-AL (Amolops loloensis)[27]
- ニワトリ: Fowlicidins 1,2,3, cathelicidin Beta-1 [28]
- タスマニアデビル: Saha-CATH5 [29]
- サケ: CATH1, CATH2
臨床的意義
[編集]酒さの患者では、カテリシジンとカリクレイン5(SCTE)が増加している。カテリシジンはカリクレイン5とカリクレイン7の双方によってLL-37へと切断される。LL-37の過剰産生は酒さの全てのサブタイプにおいて、病因に寄与していると考えられている[30]。テトラサイクリン系が他の抗菌剤よりも酒さに対する効果が高いのは、これらのセリンプロテアーゼに対する間接的な阻害作用のためである可能性がある[31]。
血漿中のカテリシジン濃度の低下は、下痢患者の感染症による死亡リスクを有意に高めるようである[32]。カテリシジンの産生はビタミンDによってアップレギュレーションされる[33][34]。
SAAP-148(synthetic antimicrobial and antibiofilm peptide)は、抗微生物活性が高められた改変型LL-37である。SAAP-148は生理的条件下でより効率的な殺菌作用を示す[35]。さらに、SAAP-148は薬剤耐性菌やそのバイオフィルムに対し、ハリシンと相乗的作用を示す[36]。
LL-37は(他の抗菌ペプチドとともに)乾癬の病因にも関係していると考えられている。乾癬においては、損傷したケラチノサイトから放出されたLL-37は自己の遺伝物質(DNAまたはRNA)と複合体を形成する。この複合体は樹状細胞(抗原提示細胞の一種)を刺激し、樹状細胞はIFN-α、βを放出してT細胞の分化と炎症の持続に寄与する[37]。LL-37は乾癬における一般的な自己抗原として知られており、中等症から重症の患者の約2/3で血中にLL-37特異的T細胞がみられる[37]。
LL-37は、アルツハイマー病に関係するペプチドであるアミロイドβに結合する。LL-37とアミロイドβの間のバランスの異常は、アルツハイマー病と関係したフィブリルやプラークの形成に影響を及ぼしている因子の1つである可能性がある。口内での慢性的なポルフィロモナス・ジンジバリスPorphyromonas gingivalisの感染や、ヘルペスウイルス(HSV-1)の感染は、アルツハイマー型認知症の進行に寄与している可能性がある[38][39]。
応用
[編集]抗菌ペプチドに関する研究、特にその作用機序に関する研究は20年近く行われている。抗菌ペプチドの臨床応用は関心を集め続けている一方で、いくつかの理由のため広く利用される状態とはなっていない[40]。まず、ペプチドはプロテアーゼによって迅速に分解されるため、抗菌ペプチド由来の薬剤のバイオアベイラビリティは限定的なものとなる。次に、ペプチド型の薬剤は低分子よりも生産コストが高く、酵素による迅速な分解に対抗するために高用量で投与する必要があるため問題となる。また、こうした性質のため、一般的に注射、持続注入、徐放性製剤といった投与経路に限定される[41]。
出典
[編集]- ^ a b “UniProt”. www.uniprot.org. 8 February 2024閲覧。
- ^ “Entrez Gene: CAMP cathelicidin antimicrobial peptide”. 2024年5月24日閲覧。
- ^ Sørensen, O. E.; Follin, P.; Johnsen, A. H.; Calafat, J.; Tjabringa, G. S.; Hiemstra, P. S.; Borregaard, N. (2001-06-15). “Human cathelicidin, hCAP-18, is processed to the antimicrobial peptide LL-37 by extracellular cleavage with proteinase 3”. Blood 97 (12): 3951–3959. doi:10.1182/blood.v97.12.3951. ISSN 0006-4971. PMID 11389039.
- ^ “LL-37, the only human member of the cathelicidin family of antimicrobial peptides”. Biochimica et Biophysica Acta (BBA) - Biomembranes 1758 (9): 1408–1425. (September 2006). doi:10.1016/j.bbamem.2006.03.030. PMID 16716248.
- ^ a b c “Cathelicidins: family of antimicrobial peptides. A review”. Molecular Biology Reports 39 (12): 10957–70. (December 2012). doi:10.1007/s11033-012-1997-x. PMC 3487008. PMID 23065264.
- ^ a b c d “Cathelicidins, multifunctional peptides of the innate immunity”. Journal of Leukocyte Biology 75 (1): 39–48. (January 2004). doi:10.1189/jlb.0403147. PMID 12960280.
- ^ Carman, Rebecca L.; Simonian, Mary R.; Old, Julie M.; Jacques, Nicholas A.; Deane, Elizabeth M. (2008-12). “Immunohistochemistry using antibodies to the cathelicidin LL37/hCAP18 in the tammar wallaby, Macropus eugenii”. Tissue & Cell 40 (6): 459–466. doi:10.1016/j.tice.2008.05.002. ISSN 0040-8166. PMID 18597803.
- ^ “A comprehensive summary of LL-37, the factotum human cathelicidin peptide”. Cellular Immunology 280 (1): 22–35. (November 2012). doi:10.1016/j.cellimm.2012.11.009. PMID 23246832.
- ^ “Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response”. Science 311 (5768): 1770–3. (March 2006). Bibcode: 2006Sci...311.1770L. doi:10.1126/science.1123933. PMID 16497887.
- ^ “The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface”. Proceedings of the National Academy of Sciences of the United States of America 95 (16): 9541–6. (August 1998). Bibcode: 1998PNAS...95.9541B. doi:10.1073/pnas.95.16.9541. PMC 21374. PMID 9689116.
- ^ “Cathelicidins: a novel protein family with a common proregion and a variable C-terminal antimicrobial domain”. FEBS Letters 374 (1): 1–5. (October 1995). doi:10.1016/0014-5793(95)01050-o. PMID 7589491.
- ^ “Primary structure of a new cysteine proteinase inhibitor from pig leucocytes”. FEBS Letters 255 (2): 211–4. (September 1989). doi:10.1016/0014-5793(89)81093-2. PMID 2792375.
- ^ “Inhibition and destruction of Pseudomonas aeruginosa biofilms by antibiotics and antimicrobial peptides”. Peptides 62: 32–7. (December 2014). doi:10.1016/j.peptides.2014.09.021. PMID 25285879.
- ^ “Human endogenous antibiotic LL-37 stimulates airway epithelial cell proliferation and wound closure”. American Journal of Physiology. Lung Cellular and Molecular Physiology 289 (5): L842-8. (November 2005). doi:10.1152/ajplung.00286.2004. PMID 15964896.
- ^ “LL-37, the neutrophil granule- and epithelial cell-derived cathelicidin, utilizes formyl peptide receptor-like 1 (FPRL1) as a receptor to chemoattract human peripheral blood neutrophils, monocytes, and T cells”. The Journal of Experimental Medicine 192 (7): 1069–74. (October 2000). doi:10.1084/jem.192.7.1069. PMC 2193321. PMID 11015447.
- ^ “The host defence peptide LL-37/hCAP-18 is a growth factor for lung cancer cells”. Lung Cancer 59 (1): 12–23. (January 2008). doi:10.1016/j.lungcan.2007.07.014. PMID 17764778.
- ^ “Identification of the cathelicidin peptide LL-37 as agonist for the type I insulin-like growth factor receptor”. Oncogene 31 (3): 352–65. (January 2012). doi:10.1038/onc.2011.239. PMC 3262900. PMID 21685939.
- ^ “An angiogenic role for the human peptide antibiotic LL-37/hCAP-18”. The Journal of Clinical Investigation 111 (11): 1665–72. (June 2003). doi:10.1172/JCI17545. PMC 156109. PMID 12782669.
- ^ “FK-16 derived from the anticancer peptide LL-37 induces caspase-independent apoptosis and autophagic cell death in colon cancer cells”. PLOS ONE 8 (5): e63641. (2013-05-20). Bibcode: 2013PLoSO...863641R. doi:10.1371/journal.pone.0063641. PMC 3659029. PMID 23700428.
- ^ “Structural features and biological activities of the cathelicidin-derived antimicrobial peptides”. Biopolymers 55 (1): 31–49. (2000). doi:10.1002/1097-0282(2000)55:1<31::AID-BIP40>3.0.CO;2-9. PMID 10931440.
- ^ “FALL-39, a putative human peptide antibiotic, is cysteine-free and expressed in bone marrow and testis”. Proceedings of the National Academy of Sciences of the United States of America 92 (1): 195–9. (January 1995). Bibcode: 1995PNAS...92..195A. doi:10.1073/pnas.92.1.195. PMC 42844. PMID 7529412.
- ^ “The human gene FALL39 and processing of the cathelin precursor to the antibacterial peptide LL-37 in granulocytes”. European Journal of Biochemistry 238 (2): 325–32. (June 1996). doi:10.1111/j.1432-1033.1996.0325z.x. PMID 8681941.
- ^ “Antimicrobial and protease inhibitory functions of the human cathelicidin (hCAP18/LL-37) prosequence”. The Journal of Investigative Dermatology 120 (5): 810–6. (May 2003). doi:10.1046/j.1523-1747.2003.12132.x. PMID 12713586.
- ^ Carman, Rebecca L.; Old, Julie M.; Baker, Michelle; Jacques, Nicholas A.; Deane, Elizabeth M. (2009-02-15). “Identification and expression of a novel marsupial cathelicidin from the tammar wallaby (Macropus eugenii)”. Veterinary Immunology and Immunopathology 127 (3-4): 269–276. doi:10.1016/j.vetimm.2008.10.319. ISSN 0165-2427. PMC 2887693. PMID 19046773.
- ^ “Immunohistochemistry using antibodies to the cathelicidin LL37/hCAP18 in the tammar wallaby, Macropus eugenii”. Tissue & Cell 40 (6): 459–466. (December 2008). doi:10.1016/j.tice.2008.05.002. PMID 18597803.
- ^ “Identification of CRAMP, a cathelin-related antimicrobial peptide expressed in the embryonic and adult mouse”. The Journal of Biological Chemistry 272 (20): 13088–93. (May 1997). doi:10.1074/jbc.272.20.13088. PMID 9148921.
- ^ “Amphibian cathelicidin fills the evolutionary gap of cathelicidin in vertebrate”. Amino Acids 43 (2): 677–85. (August 2012). doi:10.1007/s00726-011-1116-7. PMID 22009138.
- ^ “Tissue expression and developmental regulation of chicken cathelicidin antimicrobial peptides”. Journal of Animal Science and Biotechnology 3 (1): 15. (May 2012). doi:10.1186/2049-1891-3-15. PMC 3436658. PMID 22958518.
- ^ “Cathelicidins in the Tasmanian devil (Sarcophilus harrisii)”. Scientific Reports 6: 35019. (October 2016). Bibcode: 2016NatSR...635019P. doi:10.1038/srep35019. PMC 5057115. PMID 27725697.
- ^ “Cathelicidin LL-37: an antimicrobial peptide with a role in inflammatory skin disease”. Annals of Dermatology 24 (2): 126–35. (May 2012). doi:10.5021/ad.2012.24.2.126. PMC 3346901. PMID 22577261.
- ^ “Increased serine protease activity and cathelicidin promotes skin inflammation in rosacea”. Nature Medicine 13 (8): 975–80. (August 2007). doi:10.1038/nm1616. PMID 17676051.
- ^ “Low plasma level of cathelicidin antimicrobial peptide (hCAP18) predicts increased infectious disease mortality in patients undergoing hemodialysis”. Clinical Infectious Diseases 48 (4): 418–24. (February 2009). doi:10.1086/596314. PMC 6944311. PMID 19133797.
- ^ “Antimicrobial peptides of multicellular organisms”. Nature 415 (6870): 389–95. (January 2002). Bibcode: 2002Natur.415..389Z. doi:10.1038/415389a. PMID 11807545.
- ^ “Vitamin D and molecular actions on the immune system: modulation of innate and autoimmunity”. Journal of Molecular Medicine 88 (5): 441–50. (May 2010). doi:10.1007/s00109-010-0590-9. PMC 2861286. PMID 20119827.
- ^ “The antimicrobial peptide SAAP-148 combats drug-resistant bacteria and biofilms”. Science Translational Medicine 10 (423): eaan4044. (January 2018). doi:10.1126/scitranslmed.aan4044. PMID 29321257.
- ^ “Synergism between the Synthetic Antibacterial and Antibiofilm Peptide (SAAP)-148 and Halicin”. Antibiotics 11 (5): 673. (May 2022). doi:10.3390/ANTIBIOTICS11050673. PMC 9137631. PMID 35625317.
- ^ a b “Psoriasis Pathogenesis and Treatment”. International Journal of Molecular Sciences 20 (6): 1475. (March 2019). doi:10.3390/ijms20061475. PMC 6471628. PMID 30909615.
- ^ “Porphyromonas gingivalis is a Strong Risk Factor for Alzheimer's Disease”. Journal of Alzheimer's Disease Reports 4 (1): 501–511. (December 2020). doi:10.3233/ADR-200250. PMC 7835991. PMID 33532698.
- ^ “Controversial role of herpesviruses in Alzheimer's disease”. PLOS Pathogens 16 (6): e1008575. (June 2020). doi:10.1371/journal.ppat.1008575. PMC 7302436. PMID 32555685.
- ^ “Biomimetics Research from the Barron Lab”. web.stanford.edu. 2021年10月22日閲覧。
- ^ “Peptides: New Processes, Lower Costs” (英語). GEN - Genetic Engineering and Biotechnology News (2015年6月30日). 2021年11月30日閲覧。
関連文献
[編集]- “LL-37, the only human member of the cathelicidin family of antimicrobial peptides”. Biochimica et Biophysica Acta (BBA) - Biomembranes 1758 (9): 1408–25. (September 2006). doi:10.1016/j.bbamem.2006.03.030. PMID 16716248.
- “The antimicrobial peptide cathelicidin protects the urinary tract against invasive bacterial infection”. Nature Medicine 12 (6): 636–41. (June 2006). doi:10.1038/nm1407. PMID 16751768.
- “Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1,25-dihydroxyvitamin D3”. FASEB Journal 19 (9): 1067–77. (July 2005). doi:10.1096/fj.04-3284com. PMID 15985530.
- “Expression and potential function of cathelicidin antimicrobial peptides in dermatophytosis and tinea versicolor”. The Journal of Antimicrobial Chemotherapy 57 (5): 877–82. (May 2006). doi:10.1093/jac/dkl078. PMID 16556635.
- “Cathelicidins: a family of endogenous antimicrobial peptides”. Current Opinion in Hematology 9 (1): 18–22. (January 2002). doi:10.1097/00062752-200201000-00004. PMID 11753073.
- “Epithelial cell-derived antibacterial peptides human beta-defensins and cathelicidin: multifunctional activities on mast cells”. Current Drug Targets. Inflammation and Allergy 2 (3): 224–31. (September 2003). doi:10.2174/1568010033484115. PMID 14561157.
- “Interactions between neutrophil-derived antimicrobial peptides and airway epithelial cells”. Journal of Leukocyte Biology 77 (4): 444–50. (April 2005). doi:10.1189/jlb.0604367. PMID 15591123.
- “hCAP-18, a cathelin/pro-bactenecin-like protein of human neutrophil specific granules”. FEBS Letters 368 (1): 173–6. (July 1995). doi:10.1016/0014-5793(95)00634-L. PMID 7615076.
- “Structure of the gene for porcine peptide antibiotic PR-39, a cathelin gene family member: comparative mapping of the locus for the human peptide antibiotic FALL-39”. Proceedings of the National Academy of Sciences of the United States of America 92 (15): 7085–9. (July 1995). Bibcode: 1995PNAS...92.7085G. doi:10.1073/pnas.92.15.7085. PMC 41476. PMID 7624374.
- “Human CAP18: a novel antimicrobial lipopolysaccharide-binding protein”. Infection and Immunity 63 (4): 1291–7. (April 1995). doi:10.1128/IAI.63.4.1291-1297.1995. PMC 173149. PMID 7890387.
- “Structural, functional analysis and localization of the human CAP18 gene”. FEBS Letters 398 (1): 74–80. (November 1996). doi:10.1016/S0014-5793(96)01199-4. PMID 8946956.
- “The expression of the gene coding for the antibacterial peptide LL-37 is induced in human keratinocytes during inflammatory disorders”. The Journal of Biological Chemistry 272 (24): 15258–63. (June 1997). doi:10.1074/jbc.272.24.15258. PMID 9182550.
- “The peptide antibiotic LL-37/hCAP-18 is expressed in epithelia of the human lung where it has broad antimicrobial activity at the airway surface”. Proceedings of the National Academy of Sciences of the United States of America 95 (16): 9541–6. (August 1998). Bibcode: 1998PNAS...95.9541B. doi:10.1073/pnas.95.16.9541. PMC 21374. PMID 9689116.
- “LL-37, the neutrophil granule- and epithelial cell-derived cathelicidin, utilizes formyl peptide receptor-like 1 (FPRL1) as a receptor to chemoattract human peripheral blood neutrophils, monocytes, and T cells”. The Journal of Experimental Medicine 192 (7): 1069–74. (October 2000). doi:10.1084/jem.192.7.1069. PMC 2193321. PMID 11015447.
- “The human antimicrobial and chemotactic peptides LL-37 and alpha-defensins are expressed by specific lymphocyte and monocyte populations”. Blood 96 (9): 3086–93. (November 2000). doi:10.1182/blood.V96.9.3086. PMID 11049988.
- “Rhesus monkey (Macaca mulatta) mucosal antimicrobial peptides are close homologues of human molecules”. Clinical and Diagnostic Laboratory Immunology 8 (2): 370–5. (March 2001). doi:10.1128/CDLI.8.2.370-375.2001. PMC 96065. PMID 11238224.
- “Cathelicidin family of antibacterial peptides CAP18 and CAP11 inhibit the expression of TNF-alpha by blocking the binding of LPS to CD14(+) cells”. Journal of Immunology 167 (6): 3329–38. (September 2001). doi:10.4049/jimmunol.167.6.3329. PMID 11544322.
- “Cell differentiation is a key determinant of cathelicidin LL-37/human cationic antimicrobial protein 18 expression by human colon epithelium”. Infection and Immunity 70 (2): 953–63. (February 2002). doi:10.1128/IAI.70.2.953-963.2002. PMC 127717. PMID 11796631.
- “Antimicrobial peptides: an overview of a promising class of therapeutics”. Cent. Eur. J. Biol. 2 (1): 1–33. (2007). doi:10.2478/s11535-007-0010-5.
- “The chemistry and biology of LL-37”. Natural Product Reports 26 (12): 1572–84. (December 2009). doi:10.1039/b912533g. PMID 19936387.
