鉱質コルチコイド受容体拮抗薬
| 鉱質コルチコイド受容体拮抗薬 | |
|---|---|
| Drug class | |
 Spironolactone, the most widely used antimineralocorticoid. | |
| クラス識別子 | |
| 略称 | Aldosterone antagonistic; Mineralocorticoid antagonist |
| 効用 | Diuretic; Chronic heart failure; Hypertension; Hyperaldosteronism; Conn's syndrome |
| 生物学的ターゲット | Mineralocorticoid receptor |
| Chemical class | Steroidal; Nonsteroidal |
| In Wikidata | |
鉱質コルチコイド受容体拮抗薬(Mineralocorticoid receptor antagonist,MCRA[1])または抗アルドステロン薬(Aldosterone antagonist)は、鉱質コルチコイド受容体におけるアルドステロンの作用に拮抗する利尿薬である。慢性心不全の治療には、他の薬剤と併用して補助的に使用されることが多い。このクラスの最初の薬剤であるスピロノラクトンは、高アルドステロン症(コン症候群を含む)および女性の多毛症(抗アンドロゲン作用を併せ持つため)の管理にも使用される。スピロノラクトンを含む多くの鉱質コルチコイド拮抗薬は、ステロイド系スピロラクトンである。フィネレノンは非ステロイド系の鉱質コルチコイド拮抗薬である。
医療用途[編集]
鉱質コルチコイド拮抗薬は、主に腎臓に作用する利尿薬である。ナトリウムの再吸収を減少させ、腎臓からの水の排泄を増加させる[2]。水分排泄を調節することにより、鉱質コルチコイド拮抗薬は血圧を低下させ、心臓周辺の水分を減少させるため、一部の心血管疾患に非常に有効である[3]。鉱質コルチコイド拮抗薬は、心血管系の多くの臨床症状に使用されている。原発性アルドステロン症、原発性高血圧、治療抵抗性高血圧、心不全、慢性腎臓病などの疾患に有効であることが証明されている[2]。また、ACE阻害薬やβ遮断薬などの他の薬剤と併用されることが多い[4]。
副作用[編集]
尿量の増加は、特に治療開始後の初期段階でよく報告されるが、ほとんどが一過性のもので、治療を継続することで減少する傾向にある。鉱質コルチコイド拮抗薬の一般的な副作用には、吐き気や嘔吐、胃痙攣、下痢などが挙げられる[4]。臨床的に有意な高カリウム血症が起こる可能性があるため、定期的に血清カリウムのモニタリングを行う必要がある。高カリウム血症の病態生理の要点は、鉱質コルチコイド拮抗薬がカリウム(K)の排泄を減少させる点にある。
作用機序[編集]

アルドステロンは、副腎で合成される鉱質コルチコイドの一種である[5]。副腎から分泌されたアルドステロンは、腎尿細管細胞の鉱質コルチコイド受容体(MR)に結合して複合体を形成する[6]。この複合体は、核内の特定のDNAセグメントの転写を促進し、腎尿細管細胞の基底外側膜にあるNa+/K+ ATPaseポンプと頂端膜にあるENaCと呼ばれるNa+チャネルという2つのタンパク質輸送体の生成に繋がる[6]。これらのタンパク質輸送体は、腎臓の遠位尿細管と集合管におけるナトリウムの再吸収とカリウムの排泄を増加させる。これにより、体内の容積状態と電解質バランスを正常に保つことができ、血圧が低下する。
鉱質コルチコイド拮抗薬は、鉱質コルチコイド受容体に結合してアルドステロンを阻害することにより、アルドステロンの作用を低下させる。これにより、血清中のカリウム濃度が高くなり、ナトリウムの排泄量が増加するため、体液が減少し、血圧が低下する[5]。
実例[編集]
鉱質コルチコイド拮抗薬は以下の2種に大別される。





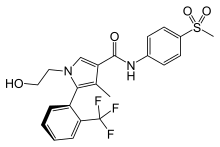
- ステロイド系
- 非ステロイド系
- フィネレノン — 非ステロイド系で、エプレレノンやスピロノラクトンよりも強力で選択性が高い。
- エサキセレノン — 非ステロイド系で、選択性が非常に高い。
その他の薬剤の中にも、主な作用機序に加えて、抗鉱質コルチコイド作用を持つものがある。例えば、プロゲステロン、ドロスピレノン、ゲストデン、ベニジピン等である[7]。
構造活性相関[編集]
スピロノラクトンとエプレレノンは、アルドステロンの鉱質コルチコイド受容体への結合を競合的に阻害し、ナトリウムイオンと塩化物イオンの再吸収を妨げる。ステロイド系鉱質コルチコイド拮抗薬の活性は、C-17位にY-ラクトン環が存在することに依存する。また、C-7位の置換基は、アルドステロンなどのC-7未置換の受容体作動薬との相互作用を立体的に阻害するため、活性には重要である[8]。

エプレレノンは、副作用を抑えたスピロノラクトン類似薬として開発された医薬品である。エプレレノンは、y-ラクトン環とC-7の置換基に加えて、9α,11α-エポキシ基を有する。この基が、エプレレノンがスピロノラクトンに比べて鉱質コルチコイド受容体に対する親和性が20〜40倍低い理由と考えられている[8]。
フィネレノンは非ステロイド性であるため、親油性や極性が異なるにもかかわらず、鉱質コルチコイド受容体に対するフィネレノンの親和性はスピロノラクトンと等しくエプレレノンの500倍であり、多くの鉱質コルチコイド拮抗薬のステロイド骨格は鉱質コルチコイド受容体への親和性に必須ではないことを示唆している[9]。エサキセレノンの鉱質コルチコイド受容体親和性はスピロノラクトンの4倍である[10][11][12]。
歴史[編集]
1950年代に起こった最初のアルドステロン拮抗薬の同定の主な目的は、アルドステロン活性の阻害物質を同定することであった。当時、アルドステロンの主な用途は、腎臓のナトリウムとカリウムの排泄をコントロールすることだと認識されていた[9]。
1959年、ラットを用いた研究により、最初のアルドステロン拮抗薬の1つであるスピロノラクトンを使用することで、アルドステロンによる心臓の壊死からラットを守ることができることが発見された。同じ年にスピロノラクトンはカリウムを保持する利尿剤として発売された。数年後、アルドステロン拮抗薬が特定の受容体タンパク質を阻害することが明らかになった。このタンパク質は、アルドステロンだけでなく、ヒトではコルチゾール、マウスやラットではコルチコステロンにも高い親和性を持つ。このため、アルドステロン拮抗薬は鉱質コルチコイド受容体拮抗薬と呼ばれた[9]。
鉱質コルチコイド受容体拮抗薬の研究開発については、製薬業界に3つの大きな波があった。第1の波は、サール研究所で起こった。アルドステロンが精製された直ぐ後に、ステロイド骨格を持つスピロノラクトンを最初の鉱質コルチコイド拮抗薬として同定した。第2の波は、より特異的なステロイド系の鉱質コルチコイド拮抗薬を発見することにあった[9]。
スピロノラクトンの発見から約50年後、幾つかの製薬会社が創薬プログラムを開始した。その目的は、非ステロイド系の鉱質コルチコイド拮抗薬を発見し、薬力学と薬物動態を明確にした上で、有効かつ安全な薬剤として使用することであった。そして、これらの候補物質を幅広い疾患に使用することを目指していた。これが実質的な第3の波であった。最初の鉱質コルチコイド拮抗薬は、全て動物実験によって発見・同定されたが、新規の非ステロイド系鉱質コルチコイド拮抗薬の同定は、さまざまな製薬会社で何百万もの化学物質を用いたハイスループットスクリーニングによって行われた[9]。
関連項目[編集]
参考資料[編集]
- ^ The Krause/King-Lewis acronym, developed at Naval Medical Center San Diego Archived 2018-07-13 at the Wayback Machine., of MCRA was developed during February 2017 to distinguish between MRA for a specific MRI which are both widely recognized medical acronyms as compared to the use of MRA for mineralocorticoid receptor antagonist type medications which is only used as a medical acronym in the cardiology and nephrology word.
- ^ a b Clark III, Donald; Guichard; Calhoun; Ahmed (June 2013). “Aldosterone receptor antagonists: current perspectives and therapies”. Vascular Health and Risk Management 9: 321–331. doi:10.2147/VHRM.S33759. PMC 3699348. PMID 23836977.
- ^ “List of Aldosterone receptor antagonists - Drugs.com”. Drugs.com. 2018年9月27日閲覧。
- ^ a b Maron, Bradley A.; Leopold, Jane A. (23 February 2010). “Aldosterone Receptor Antagonists”. Circulation 121 (7): 934–939. doi:10.1161/CIRCULATIONAHA.109.895235. PMC 2828634. PMID 20177008.
- ^ a b Nappi, Jean; Sieg (June 2011). “Aldosterone and aldosterone receptor antagonists in patients with chronic heart failure”. Vascular Health and Risk Management 7: 353–363. doi:10.2147/VHRM.S13779. PMC 3119593. PMID 21731887.
- ^ a b Furman, Brian L.「Mineralocorticoid Antagonists ☆」(英語)『Mineralocorticoid Antagonists』2017年1月1日。doi:10.1016/B978-0-12-801238-3.98012-7。ISBN 9780128012383。2018年9月27日閲覧。
- ^ “The L-, N-, and T-type triple calcium channel blocker benidipine acts as an antagonist of mineralocorticoid receptor, a member of nuclear receptor family”. Eur. J. Pharmacol. 635 (1–3): 49–55. (2010). doi:10.1016/j.ejphar.2010.03.018. PMID 20307534.
- ^ a b Lemke, Thomas L.; Williams, David A.; Roche, Victoria F.; Zito, S. William. Foye's Principals of Medicinal Chemistry. Wolters Kluwer - Lippincott Williams and Wilkins.
- ^ a b c d e Kolkhof, Peter; Bärfacker, Lars (July 2017). “30 YEARS OF THE MINERALOCORTICOID RECEPTOR: Mineralocorticoid receptor antagonists: 60 years of research and development”. Journal of Endocrinology 234 (1): T125–T140. doi:10.1530/JOE-16-0600. PMC 5488394. PMID 28634268.
- ^ http://adisinsight.springer.com/drugs/800021527
- ^ “Mineralocorticoid receptor antagonists-pharmacodynamics and pharmacokinetic differences”. Curr Opin Pharmacol 27: 78–85. (2016). doi:10.1016/j.coph.2016.02.005. PMID 26939027.
- ^ “Nonsteroidal antagonists of the mineralocorticoid receptor”. Curr. Opin. Nephrol. Hypertens. 24 (5): 417–24. (2015). doi:10.1097/MNH.0000000000000147. PMID 26083526.
